淫羊藿苷剂量对静脉血栓模型大鼠凝血功能、炎症因子及纤溶指标的影响
2022-10-19杨涛贾兆晋宋冀东王东张春梅
杨涛 贾兆晋 宋冀东 王东 张春梅
1唐山市工人医院(河北唐山 063000);2唐山市妇幼保健院(河北唐山 063000)
深静脉血栓形成作为严重威胁人类健康的常见周围血管疾病,具有较高的发病率、致残率与致死率,其在心脑血管疾病发病中位列第三,仅次于心肌梗死与脑卒中[1]。癌症、外科手术、骨折、产褥期、口服避孕药等,都是深静脉血栓形成的常见危险因素[2-3]。目前临床上预防深静脉血栓形成主要通过口服或注射抗凝药物,然而,抗凝药物在应用中有许多的局限性,因为该类药物主要是通过降低凝血水平来预防深静脉血栓的形成;可是,深静脉血栓的形成不仅与凝血系统有关,还与血管内膜损伤、炎症损伤及血液流速具有密切的联系[4]。
现代中医根据发病机制将深静脉血栓栓塞分为气虚血瘀型、脾肾阳虚型及湿热下注型,而“淤血”贯穿于深静脉血栓的发生与发展,因而中医内治方主要以“清热利湿、活血通脉”为主,再辅以针灸、外敷、熏洗等外治或综合疗手段。淫羊藿苷是淫羊藿中淫羊藿总黄酮的主要成分,其具有降黏解聚、阻滞血瘀与预防血栓的作用,在心血管疾病中受到了广泛关注[5-7],但其作用机制还有待研究。本实验主要观察淫羊藿苷对静脉血栓大鼠凝血功能、炎症因子及纤溶系统的影响,进一步明确其作用机制,为中医治疗临床预防与治疗深静脉血栓形成提供实验室数据。
1 材料与方法
1.1 材料 淫羊藿苷(≥98% HPLC,南京广润生物制品有限公司),戊巴比妥钠(北京智杰方远科技有限公司),白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、组织型纤溶酶原激活剂(tissue plasminogen activator,tPA)、纤溶酶原激活剂抑制剂-1(plasminogen activator inhibitor-1,PAI-1)Elisa 试剂盒(上海酶联生物科技有限公司),电子天平(华志科学仪器有限公司),全自动凝血分析仪(南京贝登医疗股份有限公司),离心管(宁波拓普森科学仪器有限公司),Power SYBR Green PCR Master Mix 试剂盒(北京雅安达生物技术有限公司),cNDA 逆转录试剂盒(广州泛思生物科技有限公司),NF-κB p65、VCAM-1、TF、GAPDH 抗体(碧云天生物技术有限公司)。
实验动物:10 周龄SD 大鼠54 只,雌雄各半,体质量(230±30)g,清洁级,购自河北医科大学实验动物中心,使用许可SYXK(冀)2020-002。饲养于实验动物房中,温度22 ~25 ℃,空气相对湿度50% ~65%,光暗循环周期为12 h/12 h,大鼠自由摄食、饮水。实验过程中对动物的处理严格依照国家对医学实验动物的相关要求进行。
1.2 实验分组 采用随机数字表法将54只大鼠分为5 组,假手术组(n=10)、血栓组(n=14)、低剂量淫羊藿苷组(n=10)、中剂量淫羊藿苷组(n=10)、高剂量淫羊藿苷组(n=10),假手术组开腹后仅游离下腔静脉,不给予结扎处理,其余4 组均进行静脉血栓造模。
造模方法:参考以往研究方法[8]复制静脉血栓模型。3%戊巴比妥钠(1.2 mL/kg)腹腔注射麻醉实验大鼠,将大鼠仰卧位固定于操作台上,腹中部除毛,碘伏消毒后铺巾,在剑突下腹正中做一长约6 cm 的切口,暴露腹腔,仔细游离左肾静脉与下腔静脉汇合处,将1 mL 注射器针头与下腔静脉平行放置,采用4-0 慕丝线结扎左肾静脉下方的下腔静脉,缓慢抽出针头。缝合切口。术后腹腔注射青霉素10 万U 预防感染。结扎24 h 后,从血栓组中随机选择4 只大鼠麻醉后处死,打开腹腔,解剖下腔静脉见血栓形成,说明造模成功。
给药方法:结扎1、24、48、72 h 后,低、中、高剂量淫羊藿苷组大鼠舌下静脉注射10、20、40 mg/kg的淫羊藿苷溶液,假手术组、血栓组大鼠舌下静脉注射1 mL/(kg·d)的生理盐水,每种剂量给药4 次。
1.3 血液学指标检测 末次给药1 h 后,颈总动脉采血,置于含枸橼酸钠溶液的离心管内,混匀后室温下3 000 r/min 离心10 min,获取上清液,采用全自动凝血分析仪检测凝血功能指标部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶原时间(prothrombin time,PT)、凝血酶时间(thrombin time,TT)、D-二聚体(D dimer,D-D)浓度。颈总动脉采血,置于普通离心管内静置30 min,3 000 r/min 离心10 min,获取上清液,-80 ℃保存,采用Elisa 法检测上清液中炎症因子IL-1β、TNF-α浓度,采用Elisa 法检测上清液中tPA 和PAI-1 的浓度。Elisa 法检测严格参照试剂盒说明书进行相应操作。
1.4 血栓重量检测 处死大鼠后,完整取出两结扎点之间的下腔静脉,小心分离下腔静脉内皮与血栓,取出血栓组织块,洗去多余水分;随后转移至培养皿中,置于干燥器内室温干燥24 h,称重。计算血栓抑制率,血栓抑制率=(m血栓组重量-m实验重量)/m血栓组重量×100%。
1.5 RT-PCR 检测 取下腔静脉血管组织,匀浆后提取组织总RNA,按照cNDA 逆转录试剂盒将血管组织RNA 逆转录为cDNA,反应条件为:37 ℃1 h,95 ℃3 min。以cNDA 为模板,按Power SYBR Green PCR Master Mix试剂盒说明书配RT-PCR反应体系,反应条件,95 ℃3 min,93 ℃30 s,55 ℃45 s,共40 个循环。引物序列:(1)NF-κB p65,上游引物5′-CCGGAGCTGGAGAACAACAAG-3′,下游引物5′-GCACTGGCCGGAGCACACC-3′;(2)VCAM-1,上游引物5′-CCGCGAGCGGGAGCGCAT-3′,下游引物5′-GCCACATCAGCCAGGTTGTACACC-3′;(3)TF,上游引物5′-ACAAACTGTTTTGAAAATCCA-3′,下游引物5′-CGAGTCATTGCATACTGTCC-3′;(4)GAPDH,上游引物5′-GAGGGAAATCGTGCGTGAC-3′,下游引物5′-CTGGAAGGTGGACAGTGAG-3′。
1.6 Western blot 检测 取100 mg 下腔静脉血管组织,加入组织裂解液1 mL,匀浆,4 ℃下14 000×g离心10 min,获取上清液。利用BCA 法检测蛋白浓度。将蛋白样本置入沸水中煮沸5 min,冷却后置于-20 ℃冰箱内保存。配制分离胶、浓缩胶,拔梳子,加入蛋白样品20 μL/孔,上层浓缩胶恒压80 V电泳30 min,下层分离胶恒压120 V 电泳100 min,转至PVDF 膜上,转膜50 ~100 min;洗膜3 次,置入5%BSA 中慢速封闭2 h,再次洗膜3 次,将膜浸泡于一抗(1∶1 000)中4 ℃孵育过夜,一抗分别为NF-κB p65、VCAM-1、TF、GAPDH;洗膜3 次,将膜浸泡于羊抗兔二抗(1∶500)中室温孵育1 h;洗膜3 次,ECL 显影。
1.7 统计学方法 采用统计学软件SPSS 23.0进行统计学处理,计量资料采取均数±标准差的表达方式,多组间比较进行单因素方差分析,两组之间作独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 术后实验动物一般情况 假手术组大鼠术后精神状态良好,饮食、活动正常;血栓组大鼠术后饮食及活动量减少,下肢红肿,皮温增高,经过药物治疗后上述症状逐渐好转。假手术组大鼠术后精神状态良好,饮食、活动正常;血栓组大鼠术后饮食及活动量减少,下肢红肿,皮温增高,经过药物治疗后上述症状逐渐好转。
2.2 大鼠血栓重量 5 组大鼠静脉血栓大体观见图1。相较于血栓组,低、中、高剂量淫羊藿苷大鼠血栓干重量明显下降(P<0.05),并且中剂量组血栓干重量低于低剂量淫羊藿苷组(P<0.05),高剂量淫羊藿苷组低于中剂量淫羊藿苷组(P<0.05)。见表1。

图1 大鼠静脉血栓大体观Fig.1 General view of venous thrombosis in rats
表1 大鼠血栓干重量Tab.1 Thrombus dry weight in rats ±s

表1 大鼠血栓干重量Tab.1 Thrombus dry weight in rats ±s
注:aP <0.05,vs.血栓组;bP <0.05,vs.低剂量淫羊藿苷组;c P <0.05,vs.中剂量淫羊藿苷组
?
2.3 大鼠血液学指标检测
2.3.1 凝血功能 相较于假手术组,血栓组APTT、PT、TT 减少(P<0.05),D-D 浓度升高(P<0.05)。相较于血栓组,低、中、高剂量淫羊藿苷组大鼠血清APTT、PT、TT 增加(P<0.05),D-D 浓度降低(P<0.05),并且该作用具有淫羊藿苷剂量依赖性,淫羊藿苷剂量越大作用越显著。见表2。
表2 大鼠凝血功能指标Tab.2 Coagulation function indexes of rats ±s
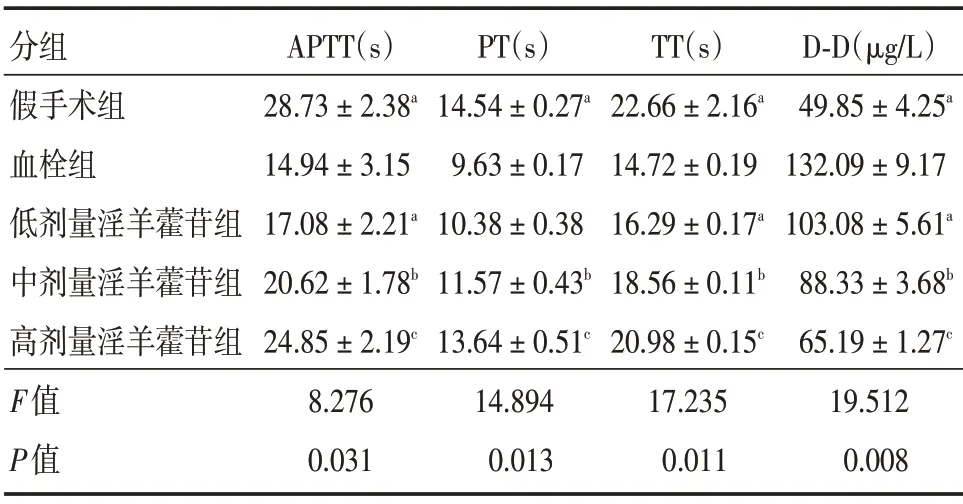
表2 大鼠凝血功能指标Tab.2 Coagulation function indexes of rats ±s
注:aP <0.05,vs.血栓组;bP <.05,vs.低剂量淫羊藿苷组;cP <0.05,vs.中剂量淫羊藿苷组
分组假手术组血栓组低剂量淫羊藿苷组中剂量淫羊藿苷组高剂量淫羊藿苷组F值P值APTT(s)28.73±2.38a 14.94±3.15 17.08±2.21a 20.62±1.78b 24.85±2.19c 8.276 0.031 PT(s)14.54±0.27a 9.63±0.17 10.38±0.38 11.57±0.43b 13.64±0.51c 14.894 0.013 TT(s)22.66±2.16a 14.72±0.19 16.29±0.17a 18.56±0.11b 20.98±0.15c 17.235 0.011 D-D(μg/L)49.85±4.25a 132.09±9.17 103.08±5.61a 88.33±3.68b 65.19±1.27c 19.512 0.008
2.3.2 炎症因子 相较于假手术组,血栓组IL-1β、TNF-α 浓度显著升高(P<0.05);相较于血栓组,低、中、高剂量淫羊藿苷组IL-1β、TNF-α 浓度显著降低(P<0.05);中剂量淫羊藿苷组IL-1β、TNF-α 浓度低于低剂量淫羊藿苷组(P<0.05),高剂量淫羊藿苷组IL-1β、TNF-α 浓度低于中剂量淫羊藿苷组(P<0.05)。见表3。
表3 5 组大鼠血清的炎症因子与纤溶系统浓度Tab.3 Serum inflammatory factors and fibrinolytic system concentrations in 5 groups ±s

表3 5 组大鼠血清的炎症因子与纤溶系统浓度Tab.3 Serum inflammatory factors and fibrinolytic system concentrations in 5 groups ±s
注:aP <0.05,vs.血栓组;bP <0.05,vs.低剂量淫羊藿苷组;cP <0.05,vs.中剂量淫羊藿苷组
分组假手术组血栓组低剂量淫羊藿苷组中剂量淫羊藿苷组高剂量淫羊藿苷组F 值P 值IL-1β(ng/L)58.01±8.21a 118.29±13.18 102.14±9.43a 88.37±6.81b 71.09±4.97c 11.743 0.003 TNF-α(ng/L)109.24±18.33a 145.93±20.07 136.28±14.24a 124.79±15.26b 113.07±10.62c 9.351 0.001 tPA(μg/L)13.56±3.07a 6.67±1.46 8.99±2.52a 10.37±2.88b 11.79±3.38c 16.672<0.001 PAI-1(μg/L)35.35±7.23a 96.37±19.13 82.03±11.05a 69.38±9.76b 49.07±8.22c 14.357<0.001
2.3.3 纤溶系统指标 相较于假手术组,血栓组tPA 浓度显著降低(P<0.05),PAI-1 浓度显著升高(P<0.05);相较于血栓组,低剂量淫羊藿苷组tPA浓度显著升高(P<0.05),PAI-1 浓度显著降低(P<0.05);相较于低剂量淫羊藿苷组,中剂量淫羊藿苷组tPA 浓度显著升高(P<0.05),PAI-1 浓度显著降低(P<0.05);相较于中剂量淫羊藿苷组,高剂量淫羊藿苷组tPA 浓度显著升高(P<0.05),PAI-1 浓度显著降低(P<0.05)。见表3。
2.4 RT-PCR 检测 相较于假手术组,模型组NFκB p65、VCAM-1、TF mRNA 表达量显著增加(P<0.05);相较于血栓组,低、中、高剂量淫羊藿苷组NF-κB p65、VCAM-1、TF mRNA 表达量显著减少(P<0.05),中剂量淫羊藿苷组NF-κB p65、VCAM-1、TF mRNA表达量少于低剂量淫羊藿苷组(P<0.05),高剂量淫羊藿苷组NF-κB p65、VCAM-1、TF mRNA表达量少于中剂量淫羊藿苷组(P<0.05)。见图2。

图2 大鼠静脉血管NF-κB p65、VCAM-1、TF 的基因表达量Fig.2 Gene expression levels of NF-κB P65,VCAM-1 and TF in rat veins
2.5 Western blot 检测 相较于假手术组,模型组NF-κB p65、VCAM-1、TF 的蛋白表达量显著增加(P<0.05);相较于血栓组,低、中、高剂量淫羊藿苷组NF-κB p65、VCAM-1、TF 的蛋白表达量显著减少(P<0.05),中剂量淫羊藿苷组NF-κB p65、VCAM-1、TF 的蛋白表达量少于低剂量淫羊藿苷组(P<0.05),高剂量淫羊藿苷组NF-κB p65、VCAM-1、TF 的蛋白表达量少于中剂量淫羊藿苷组(P<0.05)。见图3。
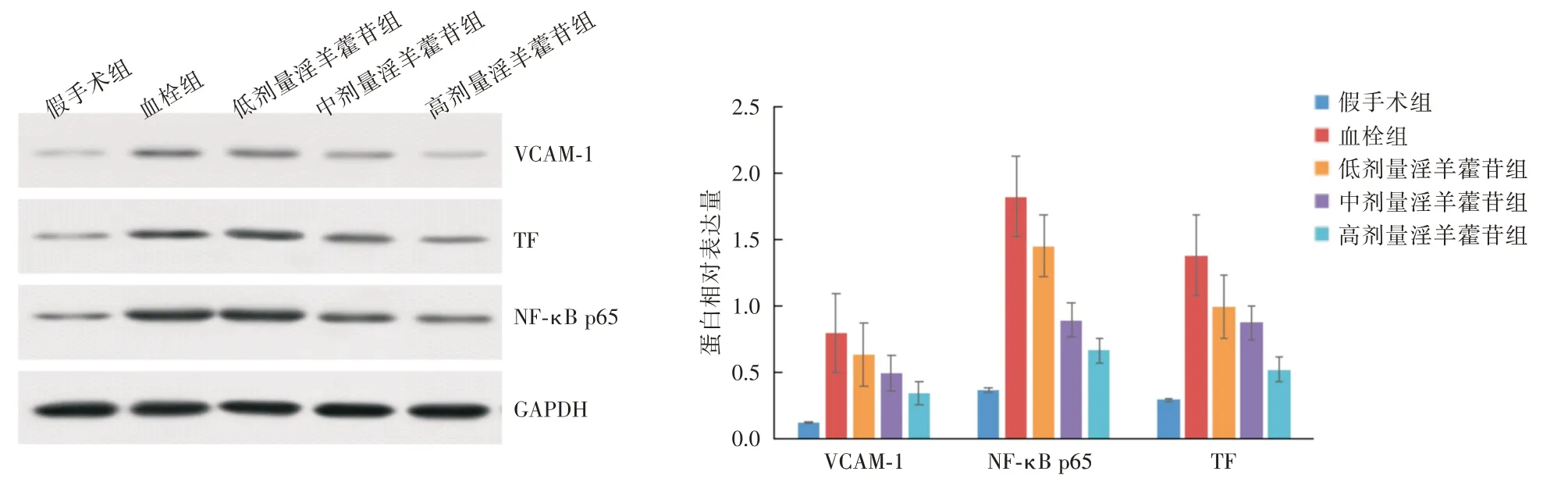
图3 大鼠静脉血管NF-κB p65、VCAM-1、TF 的蛋白表达量Fig.3 Protein expression levels of NF-κB p65,VCAM-1 and TF in rat veins
3 讨论
作为我国的传统中药,淫羊藿具有补肝肾、强筋骨、祛风湿的功效,是补肾壮阳与强阳起瘘方剂的常用中药,多用于肾阳不足、风湿痹痛与骨瘘的治疗[9-11]。而作为淫羊藿中的主要化学成分,淫羊藿苷可用于治疗骨质疏松症、心血管系统疾病、免疫性疾病、神经系统疾病等[12-13]。研究证明淫羊藿苷可以阻止不利因素对心肌细胞与血管内皮的损伤。WANG 等[14]过氧化氢诱导的人脐静脉内皮细胞损伤为模型,发现淫羊藿苷可抑制内质网中GRP78、ATF4 和eIF2α 蛋白表达减轻氧化应激损伤,发挥保护血管内皮细胞的作用。HU 等[15]以氧化低密度脂蛋白诱导的人脐静脉内皮细胞损伤为模型,发现淫羊藿可通过调节Bcl-2 和caspase-3 的蛋白和mRNA 表达水平减少人脐静脉内皮细胞的凋亡,发挥血管内皮细胞保护作用。以上结果证实,淫羊藿苷具有血管内皮保护作用。
本实验采用下腔静脉狭窄法复制深静脉血栓模型,在该造模过程中,血栓形成于下腔静脉远心端的上游,虽然血栓生长方向与临床中的患者相反,但是形成的血栓结构与人体血栓类似;另外,该法造模后在不损伤静脉内皮的情况下可允许少量血流通过,更加贴近人体内血栓区域静脉内皮完整的病理状态,进一步判断药物的治疗作用与作用途径[16]。静脉狭窄法诱导的深静脉血栓形成是一个动态的病理过程,血栓重量是评价其成熟的典型指标。本实验结果显示,采用下腔静脉狭窄法成功复制了深静脉血栓模型,而淫羊藿苷治疗可显著降低血栓重量,表明淫羊藿苷不但能抑制血栓的形成,还能促进血栓的溶解,3 种剂量下的药物均可显著抑制血栓的形成,并且具有剂量依赖性,淫羊藿苷剂量越大抑制效果越明显。
人体的凝血途径主要有外源性凝血途径、内源性凝血途径及共同途径,PT 是评估外源性凝血系统状态的重要指标,APTT 是评估内源性凝血系统状态的重要指标,二者时间的减少提示血液高凝状态与血栓性疾病[17-18]。D-D 是交联纤维蛋白水解产物,是一种特异性降解产物,是继发性纤溶亢进的标志物[19],当其浓度升高时说明血浆凝血因子活化与纤维蛋白溶解系统启动,因此,血浆中检测D-D 对于血栓性疾病的早期诊断、疗效评估和预后判断具有重要意义。本实验结果显示,复制深静脉血模型后,大鼠血液处于高凝状态,全身凝血系统受到较大影响;而淫羊藿苷可改善造模大鼠的血液高凝状态,并且具有剂量依赖性,淫羊藿苷剂量越大抑制改善越明显。韩丹等[20]研究发现40 mg/kg 的淫羊藿苷可延长深静脉血栓大鼠血浆的APTT、PT、TT,减少血浆纤维蛋白原浓度,改善血液高凝状态,与本实验结果基本一致。
tPA、PAI-1 是主要由内皮细胞产生的衡量纤溶系统的重要指标,如果二者之间的平衡遭到破坏,将引发血栓的形成[21-22]。tPA 主要是诱导纤维蛋白降解,PAI-1 是纤溶酶原活化物抑制物,其主要作用是抑制tPA。本实验结果显示,淫羊藿苷可通过调节纤溶系统抑制血栓的形成。
炎症参与了血栓的形成与发展。在IL-1β 的刺激下,单核细胞、中性粒细胞黏附于血管内皮,促进内皮细胞合成IL-8 和相关趋化因子,诱导白细胞迁移至炎症区域[23-24];另外,IL-1β 还会促进单核细胞表达TF,促进血栓形成[25]。TNF-α 是由活化的单核细胞、巨噬细胞产生的一种强烈促炎症因子,其可诱导内皮细胞表达TF,促进血栓形成;其还可促进多种炎性介质的释放,影响血栓的发展[26]。本实验证实其在静脉血栓模型中同样发挥了抗炎作用。
NF-κB 是调控DNA 转录、细胞因子分泌和细胞存活的一种蛋白复合物,近年来的相关研究显示其在静脉血栓形成中的炎症机制中扮演着中重要角色,其在内皮细胞、血小板、炎性反应间的相互作用中发挥调控作用,打破凝血-纤溶的平衡状态,因而诱发血栓的形成[27-28]。LDENG 等[29]研究发现,血小板激动剂(Pam3CSK4)介导的血小板活化与NF-κB 信号通路有关,血小板激动剂或脂多糖可导致NF-κB IκBα 降解和NF-κB p65 磷酸化,阻断血小板的活化。在血管内皮细胞中,NF-κB通路激活后分泌出的炎性细胞因子(TNF-α、IL-1等)会损伤内皮细胞,促使其进一步释放有害的黏附分子、细胞因子、酶类等介质,这些物质又进一步加重内皮细胞的损伤。NARITA 等[30]研究认为作为凝血因子的TF 能够影响机体凝血功能,其高表达和NF-κB 通路调控密切相关。在多种炎性反应中,NF-κB 信号通路是中心环节,该信号通路激活后可提升促炎症因子的浓度,反过来,炎症反应又通过该通路促进内皮细胞表达单核细胞趋化蛋白-1、血小板内皮细胞黏附分子、VCAM-1 等黏附分子和细胞因子,进一步激活NF-κB 信号通路,如此反复,促进炎症的级联反应,激活血小板聚集和凝血反应,形成高凝状态。本实验结果显示,NFκB 信号通路被激活;淫羊藿苷可抑制F-κB 信号通路的激活,降低血管内皮损伤。
本实验显示,在10 ~40 mg/kg 的剂量范围内,淫羊藿苷可通过调节凝血功能、纤溶系统、炎症反应来抑制静脉血栓的形成,并且该作用可能与调节控NF-κB p65 信号通路有关。但是,本实验还存在很多不足之处,例如:关于淫羊藿苷的最佳作用剂量还有待进一步的验证,接下来的实验应进一步增加药物作用剂量;实验周期仅设置了一个观察时间点,未进行动态观察,未来将增加时间点,进一步观察各指标的动态变化。
