青稞镰孢根腐病病原鉴定及致病性分析
2022-10-19李雪萍李敏权许世洋刘梅金漆永红李建军李晓蓉
李雪萍,李敏权,许世洋,刘梅金,漆永红,李建军,李晓蓉
(1.甘肃省农业科学院植物保护研究所,甘肃兰州 730070;2.甘肃农业大学草业学院,甘肃兰州 730070;3.甘南州农业科学研究所,甘肃合作 747000;4.甘肃省农业科学院农业质量标准与检测技术研究所,甘肃兰州 730070)
青稞是青藏高原地区裸粒大麦(L.var.nudum)的统称,其成熟期短、耐寒性强,是我国藏区及古埃及人民的传统粮食作物。研究发现,青稞富含多种氨基酸、维生素、膳食纤维、β-葡聚糖以及钙、镁、磷、锌、锰、硒等矿质元素,在增加胃动力、降低血脂、防治糖尿病、高原病等方面有独特的保健作用,且符合现代人类“三高两低”(高蛋白、高纤维、高维生素和低脂肪、低糖)的饮食结构需要。是健康食品加工、酿酒等的主要原料。青稞病害的发生对其生产造成了严重的威胁。大麦根腐病是一种世界性病害,在澳大利亚、加拿大、美国及我国青藏高原地区发生频繁。国外对大麦根腐病的研究发现,能引起大麦类作物根腐病的病原以镰孢菌(spp)、麦根腐平脐蠕孢()和丝核菌(spp.)为主,优势病原因地而异,如美国明尼苏达州大麦根腐病的病原是禾谷镰孢,加拿大魁北克大麦根腐病的病原为麦根腐平脐蠕孢(),爱德华王子岛的大麦根腐病的优势病原为燕麦镰孢()等。国内对包括青稞在内的大麦根腐病尚未全面明确其病原。
青稞是甘肃省甘南藏族自治州人民的粮饲兼用作物,青稞产业向好发展是当地人民生活水平及生态安全的保障,但根腐病发生普遍,为害严重。青稞感染根腐病后,品质下降,减产15%~30%,严重时颗粒无收;根和芽的鲜重和干重、株粒数均显著减少,从而导致其总产量降低;感病植株的干物质积累量下降23.28%~82.77%,脂肪含量下降28.45%~79.25%,蛋白质含量下降0.55%~76.62%。因此,青稞根腐病的防控工作迫在眉睫。本研究以甘肃省甘南州青稞为研究对象,调查其根腐病的发生率,记录发病症状,并采集样品分离其病原,采用形态鉴定和分子鉴定相结合的方法确定其分类地位,检测其致病特性,明确病害类型,为青稞根腐病的流行监测和防控工作夯实基础。
1 材料与方法
1.1 调查采样
2015年至2017年间,在青稞生长期的苗期及成株期,多次对甘肃省甘南州合作市、临潭县、卓尼县等不同区域的青稞根腐病进行调查,估算田间发病率,记录发病症状,并采集样品,低温运输至实验室对其病原进行分离鉴定。
1.2 分离纯化
将青稞植株根部清洗干净后,于超净工作台中从根部病健交界处剪下根段放入装有70%乙醇的小烧杯中浸2~3 s后,在0.1%的升汞溶液中消毒10 s,用无菌水涮洗4次,放在已灭菌的滤纸上吸干;用无菌解剖刀切去根段两端,接入PDA平板;约3~4 d后,及时将根段两端长出的菌丝转接到另一PDA平板,即分离成功。经显微观察,待所分离的菌株产孢后,用单孢分离法将其纯化,于-80 ℃保存备用。
1.3 菌株鉴定
1.3.1 形态鉴定
观察记录纯培养菌株在PSA培养基上的形态特征,测定其4 d时的菌落直径,在400倍光学显微镜下观察经CLA培养基培养后的孢子形态,参照《镰刀菌属》确定其种属。
1.3.2 分子鉴定
根据形态鉴定结果每个菌种随机选取2~5株进行分子鉴定。将待鉴定的菌株在PDA培养基平板上25 ℃培养5 d后,接种于马铃薯葡萄糖培养液中,120 r·min、25 ℃摇床培养5 d,收集菌丝体,按照Fungal DNA Kit试剂盒说明书提取DNA。选取ITS1(5′-TCCGTAGGTGAACCTGCG G-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)、EF-1(5′-ATGGGTAAGGARGACAAGAC-3′)和EF-2(5′-GGARGTACCAGTSATCATGTT-3′)作为引物对镰孢菌基因组DNA进行PCR扩增。反应体系为 25 μL,包括基因组DNA 1.0 μL、10×Buffer(含2.5 mmol·LMg)2.5 μL、Taq聚合酶(5 U·μL)0.5 μL、dNTP(10 mmol·L)1.0 μL、Primer(±10 μmol·L)1 μL,ddHO补至25 μL,轻弹混匀,瞬时离心收集管壁上的液滴。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸80 s,35个循环;72 ℃延伸7 min,4 ℃保存。取2 μL PCR产物用1%琼脂糖凝胶电泳检测。PCR 产物用AxyPrep DNA 凝胶回收试剂盒参照说明书进行回收;目的产物送北京天一辉远生物科技有限公司测序(测序仪为ABI3730-XL),将获得的序列拼接后于NCBI中进行序列比对,利用MEGA7构建系统发育树,1 000次重复,得到分子鉴定结果,并提交至NCBI系统,获得GenBank登录号。
1.4 致病性测定及相关指标计算
分别采用烧杯水琼脂法和盆栽法测定分离菌株的致病性,其中,发病率(%)=发病幼苗数/幼苗总数×100%;病情指数(DI)=(∑各级发病株数×病害分级值)/最高病害分级值×种子总数×100。
烧杯水琼脂法致病性分级标准:0级:健康无病,叶绿,根与根茎白;1级:根系有褐色斑点出现,但不超过30%;2级:根系成段变褐,但不缢缩发干,不超过30%;3级:根系成段变褐甚至变黑,缢缩发干,不超过50%;4级:根系成段变褐甚至变黑,缢缩发干,大于50%;或整个植株死亡。
盆栽法致病性分级标准:0级:健康无病;1级:根基部变褐,不软腐,不缢缩,叶子健康,根无明显病斑;2级:根基部及茎秆变褐,并有明显缢缩,叶尖或叶片发黄,根变褐;3级:根基部变褐腐烂,叶片发黄,根变褐甚至变黑;4级:根及根基部腐烂,整株幼苗坏死。
供试青稞品种为镰孢根腐病感病品种藏青2000,由甘南藏族自治州农业科学研究所提供。
将经致病性测定后的病株每个重复随机挑取3株,轻轻剪下其病根,接种于PSA培养基上,于25 ℃下培养7~10 d后,观察其孢子形态、培养特征,确认与接入时是否一致,将一致的确认为青稞根腐病的病原。
根据分离纯化、鉴定结果及致病性测定结果,统计各病原菌的分离率(各病原菌株数与总菌株数的比率)及检出率(各病原菌从样本中的检出概率),通过计算青稞根腐病各病原的种间致病力,确定优势病原。绝对发病率(%)=种内所有菌株的平均发病率;相对发病率(%)=绝对发病率×分离率;绝对病情指数=种内所有菌株的平均病情指数;相对病情指数=绝对病情指数×分离率。优势病原为相对发病率及病情指数较高的种。
1.5 数据统计及分析
基因序列的处理及系统发育树的构建采用CLUSTALX1.83、MEGA7完成;数据用Excel 2007和DPS 15.10整理和分析,采用Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 发病状况分析
对甘肃省甘南藏族自治州15个不同区域的青稞镰孢根腐病进行调查(表1),发现青稞镰孢根腐病的发病率为5%~20%,苗期发病症状主要表现为长势弱,不同程度的发黄或萎蔫,多有茎基部变褐、缢缩腐烂,种子根变褐、发干萎缩,严重时整株死亡;成株期发病症状多表现为穗白、粒瘪,茎秆发褐或黑红,根及茎基部缢缩发干或腐烂等(图1)。共得到病样30份,苗期18份,成株期12份。

a:苗期田间发病症状;b:苗期发病植株根部症状;c:成株期田间发病症状;d:成株期发病植株根部症状。
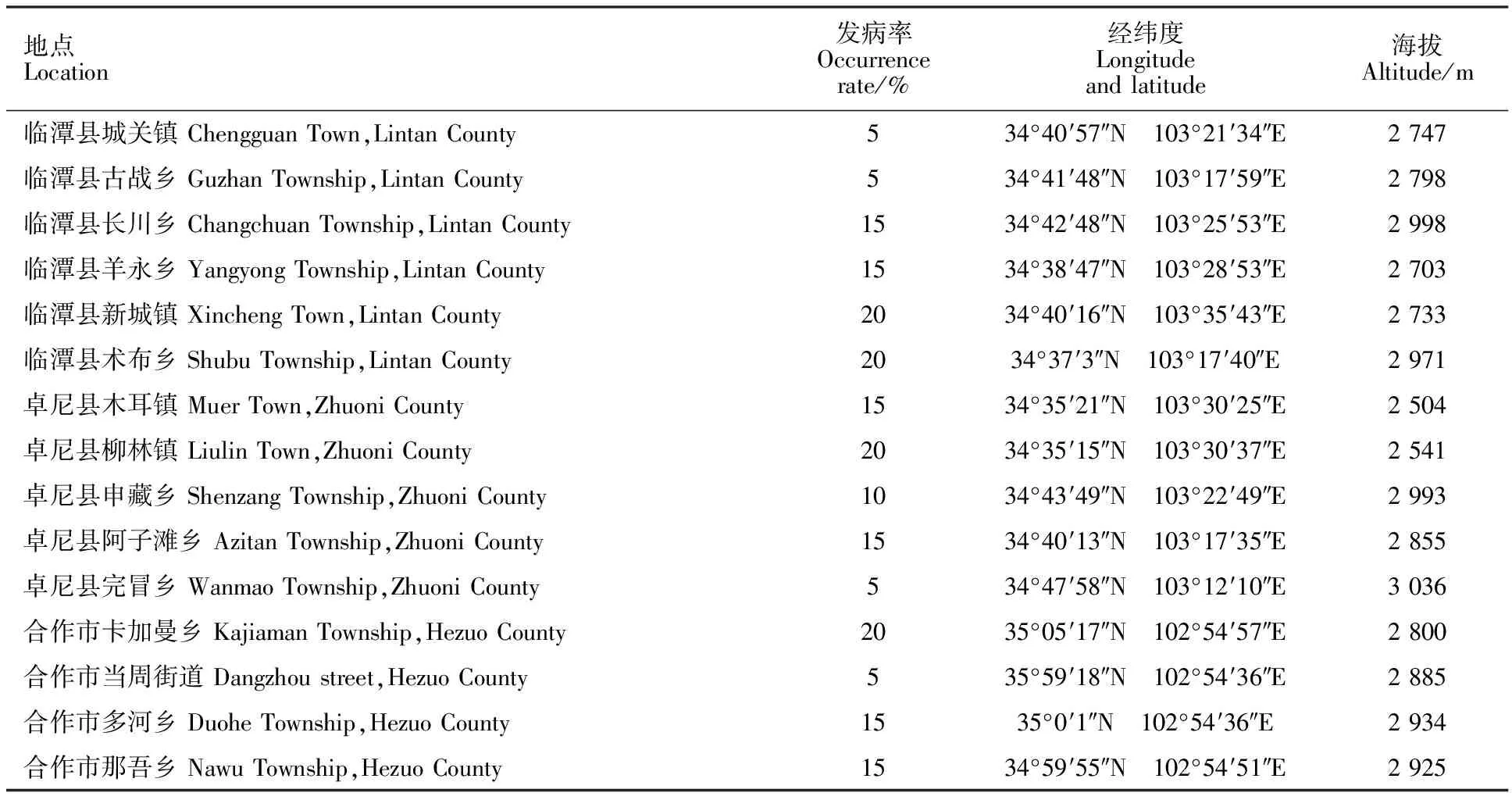
表1 青稞根腐病采样地点及发病率
2.2 菌株鉴定
2.2.1 形态特征鉴定
从30份病样中共分离纯化得到D1-1、D1-2等(表2)88株丝状真菌,其中D1-2等61株菌在PSA培养基上培养4 d平均菌落直径为4.8 cm,呈白色绒毛状,多数产玫红色和黄色色素,生长至7~10 d后,菌落正面呈浅黄棕色,背面玫红色变得浓重,趋于暗红色,菌丝变为毡状;经CLA培养基培养后,大型分生孢子形态一致,呈弯曲镰刀状,有明显的顶细胞和足细胞,4~7个分隔,平均大小为39.76~60.53 μm×3.03~4.56 μm,为燕麦镰孢(图2a1、a2、a3)。D1-1等15株菌在PSA培养基上培养4 d的平均菌落直径为5.7 cm,呈白色绒毛状,产黄褐色色素,偶产淡粉色色素;生长至7~10 d后,绒毛状菌丝逐渐退化,与培养基紧密结合,呈黄褐色辐射状;经CLA培养基培养后,其分生孢子形态一致,呈镰刀状,弯曲度大,顶细胞长,足细胞明显,4~7个分隔,平均大小为38.94~53.02 μm× 3.27~4.53 μm,为木贼镰孢(图2b1、b2、b3)。D10-1等4株菌在PSA培养基上培养4 d的平均菌落直径为5.4 cm,呈白色绒毛状,产玫红色色素,随着培养时间的延长,白色的气生菌丝退化变稀薄;在CLA培养基上产生大小分生孢子,大型分生孢子镰刀状,弯曲,有明显的足细胞,3~5个分隔,平均大小为32.02~51.24 μm×4.08~4.69 μm,小型分生孢子卵形或梨形,为三线镰孢(图2c1、c2、c3)。D14-1等4株菌在PSA培养基上呈白色丛卷毛状或毡状,气生菌丝稀疏,呈辐射状,产淡黄褐色至灰棕色色素,在PSA及CLA培养基上的培养物均未发现孢子,菌落形态如图2d1、d2、d3、d4所示,暂不能确定种,有待分子鉴定。D22-1与D32-1两株菌在PSA培养基上培养4 d的平均菌落直径为5.3 cm,呈白色绒毛状,气生菌丝发达,产生浓重的玫红色色素;培养至7~10 d后,气生菌丝变黄疏散,最终呈棕红色;在CLA培养基上分生孢子形状较一致,3~7个分隔,镰刀状,平均大小为26.06~40.64 μm×2.82~4.89 μm,有足细胞和顶细胞,为锐顶镰孢(图2e1、e2、e3)。D29-2与D29-3两株菌在PSA培养基上呈白色近毡状,产少量的淡黄褐色色素,未发现孢子,菌落形态如图2f1、f2所示,为。
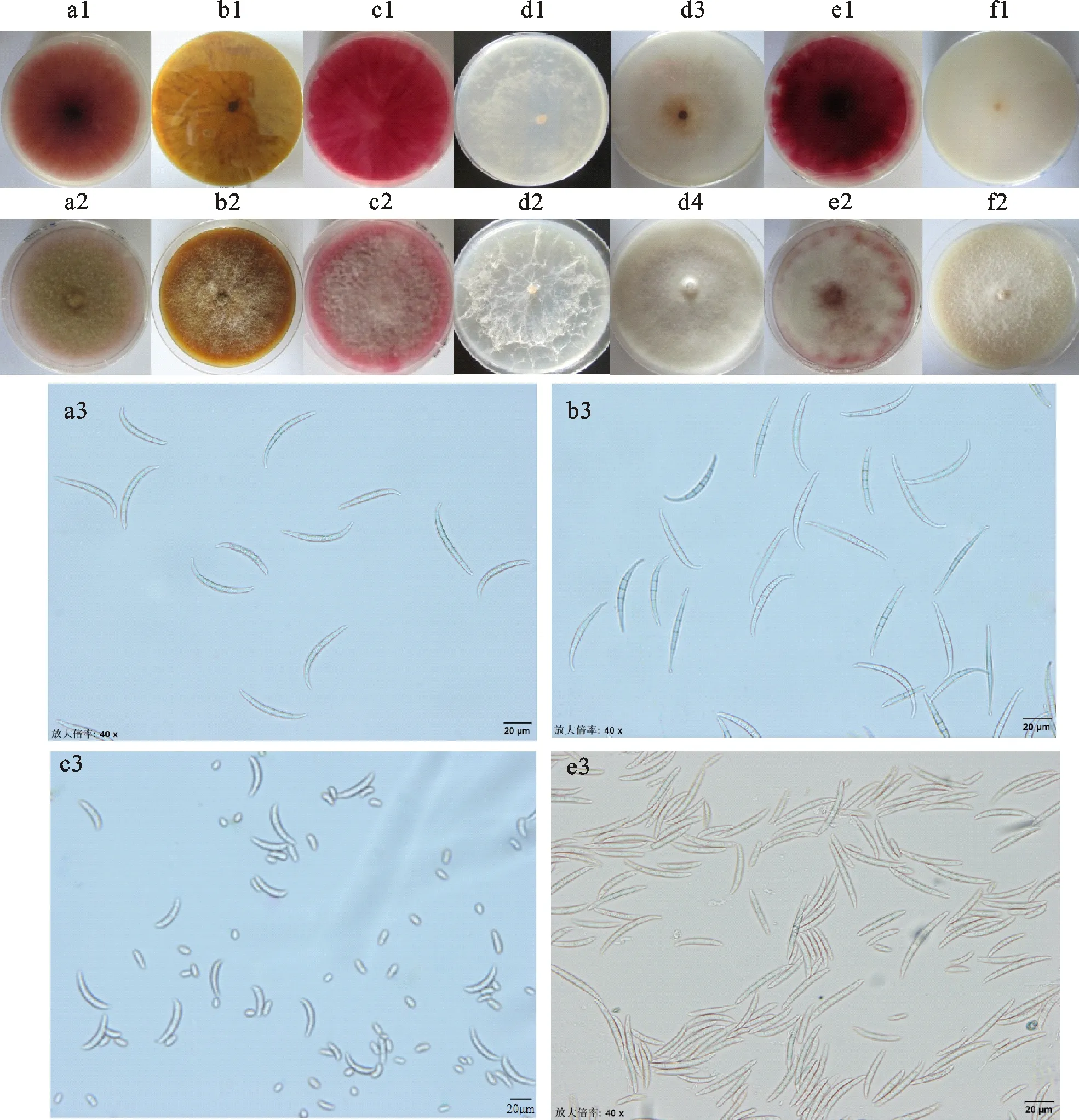
a1、a2、a3:燕麦镰孢(Fusarium avenaceum);b1、b2、b3:木贼镰孢(Fusarium equiseti);c1、c2、c3:三线镰孢(Fusarium tricinctum);d1、d2、d3、d4:柔毛镰孢(Fusarium flocciferum);e1、e2、e3:锐顶镰孢(Fusarium acuminatum);f1、f2:Fusarium langsethiae;a1、b1、c1、d1、d3、e1、f1:菌落背面;a2、b2、c2、d2、d4、e2、f2:菌落正面;a3、b3、c3、e3:孢子形态。
2.2.2 分子鉴定
如图3和图4所示,基于ITS及TEF序列构建系统发育树发现,D1-2、D7-3、D15a-1、D23-6、D23-4、D24-4、D25-2、D33-1共8株菌与燕麦镰孢的遗传距离为0,自展支持率大于90,与形态鉴定结果一致。D22-2、D32-1与锐顶镰孢的遗传距离为0,基于ITS序列的自展支持率为91,基于TEF序列的自展支持率为97,与形态鉴定结果相同。D14-1、D15b-1、D27-1与柔毛镰孢的遗传距离为0,自展支持率大于85,鉴定为柔毛镰孢。D29-2、D29-3与的遗传距离为0,自展支持率99,鉴定为。D1-1、D20-2、D25-1与木贼镰孢的遗传距离为0,基于ITS序列的自展支持率为99,基于TEF序列的自展支持率为98,与形态鉴定结果相同。D10-1、D10-2、D23-3与三线镰孢的遗传距离为0,自展支持率为91,与形态鉴定结果相同。以上结果说明,分子及形态鉴定结果可靠,提交至NCBI获得的登录号分别为KY365564(D25-1),KY365572(D23-3),KY365576(D10-1),KY365577(D10-2),KY365591(D29-2),KY365592(D29-3)KY365594(D27-1),KY365595(D22-2),KY365596(D32-1),KY365597(D23-4),KY365598(D24-4),KY365599(D23-6),KY365600(D25-2),KY365601(D33-1),KY365603(D1-1),KY365604(D20-2),KY365605(D14-1),KY365606(D15b-1),KY365607(D1-2),KY365608(D7-3),KY365610(D15a-1)。
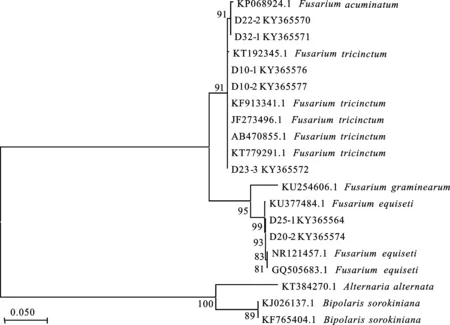
图3 基于ITS序列的青稞镰孢根腐病病原系统发育树
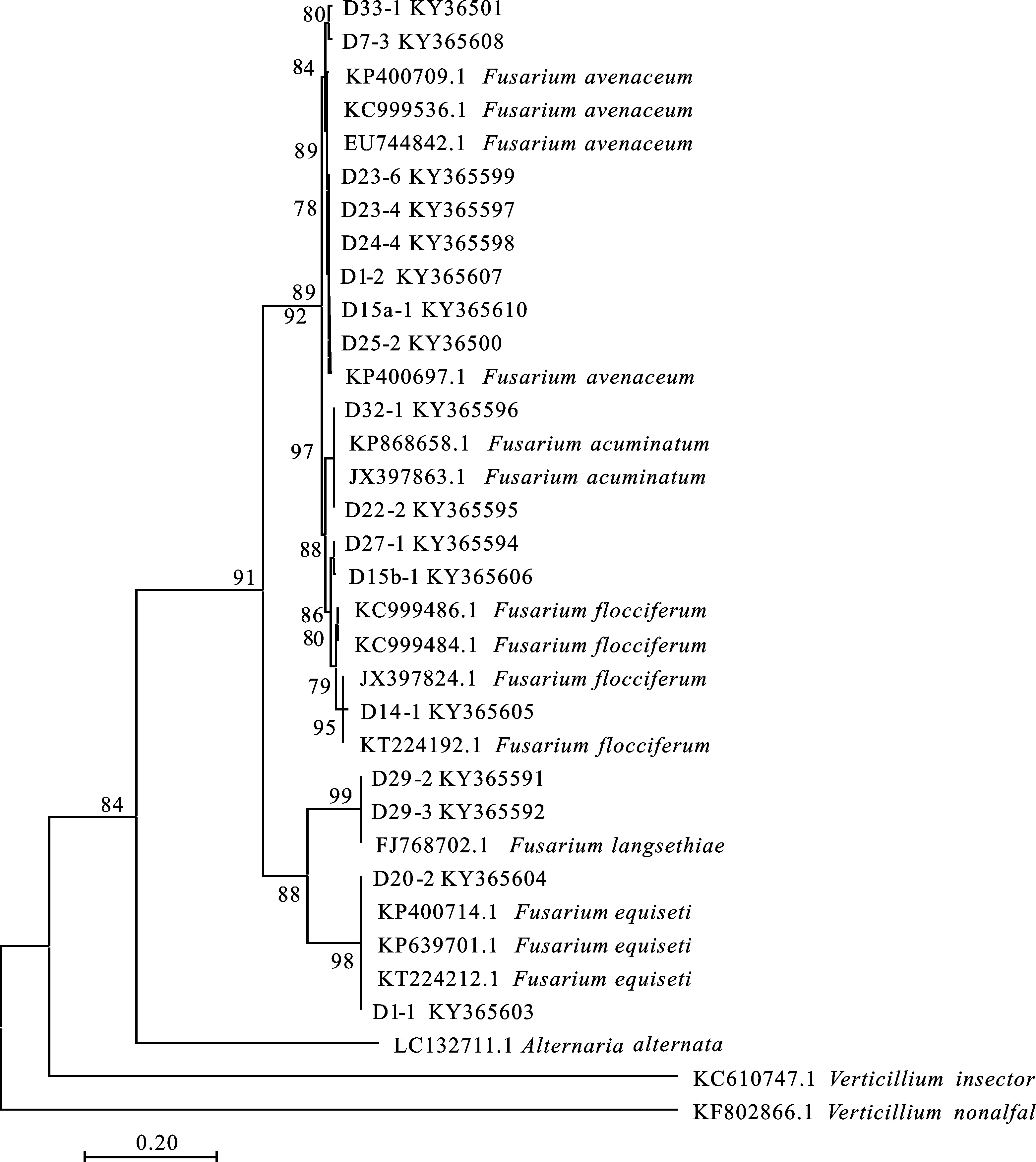
图4 基于TEF序列的青稞镰孢根腐病病原系统发育树
2.3 分离菌株的致病性与再分离结果分析
所分离的88株镰孢菌均有不同程度的致病性(表2),两种方法中青稞发病症状与田间苗期发病植株症状一致。烧杯水琼脂法测定结果显示,燕麦镰孢、木贼镰孢、三线镰孢和柔毛镰孢的多数菌株间发病率及病情指数差异显著,燕麦镰孢有29株菌发病率达100%,最低为46.67%,病情指数最高达82.5(D20-1),最低为15(D24-2);木贼镰孢亦有多株菌发病率达100%,最低为 63.33%(D15b-2),病情指数最高为57.83(D13-2),最低为27.17(D1-3),各菌株之间致病力差异不显著;4株三线镰孢中D23-3的发病率和病情指数均最高,分别为100%和89.17,最低发病率则为81.67%(D10-1),最低病情指数为33.33(D10-2),各菌株间的致病力差异显著;4株柔毛镰孢最高发病率达100%(D32-4),最低80%(D14-1),病情指数最高41.67(D14-1),最低 10.17(D27-1);2株锐顶镰孢的发病率均为100%,病情指数分别为74.17和67.5,差异显著。2株发病率差异不显著,病情指数分别为 46.67和33.33。对相同菌株,盆栽法得到的发病率和病情指数较烧杯水琼脂法有不同程度降低,但整体趋势相同。
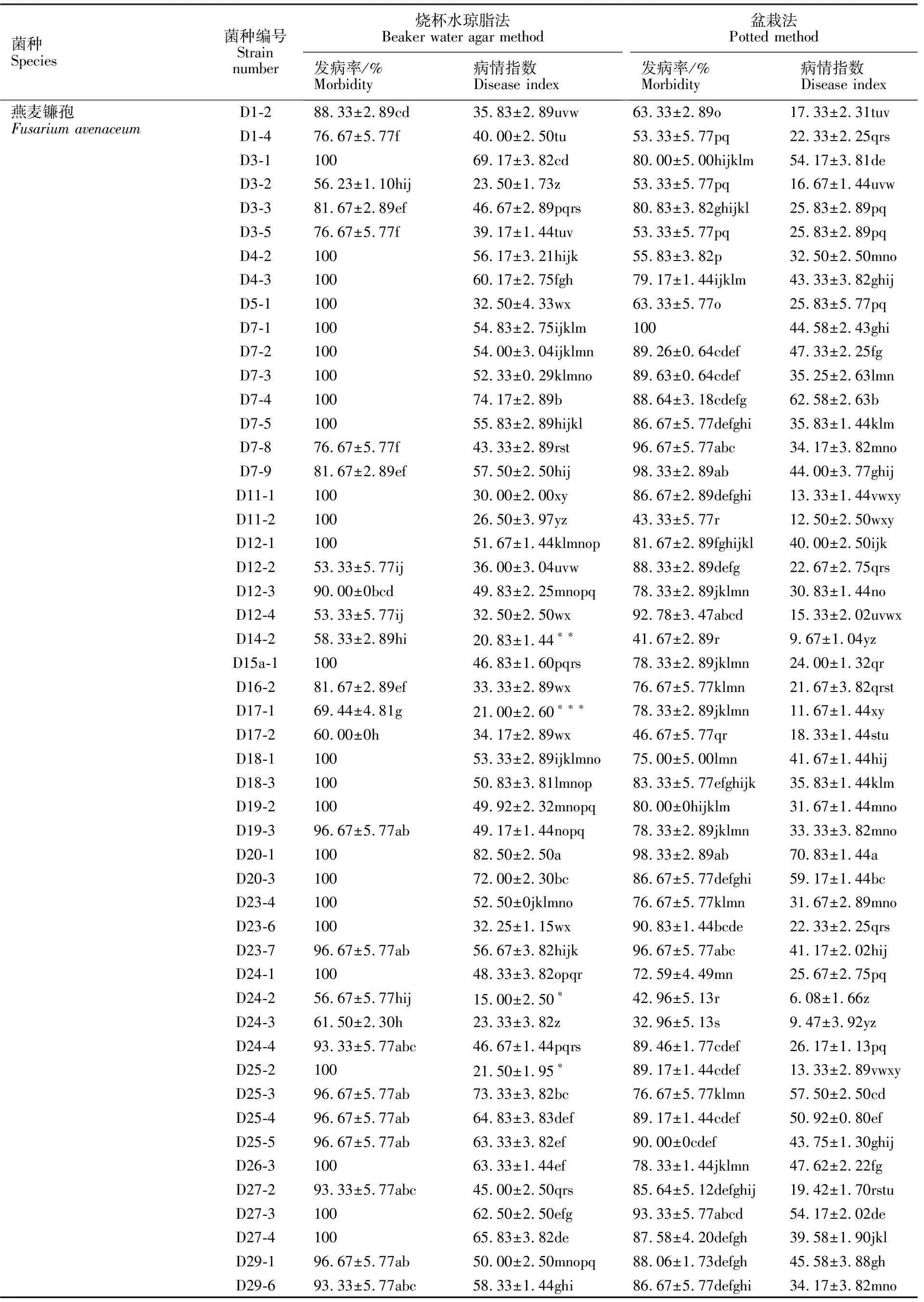
表2 接种镰孢菌菌株的青稞发病率及其病情指数
对发病植株的致病菌再次分离鉴定发现,其形态与接入时一致,符合柯赫氏法则。因此,确认燕麦镰孢、木贼镰孢、三线镰孢、柔毛镰孢、锐顶镰孢及6种镰孢菌为该区青稞根腐病的主要病原,并确定该类根腐病为镰孢根腐。
2.4 致病性测定方法及病原分析
2.4.1 致病性测定方法对发病率和病情指数结果的影响
对烧杯水琼脂法和盆栽法两种方法得到的发病率及病情指数进行检验,发现这两种方法所测得的发病率及病情指数差异极显著(< 0.01)。对其进行回归分析(图5和图6),烧杯水琼脂法和盆栽法所测得的发病率及病情指数均呈线性正相关,发病率的相关系数为0.87,病情指数的相关系数则达0.92,相关性均显著,说明烧杯水琼脂法与盆栽法所反映的菌株发病率及病情指数的程度是一致的。

图5 烧杯水琼脂法与盆栽法所测发病率回归分析
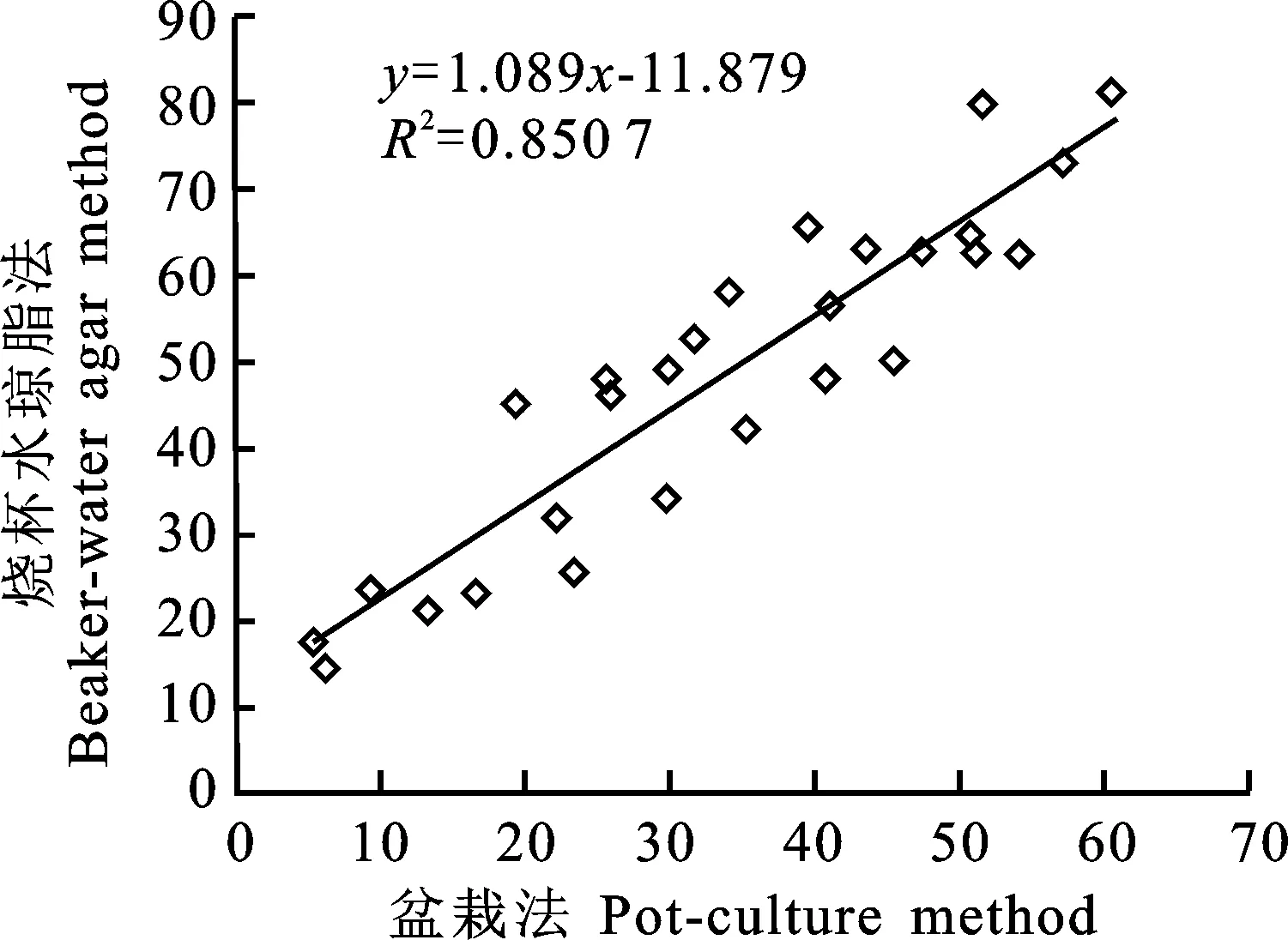
图6 烧杯水琼脂法与盆栽法所测病情指数回归分析
2.4.2 青稞根腐病镰孢菌的种类
共分离得到88株青稞镰孢根腐病病原菌,苗期50株,成株期38株,苗期镰孢根腐病的病原为燕麦镰孢、木贼镰孢、三线镰孢及柔毛镰孢,成株期镰孢根腐病病原更多样,除苗期4种镰孢菌外,还有锐顶镰孢及。但无论是苗期还是成株期,燕麦镰孢的分离率及检出率均最高,其次是木贼镰孢。其中,苗期燕麦镰孢的分离率为66%,检出率78%;成株期分离率则为74%,检出率达92%。从检出率来看,除木贼镰孢外,成株期较苗期各病原的检出程度均较高(表3)。
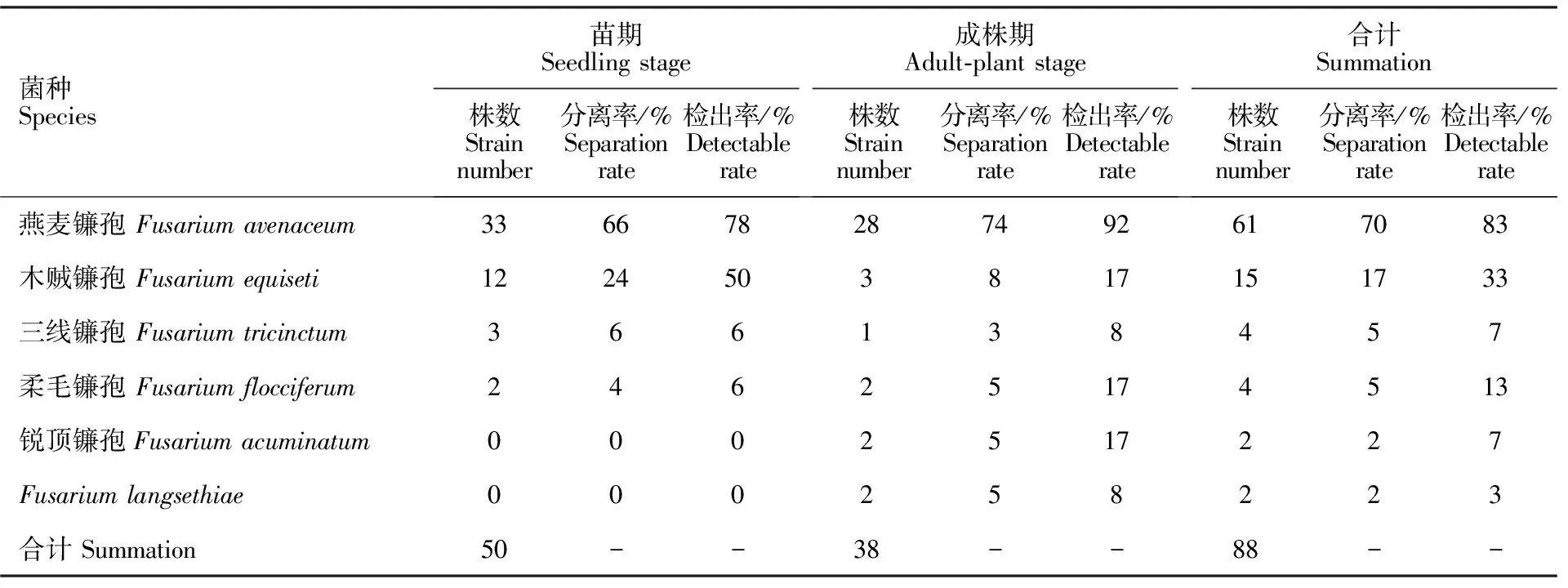
表3 青稞镰孢根腐病病原组成及分离率
2.4.3 青稞根腐病镰孢菌优势种
通过对烧杯水琼脂法测定的各菌株种间综合致病力分析发现,青稞苗期根腐病的绝对发病率以木贼镰孢最高,达94.97%,成株期则以锐顶镰孢和三线镰孢最高,柔毛镰孢次之。苗期绝对病情指数以燕麦镰孢最高,为46.53,成株期则三线镰孢最高,锐顶镰孢次之。相对发病率及病情指数无论苗期还是成株期均燕麦镰孢最高,木贼镰孢次之。因此,确认燕麦镰孢为青稞镰孢根腐病的优势病原(表4)。

表4 镰孢菌种间综合致病力分析(烧杯水琼脂法)
通过对盆栽法测定的各菌株种间综合致病力分析发现,青稞苗期根腐病的绝对发病率柔毛镰孢最高,为89.17%,与烧杯水琼脂法的结果不一致;成株期为锐顶镰孢和三线镰孢最高,达100%,与烧杯水琼脂法所测得的结果一致。绝对病情指数苗期以柔毛镰孢最高,为39.17,与烧杯水琼脂法所得结果不一致;成株期则三线镰孢最高,为85.83,与烧杯水琼脂法测定结果一致。相对发病率及病情指数无论苗期还是成株期以燕麦镰孢最高,木贼镰孢次之,与烧杯水琼脂法所得结果完全一致。因此,得出燕麦镰孢为青稞镰孢根腐病的优势病原。

表5 镰孢菌种间综合致病病力分析(盆栽法)
3 讨 论
镰孢菌分布范围广,能引起小麦、玉米、蔬菜、中药材等的多种病害,如小麦冠腐病,玉米茎腐病、鞘腐病及穗腐病,水稻立枯病,大豆根腐病,甜瓜枯萎病,豇豆根腐病,莴苣叶斑病,以及党参茎基腐,滇黄精根茎腐病,铁皮石斛根腐病等中药材病害。本研究首次对甘肃省甘南藏族自治州青稞镰孢根腐病从苗期至成株期进行了详细的调查研究,明确了甘南藏族自治州青稞苗期根腐病病原为燕麦镰孢、木贼镰孢、三线镰孢、柔毛镰孢4种,成株期病原为燕麦镰孢、木贼镰孢、三线镰孢、柔毛镰孢、锐顶镰孢及共6种,由此可见,病原种类可因生长时期的不同而不同。但无论是苗期还是成株期,燕麦镰孢均为优势病原,这可能与各采样区生态环境有关。因此,在甘南藏族自治州目前青稞生产中,应高度重视燕麦镰孢的防治,同时也应该重视如木贼镰孢等致病力较强的病原种群。
在镰孢菌鉴定方面,产孢菌株通过形态鉴定均能确定到种,因此对产孢菌株只随机挑选了部分菌株进行分子鉴定。有研究表明,通过测定编码转录延伸因子区(TEF-1α)的序列进行镰孢菌的分子鉴定成功率较高且准确。但本研究在鉴定过程中发现,三线镰孢和锐顶镰孢的部分菌株通过测定该区序列并未能鉴定到种,反而测定其核糖体内部转录间隔区(ITS)的序列可以鉴定到种,且BLAST比对结果100%相似,通过构建的系统发育树发现遗传距离为零。木贼镰孢则是无论测其ITS区序列还是TEF区序列均能将其很好的鉴定到种。燕麦镰孢等其他镰刀菌均测定其TEF区的序列即可很好地鉴定到种。说明大多数镰刀菌可以基于TEF序列鉴定,少数TEF区基因序列鉴定不到种的菌株,可以测定其ITS序列鉴定或通过多个基因序列进行鉴定。
对根腐病病原菌致病性测定的方法有多种,如平皿法、试管苗法、卷纸法、盆栽法等,致病性的测定结果也因测定方法的不同而不同。本研究将平皿法改良为烧杯水琼脂法,使青稞根和茎叶能很好地生长,更有利于准确地统计病级,且保留了平皿法的简便性。为了结果更为准确,同时进行了盆栽试验,发现烧杯水琼脂法所测定的菌株的致病性高于盆栽法测定结果,且差异极显著。但回归分析表明,两种方法所测定的致病性结果呈线性正相关,且相关性显著,说明两种方法对菌株发病率及病情指数的反映程度是一致的,如菌株D7-4、D20-2等无论是用烧杯水琼脂法还是盆栽法所测定的致病性与同组其他菌株相比都是最高的。因此,在后续试验中可以采用烧杯水琼脂法进行致病性测定,较盆栽法而言,其所需要的材料简单,操作过程省时省力,且无菌操作过程更易控制,误差较小。
