卵巢切除对高胰岛素血症MKR小鼠糖脂代谢的影响
2022-10-18王小双吴英杰冉丽媛
姚 庆,王 丹,王小双,吴英杰,冉丽媛
(1.大连医科大学重大疾病基因工程模式动物研究所,辽宁 大连 116044;2.大连医科大学 科技部基因工程模式动物国际联合研究中心,辽宁 大连 116044)
随着社会经济发展和生活水平提高,糖尿病、肥胖和脂肪肝等与糖脂代谢紊乱相关的疾病患病率逐年升高,2018年中国糖尿病患病率约12.4%,其中成人糖尿病前期比例占35.2%[1-3]。研究[4-6]显示:性激素(如男性睾酮和女性雌二醇等)与机体糖脂代谢密切相关。卵巢具有分泌性激素,维持激素稳态的重要功能,女性进入更年期后,卵巢功能逐渐退化,性激素产生减少,对体内糖脂代谢稳定造成影响,增加了绝经后女性产生胰岛素抵抗和罹患代谢综合征的风险[7-9]。此外,患有糖尿病等基础疾病或仅出现胰岛素抵抗等亚健康的女性群体,在进入绝经期后,雌激素水平的紊乱和缺乏可能成为威胁女性健康的重要因素[8-9]。因此,在多种病理生理条件下探讨雌激素缺乏对机体糖脂代谢的影响,对于阐明雌激素相关代谢综合征发生发展的机制及筛选药物干预靶点具有重要意义。
骨骼肌特异性胰岛素样生长因子1受体功能缺失 (loss of skeletal muscle-specific insulin-like growth factor-1 receptor function,MKR)小鼠是在骨骼肌中过表达人源胰岛素样生长因子1受体突变体而构建的2型糖尿病动物模型[10]。KIM等[11]发现:纯合雄性MKR小鼠自出生起就产生严重的胰岛素抵抗,8周龄时血液中葡萄糖水平达到糖尿病标准,同时表现高胰岛素血症、高血糖症和高脂血症;而雌性MKR小鼠在性成熟后,空腹血糖水平较低,仅表现出胰岛素抵抗和高胰岛素血症。
既往研究[12-13]常采用卵巢切除方法探究雌激素对机体代谢功能的影响,但其通过高糖高脂饮食诱导小鼠肥胖和胰岛素抵抗并结合卵巢切除的方法,无法排除外源糖脂水平对结果的影响。雌性MKR小鼠是非肥胖人源化胰岛素抵抗小鼠模型,排除肥胖自身产生的影响,本研究通过对其进行卵巢切除术干预,探究高内源胰岛素水平下卵巢切除对机体糖脂代谢稳态的影响,为女性患者因雌激素缺失而导致代谢综合征的临床诊断及预防提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器MKR小鼠(FVB/N)由美国西奈山医学院Derek LeRoith教授馈赠,野生型(WT)FVB/N小鼠购自北京维通利华实验动物技术有限公司,6周龄SPF级MKR和WT FVB/N雌性小鼠各20只,实验动物生产许可证号:SCXK(京)2012-0001,实验动物使用许可证号:SYXK(辽)2013-0006。小鼠饲养于大连医科大学SPF动物实验中心屏障内IVC系统,温度22.5℃,12 h明暗交替,相对湿度50%~60%,自由进食和饮水。所有动物实验流程均在大连医科大学实验动物伦理委员会指导下进行(伦理审批号IACUC:AEE17065),实验遵循3R原则。胰岛素(江苏万邦生化医药股份有限公司),葡萄糖(美国Sigma公司),血糖试纸(瑞士Roche公司),HE染色试剂盒和糖原染色试剂盒(上海碧云天生物技术公司),油红O染色试剂盒(上海歌凡生物科技公司),RNAiso Plus试剂盒、反转录试剂盒和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试 剂 盒(日 本TaKaRa公司),RT-qPCR引物(上海生工生物工程公司),激素敏感脂肪酶(hormone senitive lipase,HSL)和GAPDH抗体(中国Abbkine公司)。血糖仪(瑞士Roche公司),离心机(德国Eppendorf公司),高压灭菌器(日本TOMY公司),超纯水仪(美国Millipore公司),RT-qPCR仪(美国ABI公司),凝胶成像仪(美国Bio-Rad公司)。
1.2 实验分组和小鼠卵巢切除模型建立6周龄雌性MKR小鼠20只随机分为MKR假手术组(MKR组)和MKR卵巢切除组(MKR OVX组),每组10只;6周龄雌性WT FVB/N小鼠20只随机分为WT假手术组(WT组)和WT卵巢切除组(WT OVX组),每组10只。恢复饲养2周后检测各组小鼠体质量、空腹血糖和随机血糖等指标。
WT OVX组 和MKR OVX组 小 鼠 采 用35 mg·kg-1戊巴比妥钠麻醉,置于解剖垫上,酒精消毒暴露皮肤,于背部脊柱左侧缘用眼科剪侧切一个小的切口,轻柔拨开组织,结扎卵巢动脉,摘取卵巢后将其他组织回纳,缝合切口。WT组和MKR组小鼠在麻醉打开切口后不做任何处理,缝合切口,恢复饲养。
1.3 葡萄糖耐量试验(glucose tolerance test,GTT)检测各组小鼠葡萄糖耐受能力术后6和12周,小鼠禁食不禁水,空腹12 h后检测各组小鼠体质量及空腹血糖水平,根据小鼠体质量给予20%葡 萄 糖 溶 液(2 g·kg-1)腹腔注射,并开始计时。于注射后30、60、90和120 min分别检测各组小鼠血糖水平,根据不同测量时间的血糖变化绘制曲线并计算曲线下面积(area under curve,AUC),检测各组小鼠葡萄糖耐受力。GTT实验完成后恢复小鼠饮食。
1.4 胰岛素耐量试验(insulin tolerance test,ITT)检测各组小鼠胰岛素敏感性术后6和12周,小鼠禁食不禁水,空腹4~6 h后检测各组小鼠体质量及空腹血糖水平,0.75 U·kg-1胰岛素溶液腹腔注射,并开始计时。于注射胰岛素后15、30、45和60 min检测各组小鼠血糖水平,根据不同测量时间的血糖变化绘制曲线并计算AUC,检测各组小鼠胰岛素敏感性。ITT实验完成后恢复小鼠饮食。
1.5 计算各组小鼠肝脏系数和脂肪系数称取小鼠体质量、解剖后小鼠肝脏和脂肪湿质量,计算各组小鼠肝脏系数和脂肪系数。肝脏系数=肝脏质量/体质量×100%,脂肪系数=脂肪质量/体质量×100%。
1.6 病理学染色观察各组小鼠肝脏和性腺脂肪组织病理形态表现组织固定于10%甲醛溶液,48 h后取出部分固定组织,修剪后置于组织包埋盒中脱水、包埋。石蜡切片机切片,HE染色或糖原染色后,显微镜下观察并拍照。取部分固定的肝脏组织,修剪后置于30%蔗糖中脱水24 h,置入冷冻包埋剂中,液氮缓冻。采用冰冻切片机于-16℃下切片,油红O染色后显微镜下观察并拍照。
1.7 RT-qPCR法检测各组小鼠性腺脂肪组织中脂质分解相关基因mRNA表达水平性腺脂肪组织剪碎后加入TRIzol试剂提取总RNA,采用反转录试剂盒获取cDNA后将其作为模板进行RT-qPCR反应。PCR反应体系和反应条件依据试剂盒说明书。以GAPDH为内参基因,采用2-△△Ct法计算脂质分解相关基因mRNA表达水平。PCR引物序列:脂肪甘油三酯脂肪酶(adipose triacylglyceride lipase,Atgl),正 向 引 物5′-GCTGTGGAATGAGGACATAGGA-3′,反 向 引 物5′-GCATAGTGAGTGGCTGGTGAA-3′;HSL正 向 引 物5′-TGTGTCAGTGCCTATTCAG-3′,反 向 引 物5′-GAACAGCGAAGTGTCTCT-3′;GAPDH,正 向 引 物5′-GGGCTGGCATTGCTCTCAATG-3′,反 向 引 物5′-CATGTAGGCCATGAGGTCCAC-3′。
1.8 Western blotting法检测各组小鼠性腺脂肪组织中HSL蛋白表达水平取性腺脂肪组织剪碎加入蛋白裂解液裂解,匀浆后离心提取总蛋白,BCA试剂盒检测蛋白浓度,调整上样量使各组浓度一致,SDS-PAGE电泳后湿转,将蛋白全部转移至NC膜上。5%脱脂奶粉封闭后加入蛋白一抗(GAPDH或HSL)4℃孵育过夜,TBST漂洗后室温孵育二抗2 h,TBST漂洗后ECL试剂显色并拍照。采用Image J软件分析目的蛋白HSL和内参GAPDH蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
1.9 统计学分析采用Graphpad prism8.0统计软件进行统计学分析。各组小鼠的体质量、血糖水平、肝脏质量、肝脏系数和和脂肪系数,性腺脂肪组织中Atgl、HSL mRNA及HSL蛋白表达水平均符合正态分布,以xˉ±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体质量和血糖水平术后小鼠体质量检测结果显示:与WT组比较,WT OVX组小鼠体质量增加,但差异无统计学意义(P>0.05),MKR组小鼠体质量明显降低(P<0.05);与MKR组比较,MKR OVX组小鼠体 质 量 明 显 增加(P<0.05),但 与WT和WT OVX组比较,MKR OVX组小鼠体质量明显降低(P<0.05)。术后空腹血糖监测结果显示:OVX术后6周,各组小鼠空腹血糖无明显变化;术后12周,WT OVX组和MKR OVX组小鼠空腹血糖水平逐渐升高,与MKR组比较,MKR OVX组小鼠空腹血糖水平明显升高(P<0.05)。术后随机血糖监测结果显示:与WT和WT OVX组比较,MKR OVX组小鼠随机血糖水平升高(P<0.05)。见图1。

图1 各组小鼠的体质量(A)、空腹血糖水平(B)和随机血糖水平(C)Fig.1 Body weights(A),levels of fasting blood glucose(B)and levels of random blood glucose(C)of mice in various groups
2.2 各组小鼠葡萄糖耐受力和胰岛素敏感性与WT组比较,WT OVX组小鼠葡萄糖耐受力和胰岛素敏感性降低(P<0.05);与WT组比较,MKR组小鼠本身存在胰岛素抵抗,其葡萄糖耐受力和胰岛素敏感性均明显降低(P<0.05)。与MKR比较,MKR OVX组葡萄糖耐受力和胰岛素敏感性降低(P<0.05),并随术后饲养时间延长不断恶化,术后12周出现严重的葡萄糖不耐受和胰岛素抵抗。见图2和3。

图2 各组小鼠葡萄糖耐受力指标Fig.2 Indicators of glucose tolerance of mice in various groups
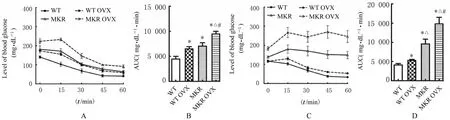
图3 各组小鼠胰岛素敏感性指标Fig.3 Indicators of insulin sensitivity of mice in various groups
2.3 各组小鼠肝脏质量、肝脏系数和肝组织病理形态表现各组小鼠肝脏湿质量比较差异无统计学意义(P>0.05)。与WT组 和WT OVX组 比 较,MKR和MKR OVX组小鼠肝系数明显升高(P<0.05),见表1。HE染色结果显示:与WT组小鼠比较,WT OVX组小鼠肝组织中肝细胞排列松散,部分区域出现轻度脂肪变性;MKR组小鼠肝脏有轻度脂质沉积;MKR OVX组小鼠肝组织中肝脂肪变程度较高,有明显的脂滴空泡。油红O染色与HE染色结果一致,与WT组比较,WT OVX和MKR OVX组小鼠肝组织中有更多的脂质成分着色。糖原染色结果显示:与WT组比较,WT OVX组小鼠肝糖原减少,MKR组小鼠肝糖原无明显变化,MKR OVX组小鼠肝糖原进一步减少。见图4。
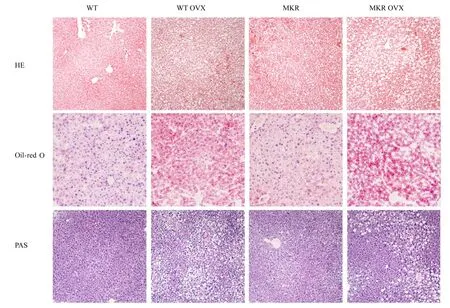
图4 各组小鼠肝组织病理形态表现(×200)Fig.4 Pathomorphology of liver tissue of mice in various groups(×200)
2.4 各组小鼠脂肪系数和性腺脂肪组织病理形态表现与WT组比较,WT OVX组小鼠棕色脂肪、皮下脂肪和肾周脂肪系数升高但差异无统计学意义(P>0.05),性腺脂肪和肠系膜脂肪系数明显升高(P<0.05)。与MKR组比较,MKR OVX组小鼠棕色脂肪和肠系膜脂肪系数差异无统计学意义(P>0.05),皮下脂肪、性腺脂肪和肾周脂肪系数明显升高(P<0.05)。见表1。

表1 各组小鼠肝脏质量、肝脏系数和脂肪系数Tab.1 Liver weight,liver index and fat index of mice in various groups (n=10,x±s,η/%)
选择WT OVX组和MKR OVX组病理形态表现均有明显改变的性腺脂肪观察其形态表现。HE染色结果显示:与WT组比较,MKR组小鼠脂肪细胞明显缩小;WT OVX组和MKR OVX组小鼠脂肪细胞均增大,但与WT和WT OVX组比较,MKR OVX组小鼠脂肪细胞仍明显缩小。见图5。
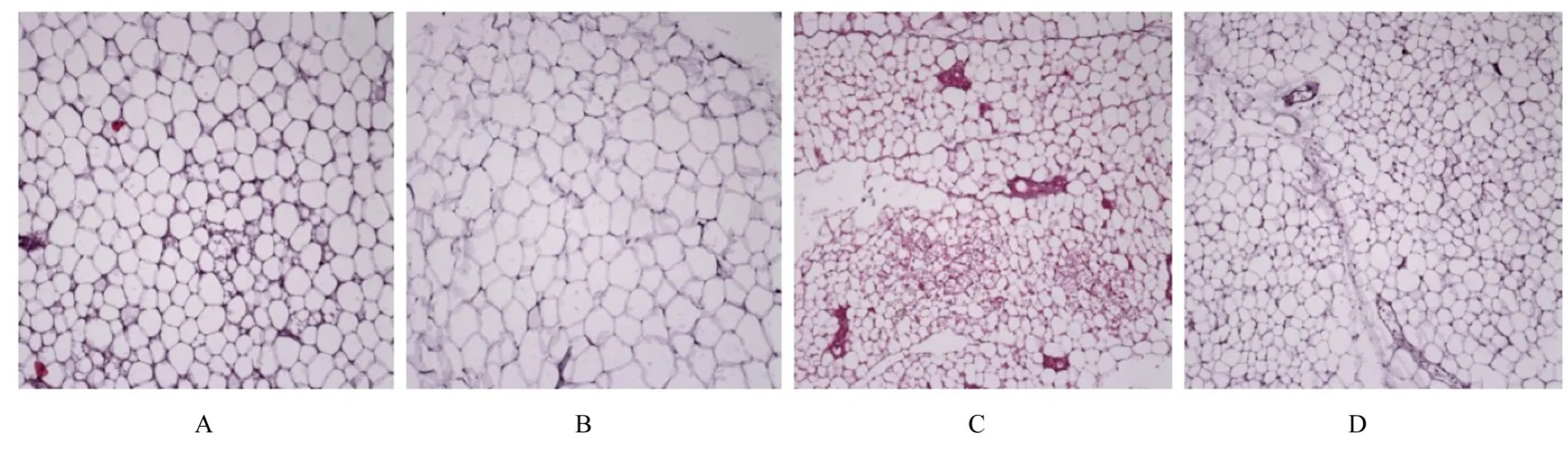
图5 各组小鼠性腺脂肪组织病理形态表现(HE,×200)Fig.5 Pathomorphology of gonadal adipose tissue of mice in various groups(HE,×200)
2.5 各组小鼠性腺脂肪组织中Atgl和HSL mRNA表达水平RT-qPCR检测结果显示:与WT组比较,WT OVX组小鼠性腺脂肪组织中Atgl mRNA表达水平明显降低(P<0.05),MKR组小鼠性腺脂肪组织中HSL mRNA表达水平明显升高(P<0.05);与MKR组比较,MKR OVX组小鼠性腺脂肪组织中Atgl和HSL mRNA表达水平明显降低(P<0.05)。见图6。

图6 各组小鼠性腺脂肪组织中Atgl和HSL mRNA表达水平Fig.6 Expression levels of Atgl and HSL mRNA in gonadal adipose tissue of mice in various groups
2.6 各组小鼠性腺脂肪组织中HSL蛋白表达水平Western blotting检测结果显示:与WT组比较,WT OVX组小鼠性腺脂肪组织中HSL蛋白表达 水平明显降低(P<0.05),MKR组小鼠性腺脂肪组织中HSL蛋白表达水平明显升高(P<0.05);与MKR组比较,MKR OVX组小鼠性腺脂肪组织中HSL蛋白表达水平降低(P<0.05)。见图7。
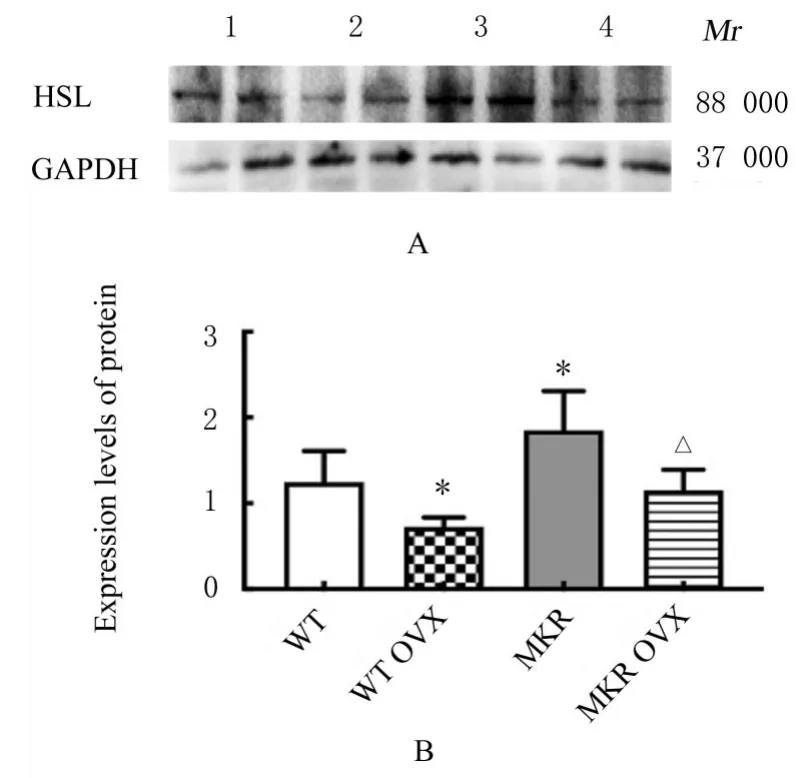
图7 各组小鼠性腺脂肪组织中HSL蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram(A)and histogram(B)of expression of HSL protein in gonadal adipose tissue of mice in various groups
3 讨 论
雌激素作为重要的内分泌激素广泛作用于全身靶器官,不仅调控性腺发育和生殖系统功能,同时还在机体糖脂代谢稳态调控中发挥重要作用[14-15]。胰岛素是调节机体代谢过程的重要激素之一,是唯一可以促进细胞对葡萄糖的摄取和利用,并通过促进糖原合成抑制糖异生而降低血糖的激素;同时胰岛素还可以促进脂质合成,抑制脂肪分解。外周器官(如肝脏、脂肪和肌肉组织等)对胰岛素响应减弱则导致胰岛素抵抗发生,是促使2型糖尿病、肥胖和非酒精性脂肪肝等疾病发生的重要危险因素[16]。而雌激素信号通路和胰岛素信号通路在绝经后女性糖脂代谢紊乱调控及相关疾病发生发展过程中的关联影响尚未完全阐明。
雌激素治疗可逆转高脂饮食诱导的小鼠产生胰岛素抵抗和葡萄糖耐受不良[17]。MKR雌性小鼠自身存在胰岛素抵抗和高胰岛素血症,是研究雌激素和内源胰岛素水平调控机体糖脂代谢稳态的理想模型[13]。本研究结果显示:MKR小鼠卵巢切除后,空腹血糖和随机血糖水平均明显升高,胰岛素敏感性降低,而卵巢切除对WT小鼠血糖水平影响较小,其胰岛素敏感性略有降低,提示在胰岛素抵抗状态下,雌激素缺失更易导致糖尿病的发生。
肝脏和脂肪组织在机体胰岛素敏感性和糖脂代谢稳态调控中发挥重要作用。研究[18]显示:绝经后女性更易患脂肪肝。雌激素抑制剂他莫西芬可诱导小鼠肝脂肪变性,而临床上使用他莫西芬的主要副作用之一为患者产生非酒精性脂肪肝[19]。此外,长期服用雌二醇可降低ob/ob小鼠肝脏脂质合成并改善胰岛素敏感性[20]。本研究结果显示:卵巢切除后,小鼠肝脏脂质沉积增加,MKR OVX组小鼠肝脏中出现大量的脂滴空泡,肝糖原水平降低,表明雌激素缺失会加重高胰岛素血症小鼠的肝脂肪变性和肝糖转运。
脂肪组织是人体重要的代谢器官,不仅是机体的能量仓库,而且作为循环中多种激素(如生长激素和胰岛素等)及代谢物(如葡萄糖等)的靶器官,在机体糖脂代谢稳态调控中发挥重要作用[21]。雌激素受体α在脂肪组织中表达并控制雌激素活性,当雌激素或雌激素受体α缺失时,会导致脂质水平升高、肥胖和胰岛素抵抗[22]。卵巢切除或女性绝经造成雌激素水平降低,均可导致体质量增加和脂肪积聚[23-24],与本研究结果一致。研究[25-26]显示:绝经期女性脂肪组织分布发生改变,主要表现为腹部脂肪积聚。本研究结果证实:卵巢切除可通过下调脂质分解相关基因mRNA和蛋白表达水平导致小鼠性腺脂肪、肾周脂肪和肠系膜脂肪等腹部内脏脂肪明显增加。既往研究常采用高糖高脂饮食诱导小鼠胰岛素抵抗并结合卵巢切除研究雌激素对糖脂代谢的影响,而MKR雌鼠是非肥胖人源化胰岛素抵抗小鼠模型,利用MKR小鼠进行雌激素调控脂代谢的相关研究,排除肥胖本身对脂肪产生的影响,使结果更具参考性。
综上所述,本研究利用胰岛素抵抗和高胰岛素血症的MKR小鼠模型,进一步探究内源性胰岛素及雌激素在机体糖脂代谢过程中的相互影响,为女性患者因雌激素缺失而可能产生代谢综合征的临床诊断及预防提供依据。
