胸腺瘤外科手术治疗及预后的回顾性分析
2022-10-18房立新李玉财边洪春
李 兵,房立新,张 伟,李玉财,边洪春
(1.潍坊医学院,山东 潍坊,261053;2.淄博市市立医院胸外科;3.中国人民解放军第960医院胸外科)
胸腺瘤是起源于胸腺上皮细胞的肿瘤,生长较缓慢,在总人群中发病率为13/1 000万[1],胸腺瘤常见于前纵隔[2-3],约占纵隔肿瘤的20%,占前纵隔肿瘤的50%,发病率逐年增加[4]。国际癌症研究机构发行的《WHO肺、胸膜、胸腺和心脏肿瘤分类》,将其分为A型、AB型、B1型、B2型、B3型、微结节性胸腺瘤伴淋巴样间质、化生性胸腺瘤、其他罕见胸腺瘤,C型曾被划入胸腺癌[1,4-5],目前WHO制定了组织学分型系统与Masaoka临床分期系统[4,6]。胸腺瘤常伴有副肿瘤综合征,最常见的是重症肌无力[7]。外科手术切除是目前胸腺瘤最有效的治疗手段[2,8]。本研究收集解放军第960医院与淄博市市立医院外科手术治疗的152例胸腺瘤患者的临床资料,以分析影响胸腺瘤预后的相关因素。
1 资料与方法
1.1 临床资料 回顾分析2010~2018年解放军第960医院与淄博市市立医院手术治疗的152例胸腺瘤患者的临床资料。纳入标准:(1)首次诊断为胸腺瘤,经手术切除;(2)术后病理依据2015年WHO胸腺上皮肿瘤病理分类标准证实为A型、AB型、B1型、B2型、B3型、C型;(3)排除其他系统恶性疾病;(4)部分行头颅MRI、上腹部彩超或CT、ECT骨扫描或PET/CT等排除远处转移;(5)两组患者完善术前检查,均行血常规、尿常规、肝肾功能、凝血功能、血型、心电图、肺功能等常规检查,无手术禁忌证。排除标准:(1)术前接受放疗和(或)化疗;(2)合并其他系统恶性肿瘤;(3)合并其他脏器严重并发症不能耐受检查或手术;(4)合并神经及精神系统疾病不能配合随访检查;(5)临床资料缺失。
1.2 手术方法 根据胸腺瘤的直径、与周围组织浸润侵犯情况,选择胸骨正中切口(图1)、经侧胸或剑突下胸腔镜胸腺瘤切除术(图2、图3)。(1)经侧胸胸腔镜组:取30°半侧卧位,全麻单腔气管插管,取腋中线第7肋间切口置入胸腔镜,经第4肋间腋中线、锁骨中线第6肋间进行操作。(2)经剑突下胸腔镜组:患者平卧呈“大”字位,全身麻醉单腔气管插管,剑突下做纵行切口,沿胸骨后钝性游离结缔组织至双侧肋弓处,于切口两侧肋弓下切口穿刺Trocar,建立CO2气胸,压力维持在7~8 cmH2O。术者立于患者双腿之间,助手立于右侧,左右两侧切口置入超声刀与抓钳。分离胸腺包膜与胸膜边界,暴露胸腺双极顶部及双侧膈神经、肺门血管、胸廓内动静脉,切勿损伤无名静脉与上腔静脉。切除双侧膈神经内侧、心包前的胸腺、肿瘤及周围脂肪组织。

图1 经正中切口胸腺瘤切除 图2 经侧胸、剑突下胸腔镜胸腺瘤切除
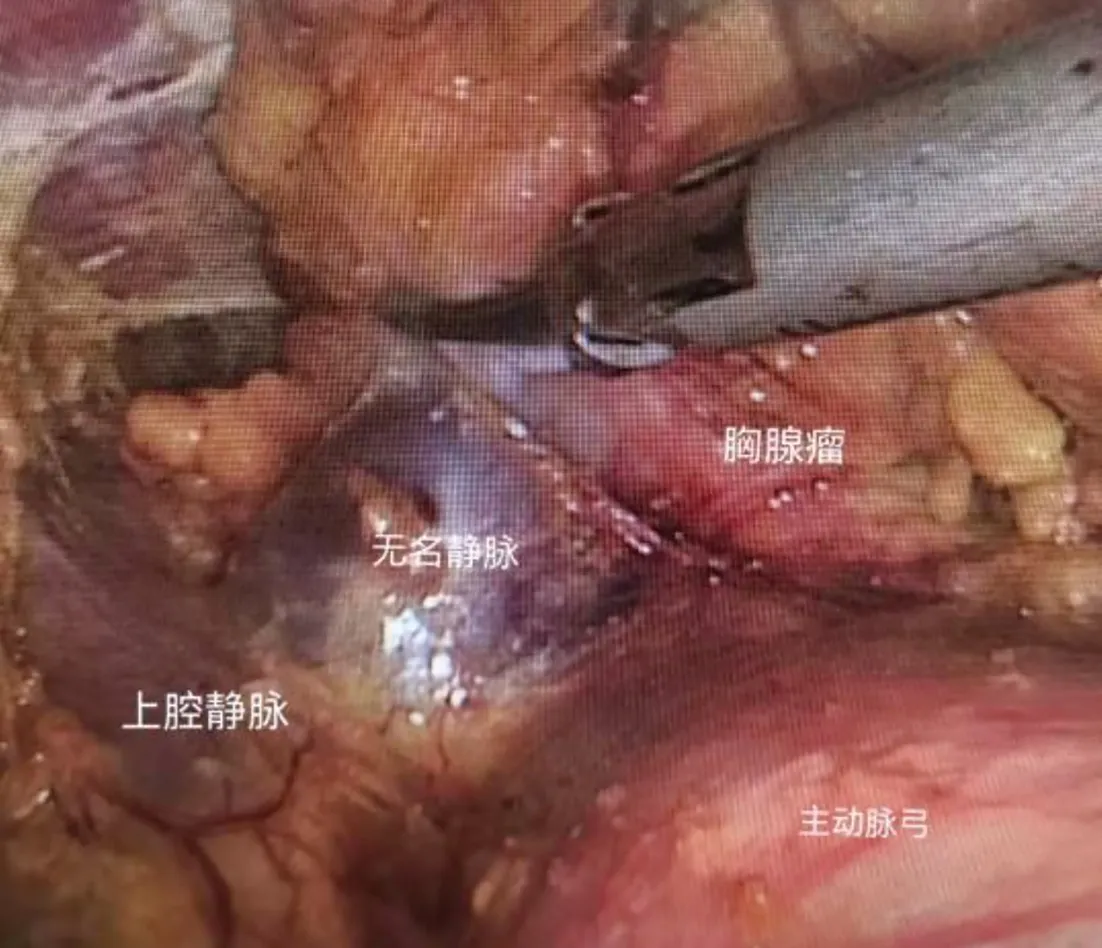
图3 经剑突下胸腔镜胸腺瘤切除术野
1.3 观察指标 观察分析患者性别、年龄、肿瘤直径、重症肌无力情况、手术方式、手术时间、术中出血量、术后引流量、住院时间、WHO病理分型、Masaoka分期、TNM分期等资料。
2 结 果
2.1 术前及围术期资料 本研究共纳入152例患者,其中男74例(48.68%),女78例(51.32%)。25~76岁,平均(51.91±14.87)岁,肿瘤直径(6.86±2.36)cm,术中出血量平均(155.72±118.84)mL,手术时间平均(132.96±45.26)min,术后引流量(341.76±128.82)mL,平均住院(9.67±2.28)d。采用3种手术方式进行切除,包括经侧胸胸腔镜手术65例(42.76%)、经剑突下胸腔镜手术72例(47.37%)、胸骨正中切口手术15例(9.87%)。按照WHO病理分类标准分组:A型16例,AB型12例,B1型19例,B2型71例,B3型30例,C型4例,见表1。
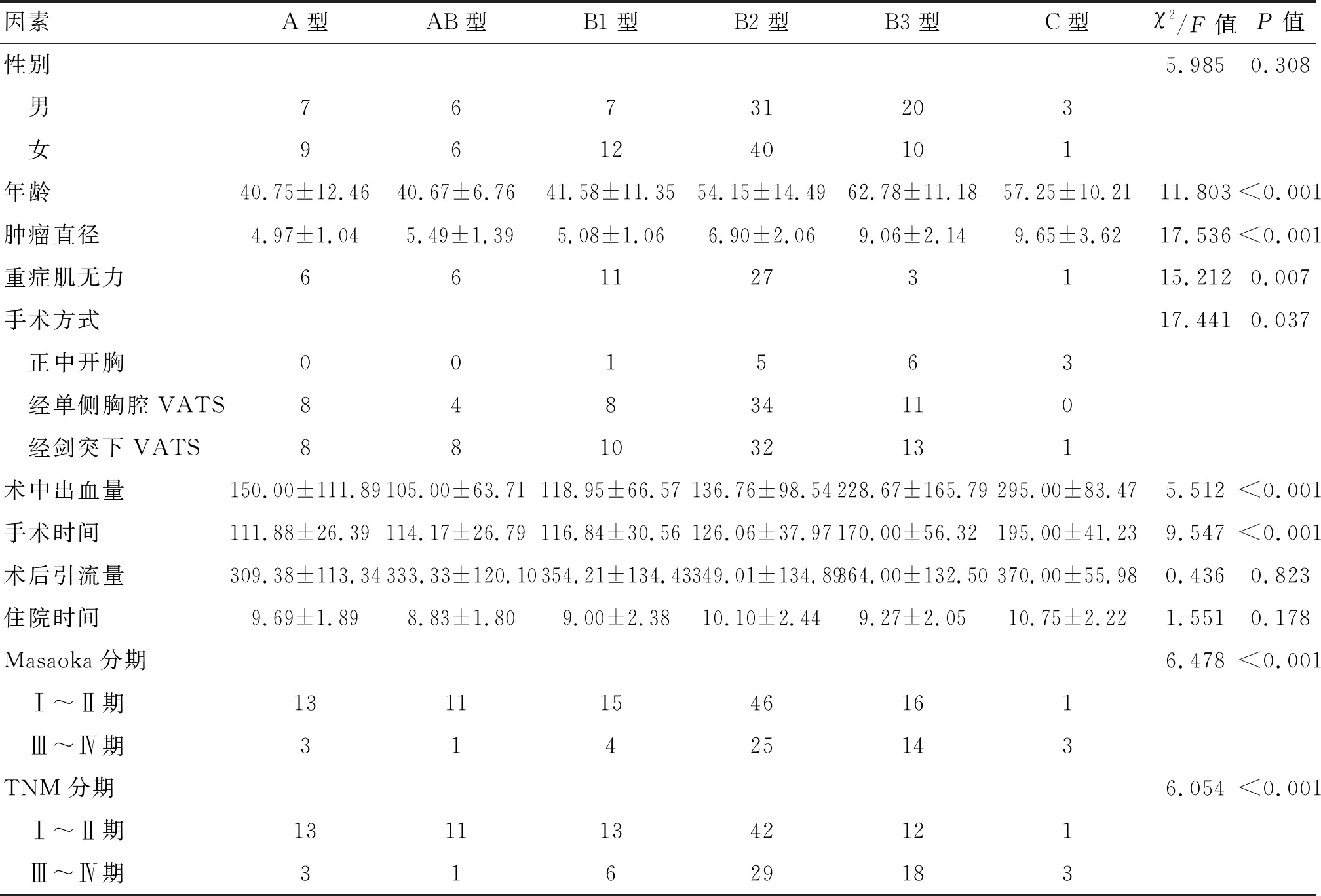
表1 术前及围术期资料的比较
2.2 随访资料 本研究平均随访(57.49±15.69)个月,12例死亡,包括B1型1例、B2型3例、B3型5例、C型3例。复发转移11例,其中A型1例、AB型1例、B1型1例、B2型3例、B3型5例。本研究中A型患者无病生存率为93.75%,AB型为91.67%,B1型为89.47%,B2型为91.55%,B3型76.67%,C型为25%。术前重症肌无力患者54例,包括A型6例、AB型6例、B1型11例、B2型27例、B3型3例、C型1例,术后随访期间完全缓解或部分缓解42例,包括A型5例、AB型4例、B1型9例、B2型22例、B3型2例。经Kaplan-Meier法分析性别、年龄、肿瘤直径、重症肌无力情况、手术方式、手术时间、术中出血量、术后引流量、住院时间、WHO病理分型、Masaoka分期、TNM分期对于无病生存期的影响,统计结果显示,重症肌无力状态(P=0.015)(图4)、手术方式(P<0.001)(图5)、Masaoka分期(P<0.001)(图6)、TNM(P<0.001)(图7)、WHO病理分型(P<0.001)(图8)差异有统计学意义(P<0.05)。将单因素分析中P<0.05的预后因素纳入Cox风险回归进一步检验,手术方式、Masaoka分期、WHO病理分型是影响胸腺瘤患者无病生存期的独立预后因素,见表2。

图4 不同重症肌无力状况患者无病生存期(P=0.015) 图5 不同手术方式患者无病生存期(P<0.001)
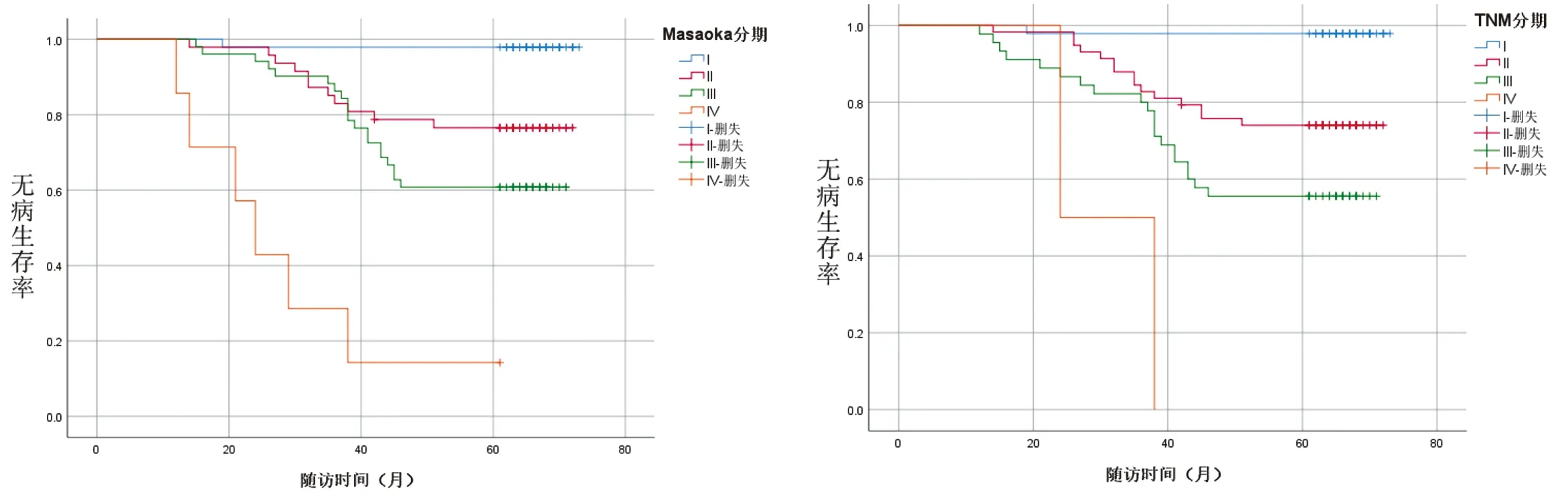
图6 不同Masaoka分期患者无病生存期(P<0.001) 图7 不同TNM分期患者无病生存期(P<0.001)
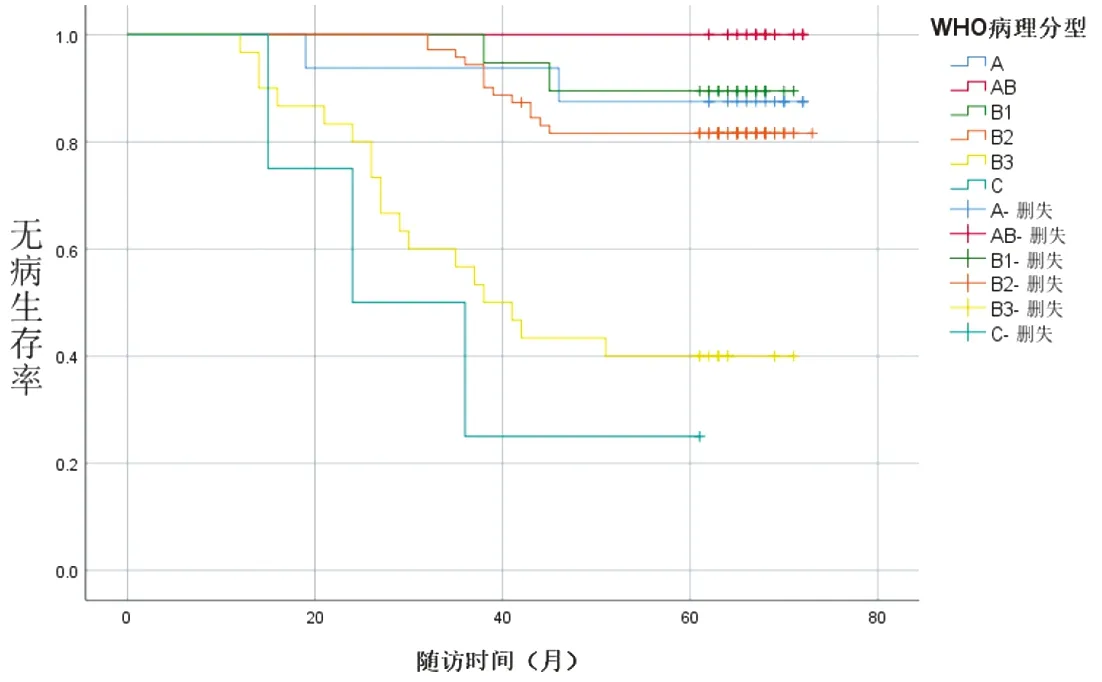
图8 不同WHO病理分型患者无病生存期(P<0.001)
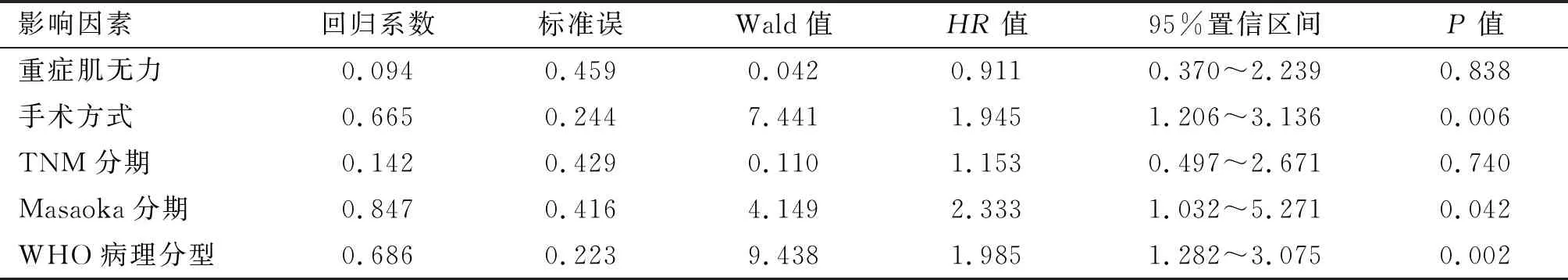
表2 影响胸腺瘤患者预后的多因素分析
3 讨 论
胸腺瘤多见于40岁以上人群,男女发病率无明显差异。目前胸腺瘤最有效的治疗手段为手术切除。一项系统的综述显示,不论采用何种方法[9],手术治疗MasaokaⅠ期、Ⅱ期胸腺瘤的5年总体生存率分别为89%~100%与71%~95%。多种因素可影响胸腺瘤的无病生存期,有研究证明重症肌无力是影响无病生存期的因素,一般胸腺瘤患者早期无症状,部分患者合并重症肌无力,诊断就诊及时,可达R0切除。有研究表明,肿瘤直径是影响无病生存期的因素之一,肿瘤体积越大,侵犯周围组织概率越高,2013年报道,>5 cm的胸腺瘤患者行胸腔镜胸腺切除术后,胸膜复发率较高[10]。日本胸腺研究协会资料显示,胸腺瘤>5 cm的患者,10年无复发生存率较低[11]。本研究的分析结果与大宗病例报道不吻合,考虑与入组病例数较少有关。
本研究采用胸骨正中切口、经左/右侧胸或剑突下行胸腔镜手术治疗。正中胸骨劈开手术适于瘤体较大并侵犯周围组织器官、分期较晚、胸腔镜切除不彻底的患者;胸腔镜胸腺瘤切除术适于早期、瘤体较小、心肺功能较差或不耐受开胸手术的患者;经侧胸胸腔镜胸腺瘤切除术开展时间较早,经剑突下入路出现前多采用经侧胸手术方式,相较侧胸入路,经剑突下手术达到了正中胸骨劈开的手术视野,可完整暴露无名静脉、双侧迷走神经,方便双侧心膈角处的脂肪切除,避免肋间神经的损伤。胸腺瘤手术的趋势是在达到肿瘤完整切除的前提下,应用胸腔镜切除术。在选择最佳手术方式前,必须考虑肿瘤的分期、是否有重症肌无力、是否有淋巴结肿大及胸腺瘤大小等多重因素[12]。根据胸腺瘤的直径、位置、分期情况选择最佳手术方式,微创手术正成为Ⅰ期肿瘤的标准术式[13-15];有报道称,其可降低并发症发生率,促进术后恢复[16-17],减少术后并发症、缩短住院时间[18]。即使微创切除手术日益增加,但不能盲目选择微创手术,部分为实现R0切除,最终可能中转开胸手术[19]。关于手术方式对无病生存期的影响,一项系统综述与Meta分析表明[20],胸腔镜胸腺瘤切除术与开放胸腺瘤切除术相比,Masaoka Ⅰ期、Ⅱ期肿瘤患者的R0切除率与局部复发无显著性差异。有研究报道[21-25],胸腺瘤微创切除术后复发率为0~6.7%,5年无病生存率为83.3%~96%。Masaoka Ⅰ~Ⅲ期患者的5年无病生存率胸骨正中切开组为86.9%,腔镜组为90.7%[15]。本研究中,经侧胸与剑突下胸腺瘤切除的方式对患者预后的影响差异无统计学意义,但在Ⅲ~Ⅳ期胸腺瘤中,肿瘤细胞在胸膜内或心包内播散,除切除胸腺,还需切除局部胸膜或心包[26-27],完整手术切除具有更好的预后[28-29],Hamaji等[30]报道,对于不能完整切除的胸腺瘤应考虑胸骨正中开胸清除。Masaoka、TNM分期、胸腺上皮肿瘤与患者的生存、预后相关[31],2014年的一项研究对胸腺瘤的TNM分期进行修改,与Masaoka分期的区别是增加了对淋巴结转移的关注,目前胸腺瘤手术中一般不进行淋巴结采样与清扫。分期晚的患者,多采用正中开胸的方式切除,手术复杂,病变累及无名静脉或上腔静脉时,需行血管置换或成形手术,手术时间长,术中出血量多,预后差,无病生存期短。胸腺癌的预后较胸腺瘤差,死亡的中位时间在3年以下[32],随访期间死亡患者集中在B2、B3、C型,复发转移集中在B2、B3型患者中,入组的C型患者较少,死亡病例占比高,对分析结果可能产生一定影响。
本研究的多因素分析显示手术方式、Masaoka分期、WHO病理分型是影响患者无病生存期的独立预测因素,重症肌无力情况、TNM分期在单因素分析中有统计学意义,但多因素分析中差异无统计学意义,考虑与样本量不足、选择偏倚有关。本研究限于2个中心的样本研究,样本量有限;未统计5年生存期与总生存期;期待多中心、大样本更深入研究加以验证补充。
