微管调控成骨细胞功能的研究进展
2022-10-18万超超曹林忠王多贤蒋玮张琪刘孟初马学强杨博马成祥
万超超 曹林忠,2* 王多贤 蒋玮 张琪 刘孟初 马学强 杨博 马成祥
1.甘肃中医药大学,甘肃 兰州 730000 2.甘肃中医药大学附属医院,甘肃 兰州 730099
成骨细胞主要由骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)分化而来,在骨基质合成、分泌、矿化过程中发挥着重要作用,是骨修复重建的关键细胞。成骨细胞分化及功能的异常与许多骨代谢疾病的发病机制密切相关,如骨质疏松症、股骨头坏死、原发性骨肿瘤等[1-2]。在骨形成过程中,成骨细胞经机械负荷等刺激,大量增殖、分化,迁移到骨修复部位,经细胞内信号级联反应分泌骨基质,引起基质矿化,达到骨修复的目的。微管(microtubules,MT)是细胞骨架的重要组成部分,在成骨细胞的增殖、分化等过程中发挥着重要调节作用[3]。本文拟对近年来微管调控成骨细胞功能的研究进行综述,以期为进一步探究成骨分化相关影响因素、筛选相关分子靶点及对预防和治疗骨代谢相关疾病的研究提供指导与参考。
1 微管的结构和功能
微管是α/β微管蛋白组成的中空管状结构,外径约22~25 nm,内径约15 nm。α微管蛋白和β微管蛋白结合为约8 nm长度的α/β异二聚体后,多个α/β异二聚体聚合通过首尾相联的方式聚合成为原纤维,13条平行的原纤维横向聚集形成圆柱状的微管管壁[4-5],见图1。由于构成原纤维的α/β微管蛋白二聚体都以相同的方向排列,且聚集成微管的原纤维相互平行,所以微管末端具有极性且表现出聚合和解聚的动力学特性[6]。微管在聚合模式与解聚模式间的转换,表现为微管末端交替的延长和缩短,即微管动态不稳定性。微管的动态不稳定性是微管发挥功能的基础,受微管蛋白翻译后修饰及微管相关蛋白的调控。
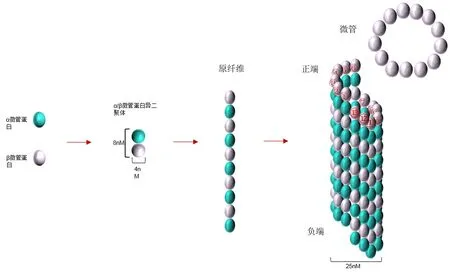
图1 微管的结构Fig.1 Structure of microtubules
1.1 微管蛋白翻译后修饰
微管蛋白翻译后修饰包括乙酰化(acetylation)、酪氨酸华/去酪氨酸化(tyrosination/detyrosination)、(多聚)谷氨酰化[(ploy)glutamylation)]、(多聚)甘氨酰化[(poly) glycylation]等,这些翻译后修饰参与微管相关蛋白与微管蛋白的结合,调控微管的动态重组,影响细胞的功能。微管的乙酰化修饰发生在微管内壁α微管蛋白的第40位赖氨酸(K40)残基上,乙酰化的K40能够影响微管内部蛋白、微管结合蛋白与微管网络的结合,从而调控微管的聚合和解聚[7],K40乙酰化亦能够降低相互连接的原纤维之间的作用力,增强微管的物理抗性,加强微管稳定性[8],抑制组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)的活性,增强微管乙酰化水平,促进成骨细胞增殖分化[9];α微管蛋白乙酰化转移酶(αTAT1)活性降低会造成细胞形态及运动能力缺陷[10]。酪氨酸华/去酪氨酸化发生在α微管蛋白羧基端的末尾酪氨酸上,尾端的酪氨酸能够被血管抑制蛋白(vasohibin,VASH)家族蛋白VASH1/2酶切割为去酪氨酸化微管(detyrosination tubulin,de Tyr-tubulin),在微管蛋白酪氨酸连接酶(tubulin tyrosine ligase,TTL)的作用下,被切割的酪氨酸又可重新与去酪氨酸化微管羧基端的末尾相连接,形成酪氨酸化微管(tyrosination tubulin,Tyr-tubulin)[11],这种修饰主要发生在纤毛和鞭毛的轴丝中, 是微管稳定的标志。微管的谷氨酸化修饰是在谷氨酸酶的作用下,谷氨酸残基与α/β微管蛋白羧基端的谷氨酸残基的γ羧基集团连接,这种修饰能够调节tau、MAP2、MAP1A、MAP1B及驱动蛋白kinesin-1等微管相关蛋白与微管的结合,影响微管的动态性,从而调控胞内物质运输及细胞迁移[12]。甘氨酸化是在糖激酶的作用下,甘氨酸残基与α/β微管蛋白羧基端的谷氨酸残基的γ羧基集团连接,甘氨酰化对于维持纤毛中轴丝微管的稳定性至关重要[13]。
1.2 微管相关蛋白
微管相关蛋白依据其对微管动态性的调控可分为微管聚合蛋白和微管解聚蛋白。微管聚合蛋白包括Tau、MAP2、MAP4等,主要通过三种机制调控微管聚合:①抑制GTP水解稳定微管;②促进α微管蛋白与β微管蛋白形成α/β异二聚体并促进其进入微管;③与微管原纤维交联增加原纤维之间的稳定性[14]。微管解聚蛋白包括隔离蛋白(Op18/Stathmin)、解聚驱动蛋白(MCAK)、热休克蛋白(HSP27)等,但其调控微管解聚的机制尚不明确,如Op18/Stathmin可通过结合微管蛋白亚基抑制其聚合,亦可通过磷酸化引起解聚,或直接与微管结合抑制其组装并诱导其解聚[15]。近期研究[16]发现,与微管密切相关的马达蛋白(kinesins),可通过ATP水解提供的能量促进微管蛋白二聚体弯曲,引起微管解聚。
2 微管对成骨细胞功能的调控
微管聚合和解聚的动态重组是微管功能多样性的物质基础,与成骨细胞的增殖、分化密切相关,并受微管翻译后修饰及微管相关蛋白的调控。微管主要通过调控初级纤毛、机械信号传导、细胞自噬等发挥对成骨细胞增殖分化的调控。
2.1 初级纤毛对成骨细胞的调控作用
初级纤毛是由轴突微管二聚体从中心粒衍生的基底体延伸而成的细胞器,存在于细胞表面,起着感受环境变化和传递信号的作用。许多研究表明,初级纤毛在骨组织的修复、代谢和机械应力的传导过程均起重要作用,与成骨细胞的增殖、分化密切相关。初级纤毛无法自行合成蛋白质,其结构和功能的维持依赖于纤毛内转运蛋白(intraflagellar transport, IFT)沿着微管的正向和逆向动力运输,IFT主要行使货物蛋白适配器的功能,能够与货物蛋白结合并将其锚定于马达蛋白(包括动力蛋白和驱动蛋白),由马达蛋白驱动将货物沿着微管运输,实现纤毛内信号的转导及结构的维持。初级纤毛内转运蛋白分为IFT-A和IFT-B两类,IFT-A能够将货物锚定于动力蛋白负责微管的逆向转运;IFT-B能够将货物锚定于驱动蛋白负责微管的正向转运[17]。IFT的突变会导致初级纤毛的结构和功能异常,引起骨骼发育障碍,相关研究[18]发现,抑制IFT-A类转运蛋白IFT-140表达,导致成骨细胞分化能力降低,造成骨质疏松。初级纤毛亦可通过介导机械信号调控成骨细胞,如流体剪切力、微重力等,连续5 d施加流体剪切力会刺激成骨细胞增殖和矿化,同时成骨细胞的初级纤毛缩短和减少,而使用水合氯醛抑制初级纤毛后,流体剪切力刺激成骨分化的能力降低[19];在微重力环境中,正向转运蛋白IFT-88和逆向转运蛋白IFT-43比率降低,纤毛变短,且成骨细胞分化能力降低,骨细胞数量减少,说明微重力引起的纤毛内正向运输活性降低,导致初级纤毛内废物无法及时排出引起纤毛功能异常,可能是导致成骨活性降低的关键原因[20]。
微管是构成初级纤毛的主要构件,初级纤毛内的蛋白转运依赖于沿着微管的动力运输(图2),因此初级纤毛对成骨细胞的影响,受到微管翻译后修饰及微管相关蛋白的调控。Shi等[21]的研究发现,使用微管稳定剂紫杉醇能够改善微重力引起初级纤毛丢失造成的成骨细胞功能异常,说明微重力通过调控微管解聚抑制初级纤毛形成,从而造成成骨细胞分化、成熟、矿化能力降低。Ehnert等[22]的研究发现,转化生长因子-β1(TGF-β1)能够诱导组蛋白去乙酰化酶6(HDAC6)上调,导致微管去乙酰化,引起微管解聚,造成初级纤毛变形、缩短、数量减少,从而阻止了骨形态发生蛋白(BMP)诱导的成骨细胞成熟。这些研究表明,微管通过调控初级纤毛的功能,对成骨细胞的增殖分化起了重要作用。

图2 微管作为初级纤毛货物的运输轨道Fig.2 Microtubules as transportation track of the primary cilia
2.2 机械信号传导对成骨细胞的调控作用
机械信号包括机械力(流体剪切力、牵张力、微重力等)、细胞外基质的硬度和表面形貌,在成骨细胞增殖、分化过程中起重要调控作用[23-24]。当前研究[25-28]认为,机械信号调控成骨细胞分化的机制包括三个阶段:①细胞骨架对机械信号的感应阶段;②机械信号与生化信号转换阶段;③信号在胞内传递及细胞效应的阶段。细胞骨架是机械信号调控成骨分化信号网络的关键起始步骤,当细胞外基质机械信号发生改变时,位于细胞膜上的整合素蛋白首先感受细胞外基质机械信号的变化,并将其传导至胞质中的细胞骨架(微管、微丝、中间丝)上,引起相关离子通道受体活性的改变,在第二信使的协同传递下,将机械信号传入细胞核,引起成骨相关信号通路的激活,如BMPs/Smad、OPG/RANK/RANKL、Notch等通路,亦可直接传递至细胞核骨架,从而将机械信号转化为生化信号调控成骨细胞分化和增殖。微管在机械信号调控成骨细胞中的影响主要体现在机械信号的传导过程受微管动态重组的调控。整合素将细胞外机械信号传入细胞后,相关信使需要依靠微管动力运输才能发挥其效用,微管处于不断的动态重组中,微管解聚增加导致微管稳定性降低,运输能力降低,将会阻断机械信号的传导。相应的,微管聚合增加则会提高微管稳定性,有益于微管动力运输,提高机械信号的传导,从而使得机械信号对成骨细胞的调控得以发挥。
James等[29]研究发现,流体剪切力依赖微管对NADPH氧化酶2(NOX2)的传导促进成骨细胞向骨细胞的分化,通过促进α-微管蛋白的去甲状腺素化修饰引起微管聚合、稳定性增强,能够促进NOX2激活产生ROS,ROS通过靶向Ca2+通道TRPV4引发Ca2+内流,促进成骨细胞向骨细胞的分化。微丝微管交联因子1(microtubule actin cross-linking factor 1,MACF1)对维持微管的稳定性具有重要作用。Chen等[30]研究发现,miR-138-5p能够靶向MACF1抑制其活性,从而下调牵张应力介导的成骨细胞增殖、分化,导致骨质疏松;MACF1亦可通过激活Wnt/β-catenin信号传导促进成骨细胞分化,而在机械卸载时,MACF1活性降低[31]。Gould等[32]研究认为,微管能够与肌动蛋白、肌动蛋白结合蛋白等其他细胞骨架成分相互作用,共同发挥调控机械信号传导促进成骨细胞增殖、分化的能力。可见,微管通过调控机械信号传导,在成骨细胞增殖分化过程中发挥重要作用。
2.3 微管调控细胞自噬对成骨细胞的调控作用
自噬与成骨细胞增殖和分化密切相关[33]。自噬是真核细胞内堆积的蛋白或受损的细胞器被内质网膜包裹后,形成自噬体,通过胞内运输至溶酶体降解、利用,以维持细胞稳态的过程。自噬体的胞内运输过程受微管动态重组的调控。Nowosad等[34]研究发现,细胞周期素依赖性激酶抑制剂p27KIP1通过激活微管蛋白乙酰化转移酶(ATAT1),上调微管乙酰化水平,促进自噬体沿微管运输,调控细胞自噬。Meercier等[35]研究发现,磺胺基化2-甲氧基雌二醇(2-ME)类似物能够靶向微管秋水仙碱结合部位,导致微管解聚,抑制细胞自噬。Jiang等[36]研究发现,自噬相关蛋白P62通过抑制HDAC6活性,加强微管稳定性,促进自噬过程。Mohan等[37]研究发现,微管的去酪氨酸化修饰能够促进溶酶体与自噬体的结合,表明微管动态重组参与自噬体胞内的运输,在细胞自噬过程中发挥重要调控作用。
微管对自噬体运输过程的调控,与成骨细胞的增殖、分化密切相关。Li等[38]研究发现,硅酸盐能够抑制微管聚合,阻滞自噬体沿微管运输,从而抑制BMSCs自噬,导致BMSCs成骨分化能力降低,通过抑制HDAC6表达,促进微管聚合,能够抵抗硅酸盐诱导的BMSCs自噬能力降低,同时促进BMSCs成骨分化。以上研究表明,微管在自噬体和溶酶体结合中起着重要的桥梁作用,微管蛋白的高乙酰化是刺激自噬所必需的。但微管调控自噬与成骨细胞增殖分化的相关研究有限,基于微管对自噬过程的重要调控作用以及自噬对维持成骨细胞稳态的重要性,从微管对自噬体动态运输的角度探索自噬调控成骨细胞的潜在机制,将会受到更多学者的关注。
3 总结
综上所述,微管通过调控胞内物质运输、信号转导,在成骨细胞增殖、分化过程中发挥着重要调节作用,其在成骨细胞功能异常机制中的作用受到越来越多学者的重视。然而,目前仍有一些问题尚未阐释清楚,如在成骨细胞胞内物质转运过程中,介导胞内物质沿微管动力运输的特异性货物识别器尚不十分明确。有研究[39-40]表明,微管在成骨细胞迁移过程中亦可发挥重要调控作用,但相关研究较少,微管调控成骨细胞迁移与骨修复的关系需进一步阐明。初级纤毛、机械信号、自噬均与成骨细胞的分化、增殖、成熟有关,微管可能通过这三个方面参与骨质疏松症、激素性股骨头坏死等骨代谢相关疾病的发病进程[41]。若能进一步研究微管在成骨细胞中的作用机制,揭示关键信号通路和靶基因,定能为骨代谢相关疾病发病机制的相关研究提供有效帮助,并可能为这些疾病的防治提供新的治疗药物。
