北京大学第三医院心脏骤停后多模态神经功能评估实施规范
2022-10-18杜兰芳田园超马青变
赵 鸿, 杜兰芳, 郑 康, 冯 璐, 田园超, 张 朔, 马青变
心脏骤停(cardiac arrest, CA)严重危害人类健康,是致死致残的常见病因,欧美院外心脏骤停的年发病率是53~55/10万人口[1],中国北京地区发病率约52.4/10万人口[2],如果将院内心脏骤停计算在内(每1000例住院患者即有1.6人发生心脏骤停),发病率将进一步显著增加[3]。心脏骤停患者发生后经及时、高质量的心肺复苏后可恢复自主循环(return of spontaneous circulation, ROSC),最终仅有少数患者可存活出院,欧美国家出院存活率7%左右[1],中国北京地区出院存活率为1.6%,仅1%的患者具有良好的神经功能预后[2],缺血缺氧性脑损伤是致死致残的主要原因。复苏后神经功能恢复过程较漫长,通过康复锻炼,通常以复苏后6个月的神经功能状态作为最终预后结局,国内外最常用格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category, CPC)评价神经功能预后,CPC 1~2级提示良好预后,CPC 3~5级为预后不良。心脏骤停患者ROSC后早期准确的神经功能评估至关重要,一方面有助于避免对于有脑复苏可能的患者,过早地撤除生命支持手段,导致不必要的死亡,而不恰当的撤除生命支持手段是心脏骤停患者ICU内死亡的主要原因;另一方面也有助于早期识别没有脑复苏希望的患者,给家属提供更加充分的预后信息,以便合理选择后续的治疗决策,优化医疗资源利用。
然而,心脏骤停患者的神经功能评估仍然是心肺复苏领域的难点。2020年美国及欧洲心肺复苏指南均推荐采用多模态的神经功能评估方法,即联合临床查体、脑部影像学、神经电生理及生物标志物进行综合评估。本单位作为综合性心肺脑复苏中心,结合国内外研究进展及本院临床经验,制定此实施规范,以期通过多模态神经功能评估,获得更为早期及准确的预后判定。
1 临床评估
1.1脑干反射 脑干具有重要的解剖学及生理学意义,脑干内有丰富的传导束及神经核团,还交错排列着网状结构。网状结构中有与循环、呼吸等功能密切相关的神经调节中枢,还有重要的上行网状激活系统,通过向皮层传递信号从而维持意识清醒状态。临床通过检查脑干反射从而判断脑干功能,最常用瞳孔对光反射和角膜反射。瞳孔对光反射检查方法如下:用光束(如瞳孔笔)照射一侧瞳孔引起瞳孔缩小,移开光源瞳孔快速复原,称为直接对光反射;检查者用手或其他物体遮挡光源,光束同时引起对侧瞳孔缩小称为间接对光反射。直接对光及间接对光均无缩瞳反射时可判定为瞳孔对光反射消失。角膜反射:抬起一侧上眼睑,将棉签的棉絮拉伸延长,由角膜外缘处轻触角膜,观察双眼有无眨眼动作,同理检查对侧。如无眨眼动作且眼睑周围肌肉完全无收缩反应时可判定为角膜反射消失。某些眼部疾病、外伤会影响上述检查结果。ROSC后72 h双侧瞳孔对光反射消失及角膜反射消失提示预后不良[4],然而双侧瞳孔对光反射及角膜反射存在却不一定提示预后良好[5]。
1.2格拉斯哥昏迷评分(Glasgow coma score, GCS) GCS包括睁眼反应、言语反应及运动反应三个部分,其中运动部分评分对预后判断的价值最高。压迫患者双侧眶上切迹或双上肢给予疼痛刺激观察患者运动反应,注意可能存在偏侧感觉异常可能,应双侧肢体多次刺激观察患者运动反应。ROSC后72 h运动评分≤3分提示预后不良[6-7]。但该检查易受镇静药物、神经肌肉阻滞剂及低体温等因素影响,需结合患者检查时的病情、用药情况判断其预后价值[5]。
1.3肌阵挛 心脏骤停复苏患者约20%出现肌阵挛,肌阵挛通常是指自发或刺激后出现的短促的肌肉不自主抽动,可以累及单个肌群,也可广泛累及全身多个肌群,是由于大脑皮层、深部脑组织如背外侧丘脑或脊髓出现不可逆损伤导致。心脏骤停后肌阵挛持续状态是指心脏骤停患者复苏后昏迷状态下出现持续性(>30 min)的面部及双侧肢体广泛肌群抽搐,通常在ROSC后24 h内出现肌阵挛持续状态提示预后不良[9],而迟发性非癫痫性肌阵挛可能提示预后良好[10],后者指复苏后数天或数周患者出现意向性或动作性肌阵挛,通常不伴随脑电图癫痫样活动。
2 影像学
影像学评估手段主要包括头颅CT和磁共振显像(MRI)。头颅CT简便易行,可以显示脑水肿的严重程度,同时可以除外脑源性心脏骤停。本中心建议在ROSC后2 h内完成首次头颅CT检查,并在ROSC后12 h、72 h、7 d分别复查头颅CT动态观察脑损伤的严重程度。头颅CT主要通过计算灰质与白质密度比(gray-to-white matter ratio, GWR)来反映脑损伤严重程度,正常的GWR应大于1.3,比值越小表明脑水肿及脑损伤越重,预后越差,但目前尚无国际公认的GWR反映不良预后的界值。结合国外多个研究结论[11-12],本中心采用全脑GWR<1.2提示预后不良。计算全脑GWR需从以下几个部位获取CT值[13](见图1):灰质包括基底节区的尾状核(CN)和壳核(PU)、端脑的中央皮质半卵圆中心(MC1)和端脑凸面(MC2);白质包括基底节区的胼胝体 (CC)和内囊后肢(PIC)、端脑的中央皮质半卵圆中心(MWM1)和端脑凸面(MWM2),首先计算基底节区和端脑的GWR平均值,然后计算全脑平均GWR值,具体计算方法如下:
基底节区的GWR平均值=(CN+PU)/(CC+PIC)
端脑部位的GWR平均值=(MC1+MC2)/(MWM1+MWM2)
全脑GWR平均值=(基底节区GWR平均值+端脑部位GWR平均值)/2

注:灰质中1为基底节区的尾状核(CN),2为壳核(PU),3为端脑的中央皮质半卵圆中心(MC1),4为端脑凸面(MC2);白质中5为基底节区的胼胝体 (CC),6为内囊后肢(PIC),7为端脑的中央皮质半卵圆中心(MWM1),8为端脑凸面(MWM2)图1 全脑CT
头颅MRI可以更加准确地评估神经功能预后,推荐复苏后2~7 d完善头颅MRI检查[4]。广泛的脑组织弥散受限提示预后不良,病变分别在弥散加权成像(DWI)序列为高信号,而表观扩散系数(ADC)图为低信号。但MRI检查需要具备特殊的核磁专用呼吸机和转运设备,目前临床应用和证据有限,仍需要进一步观察和研究。
经颅多普勒超声(transcranial doppler sonography, TCD)或经颅彩色多普勒超声(transcranial color-coded doppler sonography, TCCD)可在床旁检查患者双侧大脑中动脉、基底动脉等重要颅内血管,通过脑血流(CBF)、搏动指数(PI)及阻力指数(RI)等参数进行无创的颅内压监测。检查具有简便易行、重复性高的特点,但结果易受到患者骨窗、检查者熟练程度等影响,此外复苏后脑损伤患者不良预后的颅内压临界值、检查时机等参数还需要进一步研究。
3 血清学标志物
神经元特异性烯醇化酶(neuron-specific enolase, NSE)是最常用的评估脑损伤的生物标志物,且不受镇静药物等其他因素的影响。本中心在ROSC后即刻、12 h、24 h、48 h、72 h、7 d行NSE检查。NSE用于神经功能评估的界值仍有争议,结合欧洲2020年心肺复苏指南、文献和本中心的经验及研究结果[6,14-15],本中心建议ROSC后48 h NSE>60 ng/mL,或48 h NSE较即刻NSE升高>30 ng/mL提示预后不良,此外复苏后48 h及以后NSE进行性升高同样提示预后不良。需要注意的是,由于NSE也存在于血细胞和肺癌等神经内分泌肿瘤组织中,溶血及神经内分泌肿瘤会导致此指标升高,判定时需要注意[16]。
4 电生理检查
4.1脑电图(electroencephalogram, EEG) 脑电图是评估心脏骤停患者神经功能的标准检查之一。本中心脑电图检查时间节点为ROSC后12~24 h、48 h、72 h。检查前需评估患者意识、GCS评分,记录当前使用镇静药物、神经阻滞剂、抗癫痫药物种类及剂量等基本信息。采用国际10-20系统[17](见图2)安放19个记录电极(Fz、Cz、Pz、Fp1、Fp2、F3、F4、C3、C4、P3、P4、O1、O2、F7、F8、T3、T4、T5、T6),参考电极位于双耳垂或双乳突,接地电极放置在额极中点(FPz),并记录肌电和心电信号。采用率500 Hz,电极间阻抗<5 k,高频滤波35 Hz,低频率波0.5 Hz,灵敏度10 μV/mm。对于复苏后昏迷心脏骤停患者建议进行持续脑电监测,如无条件,应动态监测,每次至少记录30分钟,期间应对双上肢或眼眶给予疼痛刺激、耳旁呼喊或拍手等声音刺激从而观察反应性(脑电图反应性检查)。脑电图需由专业人员进行解读分析,重度异常脑电图与不良预后相关[18-19],包括爆发-抑制(抑制周期>50%)、抑制背景下的全面性周期性放电、广泛背景抑制(<10 μV)等[20]。此外,复苏后72 h内脑电图提示癫痫持续状态,或对外界刺激无反应也提示不良预后[4,6]。图3列举了部分复苏后良好预后及不良预后患者脑电图。在脑电图解读过程中,需要注意患者体温及药物等因素的影响。

图2 国际10-20系统电极位置
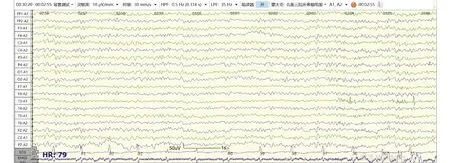
图3-A 青年男性复苏后48 h良好预后
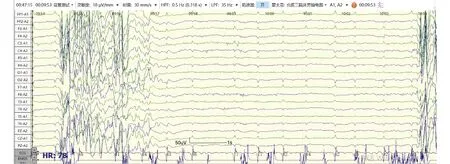
图3-B 中年男性复苏后24 h不良预后(爆发-抑制)
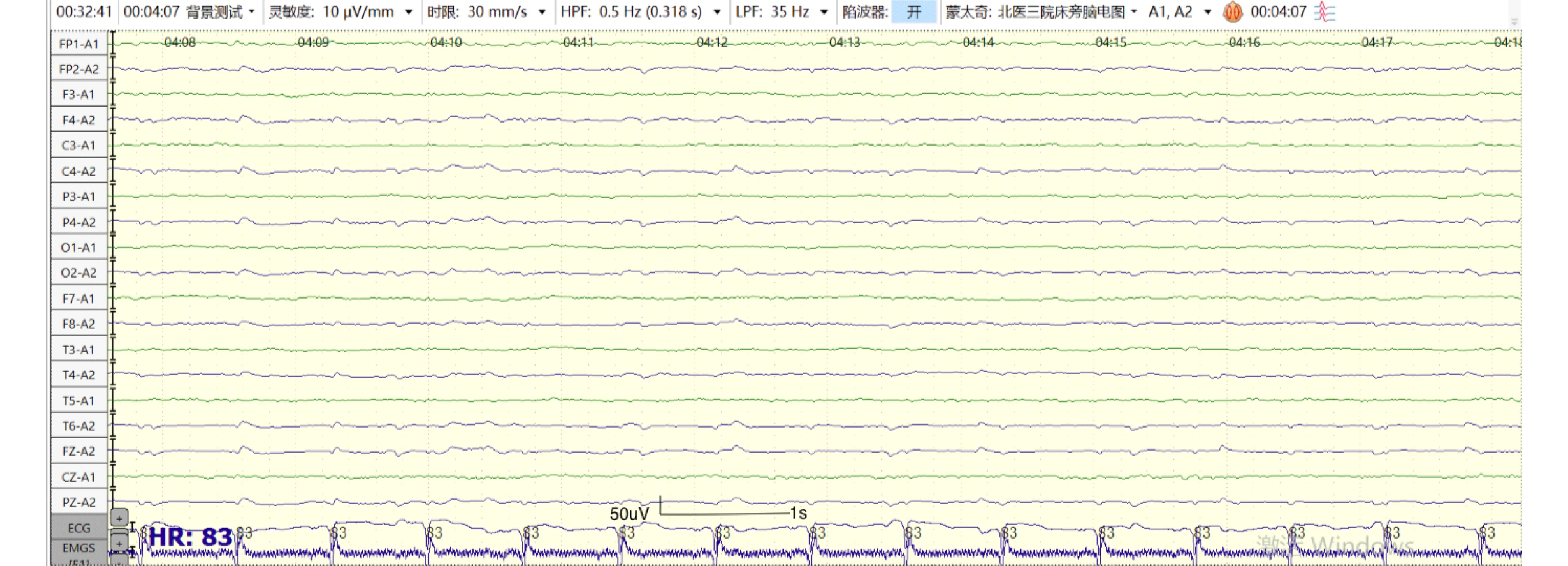
图3-C 老年女性复苏后72 h不良预后(广泛低电压)
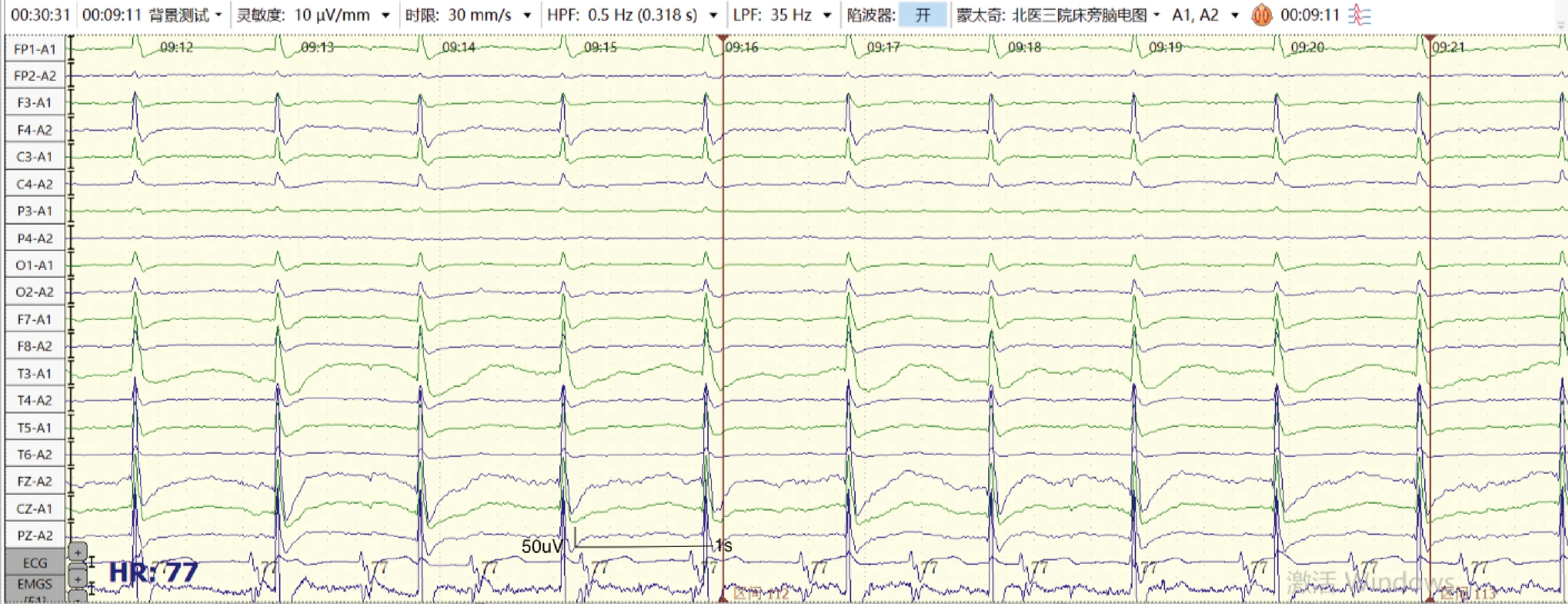
图3-D 中年男性复苏后24 h不良预后(全面性周期性放电)
4.2脑电双频指数(bispectral index, BIS) BIS是一种定量脑电图检查,将脑电图经过双频分析计算得出一个数值来反映大脑皮层功能,范围在0~100,数值越低提示大脑皮层抑制越深,100表示完全清醒。有研究发现,复苏后12.5 h BIS<23提示预后不良(特异性89%,敏感性86%),随着复苏后时间的延长,BIS逐步升高提示预后良好,而BIS持续维持在较低水平提示预后不良[21]。结合国内外研究结果,建议在ROSC后进行连续BIS监测至少72 h,停用镇静药物的情况下BIS持续>80,患者清醒可能性较大;持续<60提示预后不良可能;48 h内任何时间BIS为0并超过30 min提示预后不良。
在BIS监测时,需要注意以下参数:信号质量指数(signal quality indicator, SQI)实时监测记录信号质量,范围0~100,信号质量直接影响BIS数值的准确性,应保证SQI>80,如SQI数值低,应及时检查BIS传感器与患者额头皮肤接触是否紧密,必要时更换传感器。额肌电(EMG)指数是传感器监测到的额部肌电信号,应保证EMG<30 dB,EMG升高会影响BIS数值,应注意排查肌肉抽搐、寒战等病因,适当用药处理后再观察BIS趋势。
4.3短潜伏期躯体感觉诱发电位(short-latency somatosensory evoked potential, SSEP) SSEP检查可床旁进行,便于操作,通过刺激患者的双侧正中神经,监测有无N20波形[22],或测量N20波幅[23],对CA患者神经功能预后进行评估。因SSEP N20受镇静药物或温度影响较脑电图更小,预测神经功能预后价值较高[4,24]。本中心行SSEP检查时间点同脑电图,如复苏后24 h以上双侧SSEP N20消失或波幅极低提示不良预后[4,6]。
5 多模态神经功能评估
目前尚无某一单项特异性指标可直接准确预测心脏骤停患者神经功能预后,因此需联合临床检查、影像学、神经电生理、血清标志物等方式综合评估,多模态神经功能评估策略见图4。此外,还需规律对心脏骤停患者进行随访,确认最终预后结局。一般6个月左右达到最终状态,应至少随访至心脏骤停后6个月。
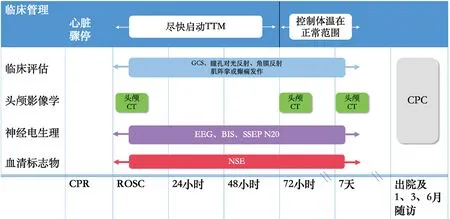
注:TTM为目标温度管理;GCS为格拉斯哥昏迷评分;EEG为脑电图;BIS为脑电双频指数;SSEP为短潜伏期躯体感觉诱发电位;NSE为神经元特异性烯醇化酶图4 多模态神经功能评估流程图
准确的神经功能评估是心脏骤停后昏迷患者管理的重要环节,规范、及时的多模态评估对预测患者神经功能预后至关重要,应联合临床检查、影像学、神经电生理、血清标志物等方式综合评估。北京大学第三医院作为心肺脑复苏中心,于2018年开展多模态神经功能评估,本文结合指南、国内外研究进展及本中心临床经验制定此实施规范,以期为国内同行提供经验和参考,推动我国心脏骤停患者多模态神经功能评估的进程。
