体外膜肺氧合对心肺复苏大鼠海马凋亡蛋白及内质网应激的影响
2022-10-18苏世琼刘瑞芳
苏世琼, 刘瑞芳
心脏骤停(cardiac arrest, CA)是医院内外常见且难治性疾病,是由于各种原因造成的心脏搏动停止导致重要器官严重缺血缺氧甚至最终死亡的临床危急重症[1]。虽然更快速和有效的心肺复苏(cardiopulmonary resuscitation, CPR)可以缓解CA后的结局,但CA/CPR后的病死率和神经功能不良预后发生率仍然很高,这是由于复苏后的脑缺血-再灌注损伤(cerebral ischemic reperfusion injury, CIRI)导致的[2]。而CIRI的发生机制与氧化应激、钙超载、线粒体功能障碍、炎症反应、神经元凋亡等多种因素有关,其中氧化和抗氧化防御系统失衡导致的氧化应激反应在诱导CIRI的发生中起到重要的作用,积累的自由基触发细胞膜脂质过氧化,也可通过线粒体、内质网或死亡受体启动神经元凋亡级联反应,导致神经功能障碍和细胞死亡[3]。近年来,内质网应激作为一种与脑缺血病理过程相关的凋亡新机制受到广泛关注。内质网应激后,启动未折叠蛋白反应有助于恢复内质网的活性,参与协调神经细胞凋亡,从而改善神经功能障碍[4]。有研究[5]显示,右美托咪定可以通过调节内质网应激相关蛋白来部分抑制由内质网应激诱导的凋亡,从而减轻CIRI。此外,有研究[6]证实,淫羊藿苷通过调节PI3K/AKT信号通路抑制内质网应激凋亡蛋白的表达,从而对内质网应激诱导的神经细胞凋亡起到保护作用。以上研究为CA/CPR后CIRI的干预提供依据。CA发生时,及时有效地为患者提供循环呼吸支持可降低并发症发生率和病死率。体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)通过代替心脏泵血功能和肺脏的氧合功能为患者提供暂时的呼吸和循环支持。有研究[7]发现,ECMO辅助CPR能够明显提高CA患者的生存率,改善神经结局。但目前ECMO应用于CA患者CPR中的研究较少,且通过何种途径及机制减轻患者脑损伤作用也尚未阐明。因此,本研究通过构建CA大鼠模型,探讨ECMO对大鼠海马凋亡蛋白及内质网应激的影响,为ECMO在临床上CA患者治疗中的应用提供参考。
1 材料与方法
1.1实验动物、药品及主要试剂
1.1.1 实验动物 50只SPF级雄性SD大鼠购自山东省实验动物中心,15个月龄,体重280~320 g,动物合格证号:SCXK(鲁)2017-007。于SPF房内55%~65%相对湿度、20~25 ℃室温、12 h/12 h阴暗交替光照条件下适应性饲养1周后进行实验,饲养期间允许大鼠自由摄食饮水。本研究获得河南省直第三人民医院实验动物伦理委员会的批准(批准文号:3128-14)。
1.1.2 药品及主要试剂 二甲双胍(中美上海施贵宝制药有限公司,国药准字H20023370,规格0.5 g×20片);盐酸利多卡因注射液(广州白云山明兴制药有限公司,国药准字H44020243,规格5 mL:0.1 g);胎牛血清(美国Gibco公司);兔超氧化物歧化酶1(superoxide dismutase 1, SOD1)抗体、兔SOD2抗体、兔Bcl-2相关X蛋白(Bax)抗体、兔B细胞淋巴瘤/白血病-2基因(Bcl-2)抗体、兔天冬氨酸特异性半胱氨酸蛋白水解酶3(Caspase-3)抗体、兔3-磷酸甘油醛脱氢酶(GRP78)抗体、兔X-盒结合蛋白1(XBP1)抗体(美国Abcam公司);4′,6-二脒基-2-苯基吲哚(4′, 6-diamidine-2-phenylindole, DAPI)、抗荧光衰减密封剂(北京索莱宝科技有限公司);TUNEL细胞凋亡检测试剂盒(上海翌圣生物科技股份有限公司);BCA蛋白质检测试剂盒(上海生工公司)。
1.2方法
1.2.1 模型制备及分组
1.2.1.1 分组 采用随机数字表法将50只健康SD雄性大鼠随机分为正常组、假手术组、模型组、ECMO组和二甲双胍组,每组10只。
1.2.1.2 造模前处理 二甲双胍组造模前14 d以200 mg/(kg·d)的剂量连续灌胃给予二甲双胍,共14 d。ECMO组造模前建立ECMO系统(由储血室、滚压泵、膜肺及配套管路组成),手术部位备皮、消毒,1%利多卡因局部浸润麻醉,游离右颈外静脉、右股动脉及尾动脉,其中右颈外静脉置入静脉引流管,右股动脉置入24 G套针管并注射0.5 mL的300 U/mL肝素,连接生理记录仪检测血压和心率,尾动脉置入20 G套针管,用于ECMO动脉段灌注;ECMO管路均采用包含300 U/mL肝素0.5 mL及6%羟乙基淀粉13 mL的无血预冲液预冲。
1.2.1.3 CA模型制备 按3 mL/kg的剂量腹腔注射10%水合氯醛麻醉模型组、ECMO组和二甲双胍组大鼠,采用经食道交流电刺激60 s的方法[8]制备CA模型。6 min后二甲双胍组行常规CPR治疗,ECMO组在ECMO辅助下行CPR,模型组不进行CPR治疗。假手术组仅行麻醉、分离股动静脉及插管,不进行电刺激及CPR;正常组不进行任何处理。
1.2.2 神经功能评分测试 采用神经功能评分系统对各组大鼠模型制备完成后及恢复自主循环后24 h的神经功能进行评价,包括一般行为缺陷(意识、知觉、觉醒、呼吸,共19分)、脑干功能(嗅觉、视觉、瞳孔对光反应、角膜反应、惊跳反应、胡须刺激反应、吞咽,共21分)、运动强度评估(共6分)、感觉评估(疼痛刺激反应,共6分)、自主行为(步态协调、平衡木行走,共6分)、反射(正位反射及直反射、拒绝趋地反射、视觉配合、转向实验,共12分)、癫痫发作(痉挛性或非痉挛性,共10分),满分80分为正常,评分越低提示大鼠神经功能缺损越严重,0分为脑死亡。

注:ECMO为体外膜肺氧合;CPR为心肺复苏图1 大鼠ECMO辅助下CPR管路图
1.2.3 海马组织病理学检查 恢复自主循环后72 h处死大鼠,取各组大鼠海马组织,4%多聚甲醛固定,脱水,二甲苯透明,浸蜡,包埋,切片,37 ℃烘干,脱蜡,水化,苏木素染色,1%盐酸乙醇浸泡分化,漂洗,脱水,苏木素-伊红(HE)染色,脱水,透明,封片,光学显微镜下(×400)观察各组大鼠海马组织病理学形态。
1.2.4 免疫荧光染色观察海马组织SOD1、SOD2表达 各组大鼠海马组织石蜡切片烘干,脱蜡,3% H2O2浸泡去除内源性过氧化物酶,柠檬酸钠缓冲液高压修复,与SOD1、SOD2一抗于4 ℃孵育过夜。阴性对照组用PBS代替一抗。PBS中洗涤3次,每次5 min,加入二抗于37 ℃孵育1 h,PBS洗涤。DAPI复染2 min,PBS冲洗3次。使用适量的抗荧光衰减密封剂进行密封。在共聚焦显微镜(日本尼康公司)下观察荧光强度。
1.2.5 TUNEL检测海马组织细胞凋亡 采用TUNEL细胞凋亡检测试剂盒检测海马组织神经元细胞凋亡情况。海马组织用4%多聚甲醛在4 ℃条件下固定24 h,用含有0.1% Triton X-100的PBS溶液在室温下放置5 min。 干燥组织,加入50 mL反应混合物(酶浓缩液∶标记溶液=1∶9),在湿箱中37 ℃避光孵育1 h。 用PBS重新洗涤载玻片,每个切片在荧光显微镜(400×)下随机选择5个视野观察海马组织细胞凋亡情况。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.2.6 免疫组化分析海马组织凋亡相关蛋白及内质网应激相关蛋白表达 大鼠海马组织切片脱蜡,水化,3% H2O2浸泡抑制内源性过氧化物酶活性,用柠檬酸钠缓冲液对切片进行微波修复,冷却,PBS洗涤。非特异性结合位点于37 ℃用10%胎牛血清阻断1 h。加Bax、Bcl-2、Caspase-3、GRP78、XBP1一抗于4 ℃孵育,次日取出切片,PBS洗涤,加山羊抗小鼠二抗于37 ℃孵育1 h,用PBS洗涤残留二抗,二氨基联苯胺(diaminobenzidine, DAB)染色,苏木素复染,1%盐酸乙醇分化,脱水封片。光学显微镜下观察Bax、Bcl-2、Caspase-3、GRP78、XBP1表达情况,计算阳性细胞率。
1.2.7 Western blot分析海马组织凋亡相关蛋白及内质网应激相关蛋白表达 RIPA缓冲液提取各组大鼠海马组织中的总蛋白质,BCA蛋白质检测试剂盒测定其浓度。97 ℃下变性5 min,电泳分离,转膜,5%脱脂奶粉封闭,将膜与针对Bax、Bcl-2、Caspase-3、GRP78、XBP1的特异性一抗在4 ℃下孵育过夜,采用辣根过氧化物酶(horseradish peroxidase, HRP)偶联的二抗在37 ℃下再孵育1.5 h。 使用增强型化学发光试剂及Image Lab软件(美国Bio-Rad公司)观察蛋白质印记并分析条带密度。

2 结果
2.1神经功能评分 造模完成后的模型组、ECMO组、二甲双胍组大鼠神经功能评分均明显低于正常组和假手术组(P<0.05),提示模型制备成功。恢复自主循环后24 h,模型组大鼠神经功能评分明显低于正常组(P<0.05),ECMO组、二甲双胍组明显高于模型组(P<0.05),ECMO组与二甲双胍组比较差异无统计学意义(P>0.05)。见图2。

注:A为模型制备完成后神经功能评分的比较;B为恢复自主循环后24 h神经功能评分的比较;ECMO为体外膜肺氧合;与正常组比较,*P<0.05;与模型组比较,#P<0.05图2 各组大鼠神经功能评分的比较
2.2海马组织HE染色结果 HE染色结果显示,正常组和假手术组大鼠海马组织细胞着色均匀,细胞核及核仁大小正常,锥体细胞排列整齐有序,组织形态及结构正常;模型组大鼠海马组织细胞结构模糊甚至丢失,胞核及胞浆着色不均匀,细胞核固缩深染,核仁变小甚至消失,锥体细胞呈松散排列,神经元肿胀呈透明空泡化,组织形态及结构紊乱;ECMO组和二甲双胍组大鼠海马组织病理形态较模型组明显改善,细胞空泡化明显减少,神经元胞浆及胞核着色较均匀,组织形态基本规则。见图3。
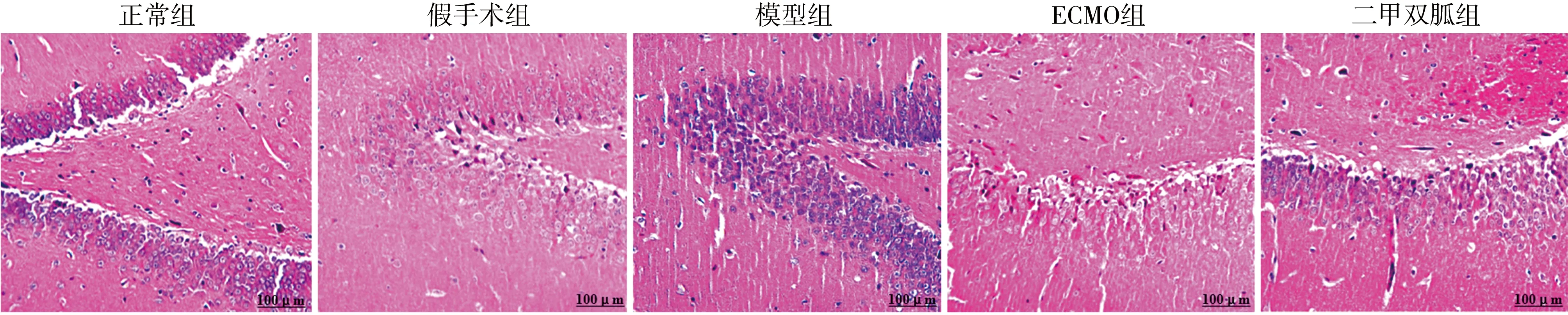
注:ECMO为体外膜肺氧合图3 各组大鼠海马组织HE染色结果的比较(×400)
2.3海马组织SOD1、SOD2表达情况的比较 模型组大鼠海马组织SOD1、SOD2的荧光强度明显低于正常组(P<0.05),ECMO组、二甲双胍组明显高于模型组(P<0.05),ECMO组与二甲双胍组比较差异无统计学意义(P>0.05)。见图4。
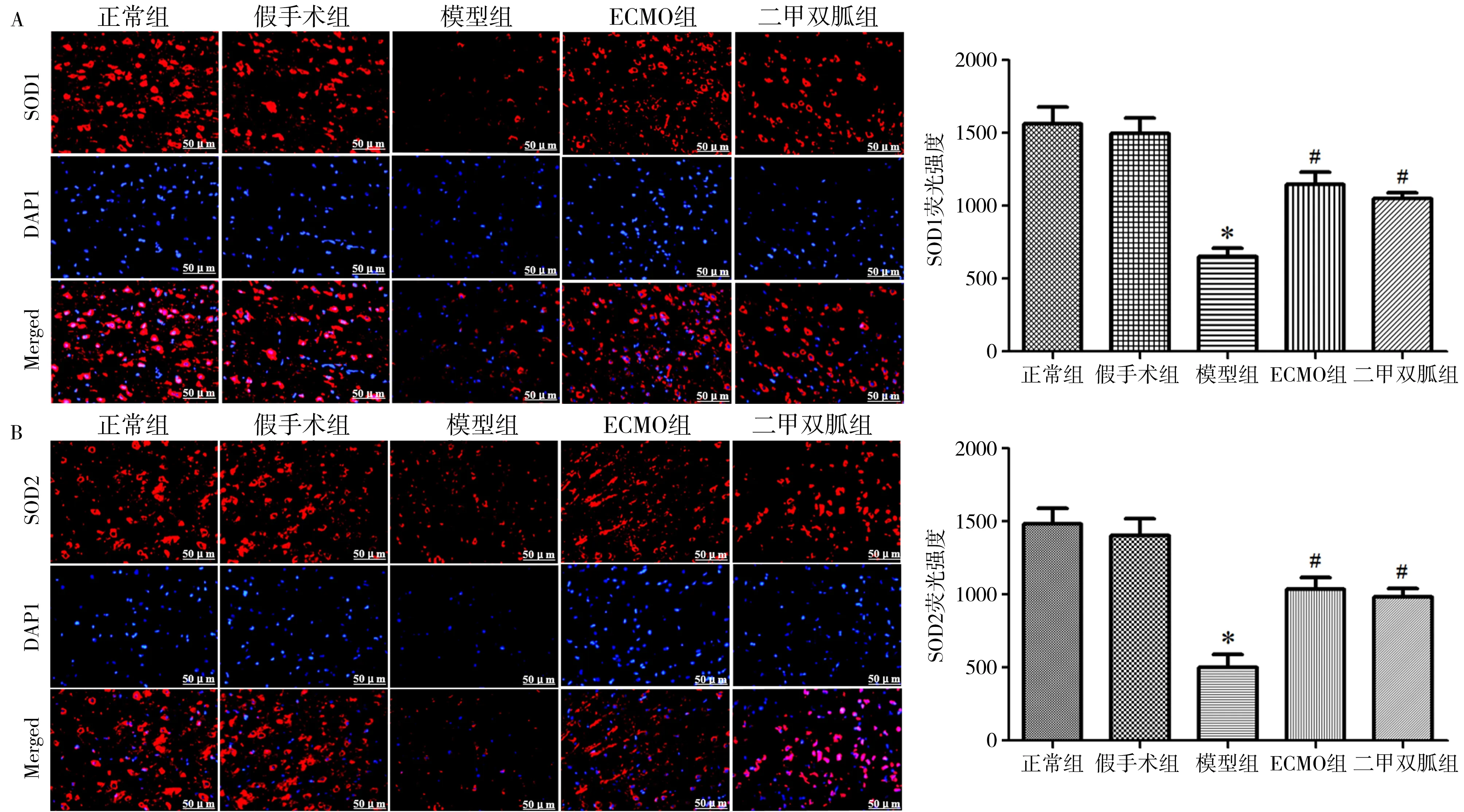
注:A为SOD1表达情况的比较;B为SOD2表达情况的比较;ECMO为体外膜肺氧合;SOD1为超氧化物歧化酶1,显示为红色荧光;SOD2为超氧化物歧化酶2,显示为红色荧光;DAPI为细胞核染色,显示为蓝色荧光;Merged为SOD1与DAPI、SOD2与DAPI染色结果图像拟合;与正常组比较,*P<0.05;与模型组比较,#P<0.05图4 免疫荧光染色观察各组大鼠海马组织SOD1、SOD2表达情况的比较
2.4海马组织神经元细胞凋亡情况 模型组大鼠海马组织神经元细胞凋亡率明显高于正常组(P<0.05),ECMO组、二甲双胍组明显低于模型组(P<0.05),ECMO组与二甲双胍组比较差异无统计学意义(P>0.05)。见图5。

注:ECMO为体外膜肺氧合;TUNEL为凋亡细胞染色,显示为绿色荧光;DAPI为细胞核染色,显示为蓝色荧光;Merged为TUNEL与DAPI染色结果图像拟合;与正常组比较,*P<0.05;与模型组比较,#P<0.05图5 各组大鼠海马神经元细胞凋亡情况的比较(×400)
2.5海马组织凋亡相关蛋白 免疫组化分析结果显示,模型组大鼠海马组织Bax、Caspase-3阳性细胞率明显高于正常组(P<0.05),Bcl-2阳性细胞率明显低于正常组(P<0.05),ECMO组、二甲双胍组Bax、Caspase-3阳性细胞率明显低于模型组(P<0.05),Bcl-2阳性细胞率明显高于模型组(P<0.05),ECMO组与二甲双胍组Bax、Bcl-2、Caspase-3阳性细胞率比较差异无统计学意义(P>0.05)。见图6。
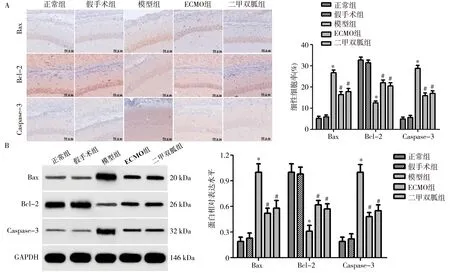
注:A为免疫组化分析海马凋亡相关蛋白表达情况(×400);B为Western blot分析海马凋亡相关蛋白表达情况;ECMO为体外膜肺氧合;Bax为Bcl-2相关X蛋白;Bcl-2为B细胞淋巴瘤/白血病-2基因;Caspase-3为天冬氨酸特异性半胱氨酸蛋白水解酶3;GAPDH为3-磷酸甘油醛脱氢酶;与正常组比较,*P<0.05;与模型组比较,#P<0.05图6 各组大鼠海马凋亡相关蛋白表达的比较
2.6内质网应激相关蛋白表达量 免疫组化分析结果显示,模型组大鼠海马组织中GRP78、XBP1阳性细胞率明显高于正常组(P<0.05),ECMO组、二甲双胍组明显低于模型组(P<0.05),ECMO组与二甲双胍组比较差异无统计学意义(P>0.05)。见图7。
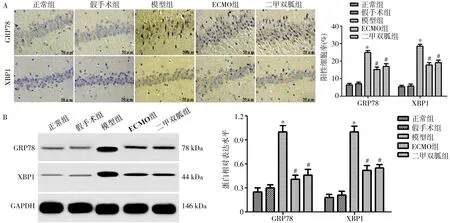
注:A为免疫组化分析内质网应激相关蛋白表达情况(×400);B为Western blot分析内质网应激相关蛋白表达量;ECMO为体外膜肺氧合;GRP78为葡萄糖调节蛋白78;XBP1为X-盒结合蛋白1;GAPDH为3-磷酸甘油醛脱氢酶;与正常组比较,*P<0.05;与模型组比较,#P<0.05图7 各组大鼠内质网应激相关蛋白表达量的比较
3 讨论
CA是导致人类死亡的首要原因,在我国每年约有50万人死于CA[9]。CPR是治疗CA的简单、经济、快速、常规手段,随着CPR技术的发展及其质量控制的不断完善,CA患者自主循环恢复率可达40%~60%,生存率明显提高[10]。但由于CPR为患者的心脏和大脑仅能提供20%~40%的血流灌注,导致患者神经功能预后及生存率仍不理想,生存的患者中神经功能保持完好的患者仅占15%,生活质量受到严重影响[11]。CA/CPR后的脑神经保护是目前临床上亟待解决的难题。近年来研究发现,二甲双胍除了是国际公认的治疗2型糖尿病的一线药物外,在抑郁症、衰老、老年痴呆等病理机制中也发挥着重要的神经保护作用,还可通过抗氧化发挥对CA/CPR后脑损伤患者的神经保护作用[12]。ECMO技术早在20世纪70年代就成功为一名接受心脏手术后的患儿提供心肺功能支持,在20世纪90年代提出ECMO辅助下的CPR为患者提供暂时的心肺支持。近年来,多项研究也证实了ECMO的应用可提高CA患者的生存率,改善患者的神经功能预后[13]。美国心脏协会指南及体外生命支持组织也认为ECMO是一种可用于CA患者的技术。但ECMO通过何种途径减轻CA患者的脑损伤从而起到神经保护作用尚未阐明,作用机制尚未明确,影响ECMO应用于CA患者治疗中的临床进展。
Zhou等[14]的研究结果显示,缺血预处理和缺血后处理可通过抑制海马组织神经元细胞凋亡及调节凋亡相关蛋白Bax、Bcl-2、Caspase-3表达在CA大鼠的CPR中发挥神经保护作用。张宗祥等[15]发现,ERK抑制剂PD98059可通过减轻内质网应激对大鼠CA/CPR后的CIRI起到保护作用。Hu等[16]研究证实,茶多酚的应用对CA/CPR后CIRI大鼠起到脑保护作用,其机制可能与茶多酚具有较强的抗氧化活性及通过抑制神经元凋亡、增加脑内源性抗氧化能力、调节内质网应激有关。上述研究结果表明,海马组织细胞凋亡、内源性抗氧化能力下降及内质网应激功能障碍是CA/CPR后发生CIRI的主要病理因素。本研究显示,模型组大鼠海马组织SOD1、SOD2、抗凋亡蛋白Bcl-2表达明显低于正常组(P<0.05),细胞凋亡率和促凋亡蛋白Bax、Caspase-3表达及内质网应激相关蛋白GRP78、XBP1表达明显高于正常组(P<0.05),均证实了上述结论。氧化和抗氧化失衡是CIRI期间神经功能缺损和高病死率的直接原因[17]。内质网应激与CIRI病理生理有关,内质网作为蛋白质折叠和合成的重要部位,对机体的稳态失衡非常敏感[18]。在缺血和缺氧时,氧化应激干扰内质网的稳态,导致错误折叠或未折叠蛋白的积累,触发未折叠蛋白反应,从而促进细胞凋亡,诱发神经损伤[19]。因此,本研究通过分析ECMO对CA/CPR后大鼠海马组织凋亡蛋白、抗氧化指标、内质网应激相关蛋白的影响,探讨ECMO改善CA/CPR后大鼠脑损伤的机制。
于洁等[20]的研究结果显示,ECMO辅助可提高CA大鼠CPR的成功率,可达87.5%。Shin等[21]证实,ECMO辅助下的CPR治疗CA患者1个月和6个月的神经功能良好率(33.3%、26.7%)明显高于常规CPR(5.0%、5.0%),ECMO能够提高CA/CPR患者的神经预后及生存率。在本研究中,ECMO组大鼠恢复自主循环后24 h神经功能评分明显高于模型组(P<0.05),提示ECMO能够减轻CA/CPR后大鼠的神经功能损伤。ECMO除了能够暂时为CA/CPR大鼠提供心肺支持外,还可通过保温水箱调节大鼠体温,降低耗氧量,起到保护重要器官的作用,从而减轻大鼠脑损伤和神经功能损伤。此外,本研究还发现,ECMO组大鼠海马组织SOD1、SOD2、Bcl-2表达明显高于模型组,细胞凋亡率、Bax、Caspase-3及内质网应激相关蛋白GRP78、XBP1表达明显低于模型组(P<0.05),表明ECMO能够改善CA/CPR后大鼠的内源性抗氧化能力、内质网应激障碍,抑制海马组织细胞凋亡。GRP78、XBP1均是内质网应激、凋亡和细胞存活的重要调控因子,正常情况下与内质网跨膜蛋白结合,表现出非活跃状态,当机体由于缺血缺氧导致氧化和抗氧化失衡等各种病理因素诱导细胞内发生错误折叠或未折叠蛋白的积累时,其与内质网跨膜蛋白分离,引发内质网应激,处于活跃状态的GRP78、XBP1通过促进Bax、Caspase-3表达,抑制Bcl-2表达,诱导细胞凋亡反应[22]。ECMO的应用可保证脑等重要脏器的血流灌注和氧供,还可排出血液中的CO2,缓解了机体氧化和抗氧化失衡状态,从而减轻内质网应激障碍,抑制海马组织细胞凋亡,发挥神经保护作用。
综上所述,ECMO辅助下CPR能够明显改善CA大鼠的神经功能,其机制可能与增加海马内源性抗氧化能力、调节内质网应激及抑制海马组织细胞凋亡有关。
