用于肿瘤免疫治疗的细胞膜包裹纳米药物研究进展
2022-10-14朱彬毓蔡颖李亚平张鹏程
朱彬毓,蔡颖,李亚平,张鹏程
(中国科学院上海药物研究所,上海 201203)
1 肿瘤免疫治疗纳米药物研究概况
恶性肿瘤是严重危害我国人民生命健康的重大疾病,近十几年来发病率年均增幅高达3.9%,死亡率年均增幅达2.5%。2020年,我国新增恶性肿瘤患者456.8万例,死亡300.2万例,居全球首位[1]。肿瘤经典的临床治疗手段包括手术和放疗等局部疗法以及化疗、内分泌治疗和分子靶向治疗等全身疗法,显著改善了肿瘤患者预后。然而,经过上述疗法治疗后,肿瘤患者的5年生存率在美国等发达国家仍不足70%,亟需发展新的肿瘤治疗策略。
免疫疗法是肿瘤治疗领域的革命性进展[2-3]。虽然肿瘤在发生初期会激活免疫监视,但其最终会通过多种免疫逃逸机制逃避免疫清除。已知机制包括降低肿瘤相关抗原展示、过表达免疫检查点分子以及招募和诱导免疫抑制细胞等。基于此,肿瘤免疫治疗主要通过激活、恢复和增强患者自身的抗肿瘤免疫反应或者引入工程化免疫细胞,实现特异和持续的肿瘤细胞清除。目前上市的肿瘤免疫疗法有免疫检查点阻断(immune checkpoint blocade,ICB)疗法和嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)疗法等,在包括肺癌、黑色素瘤和B细胞淋巴瘤等多种肿瘤的治疗中展现出了令人鼓舞的效果。尽管如此,上述免疫疗法仍面临诸多挑战。例如,ICB疗法的效果依赖于患者抗肿瘤免疫细胞的激活程度和瘤内免疫浸润的程度,而肿瘤内复杂的免疫抑制微环境则限制了ICB和CAR-T细胞疗法对实体瘤的治疗效果[4-7]。因此,临床上仍需发展新的肿瘤免疫治疗策略,以进一步提高肿瘤治疗效果。
纳米药物在肿瘤治疗领域逐渐展现出其独特的优势。纳米药物通常指粒径在10 ~ 1000 nm的药物递送系统,其特有的体内过程和生物相互作用有利于增加药物在瘤内的蓄积,降低药物副作用[8-9]。目前上市的抗肿瘤纳米药物包括阿霉素脂质体、伊立替康脂质体和紫杉醇白蛋白纳米粒等[10],其中紫杉醇白蛋白纳米粒与ICB疗法联合现已成为转移性三阴性乳腺癌的一线治疗方案[11-12]。随着研究的深入,研究者发现纳米药物因其尺度效应和表面特性等与免疫细胞具有明显的相互作用[13-14]。例如,局部注射的纳米颗粒相比于游离抗原更易被组织内和引流淋巴结内的树突状细胞(dendritic cell,DC)所捕获,而到达肿瘤的纳米颗粒则易被瘤内的巨噬细胞吞噬。因此,利用纳米药物增强抗肿瘤免疫治疗效果已成为研究前沿和热点。但另一方面,纳米颗粒会直接导致药物分布的变化,而非特异性分布会产生特殊的不良反应。作为外源性物质的纳米颗粒,还易触发免疫应答,增加网状内皮系统和生物黏附引起的滞留效应,最终被机体识别和清除。例如,长循环阿霉素脂质体会增加药物在皮肤组织的外渗和滞留,在临床上易引起手足综合征。长循环阿霉素脂质体在多次注射后,还会通过激活补体和免疫球蛋白吸附,从而引发加速的血液清除效应,促进药物肝清除,影响药物向肿瘤部位和瘤内特定细胞的蓄积。
在异质性肿瘤内,实现纳米药物对特定细胞的靶向和特异性调控是提高抗肿瘤免疫治疗效果的关键。纳米药物的表面理化和生物特征是决定其体内过程和细胞相互作用的关键参数。近年来,研究者提出用细胞膜伪装纳米颗粒,这一策略有望改善纳米颗粒与免疫系统的相互作用。利用这一策略制备的仿生纳米颗粒继承了源细胞(如红细胞、免疫细胞、癌细胞和血小板等)的特定生物功能,可以整合细胞膜上各种蛋白质和分子的优势,使其具有更好的生物相容性和较低的免疫原性,从而逃避免疫清除,延长循环时间,还可利用膜蛋白的受配体识别机制实现靶向递送,在一定程度上解决了传统纳米药物在肿瘤免疫治疗中所面临的问题。此外,细胞膜获取容易且包裹流程简单,相比于传统纳米药物有较大的优势。Hu等[15]首次用天然红细胞膜包裹聚合物纳米粒,证实了获得的细胞膜包裹纳米药物(cell membrane-coated nanomedicines,CMNs)借助红细胞膜的生物相容性和抗巨噬细胞吞噬能力使其血液循环时间显著延长。此后,基于细胞膜包裹的纳米颗粒修饰技术迅速发展,来源于不同真核细胞的细胞膜、细菌膜和细胞器膜等被广泛用于纳米颗粒表面改性,而细胞膜融合技术、细胞膜功能化技术和基因修饰技术等也被逐步探索,丰富了生物膜的来源和功能[16-19]。同时,通过采用不同的纳米核心负载不同的药物,进一步拓展了CMNs的多样性和应用范围。近年来,CMNs也被逐步用于肿瘤免疫治疗,并取得了显著的疗效。CMNs通过作用于抗肿瘤免疫循环中的1个或多个环节以提高肿瘤免疫治疗效果(见图1),主要包括:1)增加肿瘤细胞免疫原性死亡(immunogenic cell death,ICD)以及肿瘤相关抗原(tumor-associated antigens,TAAs)和危险相关分子模式(damageassociated molecular patterns,DAMPs)释放;2)促进抗原递呈细胞(antigen-presenting cells,APCs)活化;3)提高肿瘤特异性细胞毒性T细胞(cytotoxic T lymphocytes,CTLs)增殖;4)增强CTLs对肿瘤细胞识别能力;5)增强CTLs对肿瘤细胞的杀伤能力。目前,CMNs的制备技术和在传统肿瘤治疗中的应用已有较全面的综述[17,20-22],本文将重点围绕CMNs在肿瘤免疫治疗中的应用,探讨从CMNs设计到作用机制研究方面的最新进展,旨在为用于肿瘤免疫治疗CMNs的研究和临床转化提供参考。
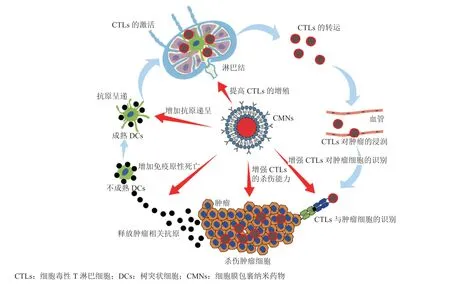
图1 抗肿瘤免疫循环及常见的细胞膜包裹纳米药物提高肿瘤免疫治疗效果的策略示意图Figure 1 Antitumor immune cycle and previously explored CMN-based strategies for improving antitumor immunity
2 细胞膜包裹纳米药物在肿瘤免疫治疗中的应用
2.1 促进肿瘤细胞免疫原性死亡
ICD是抗肿瘤免疫循环中的第一步。因此,提高肿瘤细胞ICD是增强肿瘤免疫治疗效果的有效手段。传统的放疗、化疗和分子靶向治疗均能够在一定程度上诱导肿瘤细胞ICD,然而上述疗法也会同时引发全身性免疫抑制,具有局限性。光疗是一种新兴的肿瘤治疗手段,主要通过光敏剂将光能转化为化学能(光动力疗法)和热能(光热疗法),使细胞内关键生物大分子变性失活,造成细胞急性损伤,进而强烈诱导肿瘤细胞ICD[23]。光疗因其良好的时空可控性和ICD诱导效应,在肿瘤治疗方面展现出巨大潜力。利用CMNs的肿瘤靶向递送能力,能促进光敏剂在肿瘤部位的高效蓄积以进一步增强光疗的选择性和ICD诱导能力。其中,利用肿瘤细胞膜与肿瘤细胞的同源亲和性是提高光敏剂在肿瘤内蓄积的有效策略。例如,Kim等[24]将光敏剂毒杀红蛋白(killer red,KR)嵌入到肿瘤细胞膜中制备的功能化脂质体显著提高了KR在肿瘤中的蓄积,并在局部光照下通过产生活性氧簇(reactive oxygen species,ROS)有效诱导了ICD及后续抗肿瘤免疫反应,抑制了同型荷瘤小鼠的原发肿瘤生长和肺转移。Xiong等[25]进一步通过细胞膜杂合技术,将小鼠来源的ID8卵巢癌细胞与红细胞(red blood cell,RBC)的细胞膜融合获得ID8 & RBC混合细胞膜(ID8 & RBC membrane,IRM),利用RBC和ID8细胞膜蛋白分别抑制内吞和增加肿瘤细胞靶向,提高了负载吲哚菁绿(indocyanine green,ICG)的磁性纳米颗粒(Fe3O4-ICG@IRM)在ID8肿瘤内的蓄积,从而在局部光照后产生强烈的光热效应,促进肿瘤细胞ICD。与裸纳米粒Fe3O4-ICG相比,Fe3O4-ICG@IRM显著增加了免疫炎症因子如白介素-1α(interleukin-1α,IL-1α)、IL-1β、IL-6等的释放,同时在ID8卵巢癌小鼠模型中表现出更强的抑制肿瘤生长效果。
除了利用物理刺激在肿瘤局部促进肿瘤细胞ICD之外,针对肿瘤特有微环境引发ICD也是提高特异性抗肿瘤免疫的有效手段。例如,肿瘤部位由于血液灌流异常,形成了局部乏氧微环境。单核细胞增多性李斯特菌(Listeria monocytogenes,Lmo)等厌氧细菌则倾向于定植在乏氧环境,有望用于局部诱导肿瘤细胞ICD。然而细菌作为异源微生物,在进入血液后会被免疫细胞迅速清除。为此,Liu等[26]用RBC膜包裹选择性删除毒力因子的Lmo构建了一种新型免疫治疗系统(Lmo@RBC)。Lmo@RBC通过上调成孔蛋白GSDMC的表达并激活ROS诱导的含半胱氨酸的天冬氨酸蛋白水解酶8(cysteinyl aspartate specific proteinase,Caspase-8)活化,协同触发肿瘤细胞焦亡。产生的肿瘤碎片和分泌的促炎细胞内容物可以作为肿瘤相关抗原,有效诱导抗肿瘤免疫反应(见图2)。研究中Liu等[26]将红细胞膜与Lmo混合,采用机械挤压法制备了Lmo@RBC。相比于裸Lmo和Lmo+RBC,Lmo@RBC降低了细菌的免疫细胞清除,显著减弱了全身性炎症反应。Lmo@RBC治疗后小鼠的血液指标均正常,且无慢性毒性。同时,Lmo@RBC的长血液循环优势使其更好地定植于肿瘤乏氧微环境。通过对磷酸盐缓冲液(phosphate buffered saline,PBS)、Lmo及Lmo@RBC处理小鼠的肿瘤进行基因组分析,发现Lmo@RBC处理组相比于对照组在CT26细胞中诱导了更多成孔蛋白GSDMC的表达,增加了细胞焦亡相关炎症因子IL-18、IL-1β的释放和Caspase-8活化,并有效刺激了DC熟化。Lmo@RBC在体内促进了强效而持久的抗肿瘤免疫应答,在CT26小鼠模型上有效抑制了原位瘤和转移灶。
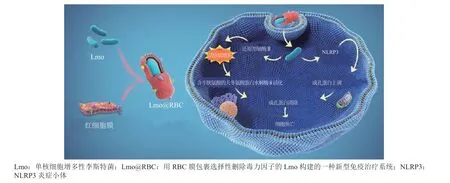
图2 Lmo@RBC促进肿瘤细胞焦亡的机制[26]Figure 2 Mechanism of Lmo@RBC-induced pyroptosis in cancer cells
促进肿瘤细胞ICD不仅能够降低肿瘤负荷,同时还能诱导抗肿瘤免疫,引发持久的肿瘤抑制,因此是一种直接而有效的抗肿瘤免疫治疗策略。然而,许多肿瘤ICD诱导物如化疗药物、光敏剂和微生物等缺乏肿瘤细胞特异性,易造成全身性副作用。CMNs利用天然和工程化细胞膜上的膜蛋白,有助于逃避免疫清除并增加肿瘤细胞靶向,提高抗肿瘤效果。
2.2 增加抗原递呈细胞激活
肿瘤细胞释放的TAAs和DAMPs通过激活APCs刺激特异性T细胞的增殖和活化。然而,随着肿瘤进展,瘤内浸润的大量免疫细胞如巨噬细胞等会通过清除DAMPs和降解肿瘤碎片等方式,导致肿瘤引流淋巴结内的APCs不能高效激活抗肿瘤免疫,甚至还会通过DCs依赖的T细胞活化诱导细胞死亡(activation-induced cell death,AICD)等机制诱导免疫耐受。为了弥补DAMPs缺乏导致的APCs激活不足,Bahmani等[27]探究了Toll样受体(Toll-like receptor,TLR)激动剂补充策略,利用血小板与肿瘤微环境细胞的黏附作用,用血小板膜包裹负载TLR激动剂resiquimod(R848)的纳米颗粒(platelet membrane-coated nanoparticles,PNP-R848),延长瘤内注射R848在肿瘤部位的滞留和作用时间。PNP-R848可有效促进DCs熟化,在MC38和4T1肿瘤模型中,均激活了强烈的抗肿瘤免疫,在促使已有肿瘤消退的同时抑制了肿瘤复发。针对AICD导致的肿瘤免疫耐受,Hua等[28]构建了基于IL-10修饰的细菌仿生膜囊(bacterial biomimetic vesicles exposing IL-10,IL10-BBVs),利用IL10-BBVs的肿瘤引流淋巴结靶向作用,通过表面IL-10与DCs上的IL-10受体结合来抑制DCs依赖的AICD,有效减少了肿瘤抗原特异性CTLs的清除,增强了抗肿瘤免疫。
肿瘤微环境具有显著的免疫抑制特性,因此仅激活部分抗原递呈通路效果可能有限。为提高APCs的抗原递呈效率,用于非肿瘤部位的肿瘤疫苗成为当前肿瘤免疫治疗的热点之一。肿瘤疫苗需要同时向APCs递送TAAs和佐剂。由于肿瘤细胞膜在表面展示大量的TAAs,因而被用于包裹载有佐剂的纳米颗粒,获得个性化肿瘤疫苗。为了获得高效的肿瘤细胞膜,Xiong等[29]在体外用阿霉素诱导小鼠三阴性乳腺癌细胞Luc-4T1发生ICD,使其展示TAAs和钙网蛋白等,随后用该细胞膜包裹载TLR7激动剂R837的聚乳酸-乙醇酸纳米粒,并发现钙网蛋白能够诱导纳米疫苗被DCs摄取,增加R837和Luc-4T1膜抗原在DCs内的蓄积,将DCs熟化率从26.2%提高到了59.3%,进而激发针对性抗肿瘤免疫应答,在4T1小鼠模型中有效抑制了肿瘤的生长。Johnson等[30]利用类似的原理,构建了针对白血病的肿瘤疫苗。为进一步提高纳米疫苗的DCs靶向效率,Liu等[31]在源自肿瘤细胞的细胞膜泡(cell membrane vesicles,CMVs)上,进一步修饰了TLR9激动剂CpG寡核苷酸和靶向DCs上过表达受体(DC特异性细胞间黏附分子3抓取非整联蛋白受体)的适配体,DNA修饰的CMVs高效靶向DCs并进一步刺激其成熟,而后与CD8+T细胞结合并将其激活(见图3A)。上述DNA修饰CMVs(CMV-CpG/Apt)可使DCs熟化率从23.7%提高到43.6%,并促进DCs释放IL-6、IL-12p40及TNF-α等细胞因子,进而激活抗肿瘤免疫,有效延迟了B16OVA肿瘤的生长。上述纳米疫苗与ICB疗法联用,在消除大部分肿瘤的同时,还能建立肿瘤特异性的免疫记忆,防止肿瘤复发。不同于上述局部注射的纳米疫苗,Han等[32]将肿瘤细胞膜和红细胞膜融合构建了称作纳米红细胞膜囊(nanoerythrosome)的可静脉注射纳米疫苗,利用纳米化红细胞膜向脾脏蓄积并特异性向其中APCs递送抗原的特性,刺激抗肿瘤免疫。运用上述技术,通过使用模型动物手术切除肿瘤细胞的细胞膜和自体红细胞膜,可快速构建个体化肿瘤疫苗,在与ICB疗法联用后能显著抑制黑色素瘤的术后复发和转移。
除了自体来源的细胞外,研究者们还探索了细菌来源的生物膜作为肿瘤疫苗成分的潜力。其中,细菌外膜囊泡(outer membrane vesicles,OMVs)是由革兰氏阴性菌释放到培养介质中的囊泡(20 ~ 300 nm),因其含有细菌来源蛋白、脂质及核酸等,能强烈激活先天免疫系统,作为候选免疫佐剂日益受到关注。Cheng等[33]通过对OMVs上的ClyA进行修饰引入SpyTag(SpT)和SnoopTag(SnT)标签,构建了一个即插即用型的多功能OMVs疫苗平台。利用构建的TAAs上SpyCatcher(SpC)或SnoopCatcher(SnC)分别与OMVs上述2个标签之间的特异的肽间偶联反应,多种TAAs可被特异性地展示到OMVs表面,引发特异和协同的抗肿瘤免疫反应(见图3B)。由于其尺寸小和细菌来源特征,OMVs在局部注射后可高效向引流淋巴结积聚,并在其中被DCs捕获,从而刺激DCs熟化。在小鼠模型上,上述基于OMVs的疫苗可消除黑色素瘤肺转移灶,并抑制皮下结直肠癌的生长。上述纳米疫苗策略需已知序列的TAAs,但不同肿瘤患者的TAAs各不相同。为了构建个体化的OMVs疫苗,Zou等[34]将OMVs与肿瘤来源的细胞膜(cell membrane originated from the tumor,mT)杂交形成新的功能囊泡(mTOMVs)。该个体化肿瘤疫苗能有效增加DCs对TAAs的摄取,在小鼠模型上经局部注射后可在腹股沟淋巴结内有效积聚,显著抑制4T1肿瘤肺转移。在上述工作基础上,Yue等[35]通过改造大肠埃希菌,使其在阿拉伯糖诱导的启动子控制下,产生展示肿瘤抗原融合蛋白溶血素A的OMVs。这些OMVs口服后可穿过肠上皮进入前肠膜,刺激DCs熟化,在肺转移性黑色素瘤小鼠模型和皮下结肠癌小鼠模型中,显著抑制肿瘤生长并诱导免疫记忆。
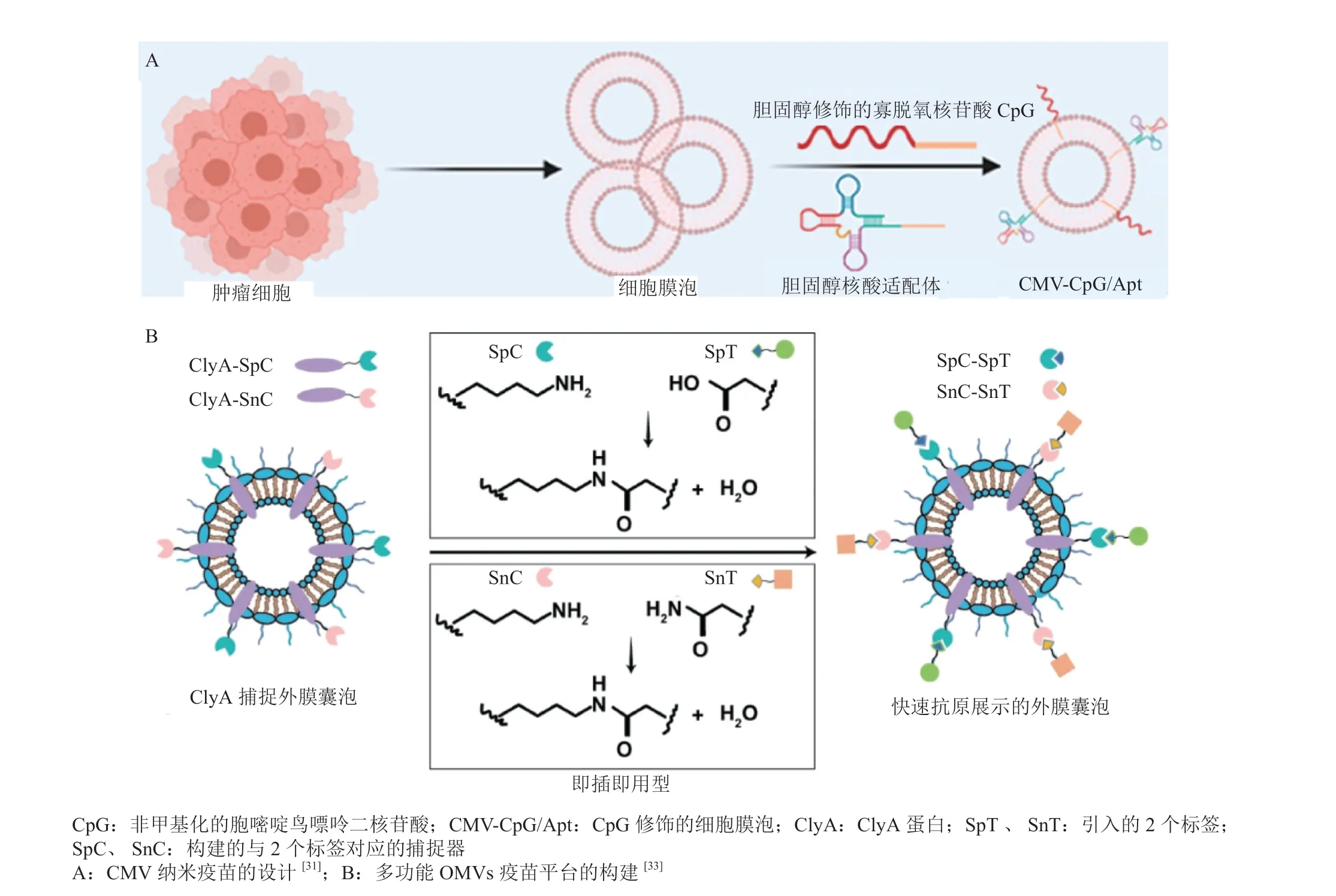
图3 基于肿瘤细胞膜和细菌外膜的细胞膜包裹纳米药物疫苗Figure 3 Cell membrane-coated anticancer nanovaccine prepared from cancer cell- and bacteria-derived membrane vesicles
2.3 活化T淋巴细胞
激活的APCs通过活化效应细胞CTLs参与抗肿瘤免疫循环。虽然正常免疫过程中APCs可通过多种共刺激分子强效活化CTLs,但肿瘤患者体内APCs可能因肿瘤进展或者治疗导致的系统性免疫抑制,而难以被肿瘤疫苗完全激活。因此,研究者探索了用纳米颗粒直接刺激TAAs特异性CTLs活化的策略,而如何强效活化特异性CTLs是其中的关键。在自然免疫过程中,APCs通过表达共刺激因子和分泌细胞因子等方式,刺激能识别其展示主要组织相容性复合体Ⅰ(major histocompatibility complex I,MHC-I)抗原复合物的特异性CTLs。由于肿瘤细胞表面天然展示供CTLs识别的MHC-I抗原复合物,Jiang等[36]通过基因工程技术,构建了表达共刺激因子抗原分化簇80(cluster of differentiation 80,CD80)的工程化肿瘤细胞,并用其细胞膜包裹聚乳酸乙醇酸[poly(lactic-co-glycolic acid),PLGA]核制备了人工的抗原递呈纳米粒(antigen-presenting nanoparticles,AP-NPs)。AP-NPs具有良好的生物相容性,能不依赖于APCs直接活化特异性T细胞,控制肿瘤的生长(见图4)。相比于未表达CD80的膜包裹纳米颗粒,AP-NPs显著提高了OT-I CD8+T细胞上CD69、CD25等分子的表达,使T细胞在4 d内增殖了近9倍,而其他所有组的细胞计数都低于实验初始值。在B16OVA小鼠模型中,AP-NPs与对照组相比明显抑制了肿瘤的生长,延长了小鼠的生存期。
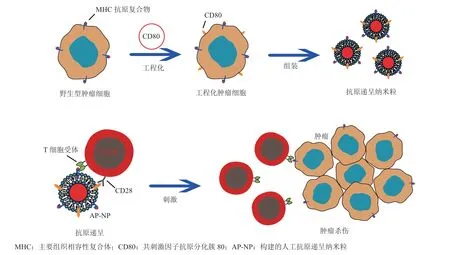
图4 人工抗原递呈纳米粒的制备及其抗肿瘤免疫的作用机制[36]Figure 4 Preparation of AP-NP and its mechanism of action in cancer immunotherapy
APCs上表达的共刺激因子除CD80外,还包括CD40等其他分子。单纯过表达一种刺激分子可能难以达到理想的T细胞活化效果,而体外活化的APCs则会协同上调多种共刺激因子。受此启发,Liu等[37]通过细胞融合技术,将DCs和4T1细胞融合,促进MHC-I抗原复合物和免疫共刺激分子在细胞膜上的表达。利用有机金属框架纳米粒作为纳米内核获得CMNs融合细胞膜包裹纳米颗粒(nanoparticle-supported fused cytomembrane,NP@FM)可发挥类似于APCs的功能活化CTLs,在体外显著刺激脾脏来源CD8+T细胞的活化。与单独的DCs膜和4T1膜相比,融合的细胞膜孵育CD3+T细胞后,CD8+CTLs的比例明显上升,并在4T1小鼠模型中诱导强烈的抗肿瘤免疫应答。虽然这一策略增加了共刺激因子的种类,但APCs在活化T细胞时还会分泌IL-12等细胞因子。因此,如何进一步整合多种共刺激信号,增加纳米疫苗的CTLs活化能力是未来激活抗肿瘤免疫的重要研究方向。
2.4 增加效应细胞与肿瘤细胞的识别
活化的CTLs在进入肿瘤后需要识别肿瘤细胞方能发挥清除肿瘤作用。然而,肿瘤细胞会通过下调MHC-I分子表达等机制降低抗原展示,逃避CTLs的选择性杀伤。因此,恢复与增强肿瘤细胞的免疫暴露日益受到关注。肿瘤内Ⅰ型干扰素(interferons,IFNs)不足是导致肿瘤细胞MHC-I表达不足的重要原因。为了特异性提高肿瘤细胞中IFNs和MHC-I的表达,Zhai等[38]首先采用基因工程手段构建了一个过表达程序性死亡蛋白1(programmed cell death protein 1,PD1)的CTL细胞系PD1-CTLL-2,并用其细胞膜包裹载有ORY-1001的蛋白纳米粒,获得了一种表观遗传纳米诱导剂OPEN。其中,ORY-1001为组蛋白赖氨酸特异性去甲基化酶1(lysine-specific demethylase 1,LSD1)抑制剂,可诱导IFNs表达。OPEN能通过表面的PD1识别肿瘤细胞上上调的程序性死亡配体1(programmed cell death ligand 1,PD-L1) 分子,从而特异性进入肿瘤细胞内,释放包载的ORY-1001,上调肿瘤细胞IFN的分泌以及下游MHC-I分子的表达(见图5)。体内研究显示,OPEN显著提高了瘤内ORY-1001暴露量,将瘤内IFN-β水平提高了23倍,将肿瘤细胞MHC-I表达和抗原展示提升近2倍,显著增加了瘤内肿瘤特异性CTLs的数量、增殖和活性。由于OPEN上的PD1还能抑制肿瘤细胞上PD-L1的反馈性上调,因此在荷三阴性乳腺癌、黑色素瘤或结直肠癌的肿瘤模型小鼠上,单独使用OPEN即可显著抑制肿瘤生长并延长动物生存期。在治疗过程中,OPEN不会引起动物显著的血液指标和脏器病理变化,初步证明了纳米囊泡的生物安全性。肿瘤细胞还会通过增加MHC-I和TAAs的胞内降解,甚至清除MHC-I相关基因逃避CTLs的识别,如何来克服上述机制导致的肿瘤细胞免疫逃逸还需进一步研究。

图5 OPEN的制备及其在肿瘤免疫治疗中的作用机制[38]Figure 5 Preparation of OPEN and its mechanism of action in cancer immunotherapy
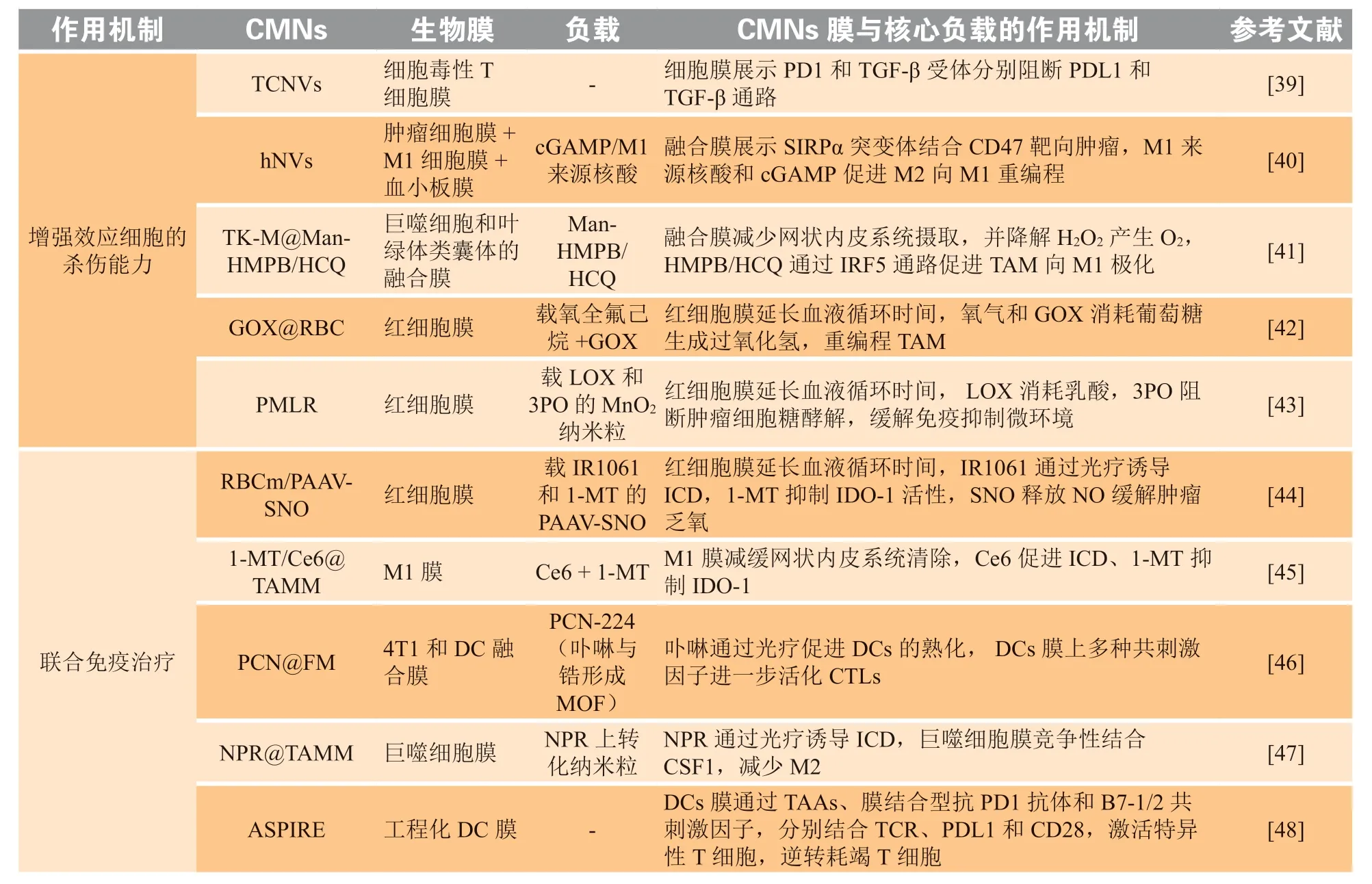
2.5 增强效应细胞的杀伤能力
CTLs识别肿瘤细胞后,其细胞裂解活性仍受到多种免疫检查点分子和肿瘤微环境的调控。例如,ICB疗法即通过阻断PD-L1/PD1介导的免疫抑制提高抗肿瘤免疫效果。然而,肿瘤微环境中还存在其他抑制CTLs活性的因素,包括抑制性细胞因子、抑制性细胞以及乏氧和微酸环境等。相比于抗体阻断疗法,CMNs可作用于多个靶点和代谢环境,具有独特的优势。因此,设计合适的CMNs克服上述抑制性因素,增加CTLs的杀伤能力是研究的热点之一。例如,Hong等[39]针对实体瘤微环境内PD-L1和转化生长因子β(transforming growth factor-β,TGF-β)抑制CTLs活性的问题,制备了一种T细胞衍生的纳米囊泡,利用其表面的PD1和TGF-β受体分别阻断肿瘤细胞的PD-L1和微环境中的TGF-β,从而有效缓解了CTLs耗竭。
肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)是肿瘤微环境中的重要组成细胞,不仅能直接杀伤肿瘤细胞还参与CTLs的活性调控。TAMs的活性受肿瘤细胞表面CD47和微环境中因子的调节,通常认为可将其分为抑肿瘤的经典活化型(M1)和促肿瘤的替代活化型(M2)两类。为了从多个水平调控TAMs。Rao等[40]利用展示高CD47亲和力信号调节蛋白α(signal regulatory protein alpha,SIRPα)突变体的肿瘤细胞膜、M1细胞膜和血小板膜,构建了混合细胞膜纳米囊泡(hybrid cell membrane nanovesicles,hNVs)。由于血小板膜和SIRPα突变体的对肿瘤微环境和CD47的高亲和力,hNVs可在肿瘤部位高度蓄积,并拮抗性屏蔽肿瘤细胞上的CD47,进一步通过递送TAMs重编程信号和干扰素基因刺激因子(stimulator of interferon genes,STING)激动剂,促使其向M1极化。在三阴性乳腺癌小鼠模型中,相比于单独的M1膜包裹的纳米颗粒或CD47单克隆抗体处理的对照组,hNVs显著提高了CD80+CD206lowM1的比例,有效激活了CTLs的活性,证明CD47阻断和M2-to-M1的复极化有效地加强了抗肿瘤免疫(见图6)。药效实验表明,hNVs抑制了B16F10小鼠模型肿瘤的复发和转移。在装载STING激动剂环鸟苷酸-腺苷酸(cyclic guanosine monophosphate-adenosine monophosphate,cGAMP)后,hNVs@cGAMP还有效抑制了4T1小鼠模型肿瘤的生长。
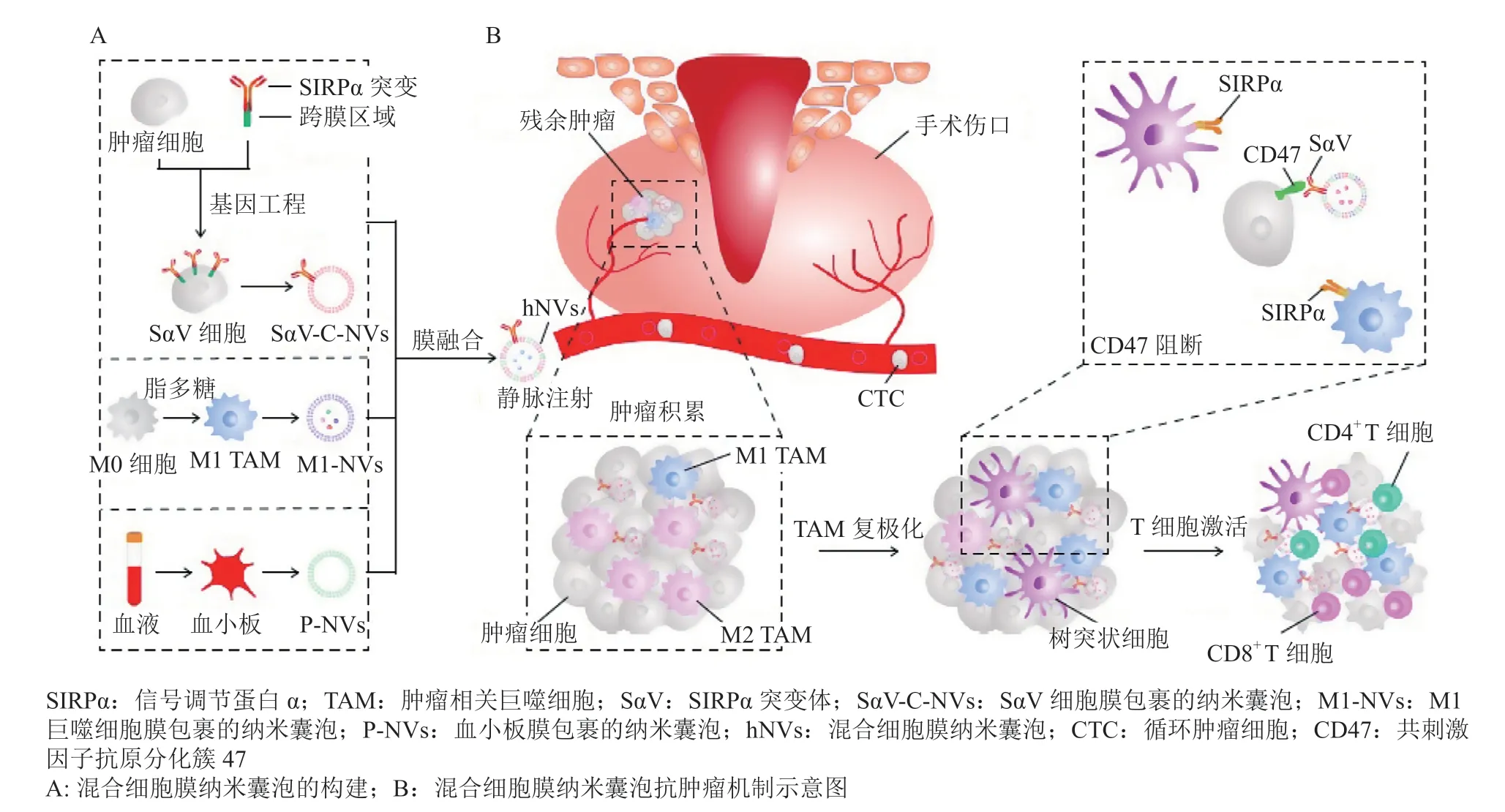
图6 混合细胞膜纳米囊泡的制备与抗肿瘤免疫的作用机制[40]Figure 6 Preparation and mechanism of action of hNVs in cancer immunotherapy
除了TAMs,肿瘤乏氧微环境也会抑制CTLs的活性。为此,Hou等[41]首先构建了一种甘露糖修饰和羟基氯喹(hydroxychloroquine,HCQ)吸附的中空介孔普鲁士蓝(hollow mesoporous prussian blue,HMPB)纳米体系Man-HMPB/HCQ,随后用来自巨噬细胞和叶绿体类囊体(thylakoid,TK)的混合膜修饰在Man-HMPB/HCQ表面,以减少体内网状内皮系统摄取,增强肿瘤积聚,缓解肿瘤的乏氧微环境。该CMN可以通过甘露糖受体介导的内吞作用促进细胞内化,并通过HMPB降解释放铁离子和HCQ,通过干扰素调节因子5(interferon-regulatory factor 5,IRF5)通路,从而诱导TAMs更多地极化为M1型。在肿瘤微环境模拟条件下,TK-M@Man-HMPB/HCQ能快速产生O2,且效率与单独的TK膜或混合膜包载的纳米颗粒相似。在体外,TK-M@Man-HMPB/HCQ可以使RAW264.7细胞向M1极化,使其CD86的表达量提高近17倍。在4T1小鼠模型中,TK-M@Man-HMPB/HCQ被证实可提高M1比例,有效抑制肿瘤的生长。不同于Hou等[41]缓解肿瘤微环境乏氧的策略,Zou等[42]利用RBC细胞膜包裹载氧的全氟己烷和葡萄糖氧化酶(glucose oxidase,GOX),在直接将氧气递送到肿瘤微环境的同时,利用GOX消耗葡萄糖生成过氧化氢,诱导多种细胞因子和趋化因子,重编程TAMs,有效解除了CTLs的抑制。
肿瘤细胞的无氧酵解代谢会使肿瘤的微环境处于一种“弱酸”的状态,这种酸性微环境不仅有利于肿瘤细胞的存活,还会抑制处于其中的CTLs的活性。因此,逆转肿瘤酸性微环境成为增强肿瘤免疫治疗效果的一种潜在策略。基于此,Gao等[43]用RBC膜包裹载有乳酸氧化酶(lactate oxidase,LOX)和糖酵解抑制剂(3PO)的中空二氧化锰(Hollow MnO2,HMnO2)催化纳米系统(PMLR),获得的PMLR用于细胞内/外乳酸耗竭以及协同代谢治疗和肿瘤免疫治疗。PMLR在胞外通过LOX催化氧化反应消耗肿瘤微环境中的乳酸,在进入胞内后则释放3PO,阻断肿瘤细胞糖酵解,切断乳酸的来源,从而改变肿瘤微酸环境,提高瘤内CTLs的活性,改善肿瘤免疫治疗效果。实验结果表明,通过消耗乳酸,该CMNs提升了M1/M2比和肿瘤内CD8+T细胞密度,从而有效抑制了B16F10肿瘤生长。
2.6 联合免疫治疗
为了进一步增强肿瘤免疫治疗的疗效,研究者构建了多功能CMNs同时增强抗肿瘤免疫的多个环节,以达到联合治疗的目的。上文提到,诱导肿瘤细胞ICD不仅能降低肿瘤负荷,同时还能启动抗肿瘤免疫应答。因此,将ICD诱导剂整合到CMNs中是基于CMNs的联合免疫治疗的常用策略。由于ICD诱导剂在瘤内发挥作用,因此许多研究探索了协同诱导ICD和克服肿瘤免疫抑制微环境的策略。Yang等[44]用RBC膜包裹热敏型一氧化氮(nitric oxide,NO)供体-亚硝基硫醇(S-nitrosothiols,SNO)-悬垂共聚物纳米粒[poly(acrylamide-coacrylonitrile-co-vinylimidazole)-SNO copolymer,PAAV-SNO],用于NIRⅡ光敏剂IR1061和吲哚胺2,3-双加 氧酶1(indoleamine 2,3-dioxygenase 1,IDO-1)抑制剂1-甲基-色氨酸(1-methyl-tryptophan,1-MT)的共递送。制备的纳米颗粒(RBCm/PAAVSNO/IR1061+1-MT)在到达肿瘤后,经局部激光照射可触发光热治疗,诱导肿瘤细胞ICD,使高迁移率族蛋白(high-mobility group box 1,HMGB1)释放增加了17.4%。而后RBCm/PAAV-SNO/IR1061+1-MT进一步释放1-MT并在原位生成NO,分别抑制肿瘤微环境中IDO-1活性和缓解肿瘤乏氧,使瘤内CD8+T细胞的比例增加了2.3倍,而调节性T细胞(regulatory T cells,Tregs)的比例下降,对原发乳腺癌及其肺转移灶均有良好的治疗效果。同样,Hu等[45]利用基于M1巨噬细胞膜的CMNs递送光敏剂Ce6和IDO抑制剂1-MT,通过协同诱导ICD和克服免疫抑制微环境改善了肿瘤免疫治疗效果。
在上述研究中,细胞膜修饰主要用于促进CMNs在瘤内的蓄积。有研究者进一步运用功能化细胞膜,来实现特定的免疫调控功能。例如,Liu等[46]在NP@FM的纳米核心中引入了光敏剂获得了具有光动力治疗效果的新CMNs。研究者用4T1和DC的融合膜包裹含有光敏剂(Zr6簇)的金属有机框架纳米粒PCN-224获得了PCN@FM。该CMNs可在光照条件下产生ROS,使DCs的熟化率从对照组的30%增加到61%。此外,该CMNs还能利用DCs膜的T细胞刺激能力,提升瘤内CD3+和CD8+T细胞密度,进一步活化CTLs并增强免疫应答,抑制纳米光敏剂诱导的光动力治疗后原发肿瘤的反弹。Chen等[47]报道了一种用原发肿瘤内TAMs细胞膜修饰上转化纳米粒得到的CMN(NPR@TAMM)。NPR@TAMM内的上转化纳米粒在局部光照后可启动光动力治疗,诱导肿瘤细胞ICD,启动后续的抗肿瘤免疫应答,同时由于瘤内的TAMs在其细胞膜上高表达克隆刺激因子1(colony stimulating factor 1,CSF1)受体,NPR@TAMM可竞争性结合由肿瘤细胞分泌的CSF1,使得TAMs分化为M2型的比例减少,最终瘤内CD8+T细胞的比例从(7.5±3.1)%提高到(22.6±8.5)%,而CD4+T细胞从(8.8±2.3)%提高到(29.8±8.2)%,显著抑制了荷4T1瘤小鼠肿瘤的生长(见图7)。
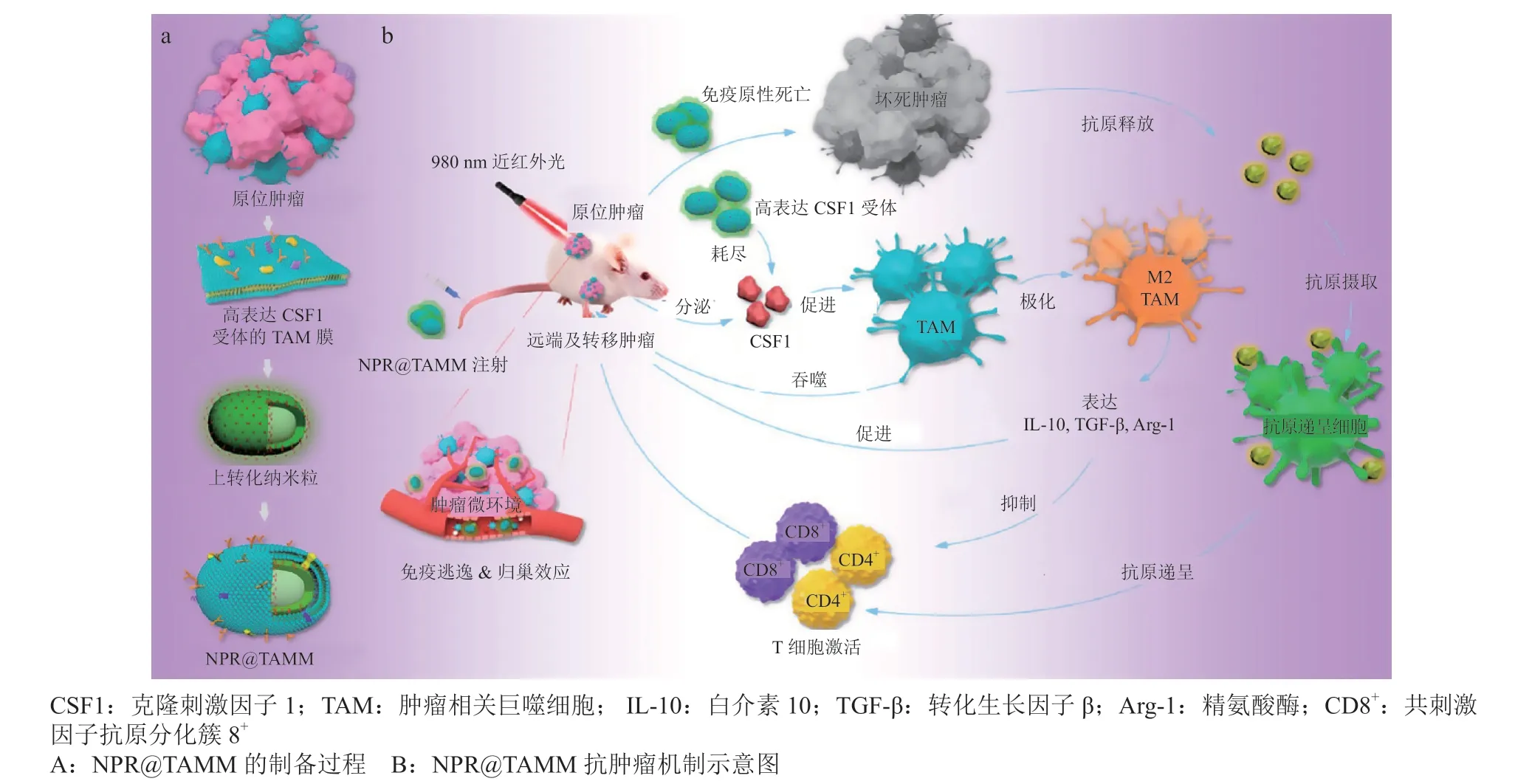
图7 NPR@TAMM的制备及其在肿瘤免疫治疗中的作用机制[47]Figure 7 Preparation and mechanism of action of NPR@TAMM in cancer immunotherapy
利用ICD诱导剂的疗法通常适用于术前或手术难以切除的肿瘤。在切除肿瘤后,活化TAAs特异性CTLs,恢复耗竭CTLs的活性是关键。为此,Liu等[48]采用基因工程技术,使DC2.4细胞过表达TAAs和膜结合型抗PD1抗体,并进一步诱导其成熟从而上调B7-1/2共刺激因子,获得了一种整合了抗原自我呈递和免疫抑制逆转的纳米疫苗(antigen self-presentation and immunosuppression reversal,ASPIRE),用于个性化的肿瘤免疫治疗。ASPIRE因其纳米级的尺寸、良好的稳定性和表面黏附分子介导的归巢效应,在皮下注射后能迅速富集到肿瘤引流淋巴结中,可直接将TAAs呈递给特异性CTLs,从而活化上述细胞。此外,ASPIRE还通过CD28/B7共刺激信号,进一步增强了αPD1的免疫检查点阻断效果,从而活化耗竭的CTLs,产生更持久的抗肿瘤免疫反应(见图8)。在荷B16F10小鼠模型中,给予ASPIRE后,肿瘤浸润抗原特异性CD8+T细胞中PD-1+CD38hi细胞的频率显著升高,且80%左右的浸润CD8+T细胞为活性T细胞,从而显著抑制了肿瘤生长和肺转移。
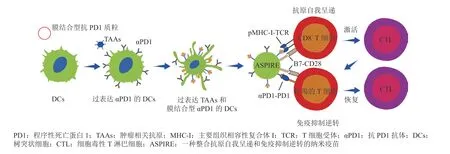
图8 ASPIRE的制备及其在肿瘤免疫治疗中的作用机制[48]Figure 8 Preparation of ASPIRE and its mechanism of action in cancer immunotherapy
3 结语与展望
肿瘤免疫治疗通过激活、恢复和增强患者的抗肿瘤免疫发挥长效抗肿瘤效果,是肿瘤治疗领域的革命性进展。然而,由于不同患者间和肿瘤内广泛存在的免疫异质性,以及现有疗法仅作用于抗肿瘤免疫循环中的一个或部分环节,导致目前肿瘤免疫治疗药物响应率低,在大部分肿瘤中效果也不甚理想。基于细胞膜修饰技术的CMNs在肿瘤免疫治疗研究中已展现出巨大的潜力,可通过不同的工程化设计提高抗肿瘤免疫的多个环节的效率(见表1)。更重要的是,丰富的细胞膜来源、细胞膜融合技术、基因工程技术和模块化制备技术等极大地拓展了CMNs的多样性,有望实现个体化肿瘤免疫治疗。同时,CMNs的临床转化也存在一些挑战。首先,目前报道的CMNs主要用于促进肿瘤细胞ICD和APCs熟化,以及提高CTLs的活性等环节,调控其他抗肿瘤免疫环节的研究仍然不多。其次,尽管最近在多个环节联合治疗中取得了一定的进展,但如何选择最佳干预组合,实现协同治疗效应仍需进一步阐明。此外,CMNs与CAR-T等细胞疗法联用的潜力尚未被探索。鉴于CAR-T技术在血液肿瘤治疗中的巨大成功,采用CMNs解决其在实体瘤治疗中所面临的挑战,有望突破实体瘤免疫治疗的瓶颈。最后,CMNs的大规模生产技术和设备尚不成熟。除了红细胞、肿瘤细胞和细菌等,其他种类细胞的规模化获取、培养以及质量控制不易。在细胞膜提取过程中,如何分离特定的生物膜并在保留功能性膜蛋白的同时,有效去除细胞内容物等,从而最大程度保留所需生物功能并减少潜在炎症反应是临床转化亟待解决的关键问题。此外,如何在工业水平上实现高效和完全的细胞膜包裹,以及相关设备的开发和质量控制技术的建立,也是CMNs规模化生产需解决的难题之一。如何设计简洁有效的CMNs,如何实现多功能CMNs的质量控制和批间质量一致性仍存在巨大的挑战。尽管CMNs的临床转化还具有上述诸多困难,但不可否认CMNs在肿瘤免疫治疗中有着巨大的优势和潜力。
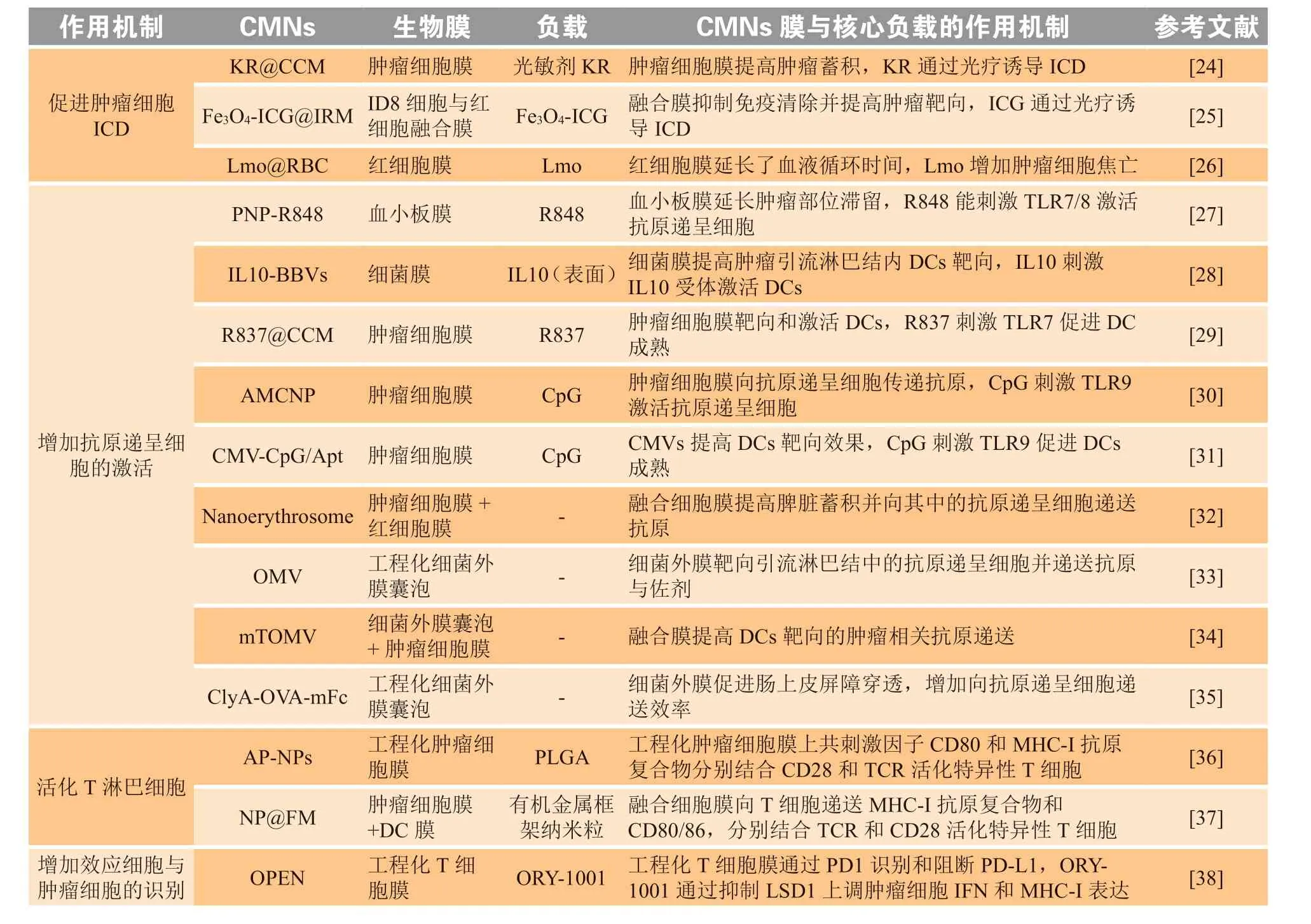
表1 细胞膜包裹纳米药物用于肿瘤免疫治疗的策略Table 1 Strategies of cancer immunotherapy with CMNs
续表1
