靶向分化群47-信号调节蛋白α的抗肿瘤药物递送系统研究进展
2022-10-14王宇辰黄俊甫王沛妍吴锦慧
王宇辰,黄俊甫,王沛妍,吴锦慧,
(1. 南京大学医学院,江苏 南京 210093;2. 南京大学化学和生物医药创新研究院,江苏 南京 210093)
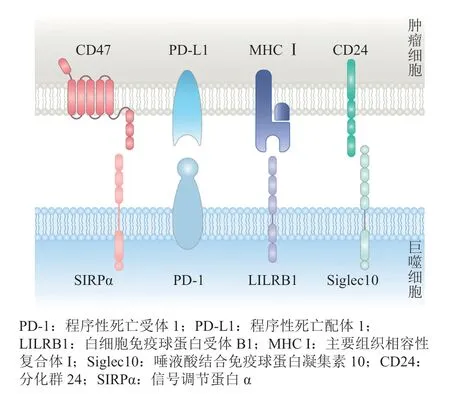
图1 肿瘤细胞表达不同的信号蛋白向巨噬细胞传递“不要吃我”信号Figure 1 Tumor cells express different proteins to transmit “Don’t eat me”signal to macrophages
巨噬细胞作为肿瘤微环境(tumor microenvironment,TME)中含量最丰富的免疫细胞,其吞噬功能在TME内通常是失调的[5]。多数肿瘤利用“不要吃我”信号而上调表达CD47,与SIPPα相互作用以避免被巨噬细胞吞噬,促进免疫逃逸的发生,并导致肿瘤进展[4,6]。所以,阻断巨噬细胞传递“不要吃我”信号,如直接应用抗体或小分子抑制剂来抑制CD47的表达与功能,对肿瘤的治疗具有积极作用[7-8]。
由于CD47在多种正常细胞上的广泛表达,其潜在的副作用受到了研究人员的广泛关注。因此为了提高肿瘤靶向性而降低副作用的发生,采用不同载体材料构建的药物递送系统受到了研究人员的广泛关注,如已经广泛应用于临床的脂质、白蛋白等载体材料包载CD47抑制剂会显著降低潜在的副作用,对CD47抑制剂的开发具有重要意义。基于此,本文将从CD47-SIRPα的生物学背景以及药物递送系统(包括凝胶、纳米递送系统、抗体偶联药物等)两个方面对近年该领域的研究进展进行综述,以期为临床药物开发提供借鉴。
1 CD47-SIRPα的概述
1.1 CD47和SIRPα的结构
CD47是由323个氨基酸残基组成的多跨膜糖蛋白,其结构包括高度糖基化的免疫球蛋白样胞外区、5个跨膜螺旋组成的跨膜区和胞质区[9]。CD47广泛表达在红细胞、血小板等正常细胞表面,通过与SIRPα相互作用以防止被巨噬细胞吞噬;然而,几乎所有的肿瘤细胞均会上调表达CD47而抑制巨噬细胞的吞噬功能,并促进免疫逃逸的发生[10]。另外,CD47可以激活磷脂酰肌醇-3-激酶(phosphoinositide-3 kinase,PI3K)/蛋 白 激 酶B(protein kinase B,PKB)等信号通路促进肿瘤细胞的迁移和侵袭,同时避免细胞凋亡[11-12]。
SIRPα由504个氨基酸残基组成,包括单跨膜螺旋、胞质区和3个免疫球蛋白样结构域组成的胞外区(包括1个V区和2个C1区),其中V区是CD47的主要结合位点[13],因此将其与Fc片段融合形成的SIRPα融合蛋白可以抑制CD47的功能。此外,SIRPα胞质区还含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)以介导“不要吃我”信号的传递。SIRPα集中分布在髓细胞中,包括单核细胞、巨噬细胞等[14]。
1.2 CD47-SIRPα的信号转导
巨噬细胞的吞噬作用与细胞骨架的改变是密切相关的。肿瘤细胞CD47与巨噬细胞SIRPα相互作用后,会引起SIRPα胞质区的ITIM的酪氨酸发生磷酸化,随后招募蛋白酪氨酸磷酸酶-1/2(SH2-containing protein tyrosine phosphatase-1/2,SHP-1/2)。SHP-1/2利用其Src同源区2(Src-homology domain 2,SH2)结合SIRPα的磷酸化位点,并阻滞磷酸化信号向下游传递,使得肌球蛋白无法结合到微丝上。因此,这将导致巨噬细胞的细胞骨架会维持相对稳定,无法发挥吞噬功能(见图2)[6,15]。
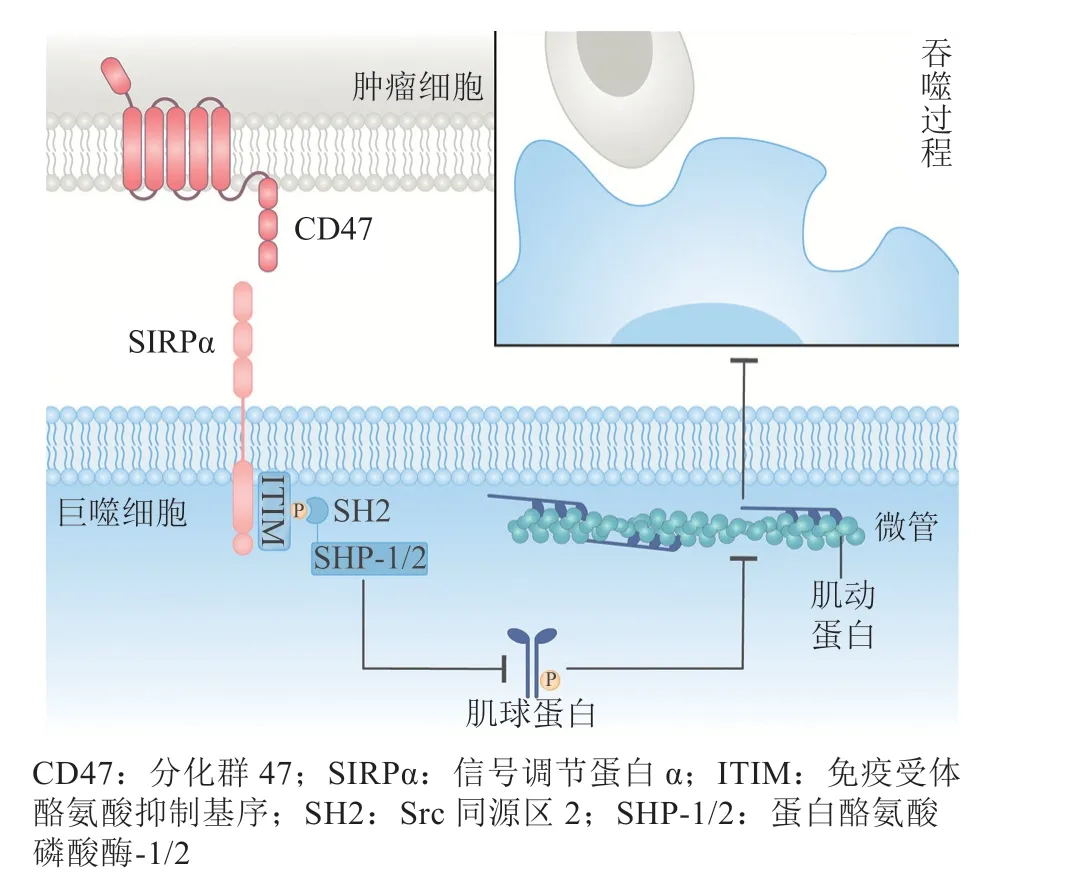
图2 CD47-SIRPα信号通路的概述图Figure 2 Schematic diagram of the CD47-SIRPα signaling pathway
2 CD47表达水平的调节
细胞CD47的表达水平受转录、翻译和翻译后修饰等多个过程的调控,包括转录因子和翻译后修饰酶的正向调控以及微小RNA(microRNA,miR)的负向调控等。
CD47的转录过程受到多种转录因子的调节。癌基因Myc促进多种肿瘤生长,通过直接与淋巴瘤等肿瘤细胞的CD47启动子结合,促进CD47的转录过程,进而实现免疫逃逸[16];乏氧诱导因子1(hypoxia-inducible factors 1,HIF-1)同样可以结合到CD47的启动子来促进乳腺癌细胞CD47的表达[17]。miR是一类可以结合到靶基因3'-非翻译区而实现对靶基因表达水平进行负向调控的非编码RNA。CD47的翻译过程也受到miR的负向调控,例如,miR-340可以直接下调CD47的mRNA和蛋白表达水平,不会直接影响肿瘤细胞的增殖和迁移,但可以促进巨噬细胞对肿瘤的吞噬而发挥抗肿瘤作用,miR-340还可以作为预测肿瘤患者预后的指标[18];除此之外,miR-200a、miR-128等均可以在不同的肿瘤模型中下调CD47的表达,并抑制肿瘤生长[19-23]。翻译后修饰过程同样影响CD47与SIRPα的相互作用,谷氨酰胺酰肽环转移酶(glutaminyl-peptide cyclotransferase-like protein,QPCTL)可以将目标蛋白N端的谷氨酸或谷氨酰胺催化为焦谷氨酸,因此,QPCTL可以在翻译后修饰过程中将CD47的关键氨基酸催化形成焦谷氨酸而促进其与SIRPα的结合[24]。综上所述,这些参与调节CD47表达的分子可以作为调控CD47-SIRPα的备选靶点。
为了圆梦,他与公司领导团队成员一起群策群力,集思广益,高起点、高标准设计远景,谋划未来,一门心思打造中国最优秀、最出色、最过硬的安保精英团队。
3 CD47-SIRPα抑制剂的临床研究进展
临床上已经开展了多项阻断CD47-SIRPα的研究用于肿瘤治疗,包括抑制CD47功能的抗CD47抗体、SIRPα融合蛋白和小分子抑制剂以及抑制SIRPα的抗SIRPα抗体等,表1总结了目前临床研究进展较快的几种处于临床试验的CD47-SIRPα抑制剂。
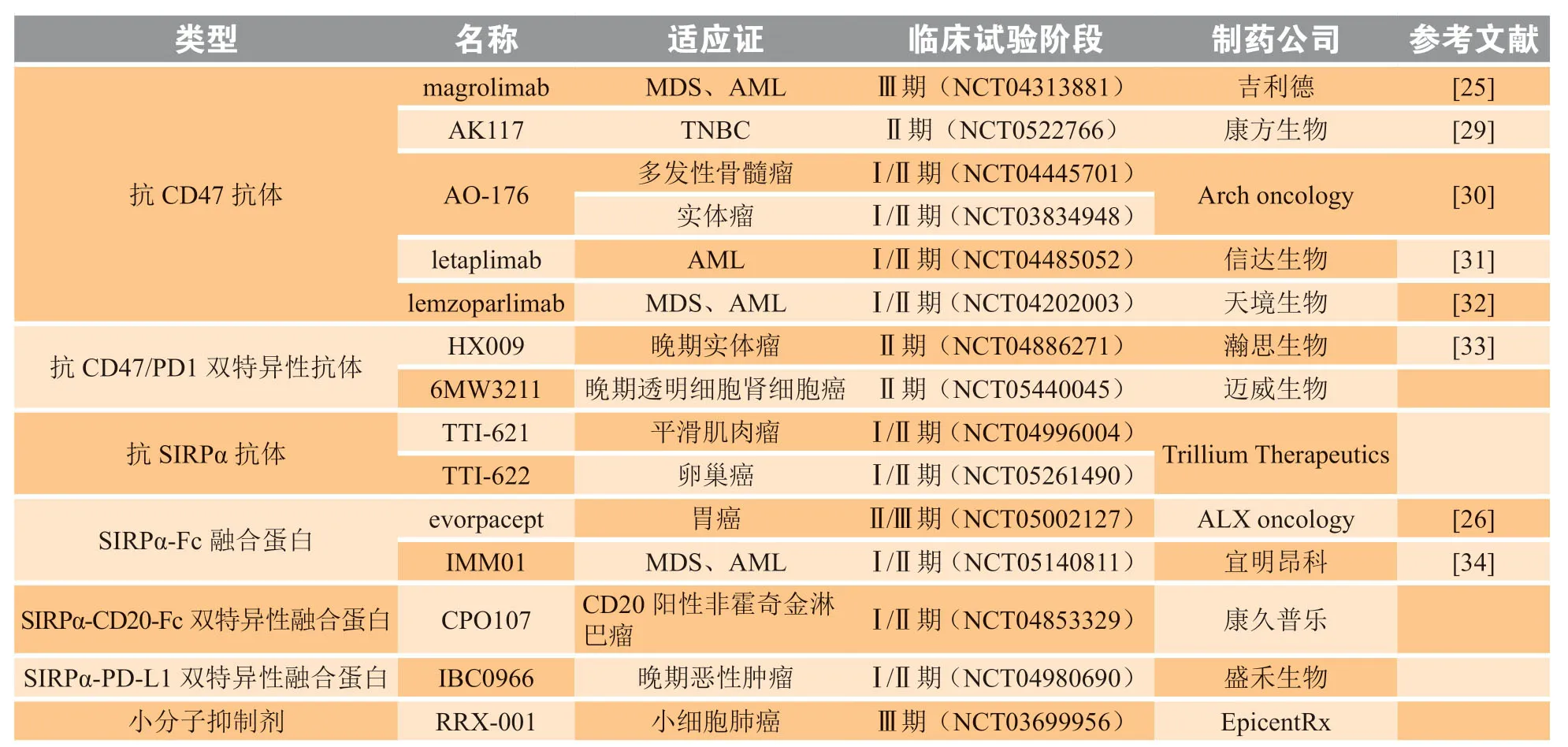
表1 调控CD47-SIRPα的药物的临床研究进展Table 1 Advances in clinical research on regulation of CD47-SIRPα axis
这些药物通过直接或者间接的方式阻断“不要吃我”信号,恢复巨噬细胞对肿瘤细胞的吞噬能力,进而激活机体的抗肿瘤免疫并产生积极的肿瘤治疗效果。目前抗CD47抗体(magrolimab)[25]和SIPRα融合蛋白(evorpacept)[26]分别有1款药物正在开展Ⅲ期临床试验。除此之外,作用于癌基因Myc的小分子药物RRx-001通过与铂类化合物联合治疗小细胞肺癌,也正在进行Ⅲ期临床试验[27-28]。
尽管CD47-SIRPα抑制剂已经在肿瘤患者体内表现出良好的治疗效果,然而这些抑制剂面临的最大问题是血液毒性的发生:由于CD47广泛表达在红细胞、血小板等多数正常细胞表面,抗CD47抗体进入机体后会优先与红细胞的CD47结合,引起巨噬细胞对红细胞的吞噬,进而造成贫血等严重血液毒性,针对这一严重副作用有待进一步解决。
4 药物递送系统
为了避免贫血等药物副作用的发生,一方面,通过构建合适的药物递送系统将CD47抑制剂包载在载体材料中,避免其与红细胞的CD47相互作用,保证其在TME中蓄积并促进巨噬细胞对肿瘤细胞的吞噬而发挥抗肿瘤作用;另一方面,通过对抗CD47抗体进行筛选可以获得与肿瘤特异性结合的抗体,从而缓解贫血的发生[35],这使得将抗CD47抗体修饰在递送系统表面以提高其靶向性成为可能。
综上所述,目前靶向CD47-SIRPα的研究主要包括2部分:1)构建药物递送系统递送CD47抑制剂(见表2);2)利用抗CD47抗体增加抗肿瘤药物递送系统的靶向性。在此,本文总结了近年来基于CD47-SIRPα的抗肿瘤药物递送系统,包括抗体偶联药物(antibody-drug conjugate,ADC)、凝胶以及基于不同载体材料构建的纳米递送系统,常见的载体材料包括脂质、白蛋白、聚合物和无机材料等。这些递送系统可以有效克服传统游离药物的局限性,具有延长药物在体内的循环时间、增加药物在目标部位的蓄积、提高药物安全性和疗效、同时递送多种药物实现联合治疗等多种优势[36]。

表2 应用药物递送系统递送的CD47-SIRPα抑制剂总结Table 2 CD47-SIRPα inhibitors delivered by drug delivery systems
4.1 凝胶递送系统
肿瘤手术切除后残存的微小病灶以及伤口愈合过程中产生的免疫抑制微环境可能会导致肿瘤复发甚至转移,因此仍然需要配合使用化疗药物或免疫治疗药物来提高手术的成功率[37-38]。将CD47抑制剂,包括抗CD47抗体、沉默RNA和小分子抑制剂包载在凝胶基质中并喷涂在肿瘤组织周围,可以防止其渗入血液,其作用范围也局限在手术部位,同时抑制剂还可以阻断肿瘤细胞CD47的表达来增加巨噬细胞对肿瘤的吞噬,从而显著提高安全性和患者依从性[39]。Song等[40]设计了可以包载短发卡RNA(short hairpin RNA,shRNA)的聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]水凝胶,用于下调脑胶质瘤细胞CD47的表达。该水凝胶在前2天释放60%的药物,在1周内可释放78%,达到缓释效果。体内实验表明,脑胶质瘤术后联合替莫唑胺的中位生存期为59 d,而在此基础上再联合水凝胶可以将中位生存期显著延长至73 d。Huang等[41]则报道了一种名为DLG的可注射双层脂质凝胶用于递送抗CD47抗体和化疗药索拉非尼。外层装载了吸附索拉非尼的氧化石墨烯纳米粒,在近红外辐射下,石墨烯受热促进索拉非尼释放并激活巨噬细胞;内层具有较高的相变温度以保持更持久的凝胶状态,因此在手术部位可以缓慢释放抗CD47抗体。实验结果表明,DLG凝胶在4T1荷瘤小鼠手术切除模型中可以显著抑制肿瘤生长,并延长小鼠的生存时间。Li等[42]构建了一种由琥珀酰亚胺琥珀酸酯和碱性牛血清白蛋白溶液快速氨解交联形成的生物可降解水凝胶支架用于递送QPCTL抑制剂PQ912,该抑制剂可以诱导B16F10黑色素瘤细胞的CD47下调,并恢复巨噬细胞的吞噬功能,手术后敷用该凝胶可以有效控制黑色素瘤荷瘤小鼠的生长。综上所述,利用凝胶来局部递送CD47抑制剂,可以有效地激活肿瘤免疫微环境,并进一步延长术后小鼠的生存期,产生良好的抗肿瘤治疗效果。
4.2 纳米药物递送系统
纳米药物递送系统已经广泛地应用于临床治疗,已经在全球范围内批准了多种纳米粒、脂质体等剂型用于临床治疗。目前在这一领域研究的热点包括:1)应用白蛋白、聚合物、脂质等载体材料包载CD47抑制剂构建的纳米药物递送系统来阻断“不要吃我”信号的同时降低副作用;2)应用化学反应或基因编辑的方式,将抗CD47抗体或SIRPα蛋白修饰或表达在无机或细胞膜材料构建的递送系统表面,增加其靶向性的同时,还可以间接抑制CD47的功能以恢复巨噬细胞对肿瘤细胞的吞噬能力,发挥双重作用(见图3)。
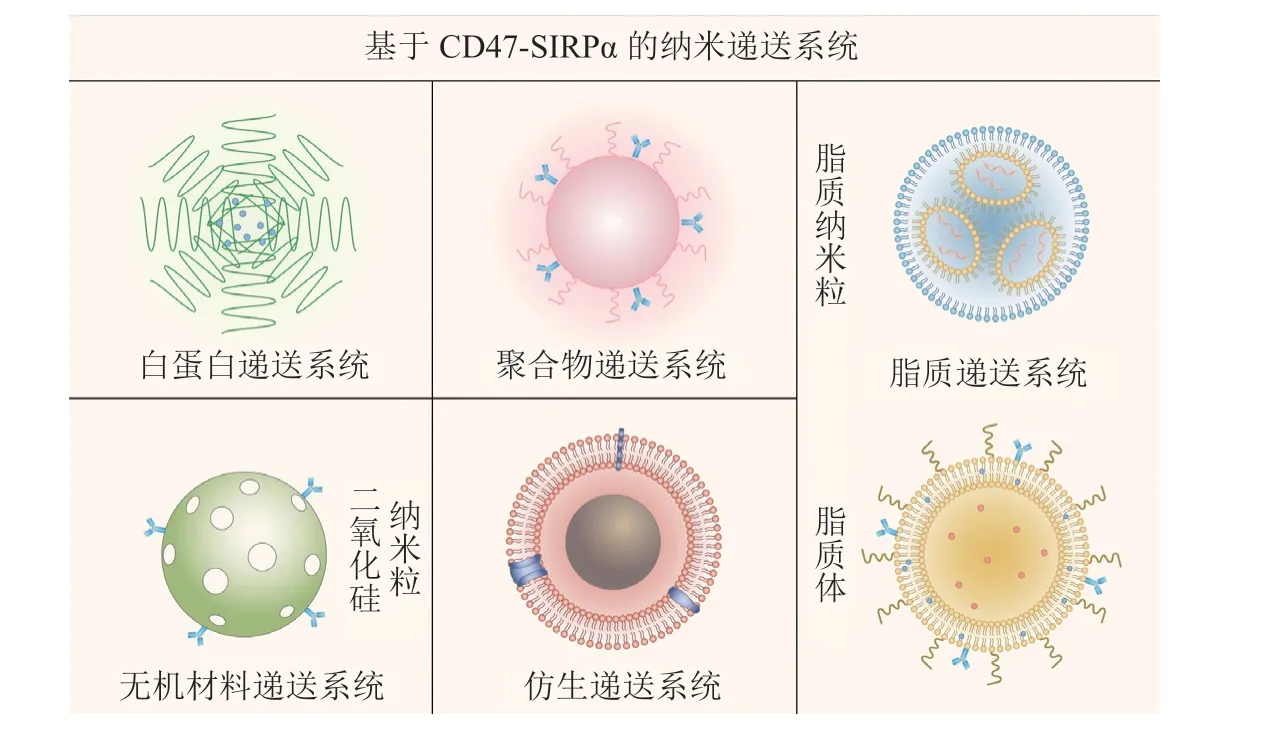
图3 靶向CD47-SIRPα的纳米药物递送系统Figure 3 Nanomedicine delivery system targeting on the CD47-SIRPα axis
4.2.1 基于聚合物的药物递送系统高分子聚合物已经被广泛应用于药物制剂领域,多种基于高分子聚合物的药物已经获批用于肿瘤等多种疾病的治疗[43]。对聚合物纳米粒而言,可以包载多种不同类型的药物分子,如小分子、蛋白质、抗体等。PLGA作为其中的代表,具有良好的生物相容性、生物可降解性和缓控释特性。
PLGA纳米递送系统利用增强渗透滞留效应(enhanced permeability and retention effect,EPR)可以实现肿瘤蓄积,在肿瘤部位的酸性条件下降解并释放CD47抑制剂,阻断CD47与SIRPα的相互作用而发挥抗肿瘤作用。Liu等[44]以聚乙二醇(polyethylene glycol,PEG)修饰的PLGA(PLGAPEG)为载体包载了光神霉素A,增加药物在肿瘤部位的蓄积并达到延长释放的效果。光神霉素A通过抑制基因Myc,降低了BxPC-3胰腺癌细胞CD47的表达。然而,基于EPR效应的纳米粒肿瘤靶向效率较低[45]。肿瘤的快速增殖需要摄取大量营养物质,如葡萄糖[46]、谷氨酰胺[47]等。因此对营养物质进行化学修饰而构建的纳米载体材料,可以更有效地被肿瘤细胞摄取,进而增加肿瘤靶向。Wu等[48]开发了名为GPI的谷氨酰胺类似物用于CD47小干扰RNA(small interfering RNA,siRNA)的递送。与未经谷氨酰胺修饰的载体相比,GPI纳米粒通过谷氨酰胺转运蛋白2(alanine-serine-cysteine transporter 2,ASCT2)被不同肺癌细胞的摄取率均有提高,进而在细胞中释放siRNA来下调CD47的表达,最终抑制肿瘤细胞的生长。Cheng等[49]则在葡萄糖上修饰了三嵌段共聚物构建了名为GPPT的葡萄糖衍生载体,并包载了多靶点抑制剂CUDC101(抑制CD47)和光敏剂IR780用于重塑肿瘤免疫微环境。相比于未经葡萄糖修饰的递送系统,12 h后肿瘤部位蓄积了更高水平的GPPT,同时肝癌Hep1-6细胞表面CD47的表达受到显著抑制,恢复了巨噬细胞对肿瘤的吞噬能力。综上所述,利用肿瘤代谢偏向性而实现的靶向是提高药物在肿瘤部位蓄积的有效手段。
4.2.2 基于白蛋白的药物递送系统与葡萄糖等营养物质类似,肿瘤细胞对白蛋白的摄取与代谢也具有偏好性,通过血管内皮细胞表面的糖蛋白60(glycoprotein 60,GP60)等受体摄取白蛋白并将其降解为氨基酸来促进其自身的增殖[50-51]。因此,利用白蛋白进行药物递送亦可以实现肿瘤靶向,目前已经有多种基于白蛋白构建的药物递送系统应用于临床。此外,白蛋白载体还可以保护抗体避免发生交联。
为了进一步提高白蛋白药物递送系统的安全性,通过化学反应交联而构建的肿瘤环境响应型的递送系统已经开展了多项研究[52],如pH响应、温度响应、活性氧(reactive oxygen species,ROS)响应以及肿瘤相关酶响应等药物递送系统,这些方法可以有效防止抗CD47抗体在血液中的泄露而造成潜在的血液毒性。Chen等[53]制备了包载抗CD47抗体和抗PD-1抗体的ROS响应型的双层白蛋白纳米粒(aPD1@aCD47),外层的抗CD47抗体通过阻断CD47-SIRPα以激活机体的固有免疫,内层的抗PD-1抗体增强T细胞的肿瘤杀伤功能,该纳米粒在黑色素瘤荷瘤小鼠模型中展示出良好的抗肿瘤生长和转移的能力,此外,治疗后第1天和第7天进行全血检测和血清生化分析结果表明,aPD1@aCD47在观察期间引起的副作用较低。Lu等[54]则构建了基于ROS和基质金属蛋白酶(matrix metalloproteinase,MMP)双重响应的白蛋白纳米粒用于递送抗CD47抗体和光敏剂IR820来增加巨噬细胞对肿瘤的杀伤能力,在乳腺癌4T1荷瘤小鼠模型中展示出良好的抗肿瘤能力,该纳米粒在治疗期间也表现出较低的毒性。综上所述,以白蛋白为载体构建的环境响应型递送系统可以实现药物的靶向递送,同时进一步提高药物的安全性。
4.2.3 基于脂质的药物递送系统基于脂质的药物递送系统是目前纳米药物选择的常见载体,具有生物相容性好、配方简单、自组装等诸多优势,因此是目前美国FDA批准的最常见的纳米药物剂型,主要包括脂质纳米粒(lipid nanoparticle,LNP)和脂质体。1)LNP是目前核酸药物递送系统中最常用的载体,多种新冠肺炎mRNA疫苗和siRNA药物均采用了这一递送系统[55-56]。Abdel-Bar等[57]设计了稳定的核酸-脂质颗粒系统用于联合递送CD47 siRNA和阿霉素,CD47 siRNA可以将CT26结肠癌细胞表达的CD47敲低约70%,阿霉素能够诱导肿瘤细胞表面钙网蛋白的外翻(一种“吃我”信号),通过阻断“不要吃我”信号并增强“吃我”信号而促进巨噬细胞对肿瘤的吞噬。Lian等[58]报道了由二油酰磷脂酰乙醇胺和胆固醇组成的LNP用于递送PD-L1 siRNA和CD47 siRNA,在4T1乳腺癌荷瘤小鼠模型中,纳米粒注射后12 h富集在肿瘤组织中,显著抑制肿瘤生长并有效防止肿瘤转移的发生。2)脂质体是具有双层膜结构的磷脂囊泡[59],有良好的生物相容性和生物降解性。对于药物递送而言,脂质体可以包裹亲水或疏水等多种不同类型的药物[60]。Ramesh等[61]构建了一种特殊的脂质体,将集落刺激因子1受体(colony stimulating factor 1 receptor,CSF1R)抑制剂BLZ-945与胆固醇半琥珀酸酯反应形成两亲性药物官能团核心后,再与脂质分子通过薄膜水化法自组装成脂质体。该脂质体可以同时将SHP2抑制剂SHP099包载其中,一方面,BLZ-945可以抑制肿瘤对巨噬细胞的募集;另一方面,SHP099可以有效阻断“不要吃我”信号的传递,促进巨噬细胞对肿瘤的吞噬;此外,该团队利用该系统还同时递送了SHP099和Toll样受体7/8(tolllike receptor-7/8,TLR7/8)激动剂R848以促进巨噬细胞的活化并恢复其肿瘤吞噬能力,发挥良好的抗肿瘤效应[62]。
为了进一步提高脂质体的靶向性,还可以在脂质体表面修饰抗体以实现肿瘤靶向性。目前已经开发出了多种与肿瘤特异性结合的抗CD47抗体,因此贫血副作用产生的可能性较小;另外,这一靶向过程还可以直接掩蔽肿瘤细胞表面的CD47,并恢复巨噬细胞的吞噬作用。Ramesh等[63]构建了可以同时靶向肿瘤和巨噬细胞的名为LPN的脂质体,抗CD47抗体和抗SIRPα抗体化学交联在脂质体表面。LPN在抗体的作用下可以同时结合在巨噬细胞和肿瘤细胞,阻断了CD47-SIRPα信号的传递,也显著增强了巨噬细胞对黑色素瘤B16F10的吞噬作用。Chen等[64]报道了环境响应型脂质体PTX-ILIP,其表面修饰了MMP2裂解肽-抗CD47抗体,在MMP2的作用下,裂解肽断裂并释放抗CD47抗体,在TNBC荷瘤小鼠模型中,PTX-ILIP通过增强巨噬细胞的吞噬能力,显著促进肿瘤细胞凋亡并重塑TME。与对照组相比,促炎因子干扰素γ(interferon-γ,IFN-γ)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的水平均有所提高。综上所述,表面修饰抗CD47抗体的脂质体可以发挥“靶头”和“治疗”的双重作用。
4.2.4 基于无机材料的药物递送系统基于无机材料而构建的递送系统已经被广泛应用于药物递送和医学成像等领域[65]。然而溶解度低以及潜在的组织毒性使这些材料的临床应用受到了限制[55]。因此,为了进一步提高载体的靶向性,抗CD47抗体同样可以修饰在载体材料表面以促进递送系统的精确递送,同时也可以发挥抗肿瘤功能。
利用化学反应将抗CD47抗体修饰在无机纳米粒的表面是增加纳米粒靶向性的常见策略,如反应条件较为简单的叠氮-炔烃点击化学反应、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)/N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS)反应等。Zhang等[66]利用点击化学反应将抗CD47抗体和重组钙网蛋白共价连接在二氧化硅纳米粒表面。抗CD47抗体与肿瘤细胞的CD47相互作用以阻断“不要吃我”信号的传递;另外,抗体还可以介导纳米粒的靶向递送以增强钙网蛋白的暴露,进而促进巨噬细胞的吞噬作用。Zhang等[67]报道了一种纳米粒的协同递送系统:包载光敏剂和溴化硒(诱导肿瘤细胞凋亡)的介孔二氧化硅纳米粒和修饰了抗CD47抗体的二氧化硅纳米粒。前者通过光热疗法和化学疗法诱导肿瘤死亡可以启动适应性免疫;后者可以增强纳米粒在肿瘤中的靶向递送,同时阻断CD47-SIRPα以增强巨噬细胞的吞噬作用。综上所述,将抗CD47抗体利用EDC/NHS等化学反应修饰在纳米表面可以有效促进肿瘤靶向以及肿瘤治疗,同时又可以利用无机材料固有的属性增强抗肿瘤的效果。
4.2.5 仿生递送系统基于细胞膜和细胞外囊泡的内源性递送载体已经引起了研究人员的广泛关注。这种仿生递送系统可以保留膜表面分子,从而保留细胞的固有功能[68],因此可以避免递送系统被机体免疫系统识别,展现出更长的循环时间[69]。Rao等[70]使用基因编辑技术构建了名为gCM-MN的仿生纳米粒来调节巨噬细胞,将过表达SIRPα的肿瘤细胞膜分离并包裹磁性纳米粒,gCM-MN与巨噬细胞竞争性结合肿瘤CD47来阻断CD47-SIRPα信号,促进巨噬细胞对肿瘤的吞噬。相比于单独的磁性纳米粒,gCM-MN可以更有效地抑制肿瘤的生长和转移,同时显著延长小鼠生存期。细胞外囊泡(extracellular vesicle,EV)是由细胞分泌的脂质囊泡。与细胞膜类似,EV的膜表面分子同样有助于保留固有功能并降低潜在的免疫原性[71]。利用化学反应将CD47抑制剂修饰在EV的表面可以恢复巨噬细胞的吞噬功能,进而促进肿瘤免疫治疗。Rao等[72]报道了膜挤出法制备的混合型纳米囊泡,结果表明,该递送平台可显著抑制黑色素瘤术后的复发和转移,产生积极的治疗效果。综上所述,这些基于细胞膜的仿生递送载体通过基因工程或化学修饰等手段过表达抗CD47抗体或SIRPα融合蛋白,可以有效地实现肿瘤细胞靶向,同时具有治疗作用。
4.3 抗体偶联药物
ADC是将细胞毒性小分子药物与可以识别肿瘤抗原的单克隆抗体偶联而构建的药物递送系统,一方面可以提高化疗药物的肿瘤靶向性并避免潜在的组织毒性,另一方面又可以增加抗体的抗肿瘤作用[73]。ADC由抗体、有效载荷和抗体-药物连接子3部分组成[74]。Kiss等[75]利用EDC/NHS反应将光敏剂IRDye700DX修饰在抗CD47抗体上,ADC可以诱导UMUC3等多种膀胱癌细胞凋亡。体内治疗后可以有效抑制肿瘤生长,延长荷瘤小鼠的存活时间。Si等[76]将抗CD47抗体与小分子DM1进行偶联。体外研究发现,抗CD47抗体与正常乳腺细胞不具有结合能力,而与乳腺癌MDA-MB-468细胞、4T1细胞的结合率达到98.9%和90.5%,并被内化进入细胞后释放DM1,通过抑制肿瘤微管聚合而抑制肿瘤增殖。药效实验表明,标准化疗后联合不同剂量的ADC可有效抑制肿瘤生长,同时未发现明显的组织毒性。综上所述,ADC是一种同时增强化疗药物靶向性和抗CD47抗体抗肿瘤作用的递送系统,具有较强的临床转化潜力。
5 结语与展望
基于CD47-SIRPα的抗肿瘤药物递送系统已经在肿瘤治疗领域中开展了大量的临床前和临床研究。包括正在进行Ⅲ期临床试验的抗CD47抗体、SIRPα-Fc融合蛋白和小分子抑制剂RRx-001,这些药物已经通过不同方案解决了贫血等血液毒性副作用的问题,此外其他制药企业也提出了针对血液毒性的治疗方案,如双特异性抗体(抗体会优先结合在肿瘤特异性抗原上,随后再结合CD47)等。除此之外,利用药物递送载体对CD47抑制剂进行包载,通过EPR效应进入TME中亦可以缓解贫血等。为了进一步提高药物递送载体的肿瘤靶向性,可以将肿瘤细胞特异性结合的抗CD47抗体通过化学反应修饰在其表面。
CD47除了介导肿瘤避免被巨噬细胞吞噬外,还可以用于药物递送系统中来延长循环时间。多数药物递送系统因其固有的免疫原性容易被机体的免疫系统识别且清除,从而无法有效发挥抗肿瘤作用,因此衍生出了PEG化修饰和仿生递送系统等策略以延长药物在机体内的循环时间。CD47作为机体固有表达的“不要吃我”蛋白而避免被巨噬细胞清除,因此可以在递送系统表面直接修饰CD47蛋白[77]或CD47模拟肽[78],进而逃避机体免疫系统的识别,从而延长药物在体内的循环时间。
综上所述,基于CD47-SIRPα开发的药物递送系统可以通过恢复巨噬细胞对肿瘤的吞噬能力而产生良好的肿瘤治疗效果,并具有良好的转化前景。
