免疫调节性纳米制剂的研究进展
2022-10-14李成龙陈小燕孙逊
李成龙 ,陈小燕,孙逊*
(1.四川大学华西药学院 靶向药物及释药系统教育部重点实验室,四川 成都 610061;2.德阳市人民医院药剂科,四川 德阳 618000)
1 自身免疫性疾病概况
自身免疫性疾病(autoimmune diseases,ADs)是一类复杂的具有器官特异性或全身性的炎症性疾病,包括类风湿性关节炎(rheumatoid arthritis,RA)、多发性硬化症(multiple sclerosis,MS)、1型糖尿病(type 1 diabetes,T1D)、系统性红斑狼疮(systemic lupus erythematosus,SLE)、强直性脊柱炎(ankylosing spondylitis,AS)等,这类疾病通常是慢性的、难治愈的,并可能危及生命,因此严重影响患者生活质量[1]。ADs的显著特征是免疫系统自身耐受紊乱与自我攻击加强,即机体免疫系统无法正确区分“自我”与“非我”[2]。流行病学统计显示,29种ADs的全球总发病率为7.6% ~ 9.4%[3]。目前,临床上尚无治愈ADs的方法,药物治疗以降低疾病活动度、改善患者生活质量为目标。传统的广谱、非疾病特异性的抗炎或免疫抑制类药物的疾病响应性低、不良反应多,即使是近10年涌现出来的非抗原特异性的、作用于细胞因子或免疫细胞信号通路的生物或小分子靶向分子,其缓解自身免疫反应的机制也是以削弱机体对抗感染和肿瘤的免疫力为代价,通常伴随危及生命的严重并发症[4],并无法真正纠正免疫紊乱。因此,以 ADs的病理机制为着力点,开发高效低毒的治疗新策略已成为迫切需求。
2 诱导免疫耐受新策略
抗原特异性免疫耐受,是指机体免疫系统对具有免疫原性的靶抗原表现出应答缺失或不应答的现象。并且,对特定抗原产生耐受的机体,在中止抗原刺激后,其仍能维持对该抗原的免疫耐受,但免疫系统对其他抗原仍具有正常的免疫应答能力。诱导抗原特异性免疫耐受以阻断免疫系统对自身或同种抗原的异常免疫响应,同时保持机体免疫系统的完整性,为ADs治疗的终极目标。为此,过去数十年间,研究者一直在探索能特异性抑制组织或器官自身免疫反应的高效低毒策略。尽管进展缓慢,但新思路的出现仍然令人兴奋,比如基于纳米技术的免疫调节性纳米制剂有助于诱导高效的抗原特异性免疫耐受发生[5-6],这也为从根本上为治愈ADs带来了曙光[7]。
适应性免疫应答的核心环节是抗原提呈细胞(antigen-presenting cell,APC)摄取、加工、处理并将抗原信号提呈给T细胞,而APC具有捕获病毒样颗粒(纳米级)的固有能力[8],这些粒子将被过滤并富集于外周免疫器官中,包括淋巴结、脾以及肝等[9]。研究表明,粒径在0.05 ~ 1 μm的各种合成粒子很容易被APC吞噬,且体内生物分布在很大程度上依赖于粒子尺寸与给药途径[10]。比如,经皮下、肌内、皮内和黏膜给药的纳米粒(nanoparticles,NPs)易与淋巴系统发生相互作用,粒径较小(10 ~100 nm)的粒子通常经毛细淋巴管迁移至淋巴结[11];较大的粒子(500 ~ 2000 nm)需借助皮下等部位的APC将其搬运到淋巴结中[12];而小于10 nm的粒子则在到达淋巴结后逃逸,不易蓄积[11]。经静脉注射的NPs则更倾向于聚集在脾、骨髓、肝、肺等器官,小于100 nm的粒子能够逃避网状内皮系统(reticuloendothelial system,RES)的清除[13];而粒径在5.5 nm以下的粒子则被肾脏过滤后经尿液排出[14]。此外,粒子尺寸还能影响与其发生相互作用的APC类型,一般认为DC优先摄取粒径较小的粒子,而巨噬细胞则倾向于吞噬较大的颗粒[13]。另外,与表面带负电的粒子相比,荷正电的NPs更容易被APC摄取,但可能具有较高的细胞毒性[15];棒状的金NPs在细胞中的摄取效率要高于球形与立方形粒子[16]。T细胞接受APC提呈的抗原信号后,其表型则决定了免疫反应的类型——免疫活化或免疫耐受。因此,基于纳米技术的免疫疗法旨在通过影响共刺激分子的表达水平以及抗原信号的传递方式诱导产生具有免疫调节作用的调节性T细胞(regulatory T cell,Treg),恢复Treg对正向免疫应答的优势,从而重塑免疫稳态并遏制ADs炎症(见图1)。
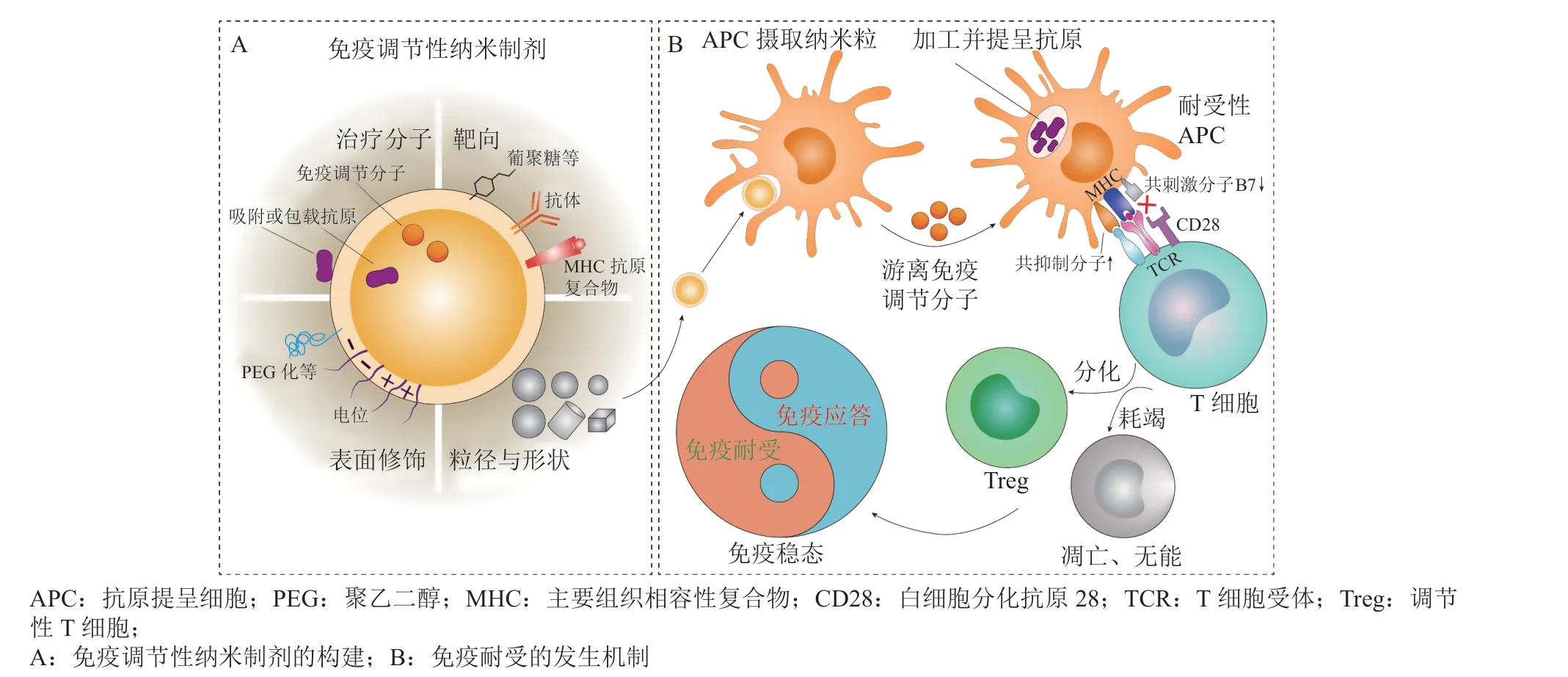
图1 免疫调节性纳米制剂的设计及其诱导免疫耐受的机制Figure 1 Design strategies and tolerogenic mechanisms of immunomodulatory nano-preparation
3 免疫调节纳米制剂用于诱导免疫耐受
通常,将包载耐受性抗原或共载耐受性抗原与免疫调节剂的纳米给药系统称为免疫调节性纳米制剂或“致耐受性”纳米粒(tolerogenic nanoparticles,tNPs)。用于构建载体的材料需同时满足生物相容性良好、无毒、易于制备等特点,包括用有机材料制备的脂质体[17]、聚乳酸-羟基乙酸共聚物(polylactic-co-glycolic acid,PLGA)与聚乳酸等聚合物NPs[18],以及以金[19]、硅[20]等无机材料所设计的载体,同时还有基于仿生纳米技术的递送策略。根据不同的分类依据,可将tNPs分为多种类型。依据免疫耐受发生的机制可以分为[8]:1)单载自身抗原的tNPs借助于免疫系统的天然响应过程诱导耐受;2)单载自身抗原的tNPs通过作用于APC表面的共抑制信号受体发挥作用;3)tNPs共载自身抗原与免疫调节剂,免疫调节剂通过影响特定的信号通路促进免疫系统针对特定抗原产生免疫耐受。按照靶细胞的不同,可以分为:1)靶向并诱导免疫原性的APC转变为耐受性的APC(tolerogenic antigen-presenting cell,tAPC),伴随Treg细胞增加;2)直接靶向并诱导初始T细胞分化为Treg[21];3)通过靶向并作用于B细胞而发挥作用。而根据不同的给药途径,诱导免疫耐受的方式有口服、鼻腔黏膜、皮肤、静脉、淋巴结以及肌肉途径等[1]。本综述以不同的给药途径为依据,分类介绍各类tNPs的研究现状。
3.1 口服途径诱导免疫耐受
口服耐受对于维持机体的免疫系统稳态至关重要,有助于平衡饮食中的外源性抗原、微生物以及自身抗原所引起的免疫反应。报道称,人类小肠黏膜的面积高达300 m2,每平方米约含1×1012个淋巴细胞[22]。M细胞是黏膜免疫系统中与上皮细胞紧密相间的一种特殊的扁平细胞,专职抗原转运,能够将肠腔中的抗原摄取并运输至肠系淋巴组织中,交由其他免疫细胞处理[23]。口服抗原后,肠绒毛上皮间的M细胞识别并摄取抗原,然后迁移至肠道相关淋巴组织(gut-associated lymphoid tissues,GALTs)—— 派尔集合淋巴结(peyer’s patche,PP)、孤立淋巴滤泡(isolated lymphoid follicle,ILF)以及肠系膜淋巴结(mesenteric lymph nodes,mLN)等,随后诱导产生高表达归巢分子C-C趋化因子受体9(C-C chemokine receptor 9,CCR9)与α4β7整合素 的Treg,并迁移至固有层引起免疫耐受。口服游离形式的抗原易被胃肠道的酸碱破坏,且GALTs中的低抗原浓度难以引起有效的免疫应答,耐受效果不佳。采用纳米载体对抗原进行包载后递送,不仅能保护抗原免遭胃肠酸碱环境降解破坏,还可以提高抗原靶向递送至GALTs中的效率。天然或合成的高分子聚合物是构建这类载体的常用纳米料材,包括壳聚糖以及PLGA等。
表达凝血因子8(coagulation factor Ⅷ,FⅧ)的DNA(FⅧ-DNA)是一种带负电的生物大分子,壳聚糖是阳离子聚合物,二者可以通过静电相互作用自组装生成NPs,能有效防止FⅧ-DNA口服后被胃肠液消化。Dharwar等[24]利用该原理经简单的制备过程合成了壳聚糖-FⅧ-DNA NPs,0.02%的壳聚糖可制备成含DNA为300 mg · L-1的NPs溶液。动物实验显示,多次经口给药显著抑制了小鼠体内FⅧ特异性抗体的产生,可以在体内持续检测到有活性的FⅧ蛋白。同样,Goldmann等[25]将能编码卵清蛋白的DNA质粒(ovalbumin-encoding plasmid-DNA,OVA/pcDNA3)硫酸钠溶液与壳聚糖醋酸溶液在55 ℃按照1:1的体积比例混合,强力搅拌30 s后,成功制备出了能编码OVA蛋白的壳聚糖-DNA NPs。多次经口给药后,该策略显著抑制了BALB/c小鼠体内OVA蛋白特异性抗体的产生以及过敏反应的发生,体外脾细胞增殖率也显著降低。细胞因子结果表明,壳聚糖-DNA NPs能有效促使1型辅助T细胞(T-helper 1,Th1)反应向Th2与Th3型转化。
PLGA是经美国食品药品监督管理局(Food and Drug Administration,FDA)批准使用的一种生物可降解大分子聚合物。以PLGA为材料制备的NPs对疏水小分子、亲水多肽与蛋白等大分子均具有较强的包载能力,且具有缓释作用,被广泛应用于各类药物递送的研究[26]。Kim等[27]采用PLGA NPs包载二型胶原(typeⅡcollagen,CⅡ),1次经口给药,就能显著降低胶原诱导型关节炎(collageninduced arthritis,CIA)小鼠模型的发病率与严重程度。免疫指标显示,接受治疗的小鼠血清中的CII特异性IgG显著减少,且淋巴结中的转化生长因子-β(transforming growth factor β,TGF-β)相 关 信 使RNA(messenger RNA,mRNA)表达增加,而肿瘤坏死因子-α(tumor necrosis factor α,TNFα)相关mRNA则表达减少。Lee等[28]用PLGA NP包载交联PEG的CⅡ表位肽CⅡ256-270(NP/PEG-pep),于第0天采用球头灌胃针胃内给予DBA/1小鼠。结果显示,与模型组或空白NPs组相比,NP/PEG-pep免疫的小鼠(PP)中,白细胞介素4(interleukin 4,IL-4)阳性CD4+T(IL-4+CD4+T)与IL-10+CD4+T细胞的比例显著增加,与经6次CII全蛋白免疫的小鼠相当,并伴随产生了对RA的遏制作用。
口服tNPs以诱导免疫耐受的特点是安全、患者顺应性好,但目前仍以临床前研究为主,相关的临床试验很少。
3.2 鼻腔黏膜途径诱导免疫耐受
鼻咽部淋巴组织是指由扁桃体、淋巴结和淋巴滤泡互相通连构成的淋巴环,又被称为瓦尔代尔(Waldeyer)淋巴环,是鼻咽道黏膜免疫发生的主要场所。在啮齿类动物中,鼻咽相关淋巴组织(nasopharynx-associated lymphoid tissue,NALT)[29]的生理功能与人类Waldeyer环相似[30]。与胃肠道中的M细胞功能相似,经鼻黏膜免疫后,抗原颗粒可能经由M细胞主动转运给树突状细胞(dendritic cell,DC)与巨噬细胞以进行处理和呈递,进而诱导产生正向黏膜免疫应答或免疫耐受[30]。研究人员通常以PLGA、纳米乳(nanoemulsions,NEs)等为载体构建经鼻腔黏膜途径诱导免疫耐受的tNPs。
Keijzer等[31]发现PLGA NPs经鼻黏膜给药具有免疫调节作用,其NALT和颈部淋巴结中Foxp3的表达显著增加。药效实验中,包载OVA的PLGA NPs能有效抑制OVA特异性的由Th1介导的免疫反应;载有热休克蛋白70(heat shock protein 70,Hsp70)表位肽的PLGA NPs经鼻免疫后,关节炎小鼠的炎症得到了有效缓解。
NEs具有粒径可调、比表面积大、抗原包封率高等特点,因此,NEs常被用于递送自身抗原以对抗ADs[32]。Wang等[33]开发了一种基于大豆油的新型NEs,并探索了其作为递送载体经鼻腔给药诱导免疫耐受的潜力。在实验性小鼠自身免疫性甲状腺炎模型上,与对照组相比,包载小鼠甲状腺球蛋白(thyroglobulin,mTg)的NEs(mTg+NEs)能有效富集于鼻腔和胸腺中,且该组的甲状腺炎症明显较轻。机制实验表明,mTg+NEs显著降低了mTg抗体与IFN-γ的水平,而显示免疫耐受程度的IL-10、TGF-β以及Treg水平则明显升高,表明该策略成功诱导模型小鼠产生了免疫耐受。
经鼻腔黏膜途径免疫,具有抗原用量小,能引起黏膜以及系统性免疫应答等优点[34],且还有利于药物的脑内递送以对抗MS等疾病。
3.3 皮下给药诱导免疫耐受
生理学上,皮肤由表皮、真皮以及皮下组织3部分构成,其中,表皮中含有专职APC——郞格罕细胞(Langerhans, cell,LC)。一方面,LC能有效防御皮肤接触的外源病原微生物与危险信号,诱导正向免疫应答;另一方面,LC可诱导免疫耐受,维持免疫稳态。tNPs经皮下注射后,一般通过两种途径到达淋巴结并引起免疫耐受:tNPs经组织间液进入淋巴管,经淋巴回流至淋巴结;tNPs在注射部位被外周组织中的LC、巨噬细胞等摄取,随后归巢返回淋巴结。用于这一策略的常见纳米载体有PLGA、脂质体以及基于无机材料(氧化铁)的表面修饰等。
机体内,抑炎细胞因子能够拮抗由炎性细胞因子产生的促炎反应,二者共同维持着机体的免疫稳态。采用纳米技术共递送抑炎细胞因子与ADs自身抗原肽,理论上可以加强免疫耐受发生的速度与程度。Cappellano等[35]将重组IL-10蛋白与髓鞘少突胶质细胞糖蛋白表位肽(myelin oligodendrocyte glycoprotein,MOG35-55)共同装载于PLGA NPs中,经2次皮下给药来治疗实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠。结果显示,PLGA共载药治疗组小鼠的EAE疾病状况显著轻于单载治疗组,在预防性与治疗性药效中均显示出了强效的抑炎能力。说明IL-10的加入增强了MOG35-55诱导免疫耐受的能力,联用产生了协同效应。
Cho等[36]合成了两种不同尺寸的PLGA粒子,其中800 nm的NPs用于包载MOG35-55,同时制备了包载维生素D3(vitamin D3,VD3)、TGF-β1与GM-CSF的粒径约55 nm的粒子。研究中,携带抗原的NPs被DC摄取;而55 nm的载药粒子则在细胞外释放VD3、TGF-β1以及GM-CSF以维持局部的耐受性微环境,其中VD3与GM-CSF能够诱导DC分化成未成熟的状态,且持续微量的GM-CSF刺激能维持DC的未成熟状态。药效实验中,皮下注射后,双重微粒递药系统有效下调了EAE相关引流淋巴结中的CD86+MHCⅡ+DC水平,最终通过诱导抗原特异性的免疫耐受而遏制了EAE模型炎症的发展。然而,这类策略所涉及的递送系统制备过程繁琐,并且可能存在较强免疫原性。
除了抗原联合抑炎性细胞因子外,还可以采用NPs同时包载并递送抗原与小分子免疫调节分子。1α,25-二羟VD3(骨化三醇)是VD3的活性形式,能显著上调CD4+T细胞表面抗炎分子CD39、CD73的水平,并能增强TGF-β的活性[37]。昆士兰大学的Galea等[38]构建了共载蛋白聚糖表位肽(Aggrecan89-103)与骨化三醇的脂质体,皮下注射用于治疗蛋白聚糖诱导的RA小鼠。结果显示,该方法通过抑制效应T细胞的增殖与功能、诱导抗原特异性Treg的产生,显著降低了RA小鼠的发病率与严重程度。
Clemente-Casares等[39]将结合多肽的主要组织相容性复合物Ⅱ分子共价连接在葡聚糖或聚乙二醇化的氧化铁NPs表面(peptides bound to major histocompatibility complex classⅡ,pMHCⅡ-NPs),皮下注射给予不同的ADs小鼠模型。结果显示,pMHCⅡ-NPs能在不损害免疫系统情况下,有效触发具有免疫调节功能的抗原特异性调节性1型CD4+T细胞(antigen-specific regulatory CD4+T cell type 1,TR1)的生成与增殖,并产生对携带相同自身抗原APC的抑制作用,促进B细胞分化为具有疾病抑制能力的调节性B细胞。基于pMHCⅡ的纳米制剂属于全新的策略,可能有助于促使以抗原特异性的方式治疗各类ADs。
皮下注射是传统疫苗的常用给药途径之一,免疫效果好。tNPs经皮下给药,可实现较好的淋巴结靶向,但该法时常受限于较小的给药剂量。
3.4 淋巴结内注射诱导免疫耐受
淋巴结是最重要的外周免疫器官之一,大量免疫细胞寄居于其中,是适应性免疫反应发生的主要场所,同时也是T细胞发生极化的部位。研究发现小鼠的大脑中存在能与外周淋巴系统相互联系的淋巴管网络[40-41],意味着中枢神经系统(central nervous system,CNS)中的抗原可能通过该通路迁移至外周引流淋巴结并引起免疫应答,而外周引流淋巴结也同时决定着迁移致病灶中的T细胞类型——促炎或调节表型。因此,淋巴结内注射可能会对CNS类ADs产生更加直接的治疗作用,且有助于进一步了解局部信号整合与全身免疫耐受之间的特异性联系。
MS在解剖学上与其他ADs的发病部位不同,该病主要累及脑、脊髓等CNS。马里兰大学的Tostanoski等[42]就采用淋巴结内注射的策略成功地在EAE小鼠上诱导出了抗原特异性免疫耐受。其制备了共包载自身抗原MOG35-55与调节信号雷帕霉素的PLGA微粒,在疾病高峰期只经1次腹股沟淋巴结内注射,就能永久性逆转EAE小鼠的瘫痪症状。同时伴随着Treg增加以及T细胞浸润减少,最终通过重塑淋巴结内局部免疫微环境驱动系统性的抗原特异性免疫耐受发生。但淋巴结内给药存在操作复杂、技术难度大、不确定性多等缺点,限制了这一策略向临床的转化。
3.5 静脉给药诱导免疫耐受
经静脉注射多肽抗原诱导免疫耐受的研究可以追溯到20世纪20年代[43],在临床前研究中,能有效诱导外周免疫耐受。以NPs作为载体经静脉途径递送自身抗原或抗原与免疫调节剂,能增加药物的靶向能力、延长作用时间并减小毒性[44]。静脉注射后,NPs经血液转运至右心室,并经肺毛细血管返回左心室,然后富集于微血管渗透性高的器官与组织中,例如肝、脾、肾、肿瘤以及炎症病灶等[45]。值得一提的是,在肿瘤或炎症病灶中,通常会形成由多种免疫细胞聚集而成的淋巴细胞簇,又被称为异位淋巴结构(ectopic lymphoid structure,ELS),ELS属于外周免疫组织的一部分,承担着病灶部位的部分免疫响应[46-47]。因此,tNPs富集于ELS[48]、脾等外周免疫器官,将有助于治疗分子与免疫细胞发生充分作用,诱导免疫耐受发生。经静脉途径诱导免疫耐受是近年来的研究热点,纳米载体的构建也呈现出多样性,常用的有PLGA、NEs、脂质纳米粒(lipid nanoparticles,LNP)、脂质体以及外泌体等。
3.5.1 纳米类诱导固有免疫耐受磷脂酰丝氨酸(phosphatidylserine,PS)是细胞膜磷脂的成分之一,位于细胞膜内,当细胞发生凋亡时,膜内的PS翻转至膜外,随后向体内具有吞噬作用的细胞发送请求被清除的信号,或者通过促进抗炎细胞因子TGF-β1的分泌而激活PS受体与巨噬细胞c-mer酪氨酸激酶(macrophage c-mer tyrosine kinase,MERTK)受体,该系列过程并不会触发机体免疫系统的正向应答,而更类似于启动了免疫耐受程序[49-51]。通过模拟机体自身凋亡细胞唤醒机体固有免疫耐受的程序,Roberts等[52]将PS连 接 在PLGA NPs上 形 成PSPLGA,静脉注射后,成功诱导EAE模型产生了固有免疫耐受,显著抑制了中枢炎症的发展。
3.5.2 mRNA疫苗诱导免疫耐受 采用LNP递送mRNA以预防或治疗疾病的技术在近两年发展迅猛。该技术不仅有助于结束新冠肺炎的大流行,Krienke等[53]的工作显示,其还可以诱导MS小鼠模型产生抗原特异性免疫耐受。该团队采用LNP递送可以编码EAE模型疾病相关抗原MOG35-55的mRNA(nanoparticle-formulated 1 methylpseudouridinemodified messenger RNA,m1Ψ mRNA),这是一种无佐剂的mRNA LNP递送技术。静脉注射后,m1Ψ mRNA靶向脾脏中的CD11c+DC,引起效应T细胞减少,而抗原特异性的Treg数量显著上升,并对促进疾病发展的Th1与Th17细胞产生了抑制作用,从而有效遏制了针对MOG35-55的特异性免疫反应。在MS小鼠模型中,该技术显著降低了MS的发病率与严重程度,而并没有产生全身免疫抑制的相关症状。m1ψmRNA技术具有高度的灵活性,且成本低廉,这将使通过设计含有不同自身抗原序列的个体化疫苗治疗ADs的设想成为可能。
3.5.3 外泌体诱导免疫耐受髓鞘来源蛋白是MS的主要疾病相关自身抗原,因此,静脉注射触发EAE的确定髓鞘抗原能诱导免疫耐受,但由于目前尚无法确证MS患者中涉及的具体免疫原,以及可能存在的个体化差异,使得相关研究成果的转化受阻。
Casella等[54]研究发现,少突胶质细胞衍生的细胞外囊泡(oligodendrocyte-derived extracellular vesicles,Ol-EVs)含有多种髓鞘抗原,这些囊泡的粒径约为240 nm。接着,他们将Ol-EVs静脉注射给予由不同髓鞘抗原诱导的EAE模型,通过诱导小鼠体内的免疫抑制性单核细胞生成以及自身反应性CD4+T细胞凋亡,成功恢复了模型的免疫耐受状态,在预防性和治疗性实验中均显示出了良好的安全性与治疗效果。更重要的是,研究者发现人源少突胶质细胞也能释放EVs,且亦含有与MS紧密相关的自身抗原,为该技术在临床上的应用奠定了基础。这一策略的便捷之处在于,它在没有确定靶抗原的情况下,仍然有机会以抗原特异性的方式治疗MS。
3.5.4 单载抗原的“致耐受性”纳米粒诱导免疫耐受体内凋亡细胞及其碎片易被外周免疫器官中高表达胶原结构样巨噬细胞受体(macrophage receptor with collagenous structure,MARCO)的巨噬细胞摄取,并以免疫耐受的方式处理掉。因此,基于自然机制清除凋亡细胞碎片的机制,连接脾白细胞的自身抗原能诱导发生抗原特异性免疫耐受[55],而惰性合成粒子则有可能通过模拟凋亡细胞而诱导免疫耐受。Getts等[56]将PLP139-151通过碳二亚胺(ethylene carbodiimide,ECDI)化学反应连接在粒径约500 nm的聚苯乙烯或PLGA NPs表面,于造模前第7天静脉给药1次,就能显著抑制EAE小鼠的相关症状,且疗效优于皮下给药。机制研究表明,这一疗效与“清道夫”受体MARCO表达增加、Treg水平升高以及诱导T细胞无能有关。此外,将供体小鼠脾细胞裂解后的混合蛋白抗原通过ECDI反应连在PLGA NPs表面,经静脉注射,能有效拮抗异体胰岛移植引起的受体排异反应[57]。
除了脾,肝也是一个针对大量抗原发生免疫耐受反应的场所[58],肝窦内皮细胞(sinusoidal endothelial cells,LSEC)是肝APC体系中的重要一员。Liu等[59]在约230 nm的PLGA NPs表面修饰上能靶向LSEC上甘露糖受体或“清道夫”受体的配体,静脉注射后,能有效抑制OVA特异性IgE反应以及Th2型细胞因子分泌。除了能被用于呼吸系统过敏性疾病的预防外,LSEC靶向PLGA NPs在ADs的治疗领域也有广阔的应用前景。
3.5.5 共载抗原与免疫调节剂的“致耐受性”纳米粒诱导免疫耐受一些小分子化合物能在体内外炎性微环境中诱导产生耐受性DC(tDC)[60-61]。据此,将体外诱导生成的自体tDC过继输入至患者体内能够产生对某些疾病的治疗作用,但高昂的费用以及苛刻的生产条件是这类个体化细胞疗法得以推广的最大障碍。值得一提的是,NPs作为一种理想的药物递送载体,可以通过实现靶抗原与免疫调节分子在体内的共同递送,以诱导内源性tDC的产生。截至目前,研究较多的两类小分子免疫调节剂分别是作用于核因子κB(nuclear factor kappa-B,NF-κB)及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的化合物,二者常被用于构建各类tNPs。
NF-κB是细胞内调控炎症与细胞存活相关基因的主要因子。Capini等[62]研究表明,脂质体共递送抗原与不同的NF-κB抑制剂(如姜黄素、槲皮素以及Bay11-7082),可以诱导产生高效的抗原特异性免疫耐受,从而遏制RA模型炎症发展。静脉注射后,载药脂质体被外周免疫器官中的MHCⅡ+APC摄取,通过抑制APC中的NF-κB信号通路,诱导产生含有特定抗原信号的tAPC,伴随诱导产生抗原特异性的Treg。此外,将这些Treg通过静脉过继输入Naive小鼠,可以对受体小鼠产生保护作用。mTOR是一类保守的丝氨酸/苏氨酸激酶,可以通过整合环境信号来调节细胞代谢与分化。雷帕霉素最早从吸水链霉菌的分泌产物中分离得到,在体内通过与FK506结合蛋白结合形成复合物而抑制mTOR信号通路,该药于1999年被美国FDA批准用于预防肾移植产生的排异反应。雷帕霉素具有强大的抑制T细胞增殖与免疫系统的能力[63],Fischer等[64]还发现该药在体外可以诱导产生tDC。
Selecta Biosciences公司(SELB)的研究人员等通过筛选大量的小分子免疫调节剂,最终发现包载雷帕霉素的生物可降解PLGA NPs在体内外具有很强的免疫耐受诱导能力[8,65-66],且同时包载雷帕霉素与蛋白或多肽抗原的tNPs能诱导机体产生持久的抗原特异性免疫耐受。机制研究表明,皮下、静脉或淋巴结内注射后,tNPs优先被脾、淋巴结、异位淋巴结构等外周免疫器官中的APC选择性优先摄取[42,48,65],随后诱导产生tAPC与Treg,伴随抑制效应CD4+或CD8+细胞生成[67]。因此,这种包载抗原与雷帕霉素的tNPs能有效纠正由T细胞介导的多类异常免疫应答,尤其在治疗EAE的实验中,tNPs能有效逆转小鼠模型疾病高峰期的瘫痪症状[42,65]。并且,取已发生免疫耐受的供体小鼠体内的Treg,过继输入受体小鼠体内,将有助于受体小鼠建立针对特定抗原的免疫耐受[68]。
近期,笔者所在团队正在探索这一策略用于治疗RA的潜力,并取得了部分进展。以新型NEs作为载体,共递送雷帕霉素与瓜氨酸化的抗原肽至炎症关节处的异位淋巴结构中,成功在CIA与佐剂诱导型关节炎(adjuvant induced arthritis,AIA)小鼠模型上诱导出了免疫耐受,遏制了RA炎症发展[48];并且,还开发了一种共载雷帕霉素与瓜氨酸化的抗原肽的“致耐受性多肽疫苗”(tolerogenic polypeptide vaccine,TPvax),经静脉注射后,CIA大鼠模型体内的Treg、IL-10显著上调,而炎性细胞因子与抗体水平则下降明显,重新在RA模型上建立了免疫平衡[69]。
此外,包载雷帕霉素和抗原的tNPs能抑制B细胞活化、生发中心形成以及抗体产生。因此,这类tNPs可以有效控制过敏模型中由IgE或IgG介导的过敏反应,并能遏制采用生物制剂治疗时药物特异性抗体的形成。例如,生物药Advate联合包载雷帕霉素的tNPs,能降低血友病A小鼠模型体内的FⅧ特异性抗体水平,从而显著提高Advate的生物利用度[70];运用该法还能有效下调RA模型中人源TNF-α抑制剂阿达木单抗的特异性抗体水平[67],并降低庞贝病模型中酸性α-葡萄糖苷酶的抗体浓度[71]。SELB开发的用于治疗慢性难治性痛风由包载雷帕霉素的tNPs与聚乙二醇化重组尿酸氧化酶组成的联合疗法SEL-212,已于2020年7月在美国展开了Ⅲ期临床研究(NCT04513366、NCT04596540)。
4 结语与展望
与早期采用游离抗原诱导免疫耐受以治疗ADs的困境相似,免疫调节性纳米制剂通常在动物模型上效果显著,而相关的临床试验往往效果甚微[6]。这种差异是其临床转化面临的最大挑战,而可能的原因有以下几方面:首先,ADs的动物模型不能完全模拟患者的病理机制。例如,EAE小鼠模型的建立是通过单次注射特定抗原而诱发的急性病理过程,而人类MS则是一种慢性的多诱因疾病。其次,人类ADs的疾病相关自身抗原尚未完全明确。例如,RA患者涉及的相关自身抗原包括二型胶原蛋白、热休克蛋白、软骨糖蛋白39、系列瓜氨酸化的蛋白/多肽以及病原微生物抗原等,参与抗原种类复杂。而广泛用于临床前研究的RA鼠科模型则采用特定的蛋白抗原与完全弗氏佐剂组成的混合物诱导而成,常用的有异源二型胶原蛋白、蛋白聚糖等[72],抗原明确且单一。另外,纳米药物在动物与人体内的分布差异可能会影响免疫耐受的效果。此外,相比于模型动物,人类MHC等位基因与TCR更具多态性,不同ADs患者所涉及的优势自身抗原表位可能存在差异,这是基于特定多肽的免疫疗法疗效有限的又一潜在原因[8]。
然而,挑战即是机遇。随着免疫学、药剂学、材料学等学科的快速发展,将会有更适用于研究免疫耐受疗法的动物模型、新型抗原、递送载体被开发出来。目前,已有人源化的RA小鼠模型被用于临床前研究[73],这些模型一般通过两种方式获得:一种是含有人类RA相关基因的转基因小鼠,包括人类MHC分子、TCR以及自身抗原等;另一种是将人类细胞或组织植入免疫缺陷小鼠体内,制备成小鼠-人类嵌合体模型。此外,髓鞘全抗原的应用正在突破由MS动物模型向临床转化的瓶颈[54],用于预防新冠肺炎的Comirnaty与Spikevax在人群中的大规模接种进一步验证了LNP技术的安全与有效性。这些技术的进步将促进免疫调节纳米制剂的发展。相信在不久的将来,基于tNPs的平台技术将会被成功用于治疗ADs,与现有的治疗策略形成互补,减轻患者痛苦,改善患者生活质量。
