“冷肿瘤”免疫调节纳米制剂研究进展
2022-10-14董婧雯黄莹李全豪周占威孙敏捷
董婧雯,黄莹,李全豪,周占威,孙敏捷
(中国药科大学药学院药剂系,江苏 南京 210009)
1990年,Paul Ehrlich在肿瘤治疗研究中发现:在肿瘤的发生与发展过程中,免疫系统可在治疗中发挥关键作用[1]。随着肿瘤免疫学及分子生物学等研究不断深入,免疫检查点阻断疗法(immune checkpoint blockade,ICB)、嵌合抗原受体T细胞疗法(chimeric antigen receptor T cell immunotherapy,CAR-T)、细胞因子调节及树突状细胞(dendritic cells,DCs)疫苗都已被美国FDA批准用于延长某些类型肿瘤患者的生存期,并取得了令人震惊的治疗效果[2-5]。然而,免疫治疗的患者响应率仅为20%,同时出现了严重的治疗相关不良反应。因此,更多科研工作者聚焦于肿瘤免疫表型及免疫治疗增效的研究中,期望根据患者的免疫表型探索肿瘤免疫治疗的优化方案。
1 “冷肿瘤”免疫屏障定义及其组成
根据肿瘤微环境(tumor microenvironment,TME)中细胞毒性免疫细胞的空间分布,肿瘤可分为3种基本的免疫表型:免疫排斥型、免疫沙漠型和免疫炎症型[6]。其中,免疫排斥型肿瘤与免疫沙漠型肿瘤可称为“冷肿瘤”,其特征为:细胞毒性T细胞(cytotoxic T cells,CTLs)浸润量低或仅局限于肿瘤组织边缘,同时伴随着免疫原性低,纤维化细胞外基质、免疫抑制细胞及相关细胞因子富集等特征[7-10]。随着肿瘤免疫学研究的深入,人们对“冷肿瘤”微环境特征及其组分构成有了更深一步的认识(见图1)。下文就“冷肿瘤”微环境的定义、特征及其各组分在TME中发挥的作用及其机制进行逐一介绍。
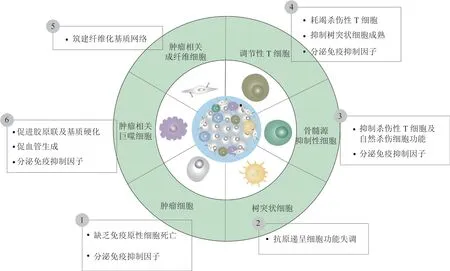
图1 “冷肿瘤”微环境特征及其组分Figure 1 The characterization and components of cold tumor microenvironment
1.1 肿瘤细胞
肿瘤发生发展中,肿瘤细胞增殖易发生体细胞突变,因而产生肿瘤细胞异质性。基于该特征,肿瘤抗原可分为两大类:非突变自体抗原和非同源体细胞突变产生的新抗原[11]。其中,非突变自体抗原包括在肿瘤细胞中异常表达或过度表达的非突变蛋白,如:肿瘤相关抗原(tumor associated antigens,TAAs)等。其中,免疫反应的主要靶标是具有特异性的非同源体细胞突变产生的新抗原,也称为肿瘤特异性抗原(tumor-specific antigens,TSAs)。TSAs的递呈可促进T细胞活化和浸润,并可导致长期临床反应[12]。然而,由于缺少免疫原性死亡(immunogenic cell death,ICD),导致TSAs暴露极少,因而形成了低免疫原性的TME,最终限制了免疫系统的激活,进而无法杀伤肿瘤。
ICD是指通过增强肿瘤细胞的免疫原性而使其死亡。研究发现,相对于非免疫原性细胞死亡,ICD具有明显特征,如:钙网蛋白(calreticulin,CRT)的 暴 露、三 磷 酸 腺 苷(adenosine triphosphate,ATP)及高迁移率族蛋白(high-mobility group box,HMGB1)的分泌等所形成的损伤相关分子模式(damage-associated molecular pattern,DAMP)[13]。具体来说,细胞中的内质网应激及活性氧(reactive oxygen species,ROS)的产生会引发CRT的暴露,释放充当“吃我”信号,有助于吞噬细胞对抗原细胞的捕获[14-15]。此外,核苷酸及内源性细胞因子的分泌对ICD至关重要。ATP的分泌可发出“找我”信号,刺激DCs表型成熟的同时,发挥抗肿瘤免疫反应传播的关键作用[16]。类似地,HMGB1分泌至胞外后,可与抗原递呈细胞(antigen-presenting cell,APC)表面上Toll样受体4(toll-like receptor 4,TLR-4)结合,一方面促进炎症因子的产生,另一方面可协助DCs对抗原的递呈[17]。
此外,肿瘤细胞表面的趋化因子受体及其分泌的趋化因子在免疫抑制性TME中发挥了重要作用。例如,趋化因子CC配体22(chemokine C-C motif ligand 22,CCL22)、CCL28、CXC型趋化因子 配 体17(CXC chemokine ligand 17,CXCL17)招募免疫抑制细胞,抑制T细胞功能活性[18];CCL2、CCL3和CCL5诱导单核细胞分泌基质金属蛋 白 酶9(matrix metalloproteinase 9,MMP 9),CXCL8和CXCL12调节血管生成,介导肿瘤侵袭和转移[19];另外,肿瘤细胞所分泌的转化生长因子-β(transforming growth factor-β,TGF-β)是免疫抑制的关键媒介,其抑制抗原呈递,严重损害T细胞介导的抗肿瘤反应[20];同时,TGF-β可介导上皮间质转化(epithelial-mesenchymal transformation,EMT),提高肿瘤转移的风险[21-22]。在肿瘤细胞强大的免疫抑制作用下,肿瘤细胞可逃避免疫监视,导致癌症免疫疗法难以发挥理想的疗效。
1.2 抗原递呈细胞
以DCs为代表,APCs可识别“危险信号”,如:损伤相关模式分子等,进而捕获抗原并迁移至淋巴器官。同时,成熟DCs表面表达共刺激信号,如:抗原分化簇80(cluster of differentiation,CD80)、CD86及CD40等,可提供激活CTLs所需的二级信号转导,从而启动体内免疫反应[23]。然而,在TME中,“冷肿瘤”微环境致使DCs功能失调,如:细胞内检查点锡钙素1可以捕获DAMPs并抑制DCs吞噬作用[24];环状GMP-AMP合成酶(cyclic GMPAMP synthase,cGAS)/干扰素基因刺激器(stimulator of interferon genes,STING)途径的钝化会加剧DCs表面共刺激分子的下调[25];谷胱甘肽(glutathione,GSH)的增加介导的氧化还原水平的失调甚至消除了信号分子的刺激活性,使DCs难以成熟,导致T细胞的增殖和激活严重减少[26]。
1.3 骨髓源抑制性细胞
骨髓源抑制性细胞(myeloid-derived suppressor cells,MDSCs)在TME中大量聚集,并具有强大的免疫抑制活性。MDSCs是一种异质性的未成熟髓质细胞群,以多种形式影响肿瘤的发生、生长和进展[27]。MDSCs可分泌ROS[28]、亚硝基过氧化物[29]、精氨酸酶1和前列腺素E2(prostaglandin E2,PGE2)来抑制T细胞和自然杀伤细胞(natural killer cell,NKs)的功能[30],显著降低癌症免疫疗法的疗效;此外,MDSCs可分泌一氧化氮(nitric oxide,NO)[29]、免疫抑制细胞因子(如TGF-β等)[31]以及程序性细胞死亡配体1(programmed cell death 1 ligand,PD-L1)从而抑制抗原特异性T细胞的积累,促进免疫逃逸[32]。
1.4 调节性T细胞
调节性T细胞(regulatory T cells,Tregs)在调节免疫耐受和免疫监视方面起着至关重要的作用[10]。临床试验表明,实体瘤患者中Tregs的比例增加与肿瘤转移、预后不良和5年生存率低呈正相关[33-35]。Tregs通过多种机制抑制APCs及CTLs的活化。高表达CD25的Tregs与CTLs竞争白细胞介素-2(interleukin,IL-2)[36],导致CTLs匮乏与凋亡,从而降低免疫治疗效果[37];Tregs还通过细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyteassociated protein 4,CTLA-4)通路进一步抑制DCs表面共刺激分子CD80及CD86的表达[32,38-40],并抑制未成熟DCs上表达的主要组织相容性复合体Ⅱ(major histocompatibility complex II,MHC-II)[41-42],而阻碍抗原递呈并抑制辅助性CD4+T细胞的激活;Tregs分泌免疫抑制细胞因子,如IL-10和TGF-β,以抑制抗肿瘤免疫反应[43]。
1.5 肿瘤相关成纤维细胞
纤维母细胞可在肿瘤微环境中TGF-β、白细胞介素6(interleukin 6,IL-6)以及血小板衍生生长因子(platelet-derived growth factor,PDGF)的作用下激活形成肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)[44-45]。癌症作为一种持续性的损伤,可诱导激活的成纤维细胞长期存在并不断增殖[46-47]。Sun等[48]报道CAFs中结合盘状结构域受体的激活能够促进纤维化胶原的产生,并在基质中不断沉积。随着CAFs的增殖和胶原蛋白的过度沉积,纤维化物理屏障逐渐形成,阻碍了CTLs的有效浸润,减少杀伤性T细胞与肿瘤细胞的接触,从而大大削弱了免疫治疗的效果。
1.6 肿瘤相关巨噬细胞
在肿瘤浸润的淋巴细胞中,肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)对于免疫抑制屏障的形成同样有着不可忽视的作用。巨噬细胞在TME的不同生理条件下分化为M1和M2两类。其中,M2表型在TME中占主导地位,能够增强肿瘤的生长、侵袭和进展[49]。TAMs可分泌γ-干扰素(interferon-γ,IFN-γ)及IL-6等免疫抑制相关因子,维持慢性炎症并启动肿瘤生长[50];TAMs可分泌大量MMPs,增大肿瘤细胞进入循环或淋巴系统的可能性,增加了癌症转移的风险[46,51-52];TAMs释放抗炎细胞因子,如IL-10和TGF-β,极大地刺激了Tregs细胞,并与之相互作用,形成免疫抑制性屏障[53-54]。
此外,TAMs可通过促进胶原交联和基质硬化,助力纤维化屏障的构建[55]。在“冷肿瘤”微环境中,巨噬细胞通过PDGF等信号通路诱导成纤维细胞增殖[56]。此外,通过分泌TGF-β、颗粒蛋白和成纤维细胞特异性蛋白-1等细胞因子,促进成纤维细胞的活化,加速纤维化TME的进程[57-59]。相对应地,CAFs也可通过激活巨噬细胞集落刺激因子-1(colony stimulating factor 1,CSF-1)及其受体的信号轴与TAMs相互作用,提高TAMs的丰度[57]。此外,研究结果显示,由M2型TAMs分泌的赖氨酸氧化酶(lysyl oxidase,LOX)和赖氨酸羟化酶2(lysyl hydroxylases 2,LH2)的表达量增加是胶原蛋白交联及基质僵化的重要原因[58]。
2 “冷肿瘤”免疫调节疗法的发展与机遇
2.1 临床治疗现状
基于肿瘤免疫抑制微环境的复杂性,近年来研究人员致力于逆转“冷肿瘤”微环境,为肿瘤的免疫治疗营造更为有利的治疗环境,造福更多患者[60]。针对上文中提出的众多治疗靶点,临床上已经提出了一些打破免疫抑制屏障的治疗方法,并正在进行临床试验(见表1),以期打破“冷肿瘤”免疫微环境中多元素相互影响、相互制约的复杂关系。此外,随着肿瘤免疫学及人工智能的飞速发展,大数据处理能够更好地分析复杂的TME,在未来的临床治疗中指导个性化肿瘤免疫治疗策略。
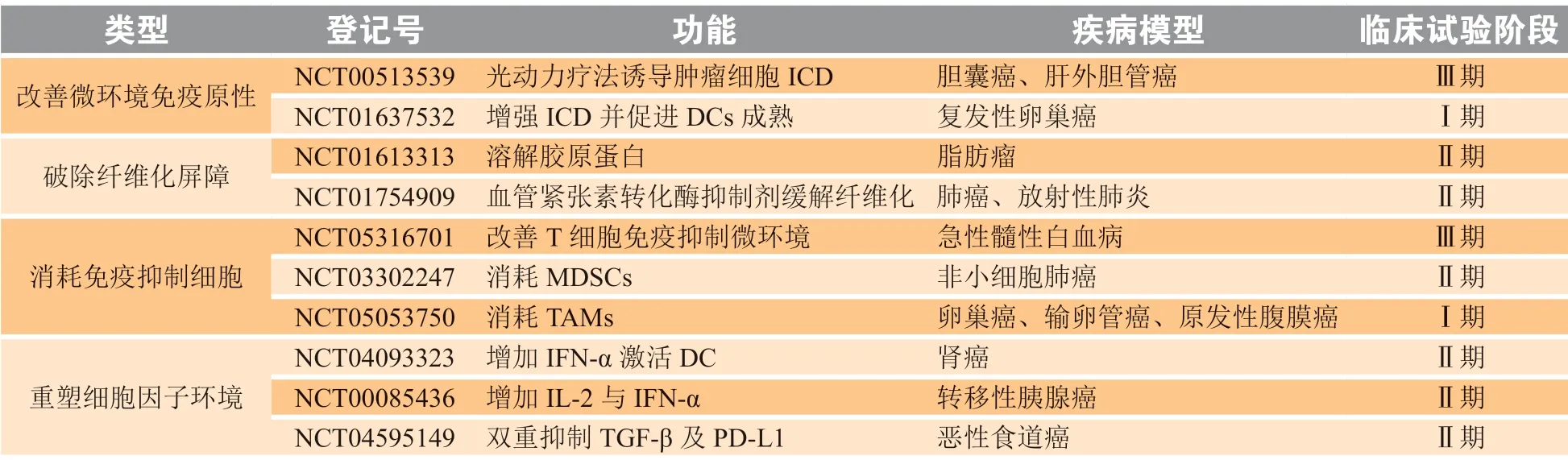
表1 打破免疫抑制屏障的临床试验Table 1 The therapy of breaking the immunosuppressive barrier under clinical investigation
2.2 临床疗法的局限性
尽管许多药物的临床试验火热开展,然而目前的临床治疗策略通常是多药联合治疗,其治疗策略仍存在以下局限性:由于药物的理化性质(如溶解性、电位等)差异,多药物间相互作用仍不明确;且不同药物的组织分布存在差异,在增加不良反应的同时,难以实现精准配伍;且如前文所述,肿瘤免疫靶点众多,作用机制复杂且时序性较强,若通过多次给药进行治疗将导致患者的依从性差,严重影响癌症患者的生存质量。
纳米医学的高速发展为纳米多药联合递送提供了更多可能。通过合理的设计,纳米系统可打破药物理化性质的束缚,在提高药物成药性的同时,实现药物的精准配伍;纳米递送系统亦可主动或被动地靶向特定的器官、细胞及亚细胞结构,精准调控药物的时空分布;通过巧妙地设计,智能程序性纳米递药系统亦可减少给药频次,提高患者依从性。由于纳米系统具备上述优势,因而有望精准作用于“冷肿瘤”免疫屏障,时序性地级联调控免疫抑制微环境,多靶点协同重塑免疫微环境,将肿瘤免疫治疗从“还原论”走向“系统论”,深入探索肿瘤免疫治疗的新出路。
3 工程化免疫调节纳米制剂在“冷肿瘤”中的 应用
近年来,纳米技术的发展给多药递送联合治疗带来新的思路,衍生出多种纳米药物载体,如脂质体、纳米胶束、聚合物纳米粒以及无机纳米粒等[60]。研究人员巧妙设计智能纳米递送系统,通过被动和主动的机制有效实现多药物联合的精准递送;通过多药级联作用,启动免疫效应的关键信号,放大抗肿瘤效应;此外,针对复杂的免疫抑制微环境,可实现多靶点协同治疗,展现出极具潜力的应用价值和开发前景。因此,开发多功能纳米免疫调节剂可提升免疫治疗策略的可行性,为未来的新型临床免疫调节提供思路(见图2)。
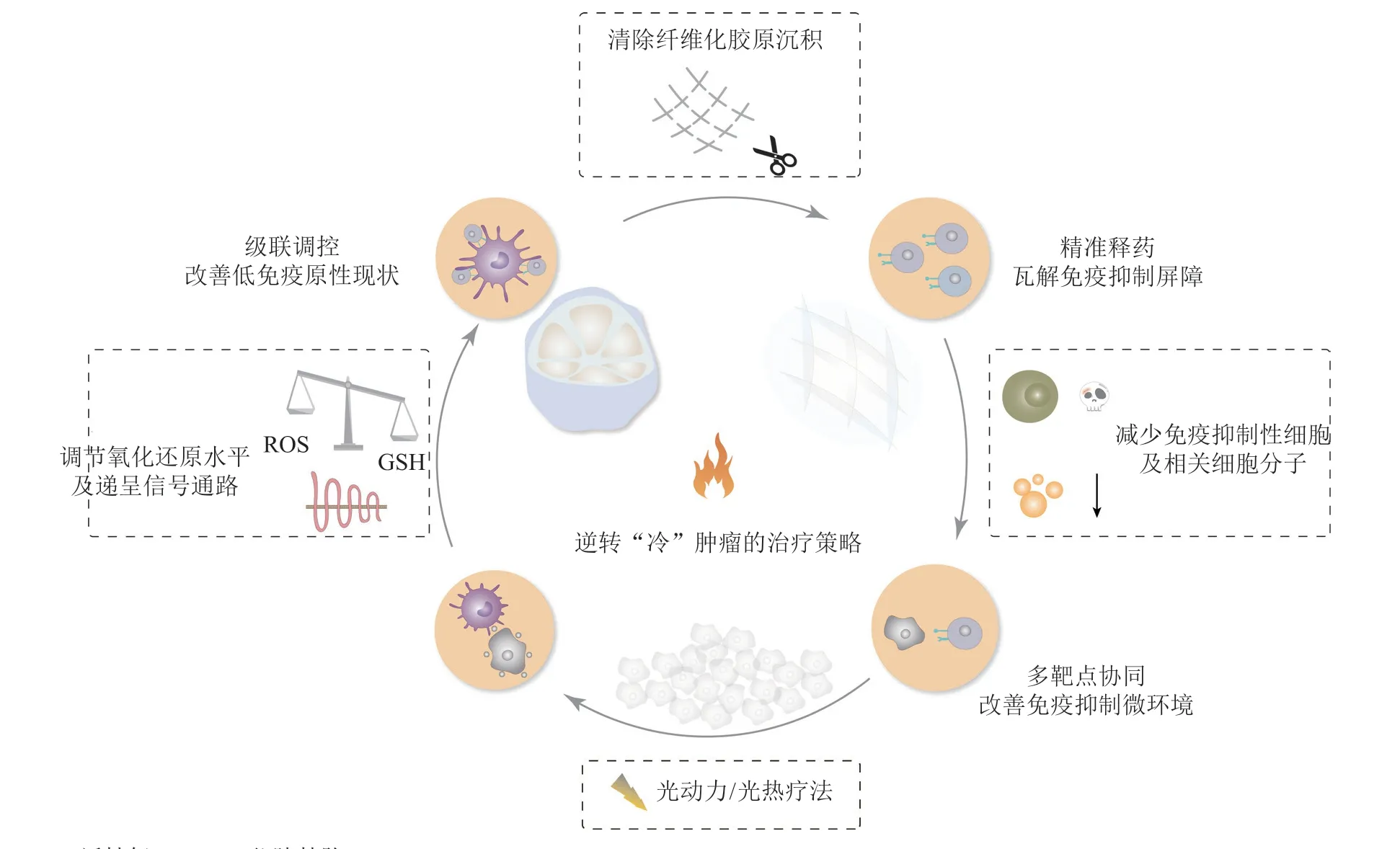
图2 破除“冷肿瘤”免疫屏障的策略Figure 2 The strategy of breaking the immunosuppressive barrier of cold tumor
3.1 精准释药,瓦解纤维化屏障
在肿瘤复杂的生理环境中,基质环境中的精准释药有利于破除纤维化免疫抑制屏障。其中,胶原酶是一种能够降解胶原蛋白的蛋白质,可用于打破胶原蛋白引起的纤维化物理屏障,有望增加CTLs浸润以及CTLs与肿瘤细胞的接触,进而发挥抗肿瘤效果。Xu等[61]开发了一种精准释放胶原酶的工程化纳米平台,以期在清除肿瘤纤维化的同时释放药物杀伤肿瘤(见图3A)。在体内循环中,硫酸软骨素形成的外壳可以防止胶原酶在血液循环中失活;聚(β-氨基酸酯)部分在TME中的偏酸性条件下由疏水性变为亲水性,使胶原酶从制剂中释放出来。胶原酶破坏致密的纤维化TME,进一步增强了该纳米免疫调节剂在瘤内的浸润(见图3B)。除此之外,聚(β-氨基酸酯)的亲水片段可增大纳米粒的尺寸以延长其滞留时间。该工程化纳米平台可精准瓦解纤维化TME,使其肿瘤生长抑制率达到94.6%,提高了实体瘤的化疗效果。此外,Dong等[62]通过制备共载化疗药物和NO供体的介孔二氧化硅纳米粒。NO可在肿瘤组织内与超氧阴离子(O2•-)快速反应,形成过氧亚硝酸盐(ONOO-),从而激活MMPs对胶原蛋白的降解。Liu等[63]将NO供体与金纳米棒偶联,该纳米免疫调节剂以上述同样的方式精准反应,降解胶原蛋白并破坏致密的实体瘤基质,以促进纳米药物的渗透。Chen等[64]提出,局部光热疗法也可以精准缓解肿瘤纤维化,增加T细胞在肿瘤部位的聚集,从而为重塑TME提供潜在的精准治疗纳米平台。
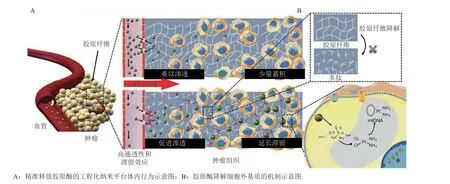
图3 胶原酶修饰的纳米免疫调节剂的构建及破除“冷肿瘤”免疫屏障体内机制及疗效[61]Figure 3 Collagenase-modified nano-immunomodulatory for breaking the cold tumor
此外,抑制CAFs功能可减少胶原蛋白的产生。Hou等[65]制备了一种以碳量子点及成纤维细胞激活蛋白-a响应型多肽搭载氯沙坦构建而成的纳米多孔免疫调节剂。该纳米多孔免疫调节剂可在TME中解体,精准释放氯沙坦抑制成纤维细胞功能,减少基质中Ⅰ型胶原蛋白的产生,促进效应T细胞的浸润。
CXC趋化因子受体4(CXC chemokine receptor 4,CXCR4)在人类多种癌症类型中过量表达,并与纤维化密切相关。笔者所在课题组开发了一种联合CXCR4拮抗剂和ICB疗法的纳米复合物,用于缓解纤维胶原蛋白的沉积并增强ICB的免疫疗法[66]。所合成的CXCR4型聚合物可精准减少CAFs的募集,从而减少α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达引发的胶原蛋白沉积,缓解肿瘤纤维化,并进一步促进CTLs的浸润,有效减少路易斯肺癌(Lewis lung carcinoma,LLC)模型及晚期转移性乳腺癌模型(late-stage metastatic breast cancer,LMBC)中的纤维化胶原的沉积,从而逆转TME免疫抑制,有效延长小鼠的中位生存期33 d。总体而言,纳米免疫调节剂可精准作用,通过缓解胶原化基质、抑制成纤维细胞功能,改善T细胞对肿瘤组织的浸润,对“冷肿瘤”免疫调节的相关研究具有十分重要的意义。
3.2 级联调控,改善低免疫原性
3.2.1 激活免疫原性死亡以促进抗原递呈纳米载体的应用可实现程序性的免疫调节,级联调控肿瘤抗原及“危险信号”的释放,从而激活ICD。
光动力疗法(photodynamic therapy,PDT)被认为是一种高效产生ICD的治疗策略,可释放“危险信号”用于激活免疫系统从而杀伤肿瘤。其中,光敏剂二氢卟吩(Ce6)具有近红外吸收系数高和1O2量子产率大的优势,因而被广泛应用于PDT[67]。例如,Ce6可与吲哚胺双加氧酶抑制剂自组装形成纳米粒,级联放大ICD反应,激活CTLs,引发针对实体肿瘤的抗原特异性免疫应答[68]。此外,Qin等[69]将Ce6与两亲性的D-α-生育酚聚乙二醇1000琥珀酸酯共轭构建纳米平台,以改善Ce6的溶解性,进而级联放大光动力效果。此外,释药后载体与线粒体复合体Ⅱ相互作用,进一步诱导ROS的产生,级联放大ICD的治疗效果以提高肿瘤免疫原性。
CO气体疗法因其具有强大的免疫调节功能,而受到广泛的关注。Xiao等[70]构建了多功能的CO纳米发生器作为ICD诱导剂,释放CO以加剧肿瘤细胞的氧化应激,继而介导ICD。该纳米粒可吸附外源性及内源性的CO2。所捕获的CO2在金涂层的C3N4纳米内核颗粒的催化下,使得CO2原位转化为CO。产生的CO加速肿瘤细胞线粒体呼吸,通过耗尽线粒体来促进发生ICD,放大了CRT的暴露产生的“吃我”信号,促进了DCs的对TSAs的识别。这种可级联反应的“一体化”的纳米免疫调节剂可扭转肿瘤免疫原性低的现状。
改变溶酶体通透性可促使溶酶体内的水解酶扩散至细胞质中,亦可有效诱导肿瘤细胞的ICD。Ji等[71]合成了新型纳米溶酶体膜通透性诱导剂,可在过度表达碱性磷酸酶的肿瘤细胞溶酶体中积累,随后诱导溶酶体膜破裂,促进ICD。DAMPs信号的释放激活了适应性免疫,增加CTLs在肿瘤细胞中的浸润,缓解“冷肿瘤”的免疫抑制性微环境。
铁死亡可通过化学动力学疗法诱导ICD,放大免疫激活效应[72]。Zhao等[73]构建了一个壳-核结构的铁死亡纳米免疫调节剂。在酸性的TME中,铁离子可催化芬顿反应生成ROS,进而促进DAMPs释放,诱导ICD。综上,纳米免疫调节剂可通过级联反应诱导肿瘤细胞发生ICD,是调节免疫抑制TME和增强抗肿瘤免疫反应的理想候选者。
3.2.2 缓解抗原递呈细胞功能失调DCs是免疫系统的“哨兵”,是最关键的APCs,是级联放大免疫系统作用的冲锋号。其作用是将抗原肽呈现给T细胞,引导T细胞的启动和效应细胞的分化。
Zhou等[74]创造性地构建了马来酰亚胺脂质体(maleimide liposome,ML)作为辅助PDT的纳米佐剂(见图4A)。ML的传递消耗了DCs中的GSH(见图4B),提高胞内的ROS水平,从而上调MHC II和共刺激分子CD80/86的表达,引发更强大的免疫反应(见图4C)。实验结果显示,ML显著促进DCs成熟至57%,且增加CTLs浸润至53%,延长了荷瘤小鼠的生存期。ML纳米佐剂与PDT相结合的创新策略缓解了DCs功能失调,级联放大了抗肿瘤免疫治疗的作用。此外,cGAS/STING途径是先天免疫系统中激活DCs的一种内源性机制。笔者所在课题组构建了一个仿生纳米平台,采用工程化的肿瘤细胞膜包裹二氧化锰纳米颗粒(MnO2),形成原位光热疫苗(CMM-DiR)[75]。基于肿瘤细胞膜同源黏附特性,CMM-DiR可靶向至肿瘤组织,随后MnO2纳米颗粒在TME高过氧化氢水平的作用下迅速降解,爆破释放Mn2+,激活cGAS/STING途径介导的APCs活化,改善DCs的功能失调。因此,纳米免疫调节剂可从调节APCs功能角度,为突破“冷肿瘤”的治疗瓶颈提供新思路和新方法。
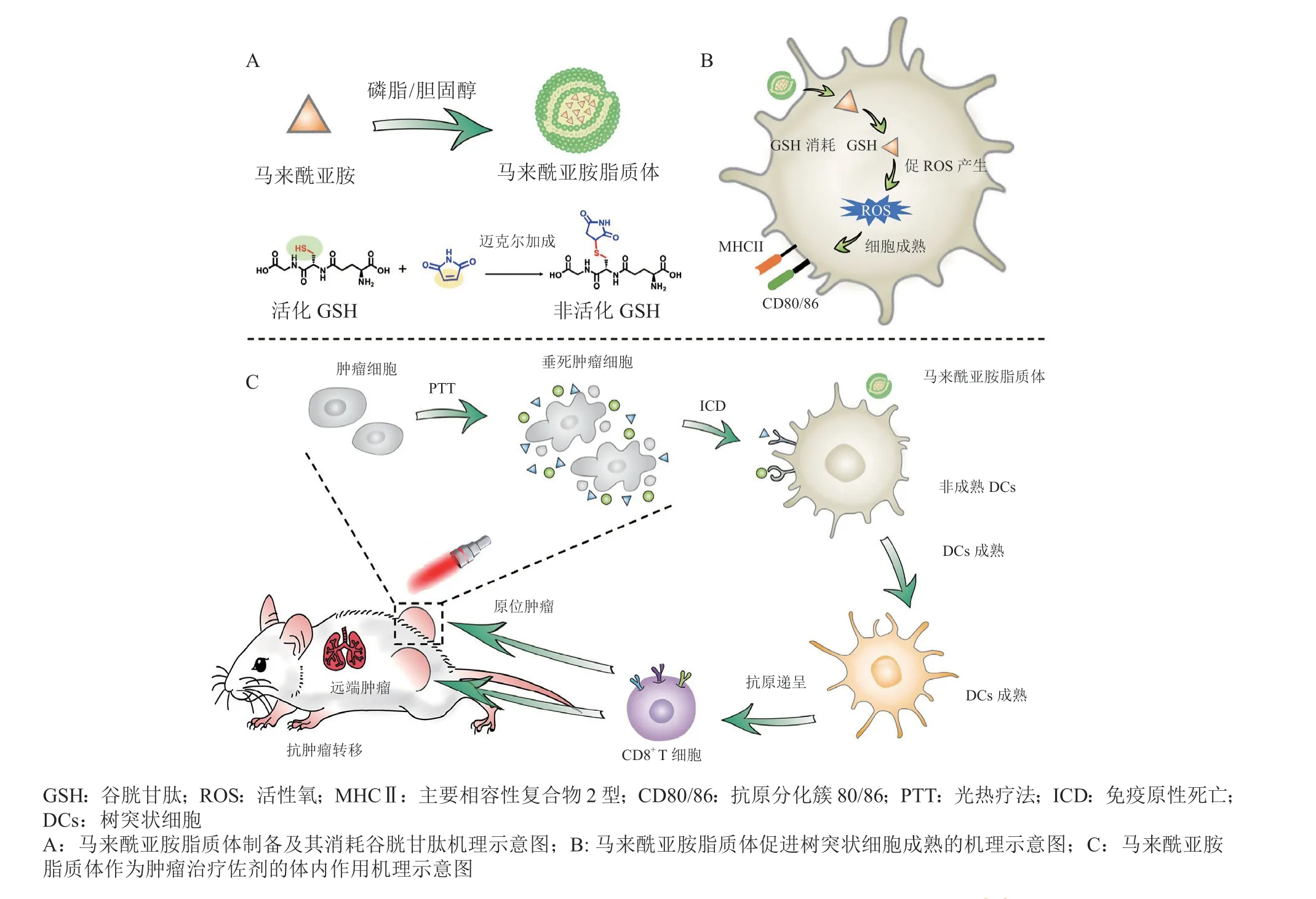
图4 马来酰亚胺脂质体用于改善树突状细胞功能失调增效抗肿瘤治疗[74]Figure 4 Maleimide liposome remodels the DCs for enhancing the immune response
3.3 多靶点协同,改善免疫抑制肿瘤微环境
3.3.1 杀伤免疫抑制细胞许多研究表明,免疫抑制细胞可作为判断患者免疫治疗预后的重要因素。然而,免疫抑制细胞众多,迫切需要开发多靶点协同的治疗方法,杀死Tregs、MDSCs和TAMs等免疫抑制细胞的同时,启动机体适应性免疫,恢复机体的免疫监测功能。
为了将“冷肿瘤”转化为“热肿瘤”,打破免疫抑制的限制,增强PDT效果,笔者所在课题组构建了氟组装的多靶点免疫调节纳米团簇[76](见图5A)。PDT触发ROS产生,不仅能够诱导肿瘤细胞ICD,还可诱导ROS敏感性骨架断裂。释放出的氟化顺铂可有效减少TME中Tregs(约80%)和MDSCs(约74%),从而解除免疫抑制(见图5B),为逆转免疫抑制提供了一种新的可能。
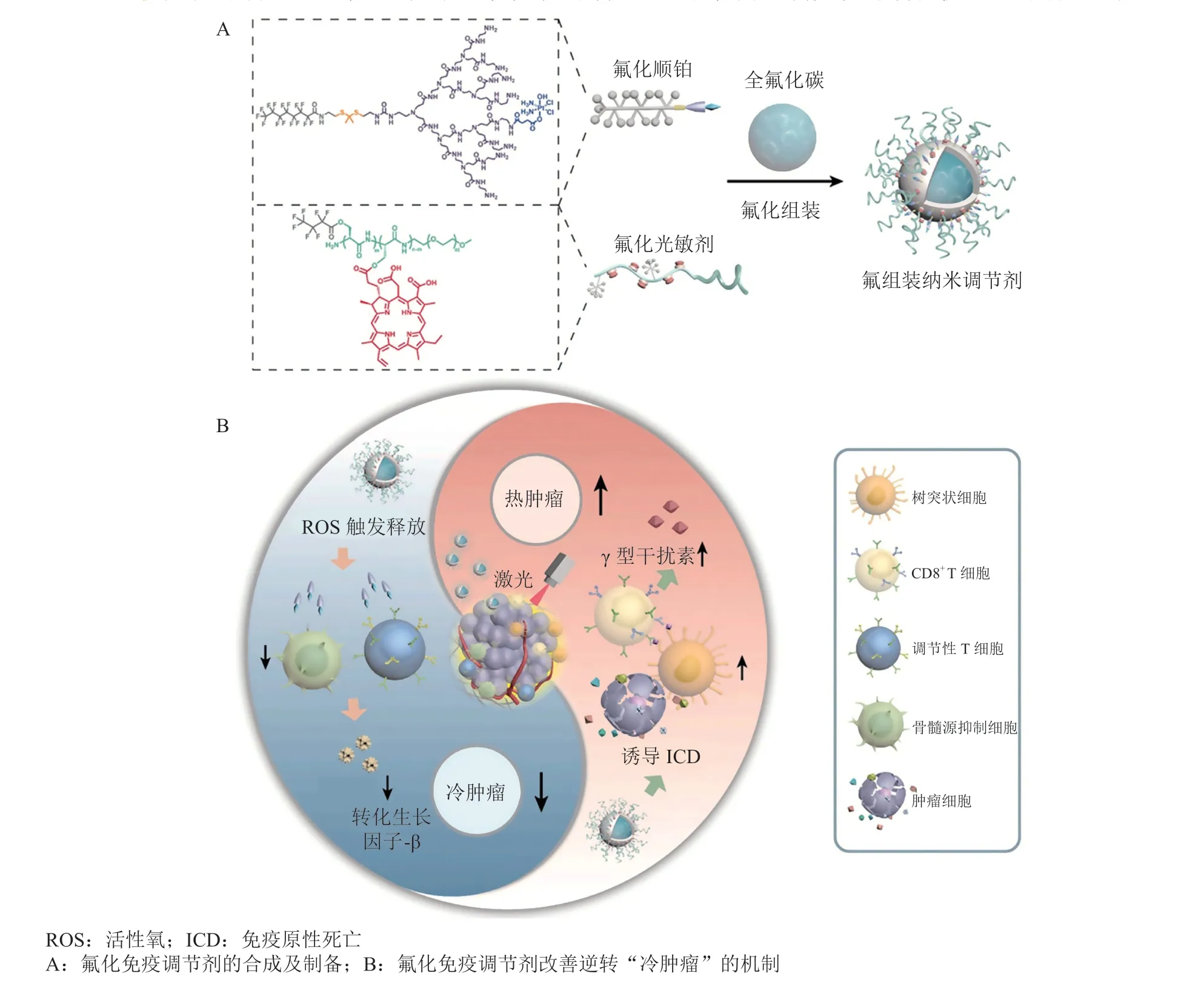
图5 氟组装的顺铂纳米团簇用于杀伤免疫抑制细胞逆转“冷肿瘤”微环境的治疗Figure 5 Fluorine-assembled nano-immunomodulators for killing the immunosuppressive cells to turn the cold tumor into hot tumor
此外,He等[77]构建了一种调节CTLs与Tregs比例的纳米平台。在酸性的TME中,该纳米平台结构中的酰胺键水解,在肿瘤局部释放甲斑蝥素至肿瘤深处。甲斑蝥素可抑制蛋白磷酸酶2的活性以及过度激活哺乳动物雷帕霉素复合物1(mammalian target of the rapamycin complex 1,mTORC1)途径,从而抑制Tregs的分化,降低Tregs的丰度。此外,PTT联合腺苷A2A受体(adenosine A2A receptor,A2AR)拮抗剂维帕地南亦可实现Treg丰度调节[78]。PTT引发肿瘤细胞ICD的同时,还能够触发温敏材料解体释放维帕地南。其与Tregs表面的腺苷受体结合,不仅减少Tregs和TAMs的数量,还可下调IL-10和TGF-β免疫抑制细胞因子的含量。
针对MDSCs,Ruan等[79]将泽布拉林(zebularine,ZeB)包载于水凝胶中,调节TME中DCs与MDSCs的比例,以逆转“冷肿瘤”免疫抑制微环境。ZeB是一种去甲基化试剂,可调节肿瘤相关抗原及PD-L1的表达,该水凝胶通过瘤周注射在原位形成,能够实现可控和持续的药物释放,有效改善免疫抑制,抑制肿瘤的生长,并使小鼠的中位生存期从16 d延长至39.5 d。
TAMs也是免疫抑制TME的重要组成部分。近期,Wang等[80]利用血红蛋白和聚ε-己内酯构建了一种仿生纳米平台,其可特异性地靶向M2型TAMs 表面CD163受体,释放多柔比星杀伤免疫抑制性TAMs,从而抑制乳腺癌的生长并防止肿瘤复发。Qian等[81]设计了一种靶向TAMs纳米免疫调节剂用于沉默集落刺激因子-1受体。可耗尽M2型TAMs,解除T细胞的抑制,实现免疫抑制微环境的重编程。在此基础上,仿生策略可进一步优化治疗体系。Yue等[82]采用巨噬细胞膜修饰多巴胺纳米颗粒用于吸附TAMs复极剂TMP195,提高重塑免疫抑制微环境策略的安全性。此外,细胞因子(CCL2和CCL5)、免疫激动剂和外源性刺激(高温、氧化应激)同样可对TAMs进行重编程,缓解免疫抑制微环境,打破免疫抑制屏障[83-85]。
3.3.2 调节免疫调节性细胞因子提高促炎细胞因子丰度的策略主要依赖于药物递送载体。Zhai等[86]制备了包载干扰素诱导剂ORY 1001的淋巴细胞膜修饰纳米免疫调节剂,可局部上调肿瘤内IFN-α/β水平,增加MHC-I和PD-L1的表达。反过来,增加的PD-L1促进了后续纳米粒的摄取,增加其在肿瘤部位的特异性蓄积。Qiu等[87]构建了一种酯酶响应型阳离子聚合物用于表达IL-12的质粒的递送。该载体在肿瘤高水平酯酶的作用下释放质粒并促进IL-12的高效转染,提高了肿瘤组织中IL-12的浓度。得益于IL-12含量的增加,M1表型促炎巨噬细胞的分布增加约4倍,改善免疫抑制微环境。
除了通过提高促炎细胞因子水平来缓解免疫抑制的策略外,减少抗炎细胞因子的丰度也是一种重要手段。例如,Miao等[88]制备了可递送编码CXCL12的捕获蛋白和编码PD-L1序列捕获蛋白的脂质体。CXCL12的减少可改善T细胞的浸润,缓解免疫抑制;PD-L1陷阱则可抑制T细胞耗竭和凋亡,显著抑制了胰腺癌的发展。
Xu等[89]制备了一种主动靶向至肿瘤细胞脂质体复合物,用于沉默TGF-β。结果表明,在晚期TME中,该纳米调节剂沉默效率约50%,同时还增强了CD8+T细胞对肿瘤组织的浸润,减少Tregs的数量,有效逆转免疫抑制环境。Dai等[90]构建了一种pH/ROS响应性的前药胶束,用于包载小干扰基因用于沉默TGF-β,可实现肿瘤深层渗透。不仅下调肿瘤组织中CD31及胶原蛋白表达,缓解肿瘤的免疫抑制微环境,还可诱导大量的效应T细胞及NK细胞至肿瘤部位,展示出极佳的抗肿瘤和抗转移疗效。
4 结语和展望
纳米免疫调节策略具有主动靶向、精确可控、易于联合多种治疗策略、良好的生物安全性以及较小的不良反应等优点[61],但仍存在诸多不足。在纳米制剂的生产过程中,各批次之间的一致性、放大过程的等效性和多种有效的表征方式值得关注。如何平衡纳米免疫调节剂的有效性和安全性,从而实现细胞和分子水平的定量精确调控也是未来克服“冷肿瘤”纳米制剂的重大挑战。此外,TME个体差异巨大,实现个体化的多药共载也是临床转化的一大难题[91]。解决上述问题需要企业与学术科研机构密切合作,探索产学结合新出路,结合政府部门指定的医疗健康发展蓝图,更好地推动肿瘤免疫治疗快速、健康的发展。
