功能性免疫调节纳米载体用于协同增强肿瘤免疫治疗的研究进展
2022-10-14庄雅利高芸芬游欣如吴钧
庄雅利,高芸芬,游欣如,吴钧
(中山大学生物医学工程学院,广东 深圳,518107)
1 肿瘤免疫治疗
肿瘤是当今全球卫生面临的一个重大挑战。尽管手术、化疗及放疗等治疗手段在临床上的应用日趋成熟,但治疗效果不彻底,肿瘤易转移复发以及不良反应强等问题仍未得到解决,肿瘤治疗仍然是临床上面临的一大难题[1]。19世纪90年代,外科医生William Coley偶然发现病人在感染链球菌后肿瘤症状有所缓解,肿瘤免疫治疗的概念开始登上历史舞台[2]。其通过放大或恢复人体本身的自然免疫能力治疗肿瘤,与传统治疗方式相比,可针对不同的免疫反应环节设计对应治疗方案,在治疗的同时提高宿主免疫力、诱导长期免疫记忆效应、抑制肿瘤复发与转移,达到更理想的治疗效果[3]。经过几十年的发展,免疫疗法逐渐成为治疗肿瘤的有力手段。
1.1 免疫治疗原理——肿瘤免疫循环
Chen等[4]在2013年首次提出了肿瘤免疫循环的概念。简单地说,肿瘤免疫循环就是由T淋巴细胞介导的肿瘤免疫响应过程。肿瘤免疫循环过程分为T细胞开始响应的准备阶段和T细胞发挥杀伤作用的效应阶段。准备阶段主要发生在淋巴结,包括肿瘤细胞释放抗原、肿瘤抗原呈递、T细胞活化3个过程;效应阶段发生在肿瘤微环境(tumor microenvironment,TME)中,包括肿瘤抗原特异性T细胞的转运和浸润、T细胞识别肿瘤细胞和T细胞杀伤肿瘤,杀伤肿瘤细胞过程中会释放肿瘤相关抗原,开始下一次免疫循环(见图1)[4-6]。针对不同的免疫循环阶段可以设计不同的免疫调节纳米药物,用于不同的免疫治疗策略。这种基于肿瘤免疫循环的免疫疗法依靠患者自身的免疫系统激活肿瘤特异性免疫过程,充分发挥人体自身免疫系统的能动性,相比传统治疗方式更具优势[7]。到目前为止,已经有许多免疫疗法被美国FDA批准上市,更多免疫治疗策略也正在临床测试阶段[5,8]。
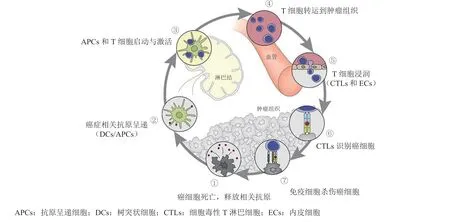
图1 肿瘤免疫循环过程示意图[9]Figure 1 Schematic diagram of tumor immune cycle
1.2 免疫治疗的发展与现状
针对肿瘤免疫循环的不同阶段,目前已经设计出了不同的免疫疗法,如肿瘤疫苗、免疫检查点阻断(immune checkpoint blockade,ICB)疗法、嵌合抗原受体T细胞免疫疗法、溶瘤病毒疗法、免疫原性细胞死亡(immunogenic cell death,ICD)疗法、过继细胞疗法和重塑肿瘤免疫微环境调节疗法等[8,10]。其中,ICB疗法为肿瘤治疗带来了新的希望。这一治疗方式通过施加免疫检查点通路抑制剂[如程序性死亡受体(programmed cell death protein 1,PD-1)抗体、细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)抗体 、细胞毒性T细胞相关蛋白-4(cytotoxic T lymphocyte associate protein-4,CTLA-4)抗体等] 恢复免疫细胞对病变肿瘤的监视和杀伤能力[11]。尽管近几年在这一方面的研究日渐火热,但临床数据表明ICB疗法并不是对所有肿瘤都有效果。即使有效,治疗效果也因人而异,这些都是ICB疗法不得不面对的难题[12]。肿瘤疫苗即通过抗原输送诱导人体自身的抗肿瘤免疫响应,刺激和扩大免疫系统T细胞反应来预防或者消除肿瘤细胞,是一种很有前途的肿瘤治疗方法。然而,全身毒性和低免疫原性是目前肿瘤疫苗不可避免的短板。另外,由于提供抗原的全长蛋白、肽片段、DNA质粒等材料生产成本相对高昂,肿瘤疫苗的发展也在一定程度上受到了限制[13]。ICD的概念在2005年引入,指肿瘤细胞在受到外界刺激发生死亡的同时由非免疫原性转变为免疫原性,进而介导机体产生抗肿瘤免疫应答的过程。该疗法通过调节ICD相关信号,加强ICD介导的免疫应答来达到治疗目的[14-15]。近年来已有许多研究报道了化放疗、光热治疗和光/声动力治疗对于调控ICD信号、启动ICD治疗的重要性。由于单一方法治疗难以实现肿瘤的根除,基于ICD原理的治疗方式可以允许多种疗法的联合,进一步强化机体对肿瘤的免疫反应,在治疗效果的提升上或有些许优势。总而言之,上述免疫疗法目前仍处于蓬勃发展阶段,在其真正迈入临床应用前,还需要在分子机制层面完成更系统全面的基础研究。
1.3 纳米药物与肿瘤免疫治疗的结合:功能性免疫调节纳米载体所带来的机遇
尽管近几年针对肿瘤免疫治疗的研究越来越多,由于TME的复杂性以及免疫抑制效应,基于免疫循环的肿瘤免疫疗法仍然存在药物递送效率和反应率不高、易出现难以控制的免疫相关不良反应等问题,限制了其在临床上的应用[6]。近年来,随着纳米技术的发展,越来越多的研究将纳米技术与肿瘤免疫治疗结合[16]。这种结合治疗的方式可以提供不少优势:首先,由于纳米材料的尺寸优势以及高渗透长滞留效应,基于纳米载体系统的免疫治疗可以靶向递送免疫药物、增加肿瘤组织内药物积累、限制药物对正常组织的暴露、降低全身免疫毒性。其次,大部分的免疫药物(抗原、抗体及小分子抑制剂)多为核酸蛋白类分子,具有不稳定性,借助纳米载体给药的方式可以防止这类免疫药物与体内各种酶相互作用而失效,有效提高药物的生物利用度,间接增强免疫疗效。最后,纳米载体的开发为多种免疫药物的高效、同时递送提供了可能性,这对于逆转免疫抑制效应导致的免疫应答不足至关重要[17]。以上种种优势证实了纳米药物与肿瘤免疫治疗结合的必要性。
目前,脂质体、聚合物、金属纳米粒子、多肽等各种有机和无机纳米材料已经在肿瘤免疫治疗中得到了应用[18-19]。关于纳米材料在肿瘤免疫治疗中的应用主要包括以下方面:抗原/佐剂的封装和递送、淋巴结引流、免疫相关细胞的摄取与靶向、人工抗原呈递等[3,18-20]。其中大部分纳米材料在肿瘤免疫治疗中都是充当惰性载体的作用,负责将药物或者抗原更高效地运送到肿瘤部位,但有些纳米材料本身表现出免疫调节特性,发挥载体功能的同时自身具有免疫调节作用,以“自我辅助”的形式参与肿瘤免疫治疗,相比于普通的载体来说,受到了更为广泛的关注[19,21]。本文将从设计原理出发,对这类免疫调节载体的应用进行重点介绍,总结这类载体在肿瘤免疫治疗中协同发挥免疫调节功能的最新研究进展,以期为更多治疗策略的开发提供参考。
2 功能性免疫调节纳米载体的设计原理与依据
在开发功能性免疫调节纳米载体时,研究者们需结合肿瘤免疫循环深入考虑针对“哪个”具体免疫步骤进行设计,“为什么”需要进一步增强这一阶段的免疫反应,以及载体材料“怎么”在其中发挥调节作用等关键问题[6]。本节根据免疫周期中简化的3个核心环节进行分类,详细阐述免疫调节基本原理,其中重点关注了各项原理中可用于设计功能性免疫调节纳米载体的一些细节,以为其协同增强肿瘤免疫提供重要理论支持及依据。
2.1 增强抗原释放与呈递
抗原的释放和呈递是启动细胞免疫的先决条件。从肿瘤抗原释放暴露,到DCs的捕获、迁移和成熟,以及最后的抗原加工并通过主要组织相容性复合体(major histocompatibility complex,MHC)分子呈递至未成熟T细胞,每个过程对于启动T细胞介导的免疫反应都至关重要[22]。因此,针对任一步骤设计开发自免疫活性纳米载体,对于增强免疫疗效来说,都是可行的。然而,由于抗原表达不足、抗原丢失和抗原调节下调,许多肿瘤的免疫原性较差[23]。因而绝大多数研究致力于肿瘤纳米疫苗的开发,“从源头上”诱导内源性肿瘤抗原的产生,或直接递送外源性肿瘤抗原,补充抗原数量,增强其“释放与呈递”[5,24]。
一些具有自佐剂特性的生物材料可以用于纳米疫苗的多样化设计。其中,介孔碳纳米球、二氧化硅纳米粒子及二维黑磷纳米片等无机载体是较为典型的例子[25-27]。它们具有高比表面积及自带免疫原性的特点,一方面可以高效负载抗原,增强DCs摄取;另一方面,载体自身还具有免疫活性,可促进DCs的成熟,减少由DCs功能失调而带来的抗原特异性免疫耐受。这一类无机纳米生物材料已成为设计纳米疫苗的优良候选材料。另外,具有类似特性的脂质样及多糖类材料也被证明可以通过Toll样受体(Toll-like receptor,TLR)信号或干扰素基因刺激因子(stimulator of interferon genes,STING)通路参与激活适应性免疫[28-29]。TLR信号通路中的重要受体主要包括TLR3和TLR4,它们通过含动物白细胞介素-1受体蛋白结构域的适配器发出信号,激活Ⅰ型干扰素(interferon,IFN)响应,启动免疫调节[30]。而STING通路则是由环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS)介导。在感知肿瘤DNA及特定激动剂的刺激后,该酶负责产生环鸟苷酸-腺苷酸(cyclic GMP-AMP,cGAMP)分子信使,随后催化DCs成熟并刺激肿瘤抗原与共刺激因子抗原分化簇8(cluster of differentiation 8,CD8)T细胞的交叉呈递,提高抗肿瘤免疫力[30]。直接在肿瘤部位启动TLR及STING通路可以显著增强免疫疗效,且不会引起全身性的副作用。因此,研究者们可基于上述原理,设计无需额外佐剂的自免疫调节纳米疫苗。通过特定靶向基团的修饰、尺寸及表面性质的控制,纳米疫苗可定向到达肿瘤部位,释放抗原,同时发挥自身免疫调节活性,以协同放大治疗效果。
除了直接递送外源性肿瘤抗原,通过诱导ICD等方式促进内源性自体抗原的产生,似乎更能唤起特异性的免疫应答,达到个性化治疗的目的[6]。一些过渡金属基材料被证实可以经ICD促进损伤相关分子模式(damage associated molecular patterns,DAMPs)的释放,包括钙网蛋白、高迁移率组盒1和三磷酸腺苷[31]。这些 DAMPs可以增强垂死癌细胞的抗原性,即诱导内源性肿瘤抗原生成,并有助于DCs的募集和成熟,从而改善抗原呈递。大量研究已证明了利用金属基材料制备纳米载体的可行性。进一步利用这类材料构建载体自身具有免疫调节活性的纳米药物,则有望为免疫治疗带来新的突破。
2.2 促进T细胞的启动和激活
作为获得性免疫的主力军,T细胞在肿瘤免疫治疗中扮演着不可或缺的角色,其免疫激活保证了下游免疫调节反应的正常进行。未成熟的T细胞主要依赖与APCs之间的抗原识别及共刺激信号来启动并激活成为效应T细胞,以参与肿瘤部位的特定免疫应答[4]。这一启动和活化过程还与众多氨基酸的代谢及细胞因子的分泌有关,理解它们间的联系对指导功能性免疫调节纳米载体的设计多有助益。
包括色氨酸(tryptophan,Trp)、精氨酸(arginine,Arg)、甲 硫 氨 酸(methionine,Met)、苯 丙 氨酸(phenylalanine,Phe)、半 胱 氨 酸(cysteine,Cys)、亮氨酸(leucine,Leu)在内的多种氨基酸均对维持T细胞的激活、增殖、分化起到关键作用[32-33]。例如,在炎性的肿瘤免疫微环境中,由于编码促进Trp和Arg的分解代谢的酶的基因高表达 [包括吲哚胺2,3双 加 氧 酶(indoleamine 2,3-dioxygenase,IDO),精氨酸酶1等],Trp和Arg的分解代谢会异常升高,将T细胞所需的这两种氨基酸转化为犬尿氨酸及L-鸟氨酸[32,34]。自此,T细胞对Trp和Arg的获取受限,促使核糖体激酶GCN2及雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号激活并刺激细胞功能的自由基重编程,最终导致其细胞周期停滞和自噬[32]。在这种情况下,T细胞难以正常增殖活化,肿瘤的免疫耐受也逐步形成,限制了免疫治疗疗效。若能基于氨基酸分解代谢原理去针对性地设计增强T细胞启动与激活的免疫治疗策略,将会大大提高治疗效果。迄今为止,已有大量研究设计了对应药物以及治疗方法。尤其是在Trp代谢方面,已经以IDO为靶点开发了几种不同的免疫调节抑制剂,如烷基化NLG919(aNLG)[35]、1-甲基色氨酸(1-methyltryptophan,1-MT)[36]等。现如今大部分的免疫治疗策略往往通过物理包裹、化学接枝等方法与纳米载体结合,靶向递送至肿瘤部位,抑制Trp分解代谢,催化必需的G1期T细胞的生长[35]。尽管在递送靶向Trp等氨基酸代谢的免疫调节抑制剂方面的研究多有报道,但鲜有人基于该类原理去设计对应的自免疫活性载体。以天然氨基酸为基本单元构建的聚合物纳米载体(如聚酯酰胺、聚氨基酸)或许可以在递送药物的同时,自身调节肿瘤原位的氨基酸代谢,协同APCs实现T细胞共活化和启动[37]。因此,在今后的研究中,可以进一步探讨氨基酸与肿瘤免疫的联系,并依此发掘更多的基于氨基酸的功能性免疫调节纳米材料。
另一方面,一些细胞因子及趋化因子,如白细胞介素-2(interleukin-2,IL-2)和IFN-α/β,在T细胞活化中也起着至关重要的作用[38-39]。它们充当着免疫激活“开关”的角色,确保T细胞可以启动最佳效应器功能,可持续存活,并形成反应性记忆群体[40]。其中,IFN-α可以通过增加具有效应器记忆表型的肿瘤特异性CD8+T细胞的数量,从而长期、持久地刺激抗肿瘤免疫反应[41];另一种主要T细胞生长因子IL-2,则通过其高亲和力IL-2受体的信号传导激活效应T细胞的扩增和优化免疫应答[42]。相当一部分纳米生物材料包括ZnO、脂质纳米颗粒等,已被证实可在生物体内有效促进细胞因子分泌,促进T细胞启动与激活[24,43]。依此设计的自免疫活性载体在增强肿瘤免疫治疗上也正逐渐成为备受瞩目的焦点。
2.3 促进细胞毒性T淋巴细胞的运输浸润/识别杀伤
肿瘤免疫循环以CTLs的运输浸润/识别杀伤过程收尾:激活后的CTLs经血液流动渗透至肿瘤部位,最后,根据T细胞抗原受体和MHC的相互作用,特异性识别肿瘤细胞并释放颗粒酶和穿孔素以执行杀伤功能[4]。在免疫抑制的TME中,诸多因素限制了这一过程的顺利进行。针对这些因素可以合理发掘功能性免疫调节纳米载体,在靶向运送免疫药物的同时协同增强治疗效果。
首先,实体瘤外围的物理屏障会在很大程度上阻碍CTLs的运输与浸润。肿瘤核心外围缺乏足够的血液灌注,难以将T细胞有效转运至内部发挥识别杀伤作用[6]。控制肿瘤血管正常化的生物材料或可用于开发纳米载体辅助增强免疫疗效。例如,一些结构中含有一氧化氮(NO)供体的高分子聚合物可在TME中提供具有调节血管生成并维持血管稳态的NO。当NO气体原位受控释放时,T细胞在肿瘤处的归巢得以改善,间接增加TME中T细胞数量,有利于免疫杀伤的进一步执行[44]。
其次,即使CTLs最终浸润至TME中,肿瘤细胞表面表达的PD-L1配体也会与PD-1受体结合,减弱T细胞活化,保护肿瘤细胞免受CTLs识别与杀伤[45]。针对PD-1/PD-L1的ICB是一种有前景的抗肿瘤免疫疗法。目前已开发出多种抑制剂(如帕博利珠单抗等)用于临床治疗[46],但在大多数情况下,抗PD-1/PD-L1治疗的持久反应率仍然相对较低。除了前文所述的CTLs浸润不足外,还与一些TME中免疫抑制细胞有关。调节性T细胞(Treg)和髓源性抑制细胞(myeloid derived suppressor cells,MDSCs)可以抑制由检查点抑制剂再生的抗肿瘤CTLs和辅助性T细胞(helper T cell,Th)如Th1和Th2反应[47]。此外,M2型巨噬细胞(tumor-associated macrophages,TAMs)可以通过表达T细胞免疫检查点配体(如PD-L1和PD-L2)直接或间接抑制T细胞功能[48-49]。它们不仅可以分泌转化生长因 子-β(transforming growth factor-β,TGF-β)等抑制性细胞因子,还可以持续招募Treg细胞,对抗由检查点抑制剂重新激活的免疫反应[50]。这启示研究者,设计增强ICB的治疗策略可以从增强CTLs浸润及调节免疫抑制细胞出发[51]。目前,可自身实现上述双重调节的纳米材料(如Fe3O4纳米粒子)已在抗肿瘤免疫中取得重大进展,相关研究仍在不断完善[52]。
3 功能性免疫调节纳米载体在协同增强免疫治 疗中的应用
肿瘤免疫循环的3大核心环节是设计功能性自免疫活性纳米载体的坚实理论基础。近年来,一系列具有内在免疫调节特性的纳米载体陆续诞生,为肿瘤免疫治疗带来了新突破。本节以这些载体的材料类型进行分类(有机与无机),系统性介绍功能性免疫调节纳米载体在协同增强免疫治疗中的具体应用,以期对更多治疗策略的开发提供指导和建议(见图2)。
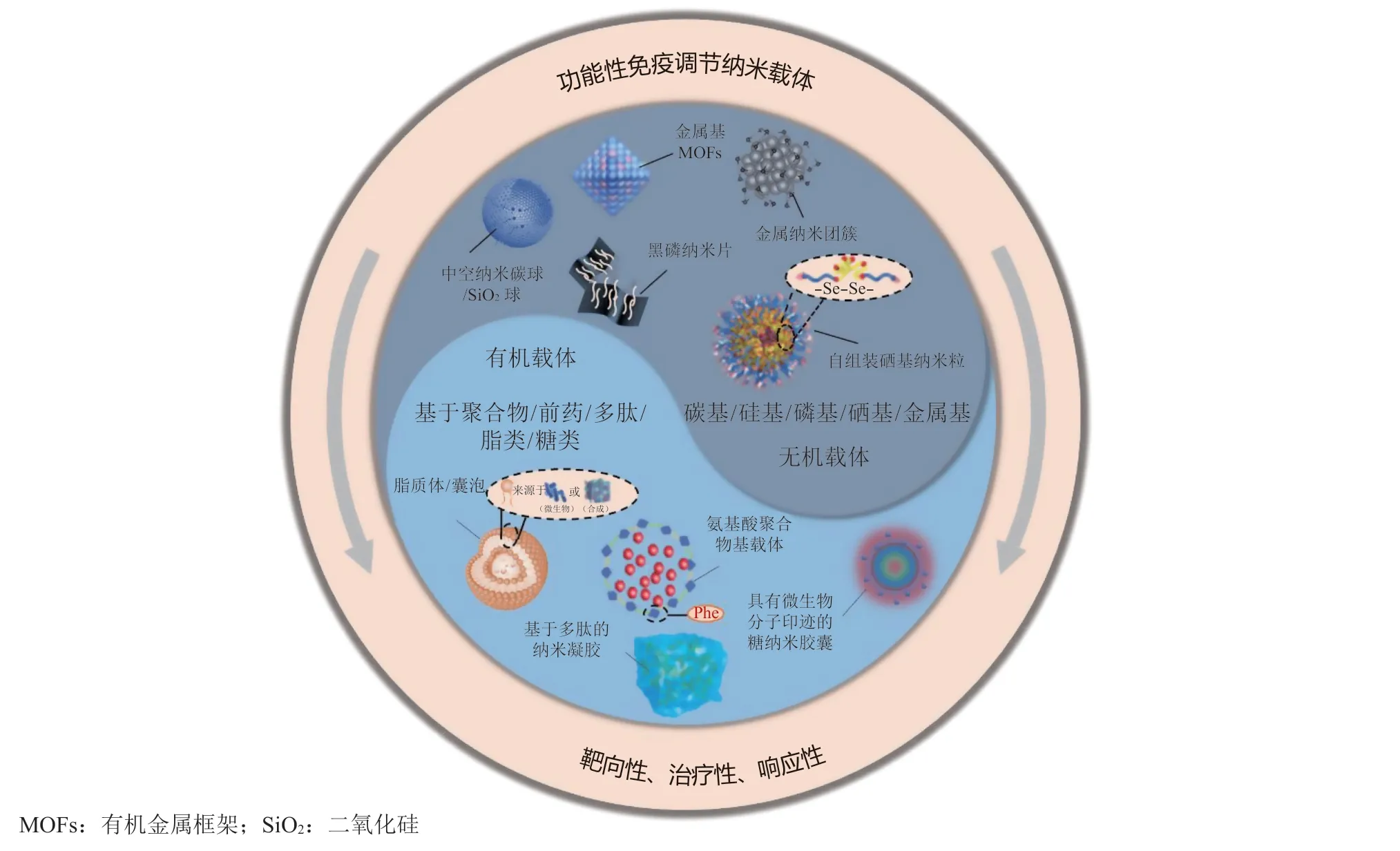
图2 功能性免疫调节载体的分类、形式与特点概述图Figure 2 Overview diagram of the classification, forms and characteristics of functional immunomodulatory nanocarriers
3.1 无机纳米载体
功能性免疫调节无机纳米载体可以分为碳基、硅基、磷基、硒基以及其他金属基无机纳米载体。与以往所理解的“无机即惰性”不同,它们也具有固有的免疫原性特征(大小、形状和化学性质等),可以作为疫苗和免疫疗法的反应载体,或用于改变体内的免疫细胞功能[20]。尽管相关免疫调节机制仍未研究得十分透彻,但近几年基于功能性免疫调节无机纳米载体的免疫治疗策略在肿瘤治疗领域引起了广泛的关注,更多研究也在不断涌现。
3.1.1 碳基作为研究最早的免疫治疗疫苗载体之一,碳基纳米颗粒已被证实可用于抗原蛋白的定向递送,同时,其自身还可作为有效的佐剂,提高抗原摄取并加速DCs的成熟,以进一步优化免疫应答[53]。
Jambhrunkar等[27]于2017年便报道了关于自佐剂中空碳球纳米疫苗的研究。他们使用外表完整但具有内陷结构的中空纳米碳球(invaginated mesostructured hollow carbon spheres,IMHCSs)递 送模式抗原卵清蛋白(ovalbumin,OVA),这一设计相比于其他的碳基免疫复合物(如碳纳米管复合免疫蛋白)来说可引发更高水平的免疫应答。一方面,免疫刺激的提升归因于碳基纳米载体形式的优化:其迷走型孔道赋予了自身高比表面积特性,可以高效装载蛋白质抗原,实现免疫蛋白的更佳递送。另一方面,IMHCSs也在促脾细胞成熟方面提供了优势:通过激活APCs表面表达的共刺激分子(CD40,MHCⅡ),IMHCSs-OVA可有效促进DCs和巨噬细胞的成熟,因而Th2极化的免疫反应得到了进一步优化提升。尽管这一研究尚未深入到具体的疾病治疗应用,但其显示了碳基纳米材料自身在免疫调节中发挥的重要辅助作用。在此基础上,2018年发表的另一项研究则将功能性免疫调节碳纳米材料的应用推进至肿瘤治疗领域,Luo等[54]将光致发光碳点与OVA结合时,观察到碳点作为佐剂可以有效提升OVA促脾细胞增殖,并促进TNF-α和IFN-γ等因子的分泌,同时,在体内,这一纳米体系可显著抑制小鼠B16-OVA黑色素瘤的生长。作为碳点用于肿瘤抑制疫苗自佐剂载体的首次报道,这项工作为其在肿瘤免疫治疗和其他潜在临床应用方面的实践开辟了许多可能性。
3.1.2 硅基类似地,硅基纳米颗粒也被认为是构建具有自身免疫调节功能的纳米疫苗的有前途的载体之一。它们可以改善体内Th1和Th2细胞因子的分泌,通过增加CD4+和CD8+效应记忆T细胞群,显著增强抗肿瘤免疫效应[55]。Liu等[25]设计了一种聚乙烯亚胺(polyethyleneimine,PEI)杂化的薄层中空介孔二氧化硅纳米颗粒(thin-shell hollow mesoporous silica nanoparticles,THMSNs),可作为自佐剂纳米疫苗的有效载体。其超薄的壳层结构为黑色素瘤抗原肽Trp2的高效负载腾出了更多空间,同时,PEI的表面修饰可以大大提升DCs对纳米颗粒的吸收效率,进一步促进抗原交叉呈递。实验结果证明,基于THMSNs的纳米疫苗可在体内产生强大的Th1免疫力以及持续的免疫记忆,最终对肿瘤的生长和转移都起到显著的抑制作用,因而THMSNs被认为是形成肿瘤疫苗的重要的、有前景的载体和佐剂。
3.1.3 磷基磷基纳米平台具有许多有利的免疫特性,包括促炎性细胞因子分泌(如TNF-α)、通过钙流入极化巨噬细胞等,已在辅助免疫调节方面显示出了优异的适用性[56-57]。其中,含高比表面积的二维黑磷纳米片(black phosphorus,BPs)应用较广。其大而宽的平面为免疫药物的结合提供了充足的锚定位点,同时自身具有光热效应,可诱导ICD产生内部肿瘤抗原,增强局部免疫,因而以BPs为载体和助剂的免疫治疗策略在增强疗效方面有巨大的前景[58]。由Li等[26]开发的OVA抗原表位包覆的BPs(FKF-OVA@BPs)便是磷基自免疫纳米平台的代表性例子。苯丙氨酸-赖氨酸-苯丙氨酸(FKF)的三肽修饰使得OVA能更有力地结合在BPs的二维平面上,达到抗原有效片段高负载的目的。另外,BPs的近红外光热效应可以产生温和的局部热量,最终改善全身性T细胞增殖反应。当与ICB疗法相结合时,FKF-OVA@BPs可以在黑色素瘤小鼠模型中诱导积极的免疫保护作用,产生强大的协同疗效。这一研究也为利用磷基纳米助剂整合免疫活性和光热效应以增强肿瘤免疫治疗提供了新的见解。
3.1.4 硒基其他无机材料往往直接启动T细胞免疫直接调控抗肿瘤免疫反应。与此不同的是,含硒纳米颗粒则是通过在TME中响应特定刺激[如活性氧(reactive oxygen species,ROS)和辐射]而原位氧化产生硒酸来间接调控自然杀伤(natural killer,NK)细胞介导的免疫反应。目前,硒酸已被报道可以阻碍多种类型肿瘤的细胞表面HLA-E(一种抑制性配体,可与NK细胞表面NKG2A受体结合而抑制免疫)的表达,从而激活NK细胞免疫活性,启动先天性免疫应答[59]。这一发现也奠定了含硒纳米载体用于增强免疫治疗的可行性。由于特定的治疗方式(如放疗、化疗)可以提供相应的高ROS或电离辐射以激活含硒纳米颗粒产生硒酸,启动免疫调节,硒基材料载体可通过协同多重疗法展现其优良的抗肿瘤潜力。例如,Gao等[60]首次提出了一种涵盖三重化学-放射免疫疗法的含硒纳米胶束治疗平台(PSeR/Dox)。该平台包含了1个辐射敏感的含二硒醚的聚合物骨架、肿瘤靶向多肽修饰的聚乙二醇(PEG-RGD)和化疗药物阿霉素(doxorubicin,Dox)。其中,含二硒醚的聚合物骨架易于响应放疗提供的电离辐射而氧化二硒键,裂解产生硒酸。这一过程不仅促进了Dox在肿瘤细胞核处的定向释放,提升化疗效率,还可以催化产生DAMPs调控肿瘤相关抗原,提高肿瘤对CTLs所介导的免疫治疗的敏感性。结合硒酸的NK细胞免疫疗法,含硒纳米胶束平台PSeR/Dox可对多种肿瘤模型提供“1+1+1>3”的协同增强疗效。
3.1.5 金属基自从80多年前铝佐剂在疫苗制备上被首次应用,越来越多其他的金属基材料的免疫调节功能被慢慢发掘出来。这类以锌基、铁基材料等为代表的免疫活性金属材料以其易于制备、性能可调的优势受到认可,是作为功能性免疫调节纳米载体的不二选择。这些基于金属的免疫调节纳米平台其具体细节归纳如表1所示。
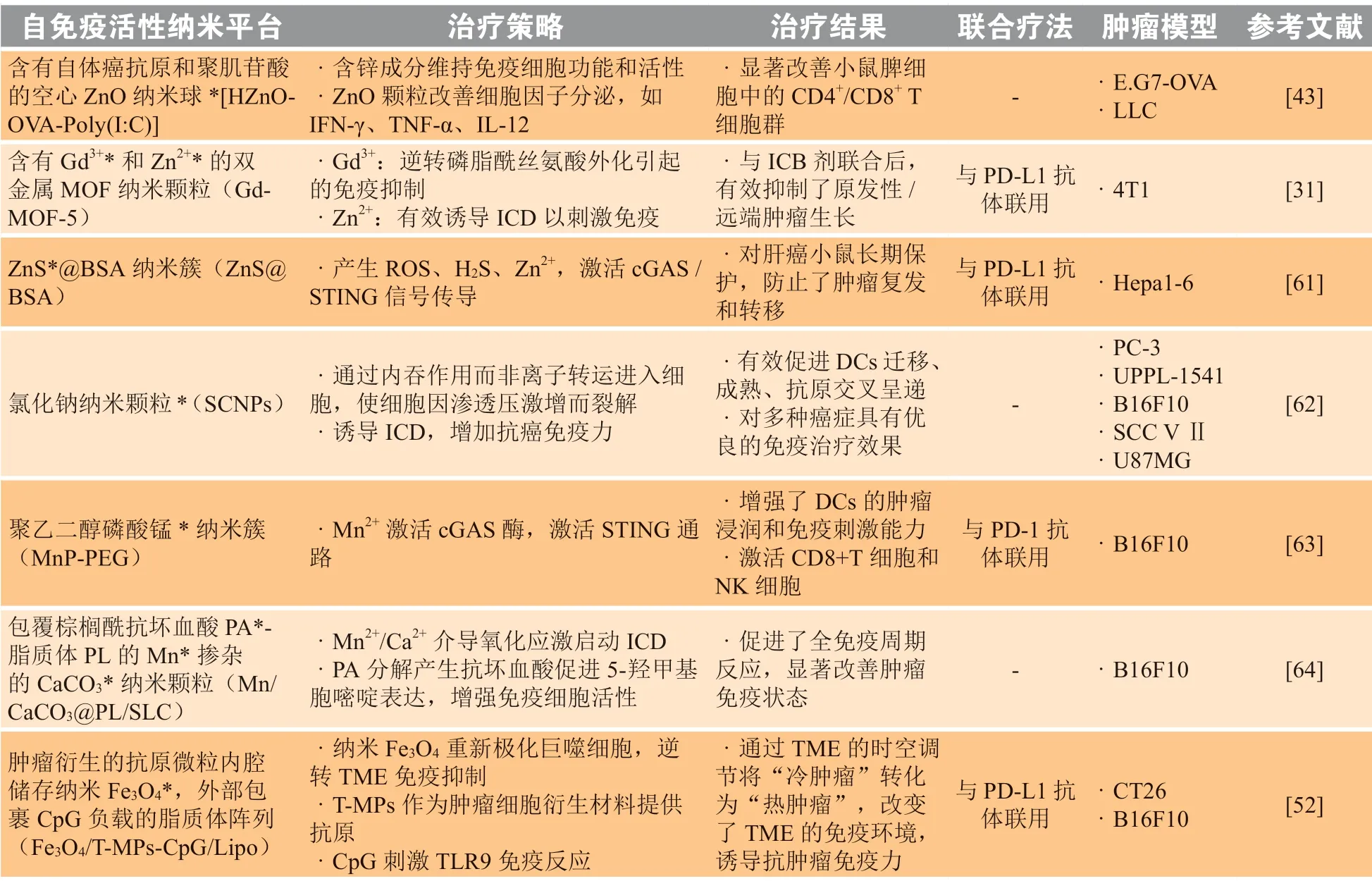
表1 基于无机金属功能性免疫调节纳米平台的免疫治疗策略实例Table 1 Examples of immunotherapeutic strategies based on inorganic metal-functional immunomodulatory nanoplatforms
3.2 有机纳米载体
与无机纳米载体相比,应用于免疫调节的有机纳米载体的种类更为丰富,它们也受到了更为广泛的研究与关注。这类可实现自我辅助功能的免疫活性有机纳米载体相比前者可能更具优势: 1)它们来源广泛,许多天然的脂质、糖类均具备免疫刺激功能,易于提取并用于免疫调节载体的制备; 2)它们可以被更灵活的设计和多功能化修饰以满足免疫需求,例如合成高分子聚合物、小分子合成前药均可以通过对合成单元和前药元素的合理选择去设计成针对特定靶点的免疫药物。
3.2.1 聚合物聚合物载体以其制备简单、易于功能修饰、性能灵活(可通过合成单元调控结构进而影响性能)等特点在肿瘤免疫乃至其他领域都显示出了重要的应用价值[65]。依照来源分类,目前已有两种聚合物载体被报道用于构建自免疫型的纳米药物平台:基于天然聚合物的纳米载体以及基于合成高分子的纳米载体。本部分主要举例一些合成聚合物免疫活性载体的应用。
TL:Chinese Proverb-an outwardly attractive but worthless person
氨基酸的自佐剂性能已在一些肽疫苗的使用中得以发现[66]。如上文所述,氨基酸代谢对于调节免疫反应和塑造TME影响重大。因而由氨基酸构建的肿瘤免疫治疗纳米平台或许能产生意想不到的治疗效果。例如,Li等[67]开发了一种基于L-苯丙氨酸(L-phenylalanine,L-Phe)的负载Dox的代谢重编程和免疫监视激活纳米药物(doxorubicin-loaded metabolic reprogramming and immunosurveillance activating nanomedicine,MRIAN-Dox),他 们 通 过二羧酸基单体和L-Phe单体缩聚合成聚酯酰胺,并包载化疗药物Dox,为血液系统恶性肿瘤提供了新的治疗方法:一方面,MRIAN-Dox可以专门靶向小鼠T细胞急性淋巴细胞性白血病(T-cell acute lymphoblastic leukaemia,T-ALL)模型中的病变细胞,提供化疗药物;另一方面,MRIAN降解为L-Phe以重新编程MDSCs的能量代谢,这驱动它们向正常骨髓细胞的分化,并解除其免疫抑制功能以加强T-ALL中的免疫监视,为T-ALL的成功治疗提供双重保障(见图3)。在此之后,Xu等[37]也开发了一种治疗急性髓系白血病(acute myeloid leukemia,AML)的自组装亮氨酸聚合物,以用于负载Dox形成Leu-Dox。它通过释放Leu,激活了mTOR并且抑制AML细胞中的自噬,使白血病干细胞对化疗更加敏感。与上述MRIAN-Dox策略类似,这一基于Leu-Dox的策略在白血病的治疗上同样具有革命性意义。
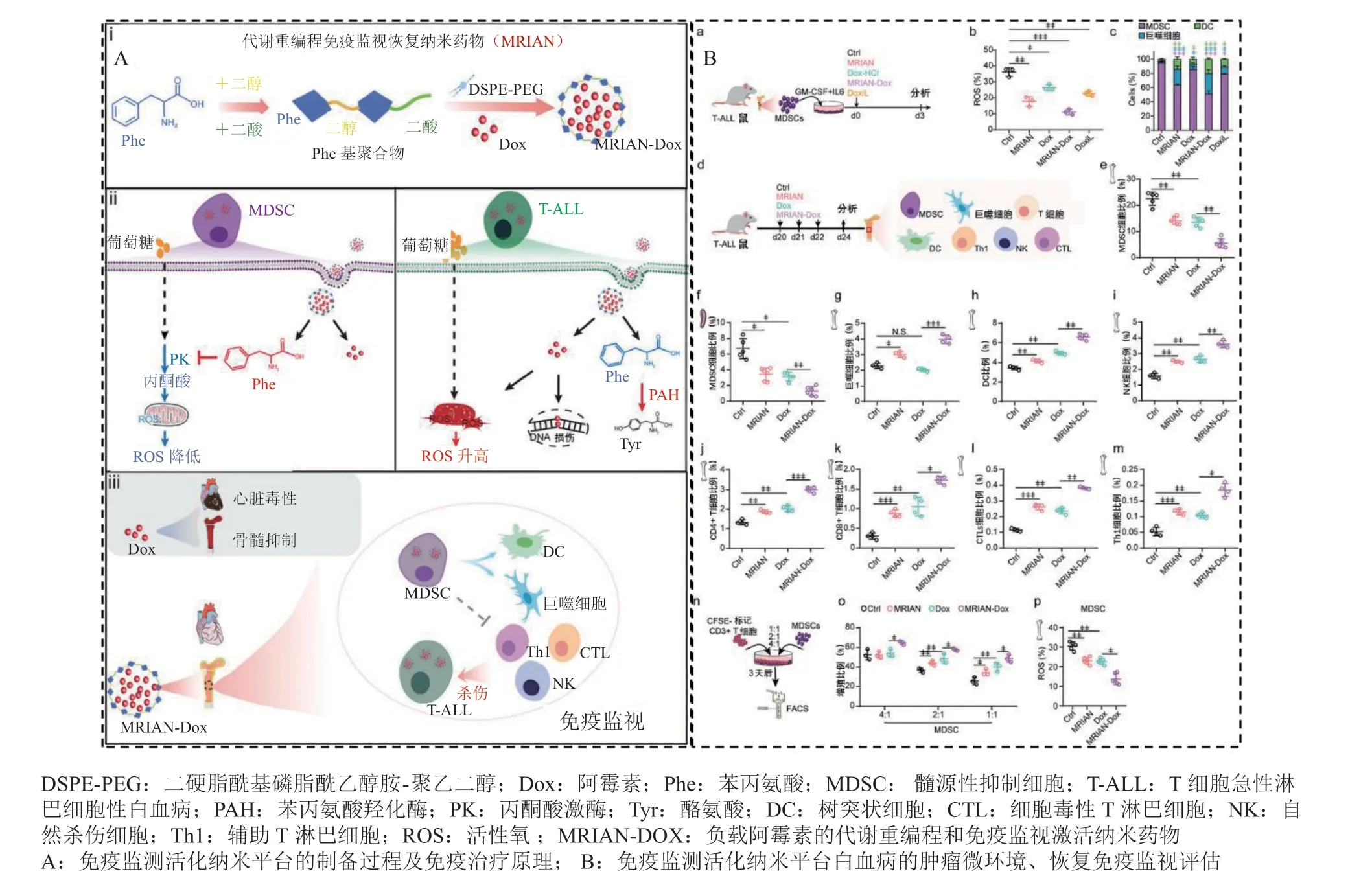
图3 代谢重编程免疫监视恢复纳米药物的设计及其抗肿瘤免疫疗效[67]Figure 3 The design and antitumor efficacy of metabolic reprogramming and immunosurveillance activating nanomedicine
作为携带七元环状叔胺结构的pH敏感聚合物,PC7A是另一种常用于自我辅助免疫治疗的可靠材料。它通过聚合物自身诱导的STING途径,激活先天免疫应答,促进如干扰素调节因子7(interferon regulatory factor 7,IRF 7)、C-X-C基序趋化因子10(CXC chemokine ligand-10,CXCL10)等多种免疫因子表达[68-69]。德克萨斯大学西南医学中心高教授课题组首次将这类具有免疫激活特性的聚合物筛选出来,并命名为PC7A。通过以PC7A为载体,他们成功制备了肿瘤抗原包裹的自组装纳米疫苗,实现了对黑色素瘤及结直肠癌的高效免疫治疗[70]。这一重大发现也为日后PC7A在免疫治疗方面的更多应用铺平了道路。
NO是免疫调节过程中的重要信号转导生物分子[71]。一些含有NO供体的聚合物纳米载体,可在肿瘤部位响应刺激而受控释放NO,扮演间接调控肿瘤免疫的角色。Jiang等[72]设计制备了这样一种多硝化聚酯NO纳米发电机(NanoNO)。在肿瘤位置的高谷胱甘肽作用下,NO大量富集于TME,触发了有效的ICD反应。随后,免疫活性的NO可以有效调节抑制性微环境,支持了抗肿瘤免疫。这一例子为气体治疗型免疫活性载体的应用提供了有力佐证。
3.2.2 小分子合成前药一些小分子免疫调节剂(如ICD诱导药物、抗体或其他通路抑制剂)的分子结构中存在着易于反应的活性基团。基于小分子合成手段,上述不同免疫调节剂有望通过化学修饰、共价连接的方式整合成为单一的免疫活性前药载体,以实现增强的免疫疗法[73-74]。例如,Zhou等[75]开发了一种极简的功能性双前药免疫调节纳米平台,其中,吉西他滨(gemcitabine,GEM)和1-MT被设计为双前药分子(GEM-1-MT),可自组装成“自载体”GEM-1-MT纳米粒子用于肿瘤化学免疫治疗。该双前药纳米体系到达肿瘤部位后可充分发挥“一石四鸟”的作用:一方面,释放的GEM能杀死肿瘤细胞触发ICD 并诱导选择性 MDSCs消耗 ;另一方面,释放的1-MT还同时导致肿瘤细胞、MDSCs的双重IDO抑制,缓解了免疫抑制,增强了化学免疫疗法的整体治疗效果。总体而言,这一双前药免疫调节纳米药物唤醒并增强了机体内在的免疫治疗能力,为用于协同增强抗肿瘤免疫的极简纳米平台的设计提供了新的概念。
3.2.3 多肽由有限数量氨基酸残基组成的多肽已被广泛用作制备肿瘤疫苗的生物材料。它具有易于合成、可自组装等特点,在构建为自免疫活性纳米平台时可通过自身抗原性诱导强烈的T细胞反应,实现肿瘤免疫治疗[76]。超分子共组装是生产这类“自我免疫”肽疫苗的简单方法。Su等[77]就采用了这种方式开发了对应的含有抗原表位偶联肽纳米纤维水凝胶疫苗平台。皮下接种后,该共组装肽疫苗可以激活DCs中的核转录因子(nuclear transcription factor-κB,NF-κB)信号通路来引发T细胞免疫,而不会诱导局部炎症反应,具有较好的治疗效果。但是,这种递送单个外源性肽抗原的治疗方式无法引发更为全面、强大的免疫应答,肿瘤转移和复发的概率仍旧较高,造成了其应用的局限性。可原位提供全细胞肿瘤抗原的疫苗平台也因此在免疫治疗方面更胜一筹。Yu等[78]利用蜂毒肽、脂质材料开发了一种靶向淋巴结的全细胞抗原纳米疫苗。相比于前者而言,它可以有效引发全身性的抗肿瘤免疫反应,达到治疗目的。在他们的设计中,蜂毒肽美利汀(α-melittin)是促进肿瘤全细胞抗原释放的关键成分。作为一种阳离子宿主防御肽,它具有多种免疫调节作用,可以通过破坏细胞膜来诱导肿瘤坏死或细胞凋亡,使细胞内容物如全肿瘤抗原和损伤相关分子模式爆发性原位释放,以最大化启动疫苗的免疫反应。经实验验证,使用α-melittin纳米疫苗治疗的小鼠原发性肿瘤大小减少了95%,肿瘤抑制率达到70%,同时,远端肿瘤大小也减少了92%,并且也具有50%的抑制率。这一策略也为基于多肽的自身免疫调节纳米平台的设计提供了新的思路。
3.2.4 脂质自1964年脂质体的问世到1995年首个基于脂质的纳米药物(聚乙二醇化的阿霉素脂质体Doxil)获得美国FDA的批准以来,脂质纳米颗粒在肿瘤治疗方面的应用已被广泛发掘[79]。它是该领域研究得最为成熟的材料之一,凭借其毒性低、带电性质可控、结构类膜等特性,适宜作为通用的载体递送化疗药物、免疫蛋白、RNA等多种治疗物质。近年来,一些研究阐明了脂质在肿瘤免疫调节信号转导方面的重要作用[80],自此,越来越多基于脂质的免疫调节纳米载体被开发,以用于解决当前免疫疗法的局限性,进一步增强疗效。
以脂质及其衍生物去搭建疫苗载体是最常见的一种自免疫调节肿瘤治疗策略。无论是抗原肽连接的脂质类似物、抑或是碳水化合物抗原连接的脂质衍生物,都已被证实可以作为合适的自佐剂疫苗,促进抗原呈递,启动特异性CD8+T细胞免疫[81]。然而,这种基于抗原偶联物的脂类疫苗的合成可能既昂贵又耗时。使用可以快速简单合成的脂类mRNA疫苗来代替前者或能解决这一难题。Miao等[28]就巧妙地通过三维组分反应系统,短时间内一步合成了1000多种可用于mRNA疫苗的脂质制剂。经过筛选后,他们确认了具有环状胺基基团的脂质材料(A2-Iso5-2DC18,A2)可以在小鼠模型中更有效地输运mRNA,同时激活STING通路以刺激免疫,是作为制备肿瘤疫苗的首选结构。这一研究为基于脂质的免疫活性mRNA疫苗载体开发提供了杰出的先例。在此以后,Zhang等[24]也基于类似的阳离子脂质样材料C1,开发了一种极简的自免疫活性纳米疫苗。通过有效地递送mRNA至APCs,并发挥脂质载体自身的TLR4受体激活特性,接种有该疫苗的荷瘤小鼠体内均可以产生强大的T细胞活化反应。以上两种涉及免疫调节活性的合成脂质应用实例,均为协同增强免疫疗效提供了可行的方法。
免疫细胞衍生的纳米脂质囊泡(如M1巨噬细胞或NK细胞来源纳米囊泡)表面具有丰富的可与肿瘤免疫微环境相互作用的受体和配体,可有效改善微环境免疫抑制效应,也被用于肿瘤免疫治疗[85]。例如,Hong等[86]设计了一种T细胞来源的纳米囊泡(T cell-derived nanovesicles,TCNVs),它由CTLs通过具有微/纳米孔的膜连续挤压所产生,能够抑制T细胞衰竭并在免疫抑制TME中保持抗肿瘤活性。通过该囊泡表面编程的PD-1受体和TGF-β受体,能够阻断癌细胞上的PD-L1,清除免疫抑制TME中的TGF-β,从而防止CTLs衰竭。基于该自免疫活性的TCNVs治疗是克服肿瘤免疫抑制机制的新型有效的治疗策略。
3.2.5 糖类一些具有特殊重复碳水化合物单元的微生物来源多糖大分子往往也具有有效的免疫刺激能力。它们包括甘露聚糖、葡聚糖及其衍生物,已被报道可与各种模式识别受体[如C型凝集素、TLR、凝集素样甘露糖受体(CD206)]相互作用,促进DCs的强激活[87-88]。因此,基于糖类的免疫活性载体在肿瘤疫苗的制备上正崭露头角,它们可以被设计成胶囊、水凝胶等各种形式,在递送抗原的同时发挥自身免疫特性[89-90]。Son等[29]制备的基于双重微生物多糖的免疫原性纳米胶囊就是mRNA疫苗递送方面的典型应用实例。他们使用PEI包被的SiO2纳米颗粒作为牺牲模板,通过与mRNA及多糖分子的简单先后孵育,以及对模板的去除,最终可以得到尺寸在200 nm左右的空心糖胶囊疫苗。利用自身尺寸效应,纳米粒子可以有效传递至淋巴并积累,实现DCs激活,诱发强大的抗肿瘤免疫反应。这一利用病原体来源多糖构建免疫刺激材料的独特策略或将成为未来研究的方向之一。
4 结语与展望
与纳米技术结合的肿瘤免疫治疗在生物医学领域已经掀起了革命性的浪潮。较传统免疫治疗而言,纳米载体不仅可以发挥靶向递药、响应释药的功能,还可以通过合适的材料选择、合理的结构设计在肿瘤原位启动固有免疫调节,提高原有的治疗功效。这种基于功能性免疫调节纳米载体的治疗策略将引起越来越多的关注。为了进一步推进其临床转化,日后在研究过程中还应特别关注以下几点。1)免疫活性纳米载体的安全性、有效性须得到进一步评价。尽管在现有的研究中,这类载体在细胞及动物层面的安全性被初步证实,但部分材料的使用还是可能会给人体带来潜在的危害。例如,未经纯化和修饰的微生物来源材料(如来源于细菌的脂多糖)在人体内可能会引起严重的感染,或导致过度免疫而引发全身性的不良反应[91]。因此,在临床应用前,应建立更系统的方式全面评价这类载体的安全性,为治疗提供保障。2)针对单一靶点设计的活性载体免疫疗效往往不足,需联合使用多种手段,以进一步提高疗效。复杂而多变的TME为多种免疫抑制细胞的活动及免疫抑制因子的分泌提供场所,导致部分肿瘤存在着免疫不敏感的特性,也被称之为“冷肿瘤”。联合多种疗法如放疗、光动力疗法、光热疗法的免疫治疗策略有望增强“冷肿瘤”的免疫原性,将其转化为“热肿瘤”,实现更好的治疗效果[10]。因此,未来基于免疫活性载体的肿瘤治疗策略也应考虑多手段联用。3)仍有多个基于肿瘤免疫循环的调控途径未被开发为对应的自免疫活性载体治疗策略,例如Trp分解代谢,仅有特定的小分子抑制剂(如1-MT)被开发且使用,未来可期待这些创新策略的诞生,以提供多元化的肿瘤治疗方案。
基于功能性免疫调节纳米载体的治疗策略有望在肿瘤免疫治疗方面得到进一步应用,这需要不同领域研究人员的共同努力。随着研究继续深入,期待功能性免疫调节纳米载体未来进一步向临床的转化。
