肺炎克雷伯菌ATCC700603裂解性噬菌体的分离鉴定和基因组学研究
2022-10-14刘兰刘潺加明明万璐吴小军
刘兰 刘潺 加明明 万璐 吴小军
(武汉大学人民医院呼吸与危重症医学科,武汉 430060)
肺炎克雷伯菌(Klebsiella pneumoniae)是常见的机会性病原体,会引起肺炎、尿路感染、以及严重的血流感染[1]。常规的治疗方式是采用碳青霉烯类抗生素,例如亚胺培南、美罗培南等,但是随着抗生素的滥用和耐药性的扩散,耐碳青霉烯的肺炎克雷伯菌已经在全球广泛分布,部分菌株甚至具有多重耐药性[2-4]。因此,寻求抗生素以外的细菌病治疗方式是当务之急。
噬菌体是特异性侵染细菌的病毒,且广泛存在于自然界,是细菌的“天敌”。与抗生素相比,噬菌体具有研发快、特异性强、避免杀灭人体益生菌群以及对人体毒性低等优势,因此面对多重耐药菌的威胁,噬菌体疗法的研究和应用已经成为当今的热点,具有良好的发展前景[5]。
本研究以具有β-内酰胺类抗生素抗性,产SHV-18型ESBLs的标准菌株肺炎克雷伯菌K.pneumoniaeATCC700603[6]为宿主菌,从某医院的污水中分离鉴定出了一株裂解性噬菌体,命名为P1,并对其裂解谱,最佳感染复数和热稳定性等生物学特性和基因组信息进行了研究和分析,确定P1为一株全新发现的噬菌体。
1 材料与方法
1.1 菌株来源
宿主菌K.pneumoniaeATCC700603,实验用菌株Escherichia coliMG1655,Staphylococcus aureusRN4220和Pseudomonas aeruginosaPAO1均为实验室存储。临床菌株K.pneumoniae2-21来源于武汉大学人民医院医学检验中心,从血流感染患者感染血液分离而来;裂解性噬菌体分离自武汉大学人民医院附近的污水。所有K.pneumoniae菌株均在添加了100 μg/mL 氨苄西林的Luria-Bertani (LB)培养基中37℃过夜震荡培养,其它菌株在不添加抗生素的LB培养基中37℃过夜震荡培养。
1.2 噬菌体的分离纯化和收集
该步骤全部采用双层平板法。将过夜培养的K.pneumoniaeATCC700603菌液、0.22 μm滤膜过滤后的医院污水和3×LB培养基等体积混合,37℃震荡培养过夜。离心、0.22 μm滤膜过滤培养液上清后保留滤液。
制备LB固体下层平板(1.5%琼脂),在半固体LB培养基(0.7%琼脂)中混合20 μL过夜培养的K.pneumoniaeATCC700603菌液和10 μL培养液滤液后平铺为上层平板。37℃培养过夜后可看到宿主菌背景之上的透明圆形噬菌斑。
挑取单噬菌斑悬浮于SM buffer (NaCl,MgSO4,Tris-HCl pH7.5,2%glutin) 后再次与K.pneumoniaeATCC700603菌液混合制备双层平板以进行进一步纯化,进行3轮“挑取噬菌斑-悬浮-铺双层LB平板”的循环。
收集噬菌体前,在上层平板滴加3~4 mL SM buffer,室温下孵育2 h。轻刮下含噬菌斑的上层半固体平板,在SM buffer中捣碎。4℃,5000 r/min离心30 min后收集上清,用0.22 μm无菌滤器过滤上清,收集滤液并保存。
1.3 噬菌体裂解谱分析
分别以肺炎克雷伯菌临床菌株K.pneumoniae2-21、大肠埃希菌E.coliMG1655、金黄色葡萄球菌S.aureusRN4220以及铜绿假单胞菌P.aeruginosaPAO1的稳定期菌液作为宿主,与P1混合后利用双层平板法测试P1的裂解谱,观察是否有噬菌斑产生。有噬菌斑出现视为有裂解性,无噬菌斑视为无裂解性。
1.4 最佳感染复数(multiplicity of infection,MOI)测试
参照文献[7]进行,噬菌体与宿主菌的比值(MOI) 分别为0.01、0.1、1、10和100混合后用双层平板培养过夜,计噬菌体PFU,得到噬菌体滴度最高的MOI即为最佳感染复数。
1.5 噬菌体热稳定性试验
分别在室温(room temperature,RT)、40℃、50℃、60℃、70℃和80℃条件下处理噬菌体并开始计时,分别在20、40和60 min取样,用双层平板法计算噬菌体滴度。
1.6 噬菌体形态的电镜观察
将封口膜平铺于冰盒上冷却,将20 μL噬菌体原液滴在封口膜上,将铜网浸入噬菌体原液中,15 min后用滤纸吸除铜网上多余的液体,滴加适量的2%磷钨酸(PTA)溶液,染色10 min后用滤纸吸干,放置于滤纸上,在阴凉处自然干燥后使用透射电子显微镜进行观察。并按照国际病毒分类委员会(ICTV)第九次病毒分类报告,对噬菌体形态进行鉴定和分类。
1.7 噬菌体基因组提取、测序和生物信息学分析
将噬菌体P1与宿主菌共培养以进行噬菌体的扩增,5000 r/min离心30 min后取上清,用0.22 μm无菌滤器过滤,保留滤液。加入DNaes I(1 μg/mL)在37℃下消化4 h,以降解宿主DNA。加入0.5 mol/L EDTA,65℃放置30 min以失活DNase I。冷却至室温后加入蛋白酶K(50 μg/mL),在56℃孵育1 h以裂解噬菌体蛋白衣壳。进行酚氯仿抽提步骤以除去蛋白,保留DNA。得到的DNA进行琼脂糖凝胶电泳以检测是否降解,同时用宿主基因组匹配引物对得到的产物进行PCR以检测噬菌体基因组污染情况。
DNA文库构建使用Vazyme公司的TruePrep Index Kit V3 for Illumina进行,具体操作参照产品说明,用Qubit蛋白核酸定量仪对DNA文库样品量进行检测。使用Illumina平台X-ten进行测序,二代测序由安诺优达基因科技(北京)有限公司完成。测序结果的分析分别使用FastqC (https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)和Trim galore (https://www.encodeproject.org/software/trim_galore/)进行质控和低质量reads去除;分别使用megahit (http://www.l3-bioinfo.com/products/megahit.html)[8]和RAST (http://rast.nmpdr.org/)[9]进行基因组组装和注释,基因组数据已提交至NCBI,获取序列号MZ598515。使用NCBI在线BLAST功能进行同源序列比对,应用MEGA-X software(https://www.megasoftware.net/)[10]构建进化树。
2 结果
2.1 噬菌体的分离鉴定
本研究以肺炎克雷伯菌ATCC700603为宿主菌,经过双层平板法多次纯化后,从污水中分离到一株裂解性噬菌体,命名为P1,P1拥有直径为2~5 mm的噬菌斑,有明显的晕环(图1)。
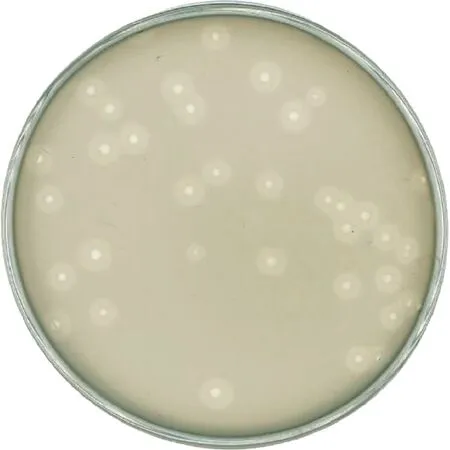
图1 噬菌体P1形成的噬菌斑Fig.1 Plaque of P1
2.2 裂解谱
P1无法裂解肺炎克雷伯菌临床菌株K.pneumoniae2-21、大肠埃希菌E.coliMG1655、金黄色葡萄球菌S.aureusRN4220以及铜绿假单胞菌P.aeruginosaPAO1,说明P1具有强特异性(图2和表1)。

表1 噬菌体P1裂解谱Tab.1 The host range of phage P1

图2 噬菌体P1裂解谱测试Fig.2 Test of lysis range of P1
2.3 噬菌体生物学性质的测定
本研究得知噬菌体P1在MOI=10时达到最高滴度,即最佳感染复数(MOI)为10(表2)。

表2 噬菌体P1的最佳感染复数(MOI)测定Tab.2 Determination of optimal multiplicity of infection (MOI)of P1
本研究测试了噬菌体P1在不同温度下的稳定性,结果表明P1耐受50℃及以下温度,在60℃及以上温度处理下稳定性明显降低,在70℃及以上处理时20 min即可看到噬菌体稳定性骤降(图3)。

图3 噬菌体P1热稳定性Fig.3 Resistance of P1 to temperature
2.4 噬菌体形态的电镜观察
经透射电镜观察,噬菌体P1拥有一个典型的二十面体头部结构以及一个不可伸缩的尾丝结构。二十面体头部直径大约为55~60 nm,尾丝长度约为150~155 nm。根据ICTV第九次报告,P1应该被归类为有尾体目,长尾噬菌体科(图4)。
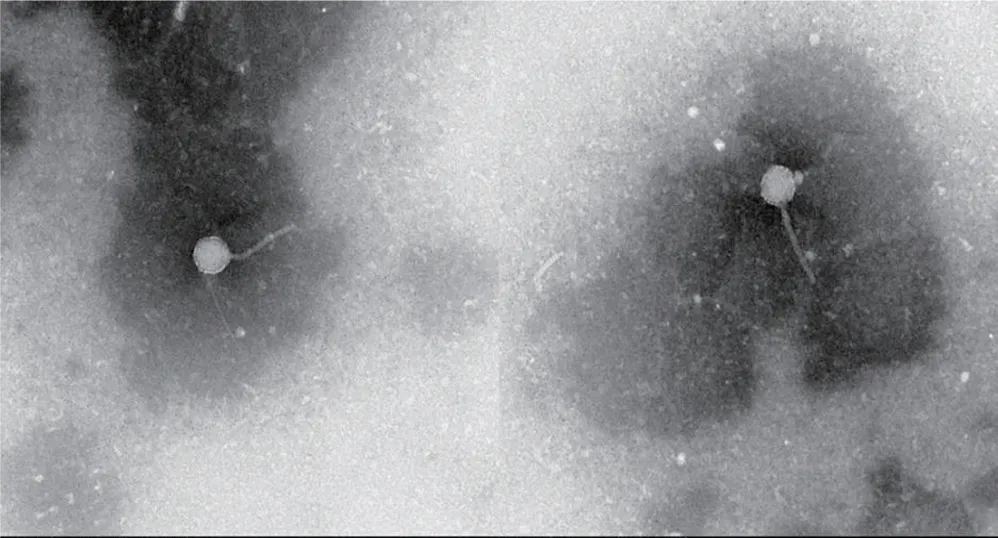
图4 噬菌体P1透射电镜照片Fig.4 Transmission electron micrographs of phage P1
2.5 全基因组测序及结果分析
2.5.1 全基因组概述
二代测序结果显示,噬菌体P1基因组含50675 bp DNA,GC含量为50.88%,预测到82个编码序列(CDS)。经NCBI比对,与噬菌体P1的全基因组序列最相近的是Klebsiellaphage KOX1[11],具有97.18%的一致性和89%的覆盖率。
2.5.2 基因功能预测
在82个分析到的CDS中,50个为功能未知的假设蛋白,32个为可预测到蛋白功能的CDS,包含了噬菌体头部/衣壳蛋白、尾部蛋白、DNA复制与转录相关蛋白等(表3)。

表3 噬菌体P1的ORF功能预测(不含假设蛋白)Tab.3 Prediction of ORF function of phage P1 (without hypothetical protein)
2.5.3 序列比对与的系统发育分析
为进一步研究噬菌体P1的进化关系以及了解宿主特异性与噬菌体尾丝蛋白基因序列的关系,基于噬菌体保守的末端酶大亚基(ORF 2)与尾丝蛋白蛋白序列构建进化树(图5A),进化分析结果表明噬菌体P1与克雷伯菌噬菌体KOX1、PKP126、LF20、P528等具有更近的亲缘性。而尾丝蛋白序列同源性最高的为克雷伯菌噬菌体LF20、PKP126、KLPN1、KOX1(图5B)。

图5 噬菌体P1进化树Fig.5 Phylogenetic analyses of phage P1 and homologous phages.
3 讨论
从1980年以来,人类很少发现新的抗生素种类,世卫组织在2017年确认并宣布当今世界抗生素濒临枯竭,细菌耐药将成为人类健康最大的威胁之一。在全世界范围内,“ESKAPE”病原体,即致病性大肠埃希菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和粪肠球菌是院内耐药细菌感染的代表。在此背景下,噬菌体治疗理论与应用研究的辉煌时代应运而生[5],噬菌体是细菌的“天敌”,除了研发新的抗菌药物以外,寻找自然界中对应的噬菌体攻克耐药细菌从而与耐药菌的进化“赛跑”同样为一种好的思路。目前,国内对于“ESKAPE”病原体的噬菌体分离鉴定、功能及基因组学研究等已取得了不菲的成果[7,12-16]。
肺炎克雷伯菌作为肠杆菌科的一员,是医院和社区获得性感染的常见病原体,可引起多种感染,特别是多重耐药肺炎克雷伯菌和耐碳青霉烯类超强毒力克雷伯菌(CR-hvKP)的出现给肺炎克雷伯菌感染的治疗带来了更严峻的挑战[17],此外,肺炎克雷伯菌荚膜血清型的多样化(至少79种)也大大增加了治疗的复杂性,进一步限制了抗生素治疗的选择性,因此,寻找肺炎克雷伯耐药菌株感染的替代治疗方法势在必行。已有研究报道,应用一株新型噬菌体(PKP2)联合庆大霉素可有效治疗肺炎克雷伯菌感染的小鼠,联合治疗组小鼠不仅全部存活,而且肺部的病理改变和炎症因子均恢复到正常水平,疗效优于庆大霉素单药治疗[18]。
本研究分离到的肺炎克雷伯菌裂解噬菌体P1在最佳感染复数(MOI)为10时的一步生长曲线显示出较短的潜伏期和较大的裂解量,表明其具有较强的裂解性质。且在40℃和50℃时存活率保持在较高水平,这与之前许多研究报道的噬菌体最适温度相似[14]。基因组BLAST结果表明,除与Klebsiellaphage KOX1具有较高的相似性外(97.18%的一致性和89%的覆盖率),P1基因组与NCBI发表的其他噬菌体基因组相似性较低,这也提示可以将这些噬菌体的研究与噬菌体P1结合起来,分析它们在基因组中的共性和差异,这样不仅可以更深入地了解噬菌体P1,更重要的是挖掘出目前未知的信息。
尾丝蛋白作为噬菌体特异性识别宿主的物质基础,决定了噬菌体的宿主范围,在这次研究中,挑选的部分临床菌株均无法被噬菌体P1特异性吸附裂解,这可能和噬菌体往往具有严格的宿主特异性有关,且噬菌体P1尾丝蛋白同源序列比对结果也进一步说明了其具有很强的宿主特异性。而其对肺炎克雷伯菌ATCC700603(分离自院内感染患者尿液,荚膜血清型为K6,具有编码ESBLs基因bla-SHV-18的质粒)的裂解特异性填补了针对K6血清型肺炎克雷伯菌感染的噬菌体文库的空白,也为后续的噬菌体-抗生素联合治疗提供了理论依据,在未来,P1有望成为K6血清型肺炎克雷伯菌感染的治疗剂。值得注意的是,基因测序分析表明,该噬菌体未见已知毒素基因,这也为今后噬菌体应用于临床治疗提供了安全保障。
4 结论
本研究从医院的污水中成功分离出一株新型肺炎克雷伯菌裂解性噬菌体,经电镜观察,属于典型的有尾噬菌体,命名为“P1”,并进一步研究了裂解谱、最佳感染复数、全基因组及基因功能的特性,为肺炎克雷伯菌的噬菌体治疗提供理论基础和噬菌体储备。除此之外,噬菌体P1的噬菌斑所形成的晕环大、圆,晕环内的宿主特性值得进一步研究。加快对新型噬菌体的分离鉴定和基因组测序研究,明确噬菌体与宿主菌之间的相互作用机制对未来抗生素替代疗法的发展意义重大。
