中药内生真菌的生物活性物质及其多组学研究进展
2022-10-14郝艳琦潘英妮赵司南李谭谭李宁孙奕
郝艳琦 潘英妮 赵司南 李谭谭 李宁 孙奕,*
(1 沈阳药科大学 中药学院,沈阳 110016;2 中国中医科学院中药研究所,北京 100700)
近年来,由于耐药病原微生物和新疾病的出现,加之合成药物在治疗疾病过程中时常伴有的毒副作用,导致世界范围内对天然药物的需求不断增加,从而促使科学家们寻找多种药用资源来应对各种挑战。内生微生物是生物活性代谢物的丰富来源,其次级代谢物(包括生物碱、萜类、聚酮等)具有抗肿瘤、抗炎、抗菌、抗氧化等作用,其潜在的药用价值可作为重要的天然先导化合物进行开发利用。尽管有许多关于内生真菌生物活性化合物的研究报道,但内生真菌的研究仍处于起步阶段。1993年,Stierle首次从药用植物短叶红豆杉的韧皮部中获得一株产抗癌物质紫杉醇的内生真菌Taxomyces andreanae[1]。此后,内生真菌的研究受到越来越多的研究者重视[2]。本文综述了近10年中药来源的内生真菌次级代谢产物多样性及其生物活性,以及与次级代谢产物相关的代谢组学、基因组学、蛋白组学等多组学研究,以概括中药来源内生真菌活性次级代谢产物的多维度研究现状。
1 中药内生真菌次级代谢产物的多样性
1.1 聚酮类
从红豆杉茎内生真菌ColletotrichumS8中分离得到1个多肽-聚酮杂合12元环状三肽colletopeptides A(1),结构中含有3,5,11-三羟基-2-甲基十二酸单元。Colletopeptide A可抑制脂多糖诱导的RAW264.7巨噬细胞产生NO(IC50值为8.3 μmol/L),并能够抑制炎症因子IL-6和TNF-α的产生,降低NF-κB相关蛋白IκBα和p65的磷酸化[3]。Yang等[4]从丹参地上部分分离到内生真菌球毛壳菌Chaetomium globosum,从其固体发酵产物中分离到2个新聚酮类化合物aureonitols A和B(2-3)和已知化合物equisetin(4)。其中,化合物4对4种多重耐药菌(粪肠球菌、粪肠球菌、金黄色葡萄球菌和表皮葡萄球菌)具有显著的抗菌活性,其MIC值为3.13~6.25 μg/mL。另外,从丹参的地上部分还分离出内生真菌Colletotrichum gloeosporioidesXL1200,从该真菌中的固体发酵培养物中鉴定了2个新的乙氧基苯乙酮衍生物colletotricholides A(5)和B(6)[5],化合物1~6结构式见图1。
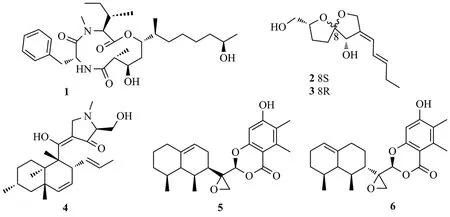
图1 化合物1~6结构式Fig.1 The structures of compounds 1~6
从三七内生真菌裸孢壳属EmericellaXL029分离得到4 个异戊二烯黄嘌呤型化合物14-hydroxyltajixanthone(7)、14-hydroxyltajixanthone hydrate(8)、14-hydroxyl-15-chlorotajixanthone hydrate(9)、epitajixanthone hydrate(10),上述化合物对除耐药金黄色葡萄球菌外的所有测试革兰阳性菌和阴性菌均有显著的抗菌活性,MIC值为12.5~50 μg/mL[6]。从另1株三七内生真菌康氏木霉属Trichoderma koningiopsisYIM PH30002中分离到2个新聚酮化合物koninginins O和Q(11和12),这2个化合物对尖孢镰刀菌Fusarium oxysporum和黄瓜枯萎病菌Plectosphaerella cucumerina表现出较弱的抑菌活性(MIC值为128 μg/mL)[7]。此外,Yang等[8]从三七内生青霉菌PenicilliumYIM PH30003发酵液中分离到一个多氧苄基环己酮penginsengin A(13),该化合物对三七病原菌Fusarium.solani具有一定的抗菌活性(MIC值为64 μg/mL),化合物7~13结构式见图2。

图2 化合物7~13结构式Fig.2 The structures of compounds 7~13
Biasettoa等[9]从喜树内生真菌Phomopsis stipata代谢物中分离到新化合物koninginins T(14)和U(15),其中,化合物14在10 μg时表现出抑制乙酰胆碱酯酶的作用。Wu等[10]从金钱草叶组织内生真菌Byssochlamys spectabilis中分离得到一种新骨架聚酮衍生的八酮二聚体byspectin A(16),该化合物是一种新型高选择性的hCE2抑制剂(IC50值为2.01 μmol/L)。Feng等[11]从华布贝母的健康鳞茎中分离得到一种球孢菌Cladosporium sphaerospermumWBS017,在大米培养基上发酵,分离得到2个聚酮类化合物cladosins L和N(17和18),其中17对2种金黄色葡萄球菌(Staphylococcus39aureusATCC 29213和S.aureusATCC 700699)具有抗菌作用(MIC值为50和25 μmol/L);而在白豆培养基上培养这种真菌,得到了另外1种杂合聚酮cladosin O(19),化合物14~19结构式见图3。

图3 化合物14~19结构式Fig.3 The structures of compounds 14~19
Shi等[12]从艾蒿的根组织中分离得到内生真菌Trichoderma koningiopsisQA-3,从中纯化到双环聚酮类化合物15-hydroxy-1,4,5,6-tetra-epi-koninginin G(20)和14-hydroxykoninginin E(21),化合物20对水生病原菌溶藻弧菌Vibrio alginolyticus具有显著的抗菌活性(MIC值为1 μg/mL)。从艾蒿内生真菌Trichoderma koningiopsisQA-3的培养液中分离鉴定出具有八氢萘骨架的三环聚酮化合物ent-koninginin A(22),化合物22对人类病原体大肠埃希菌(Escherichia coli)、海洋水生病原体溶藻弧菌(Vibrio.alginolyticus)和鳗鲡弧菌(V.anguillarum)等显示出较强的抑菌活性(MIC值为8~64 μg/mL),化合物22抗创伤弧菌(V.vulnificus)的活性(MIC,4 μg/mL)强于对照药氯霉素(MIC,8 μg/mL)[13]。Liu等[14]从巴戟天内生真菌Cytospora rhizophoraeA761中分离到4个聚酮类异二聚体cytorhizins A-D(23~26),它们具有6/6/5/6/8或6/6/5/6/7五环系统,形成笼状骨架,由聚氧化异戊基单元和高度结构化的二苯甲酮骨架组成。化合物24和26对HepG-2、MCF-7、SF-268和A549细胞均表现出较弱的细胞毒性,IC50值在29.4~68.6 μmol/L之间,化合物20~26结构式见图4。
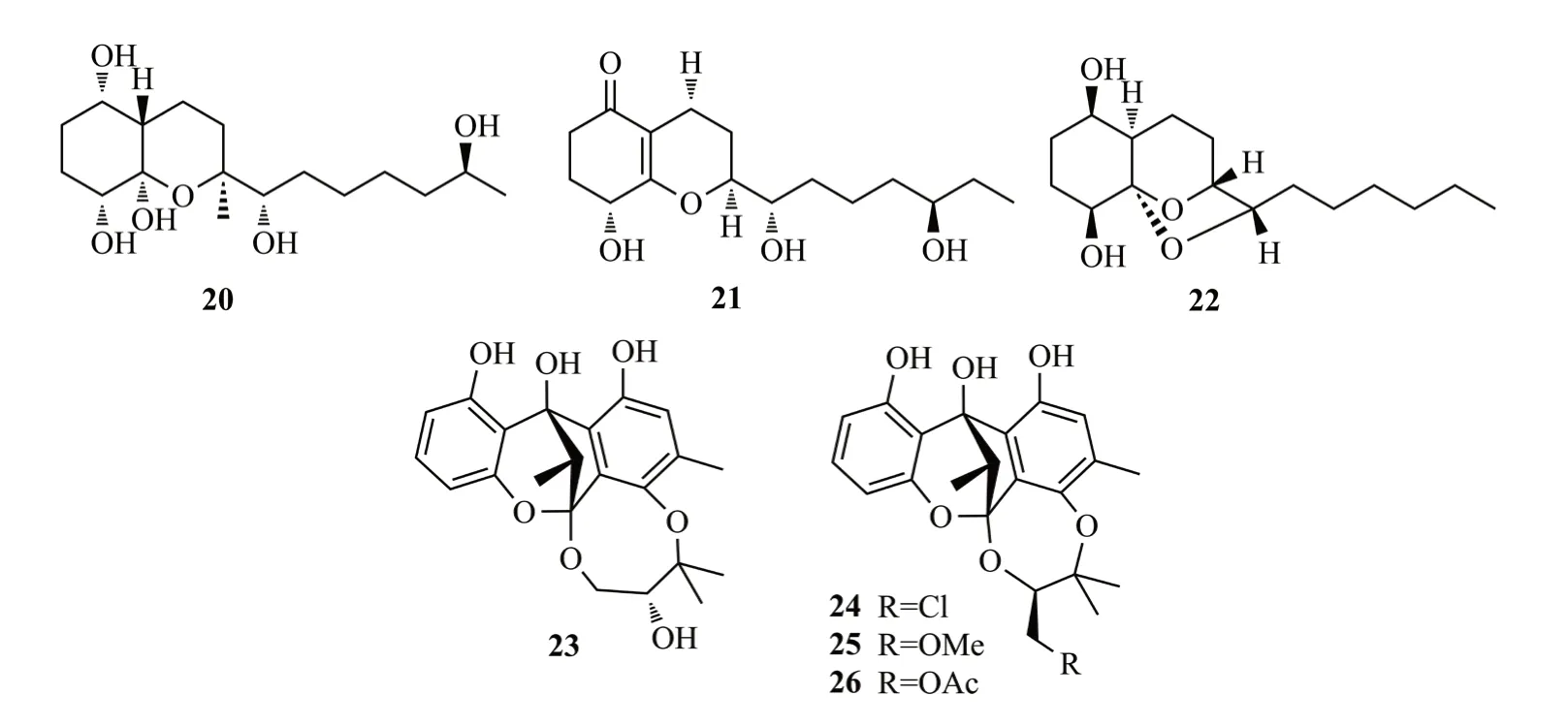
图4 化合物20~26结构式Fig.4 The structures of compounds 20~26
Phomopsin A(27)是从大叶藤黄内生真菌PhomopsisCAM212的固体培养物中分离出的聚酮化合物,乙酰化的27a以浓度依赖的方式能够显著抑制酯多糖诱导的RAW264.7细胞NO的生成(IC50值为14.8 μmol/L)[15]。Bang等[16]从桑树叶内生毛盘孢菌ColletotrichumJS-0361中分离到具有5/6/10融合环系统的聚酮化合物,命名为colletotrichalactones A和Ca(28和29)。其中,化合物28具有不稳定的醛基,在溶剂中易转化为缩醛基。以上两个化合物对MCF7细胞显示较弱的细胞毒性。Antonius等[17]从蒺藜内生真菌烟曲霉Aspergillus fumigatiaffnis中分离到1个抗菌聚酮(-)palitantin(30),能抑制粪肠球菌Enterococcus faecalisUW2689和肺炎链球菌Streptococcus pneumonia(MIC值为64 μg/mL),化合物27~30结构式见图5。
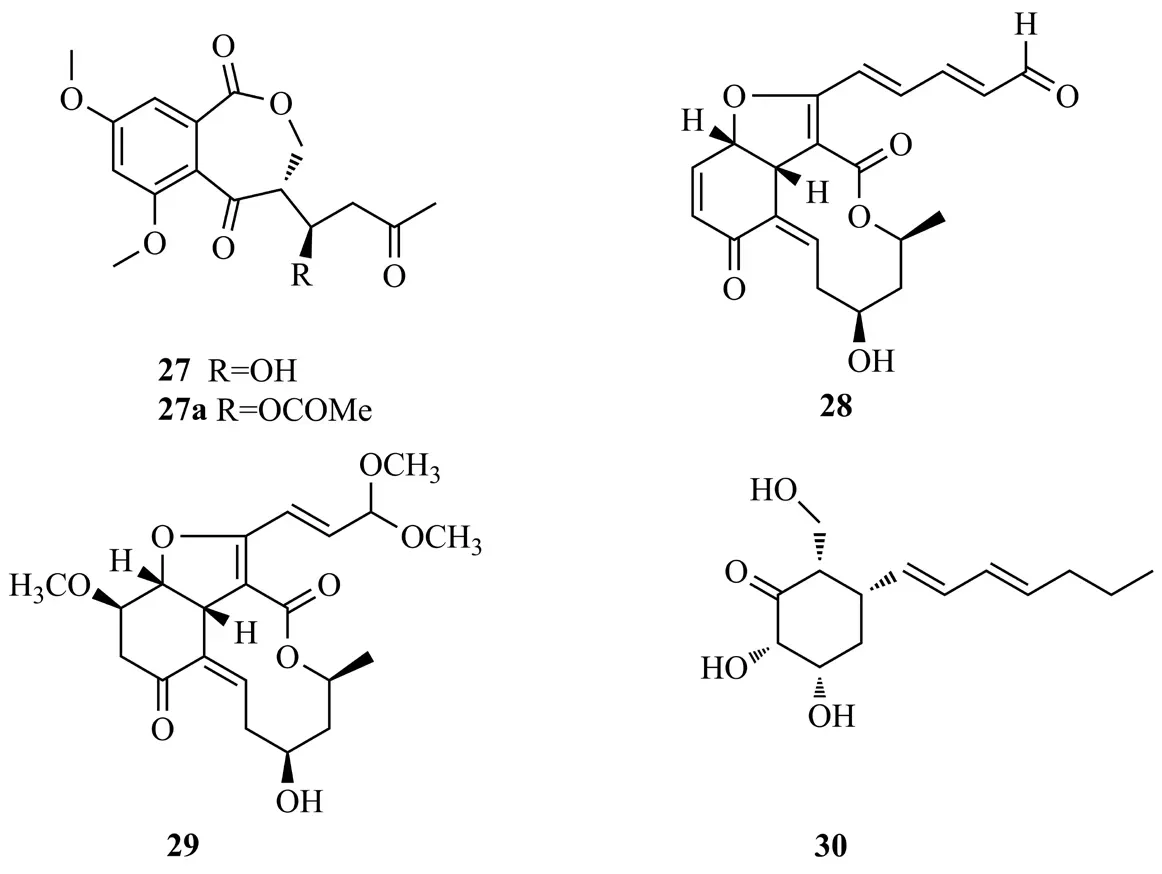
图5 化合物27~30结构式Fig.5 The structures of compounds 27~30
Luo等[18]从广西地不容块根中分离得到青霉菌Penicillium citrinumDBR-9,从其发酵液中分离鉴定出2个抑菌活性的聚酮化合物citrinin(31)和emodin(32);二者对植物病原真菌菌丝生长均有明显的抑制作用,其IC50值范围为3.0~141.0 μg/mL;化合物32能够影响病原真菌的菌落形态,破坏细胞膜完整性而影响所测试真菌细胞的蛋白质合成。Alternates D(33)是从蛇足石杉内生真菌Alternaria alternataMT-47的固体发酵时分离得到的聚酮类化合物,该化合物能够抑制凝血酶激活血小板的ATP释放,IC50值为(57.6±3.2) μmol/L[19]。Li等[20]从马鞭草中分离的真菌Peyronellaeasp.FT431培养液中纯化出一种含有苯并异喹啉-9-酮片段的聚酮化合物peyronetide A(34)及其衍生物peyronetide B(35),化合物34和35对人肾腺癌细胞TK-10、顺铂敏感的人卵巢癌细胞A2780S和顺铂耐药的A2780CisR细胞株具有细胞毒性(IC50值为21.2~29.2 μmol/L),化合物31~35结构式见图6。
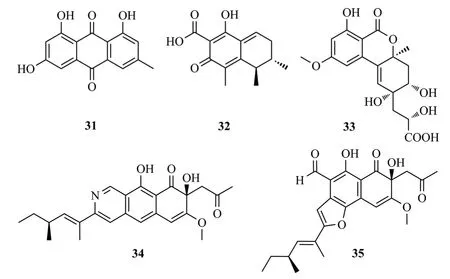
图6 化合物31~35结构式Fig.6 The structures of compounds 31~35
1.2 萜类
1.2.1 倍半萜
Chen等[21]从三七叶内生真菌LeptosphaeriaXL026的固体发酵培养基中分离出2个倍半萜化合物leptosphins A(36)和B(37),化合物37对蜡样芽胞杆菌(Bacillus cereus)表现出中等的抗菌活性(MIC值为12.5 μg/mL)。Xu等[22]从三七茎中分离得到内生真菌Preussia isomera,从中分离得到一对罕见的天然存在的倍半萜对映体(+)-和(-)-preuisolactone A(38),对黄色微球菌(Micrococcus luteus)具有抗菌活性(MIC值为10.2 μmol/L)。Pang等[23]从三七叶组织得到另外一株内生真菌Emericellasp.XL 029,从其液体培养液中分离到2个具有三环[4,4,2,1]十一烷骨架的倍半萜emericellins A(39)和B(40),这2个化合物对3种真菌菌株(黄萎病菌Verticillium dahliaeKleb、玉米小斑病菌Helminthosporium maydis和葡萄座腔菌Botryosphaeria dothidea)和3种细菌菌株(枯草芽胞杆菌Bacillus subtilis、蜡样芽胞杆菌B.cereus、大肠埃希菌E.coli)的MIC值在25~50 μg/mL之间。化合物36~40结构式见图7。

图7 化合物36~40结构式Fig.7 The structures of compounds 36~40
Qu等[24]从黄海棠内生真菌Phomopsis prunorum中分离得到2个倍半萜对映体(±)photerterpenes A(41)和B[(±)-1](42),photerterpene A对植物病原菌甜瓜细菌性叶斑病菌(Pseudomonas syringae Pv.lachrymans)具有中等抗菌活性(MIC值为15.6 μg/mL)。Liu等[25]从黄乌头内生真菌Phomasp.的培养液中得到phomanolide(43),该化合物对A型流感病毒A/Puerto Rico/8/34,H1N1表现出很强的抗病毒活性IC50值(2.96±0.64)μg/mL。Wu等[26]从南方红豆杉内生真菌Perenniporia tephropora培养液的EtOAc提取物中得到倍半萜perenniporin A(44);从另外1株南方红豆杉树皮内生真菌PhomopsisA240的提取物中分离得到倍半萜eremophil-9-ene-11,12,13-triol(45)[27],化合物41~45结构式见图8。
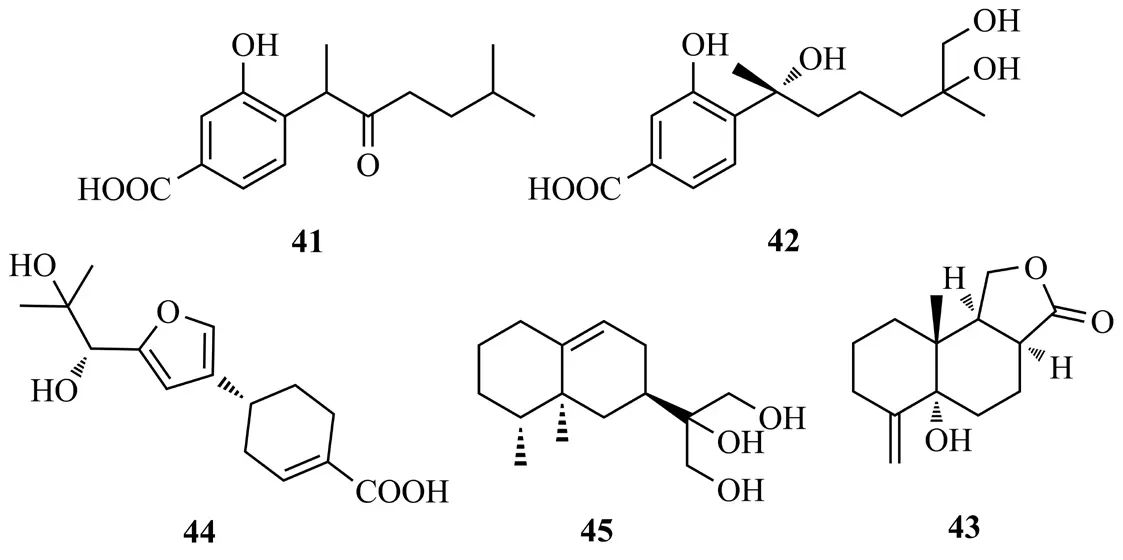
图8 化合物41~45结构式Fig.8 The structures of compounds 41~45
1.2.2 二萜
Ariantari等[28]对生姜根部分离的内生真菌青霉Penicilliumsp.进行研究,发现吲哚二萜型化合物shearilicine(46),该化合物对L5178Y和A2780细胞系具有较强的细胞毒性(IC50值分别为3.6和8.7 μmol/L)。46是含有6/5/6/6/6/6/5杂环系统的新型吲哚二萜,其结构中的芳香环对于其细胞毒性起到重要的作用。从三七根部分离到真菌Drechmeriasp.,从中也分离得到1个吲哚二萜化合物drechmerin I(47)[29]。从虎杖内生真菌Cercosporasp.的粗提物中分离到1个guanacastane型二萜的异二聚体cercosporenes F(48),该化合物对人源肿瘤细胞系HeLa和T24具有较强的细胞毒性(IC50值分别为19.3和8.16 μmol/L)[30]。
从银杏树皮中分离到的一株内生真菌Trichothecium roseum,从中得到一个二萜类代谢产物rosoloctone(49),该化合物对人宫颈癌Hela细胞具有抗增殖与促凋亡作用,它能够通过激活内质网应激和线粒体损伤来诱导Hela细胞凋亡[31]。从另外一株银杏内生真菌Aspergillussp.的发酵液中分离到三联苯基衍生物4′′-deoxycandidusin A(50)和terphenolide(51),它们对神经氨酸酶具有中等强度的抑制活性(IC50值:4.34~9.17 μmol/L)[32]。
从蛇足石杉内生真菌Penicillium chrysogenumMT-12固体基质培养基中分离到二萜penicichrysogenes A(52),该化合物具有抑制凝血酶活化血小板ATP释放的作用[IC50值为(42.7± 3.5) μmol/L][33]。从火把花的健康花中内生真菌Trichoderma atrovirideB7的液体发酵物中获得了具有4/7/5/6四环骈合的哈茨烷二萜harzianols I(53),对金黄色葡萄球菌[EC50=(7.7±0.8) μg/mL]、枯草芽胞杆菌[EC50=(7.7±1.0)μg/mL]和黄体微球菌[EC50=(9.9±1.5)μg/mL]均具有显著的抑菌作用[34]。化合物46~53结构式见图9。
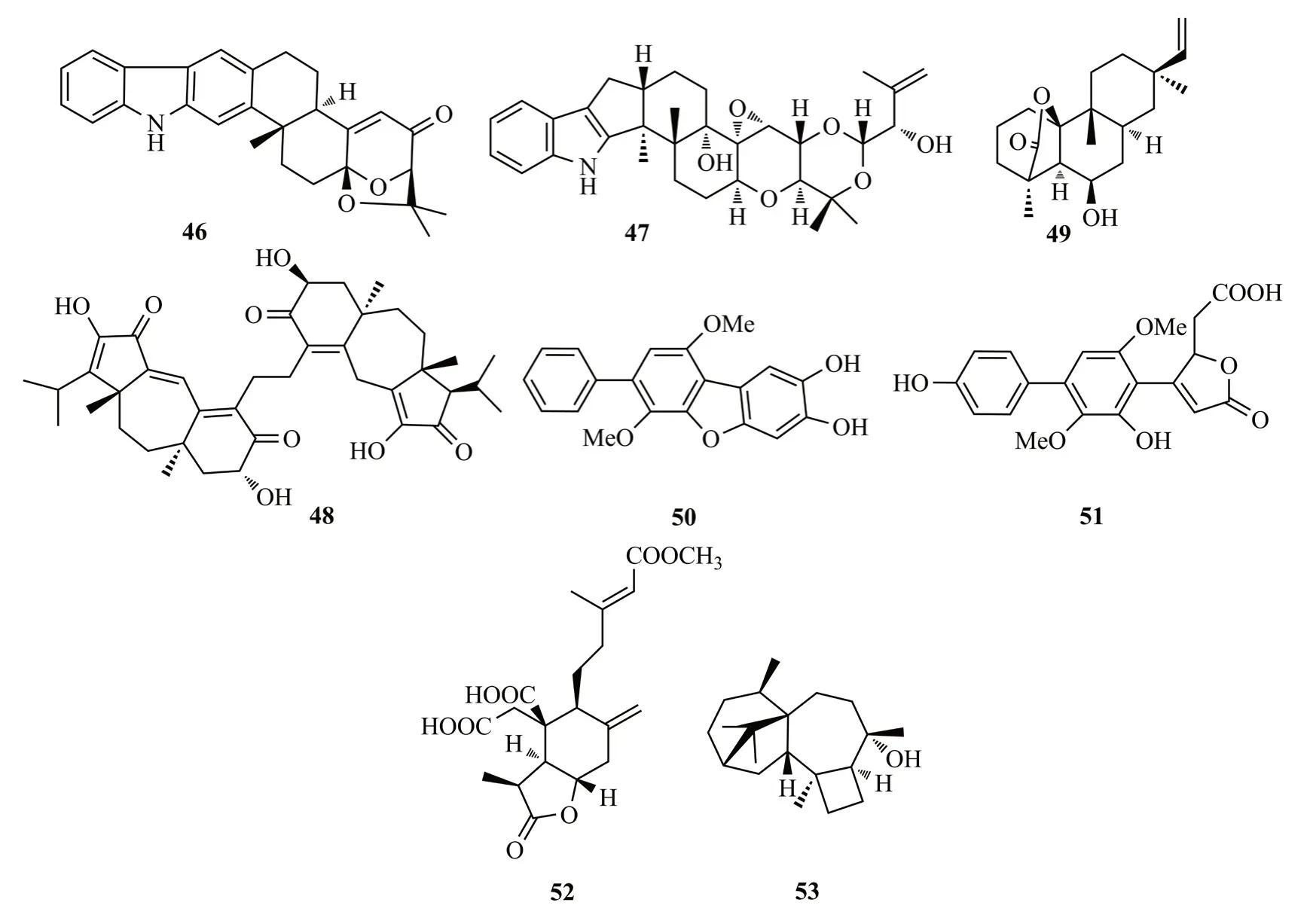
图9 化合物46~53结构式Fig.9 The structures of compounds 46~53
1.2.3 杂萜
Yang等[35]从石菖蒲内生真菌PhyllosterpictaJ13-2-12Y中分离到杂萜化合物Phyllomeroterpenoids A(54)和C(55),这两个化合物对金黄色葡萄球菌Staphylococcus aureus209P和白念珠菌Candida albicansFIM709具有一定的抑制活性(IC50值为32~128 μg/mL)。Qin等[36]从南五味子内生青霉菌Penicillium ochrochloronSWUKD4.1850的发酵物中分离得到一系列多氧化取代的萜类化合物,其中kadangusloctones A和C(56~57)对肿瘤细胞HepG2具有中等细胞毒性(IC50值10.2和17.3 μmol/L)。Long等[37]从枸杞内生真菌BipolarisL1-2中分离得到一系列强细胞毒性的cochlioquinones类杂萜,bipolohydroquione B(58)和C(59),cochlioquiones I(60)和K~M(61~63)。58是第一个含有苯并呋喃基团的cochlioquinones类衍生物。59~63对NCI-H226和/或MDA-MB-231具有较强的细胞毒性,IC50值为5.5~9.5 μmol/L。化合物54~63结构式见图10。
Duan等[38]从天麻内生真菌PenicilliumT2-8中分离到1个杂萜类化合物preastinoid D(64),该化合物对白念珠菌显示有中等的抑菌活性(MIC值128 μg/mL)。Yan等[39]从檀香树嫩枝中得到内生真菌FusariumYD-2,并从中获得了2个螺旋体萜类化合物,即镰刀菌素A(65)和B(66)。化合物65对金黄色葡萄球菌Staphylococcus aureus和铜绿假单胞菌Pseudomonas aeruginosa表现出显著的活性(MIC值为6.3 μg/mL)。Bowen 等[40]从蛇足石杉内生真菌Penicillium chrysogenumMT-12的固体底物培养物中分离出杂萜类化合物chrysogenolides C-D(67-68)和F(69)。这3个化合物具有抑制脂多糖诱导的RAW 264.7巨噬细胞释放NO的作用(IC50值4.3~78.2 μmol/L)。Li等[41]从钩腺大戟的内生真菌Guignardiasp.固体培养物中分离出杂萜guignardone N(70),评价该化合物在6.3 μg/mL的氟康唑溶液中,对白色念珠菌的生长有显著的抑制作用,其抑制浓度指数为0.23;在40 μg/mL浓度下与氟康唑联用,可抑制白色念珠菌生物膜并逆转其对氟康唑的耐受性。化合物64~70结构式见图11。
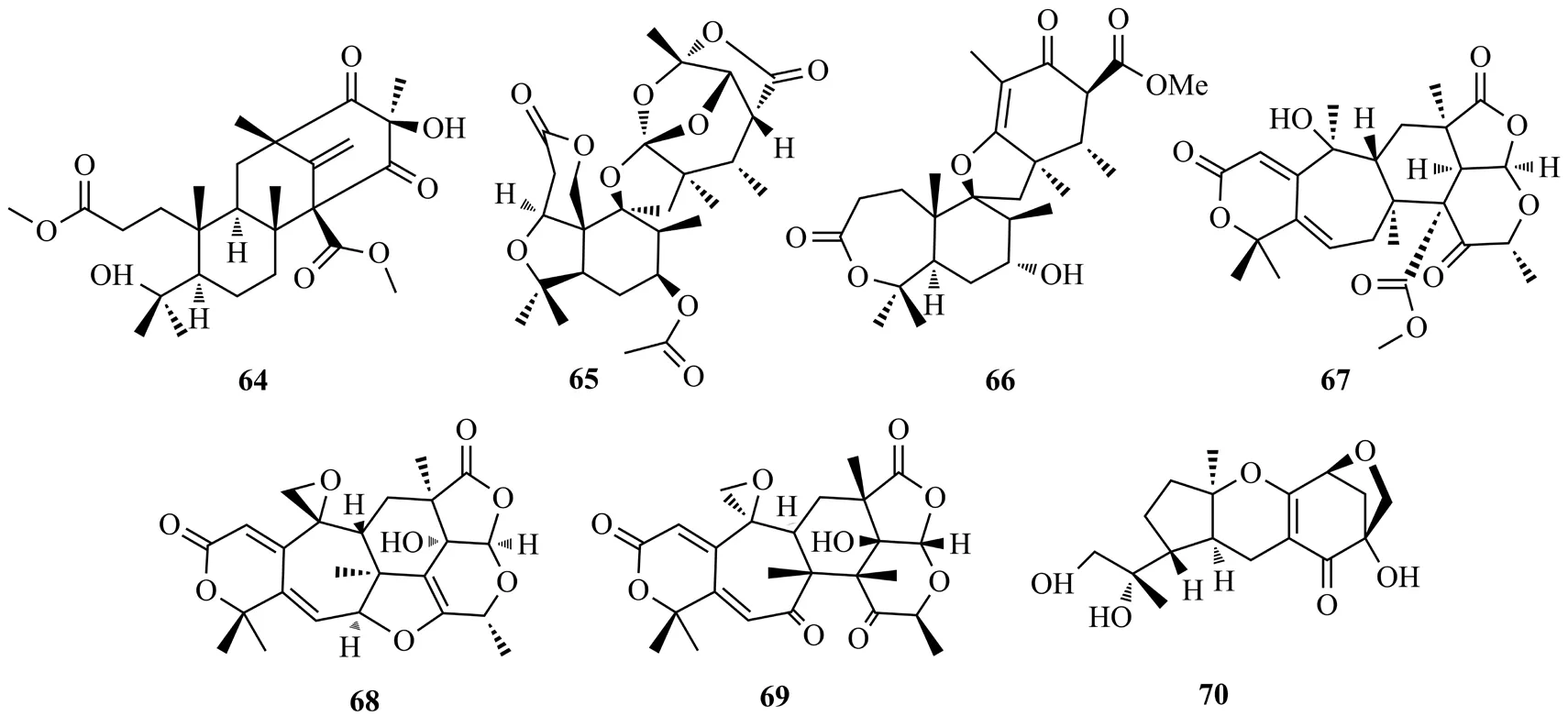
图11 化合物64~70结构式Fig.11 The structures of compounds 64~70
1.3 生物碱类
1.3.1 哌嗪类生物碱
Zhai等[42]从糙苏的内生真菌Phaeosphaeria fuckelii中分离得到硫二酮哌嗪生物碱phaeosphaones A~D(71~74),这4个化合物都含有β-O-硫代色氨酸基团,化合物74能够抑制蘑菇酪氨酸酶的活性[IC50值为(33.2±0.2) μmol/L],比阳性对照药曲酸IC50=(40.4±0.1) μmol/L活性强。
1.3.2 细胞松弛素
从三七内生真菌Trichoderma gamsii中分离得到细胞松弛素trichalasins A(75)[43]和C(76)[44]、trichoderone A(77)以及aspocharasin D(78);其中,78对HeLa细胞有抑制作用,IC50值为5.72 μmol/L[45]。
1.3.3 吲哚类生物碱
Peng等[46]从三七内生真菌Chaetomiumsp.固体发酵产物中分离出1个吲哚型生物碱chetoseminudin F(79),该化合物对人乳腺癌细胞MDA-MB-231具有强于紫杉醇的细胞毒性(IC50值为26.49 μmol/L)。化合物71~79结构式见图12。
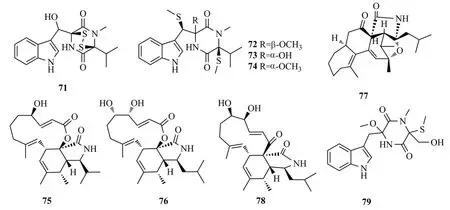
图12 化合物71~79的结构式Fig.12 The structures of compounds 71~79
1.3.4 其他类生物碱
Sun等[47]从三七的内生镰孢菌属(内生镰孢菌属)Fusarium tricinctum分离到2个生物碱rigidiusculamide E(80)和[-(α-oxyisohexanoyl-N-methyl-leucyl)2-](81),化合物81对小鼠巨噬细胞NO产生具有显著的抑制作用,IC50值为(18.10±0.16)μmol/L;从三七另一株内生真菌Preussia isomera中分离出生物碱(±)-Preisomide(82),结构中含有少见的天然四氢-2H-1,2-恶嗪环[48];从霍山石斛的内生真菌Stagonosporopsis oculihominis中分离得到两个生物碱stagonoculiepine(83)和stagonoculiazin(84),二者对SMMC-7721细胞的抑制率最高,而对A549细胞的抑制率最低(IC50>40mmol)[49]。Zhu等[50]从百山祖冷杉树皮的内生真菌Penicillium nothofagiP-6中分离鉴定了1个N-甲氧基-1-吡啶酮生物碱chromenopyridin A(85),对A549和Hela人癌细胞株具有较强的细胞毒性(IC50值分别为14.7和11.3 μmol/L);从苦楝的茎皮中得到曲霉菌Aspergillussp.,从中分离到3个吲哚二酮哌嗪生物碱,命名为asperptanthrins A-C(86-88);这些化合物结构中包含由色氨酸残基和邻氨基苯甲酸酯形成的色氨酸骨架,aspertypanthrin C含有稀有16元环分子骨架[51]。化合物80~88结构式见图13。
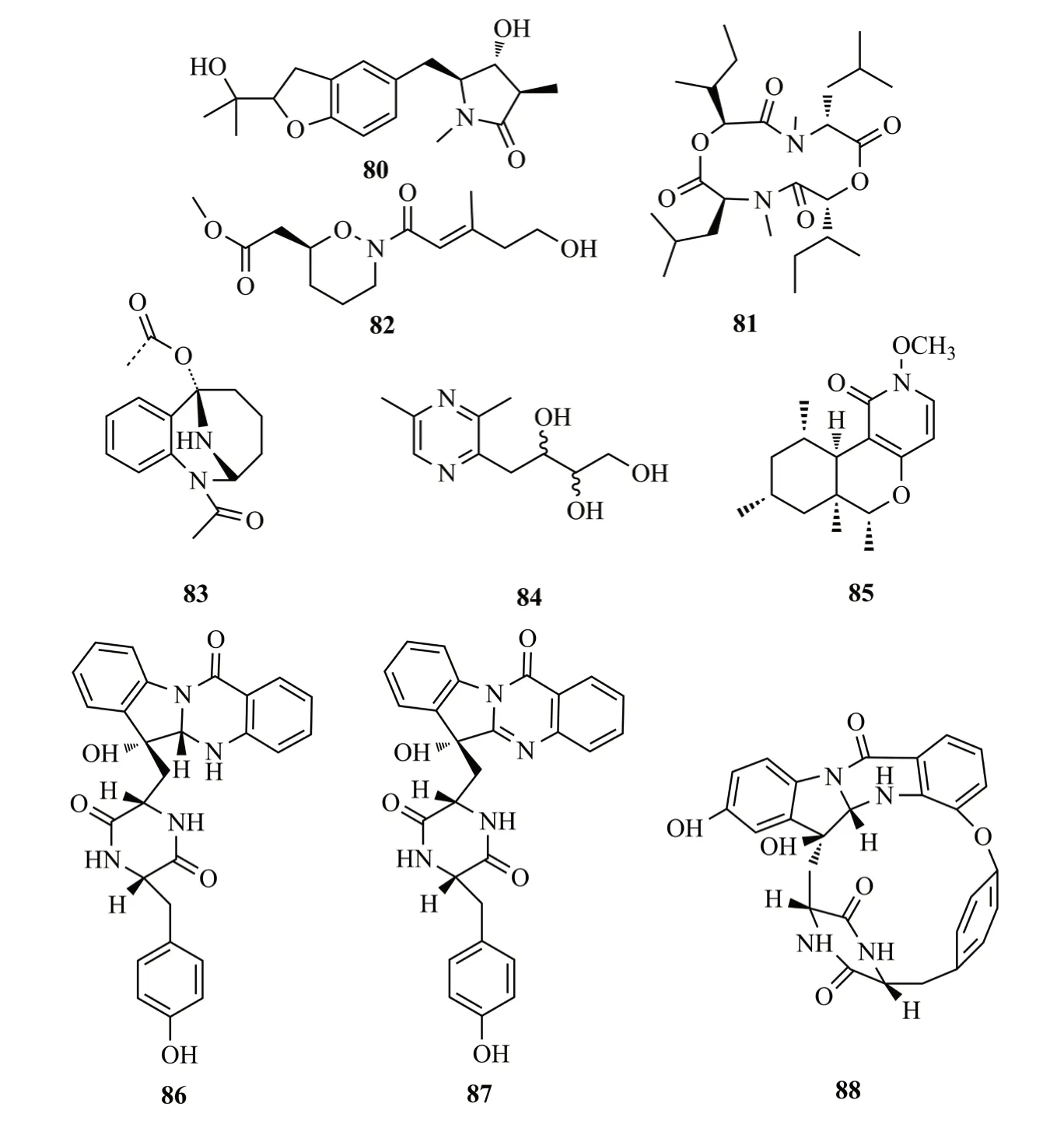
图13 化合物80 ~88的结构式Fig.13 The structures of compounds 80~88
1.4 其他类化合物
Zheng等[52]从人参的内生青霉菌Penicillium melinii培养液中分离出苯甲醛衍生物ginsenocin(89)和brefeldin A(90);2个化合物对MKN45、LOVO、A549、MDA-MB-435、HepG2和HL-60等肿瘤细胞系表现出很强的细胞毒性(IC50值分别在0.49~7.46 μg/mL之间和IC50值<0.12 μg/mL);从人参Panax ginseng根中分离到另外一株青霉菌PenicilliumSNF123,并从中得到化合物acremonidin E(91);考察acremonidin E的抗色素沉着作用,用α-MSH刺激小鼠黑色素瘤细胞B16F10,用2.5~50 μg/mL的acremonidin E处理48 h后,显示细胞内黑色素含量显著降低[53]。化合物89~91结构式见图14。
Yang等[54]从牛膝茎部的内生真菌PhomopsisCGMCC No.5416的培养物中分离到2个azaphilones类化合物 phomopsones B-C(92-93),二者对HIV-1病毒有显著的抑制作用,其IC50值分别为7.6和0.5 μmol/L;另外,这2个化合物对A549、MDA-MB-231和PANC-1细胞具有细胞毒性(IC50值在3.2~303 μmol/L);93还能够诱导PANC-1癌细胞早期凋亡,凋亡率为28.54%。
Xia等[55]从黄瑞香叶片中分离得到PenicilliumpurpurogenumIMM 003,从该菌株的发酵产物中分离得到3个新的含6/4/5/5四环体系的多氧佛手莫烷类化合物purpurolides D~F(94~96),这些化合物的C-14位上3-羟基癸酸部分对提高抑制胰脂肪酶(PL)的能力起到重要作用[如96的IC50值为(1.22±0.08) μmol/L]。从鱼腥草叶的内生真菌TubakiaECN-111中分离得到3个异香豆素类化合物,tubakialactones A-C(97-99)[56]。Sabrin等[57]从红花的根部内生真菌土曲霉Aspergillus terreus中分离得到2个丁内酯aspernolides F(100)和G(101)。化合物92~101结构式见图14。
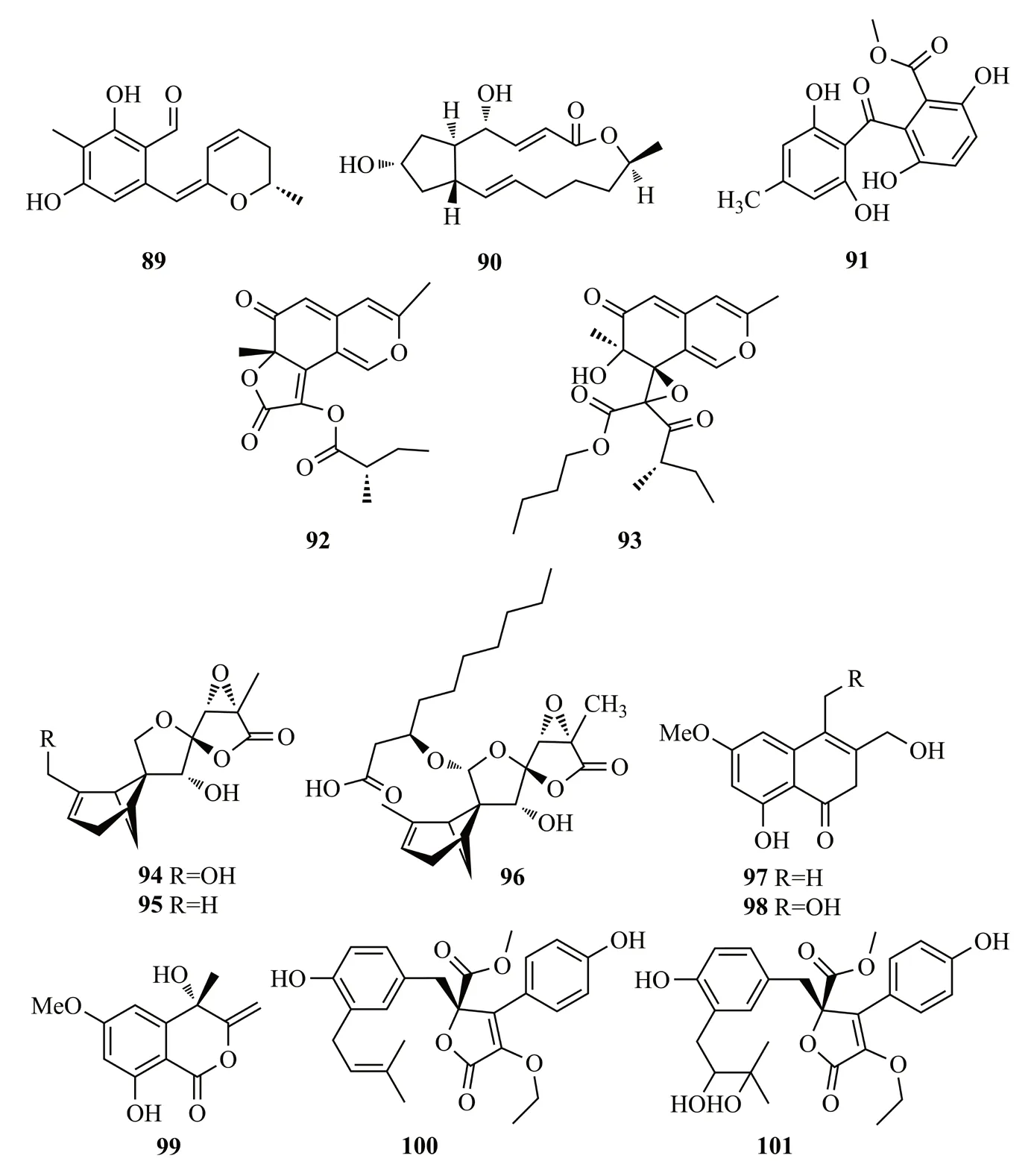
图14 化合物89~101的结构式Fig.14 The structures of compounds 89~101
2 次级代谢组学、基因组以及蛋白质组学的应用
植物内生真菌次级代谢产物是天然药物的重要来源之一。当以生物活性为导向的传统筛选机制出现停滞时,采用新的筛选方法减少已知化合物的重复检测,快速得到结构新颖且有生物活性的新化合物是药物开发的关键。研究者们对复杂微生物代谢通路进行分析的技术已逐渐成熟,随着高通量测序技术和生物信息学的发展,能够通过基因水平和代谢调控定向寻找与实际需求相符的药物,最终对于天然活性产物的挖掘将会得到更大的发展,次级代谢组学、基因组挖掘技术和蛋白质组学技术已成为寻找新药源的重要手段。
2.1 次级代谢组学
以LC-HRMS和1H NMR技术作为检测手段的微生物次级代谢组学能够对微生物次级代谢产物进行定性和定量分析,已成为研究潜在复杂微生物次级代谢产物谱的重要技术。基于次级代谢组学分析应用于次级代谢产物之间的化学筛选和快速对比,能够高效揭示一系列次级代谢组间的成分差异,并定位各个实验组数据中的差异化合物[58-59]。
Tawfike等[60]从桔梗的茎中分离到内生曲霉菌Aspergillus flocculus,在次级代谢组学的辅助下从该曲霉培养物中鉴定出抗肿瘤和抗锥虫的次级代谢产物。通过主成分分析筛选最佳的内生菌培养条件,再运用多变量数据分析辅助去重处理,有效地注释了活性小分子化合物,最终活性跟踪得到7个活性次级代谢产物。其中顺-4-羟基甜菜碱、5-羟基甜菜碱、间苯二酚、葡萄毒香豆素A和甜菜碱能够抑制慢性粒细胞白血病细胞株K562的生长;3-羟基水杨素和间苯二酚分别对引起寄生虫布鲁氏菌的昏睡病具有56%和97%的抑制作用。利用高分辨质谱和核磁共振谱作为次级代谢组学分析工具,Mazlan等[61]优化了两种内生真菌镰孢菌属Fusariumsp.和焦腐病菌Lasiodiplodia theobromae,在不同培养基和生长阶段的活性次级代谢产物的产生;通过运用定量分析软件与数据库的去重,最终从两株菌中共得到8个具有萘醌结构的1,4-萘醌类化合物和双氢异香豆素。其中双氢异香豆素化合物对布鲁氏锥虫具有显著的活性(MIC值为0.32~12.5 μmol/L)。使用MS/MS分子网络技术,根据化学结构和成分相似性(CSCS)指标,通过对草菇(Crptoporus volvatus)培养物和子实体提取物的研究发现,从培养的真菌中发现的化合物也可以从野生蘑菇中分离出来。对子实体提取物进行靶向分离,得到3个未知和6个已知cryptoporic acids衍生物,它们是具有异柠檬酸部分的drimane型倍半萜,Cryptoporic acid T是首次报道的三聚体。其中,化合物5′,6′-cryptoporic acid G dimethyl ester和6′,6′Cryptoporic Acid G Dimethyl Ester对HCT-116细胞具有细胞毒性,IC50分别为4.3和3.6 μmol/L[62]。利用非靶向代谢组学,Albright等[63]利用遗传或化学的方法检测了降低组蛋白脱乙酰基酶活性(HDACi)后,模型真菌Aspergillus nidulans代谢的1000多个小分子的变化。通过定量的差异分析,发现几乎相同数量的化合物被上调和下调了100倍以上。检测到已知和未知生物合成途径的产物,并发现构巢曲霉A.nidulans能够产生氟果糖酰胺,这是蛋白酶体抑制剂,其表达被HDACi诱导约100倍或更多,这项工作为“组学”驱动的天然产物研究的复兴提供了动力,成为新药效团的主要筛选方法。Wei等[64]从芜青中分离出内生真菌pr10,pr10的代谢提取物在抗肿瘤活性方面具有重要作用,通过代谢组学分析确定了pr10的主要代谢产物,结果表明,pr10的代谢产物富含氨基酸和糖衍生物(如海藻糖),具有抑制A549细胞作用。
2.2 基因组学
基因组挖掘是通过高通量测序技术对生物信息学预测的可能编码高价值天然产物的基因进行测序,了解基因表达翻译的控制机制并通过一系列手段将其激活表达,分离纯化出相应目的产物后解析结构并对生物活性测试的技术[65]。随着基因组测序技术的不断进步,研究人员发现微生物中存在大量常规培养条件下未被表达的“沉默代谢途径”,新型天然产物的生物合成基因簇往往处于沉默状态,其编码的次级代谢产物不表达或产量极低。因此,找到激活这些“沉默途径”,使其产生更多新型次级代谢产物的方法已成为当前研究的热点[66]。Cain等[67]对云南红豆杉内生真菌子囊菌F53进行基因组挖掘,发现35个可能的代谢产物合成基因簇,且其中之一编码聚酮合酶途径,与氮杂磷酮生物合成途径具有同源性。从F53中分离得到了一个新的化合物lijiquinone,并且lij基因簇上编码的酶负责lijiquinone的合成。Wang等[68]以聚酮-二萜杂合分子为靶点的基因挖掘策略,在滇重楼的内生真菌Aspergillus versicolor0312的基因组中,鉴定出1个新化合物(chevalone E)及其氧化衍生物的生物合成基因簇,该生物合成途径已成功重建在异源真菌Aspergillus oryzae中。
Wang等[69]对内生真菌Phomopsissp.A123的8个亲本原生质体进行基因组改组,以提高化学结构新颖的抗肿瘤天然产物脱乙酰基霉环氧二烯(DAM)的产量;经过两轮基因组改组,获得了4株高产水坝菌株G2-119、G2-448、G2-866和G2-919;这4个菌株的产瘤率分别是原菌株A123的243、241、225和275倍,这是首次以原生质体融合中亲本类型数目为重点的基因组改组优化研究。Li等[70]采用基因组数据挖掘、系统发育分析和合成生物学快速产物鉴定相结合的方法,从220株担子菌基因组测序真菌中发现并功能鉴定了4个二萜合成酶;通过基因挖掘技术从担子菌中发现新的二萜类化合物提供了机会。应用基因组改组技术,筛选出高产丹参酮IIA菌株F-3.4,使丹参酮IIA的产量增加了(387.56±0.02) mg/g,是原始菌株TR21的11.07倍,该菌株可替代植株丹参S.miltiorrhiza生产丹参酮IIA;通过基因组改组可以获得高产菌株的遗传基础,这证明基因组改组可以缩短育种周期并提高诱变性,从而获得具有良好性状的菌株,这种有用的方法用于工业菌株的分子育种[71]。Soliman等[72]用含异戊烯基焦磷酸酯(IPP,异戊二烯)和GGPP的萜类前体喂养产紫杉醇的内生真菌ParaconiothyriumSSM001,与对照相比,紫杉醇的产量分别提高了3倍和5倍。Mao等[73]对蘑菇内生真菌丛枝根孢(Calcarisporium arbuscula)进行基因组测序,发现了68个与天然产物生物合成有关的核心基因,并且组蛋白H3脱乙酰酶的失活会导致超过75%的生物合成基因的多效性激活和过度表达。通过鉴定,分离得到10种化合物,其中4种含有新结构,包括环肽阿霉素和阿布霉素、二萜类阿布霉素A等。
2.3 蛋白质组学
了解内生真菌基因组编码的全部蛋白质的表达、功能和调控,是真菌生物学的一个重要挑战。这对理解植物-真菌的相互作用,发病机制和真菌的定植是非常宝贵的,而蛋白质组学补充了其他功能基因组学方法[74]。利用组学技术,揭示了植物干旱胁迫反应的分子基础。Ghaffari等[75]研究了接种印度梨形孢菌(Piriformospora indica)的大麦叶片,在受到水分胁迫时蛋白质组学和代谢组学的变化。结果表明,中度干旱对接种梨状孢菌的植物,有145种蛋白质的丰度产生了影响,而未接种梨状孢菌的植物,有104种蛋白质的丰度也发生了变化,而更严重的胁迫则分别改变了144种和462种蛋白质的含量。Gao等[76]采用蛋白质双向电泳结合MALDI-TOF/TOF质谱方法,研究了接种瘤菌根菌属Epulorhizasp.的福建金线莲的蛋白组学,共分析了27个差异蛋白点,在数据库中以绿色植物为检索范围,确定了22个差异蛋白,功能大多是植物的信号传导、代谢调节等,光合作用及物质代谢中的功能蛋白及酶类等也有涉及。
Sulc等[77]报道了曲霉菌Aspergillussp.的蛋白质谱,并且利用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)技术对孢子进行分析,建立了24株Aspergillus菌株的蛋白质质谱数据库,这些质谱指纹图谱可用于不同真菌菌株的分型和鉴定,也可用于在宿主-病原相互作用中寻找新的生物标志物。Noir等[78]采用双向电泳(2-DE)和质谱联用技术,对布鲁美亚禾本科植物Blumeria graminisf.sp.hordei分析了Bgh分生孢子的蛋白质组;通过在NCBInr-ESTs数据库中搜索,共鉴定出23种不同的真菌基因产物,其中大多数在碳水化合物、脂质或蛋白质代谢方面具有预测功能。
3 结论与展望
近年来,越来越多的天然产物已在临床使用,如紫杉醇、鬼臼毒素和喜树碱等。由于天然产物获取途径的局限性,产量较低,极大阻碍了中药材及天然产物的应用和发展。中药来源的内生真菌在活性天然产物的开发和获取方面具有重要价值;利用内生真菌菌株生产具有药用价值的活性物质,为新药发现和应用开辟了新途径。
目前,仅有小部分内生真菌资源被开发,许多资源尚处于研究空白状态。随着高通量筛选、组合化学、分子生物学等技术手段的发展,可将高通量测序技术与内生真菌的分离相结合,对内生真菌活性物质的发现、合成机理以及与宿主植物关系的相关生物学的研究,极大地推动了内生真菌的天然产物的发展。
