基于网络药理学探讨人参皂苷Rb1肠道菌转化物治疗胃癌的作用机制
2022-10-13万彦敖慧
万彦,敖慧
(成都中医药大学,四川 成都 611137)
胃癌是癌症相关死亡率的第二大原因,也是全球第四大常见癌症[1]。其发病机制复杂,涉及多通路以及多靶点[2]。目前,胃癌的治疗手段多样,多以化疗以及手术疗法居多。然而,这些方法有着不可忽视的副作用,例如化疗后的不良反应以及预后不佳等[3]。因此,有必要寻找安全有效且多靶点的药物。
研究表明,人参皂苷可有效防治胃癌[4]。人参皂苷Rb1是人参含量最高的皂苷原型成分之一,但膜通透性差,口服生物利用度低,较难被人体肠道直接吸收[5,6]。本课题组前期研究表明,人参皂苷Rb1并无明显的体外抗胃癌活性,常经肠道菌群的脱糖作用转化为稀有人参皂苷而转运到上皮膜被肠道吸收。因此,肠道菌群转化的代谢物可能是人参皂苷Rb1在体内发挥药效的主要形式[7,8]。人参皂苷Rd、F2是人参皂苷Rb1主要肠道菌群转换产物[9]。有研究表明人参皂苷Rd和人参皂苷F2具有一定的抗胃癌活性,但其机制不清晰[10,11]。
网络药理学就是将生物学网络与药物作用网络整合,分析药物在网络中与节点或网络模块的关系,由寻找单一靶点转向综合网络分析[12]。网络药理学主要是通过系统生物学的研究方法进行研究,使用统计学、复杂网络等数学手段,能够在分子水平上更好地理解细胞以及器官的行为,加速药物靶点的确认以及发现新的生物标志物[13-15],对于研究多靶点药物作用机制具有一定优势。本研究拟将网络药理学应用于预测人参皂苷Rd和人参皂苷F2的抗胃癌作用机制,为人参皂苷的临床合理应用提供科学依据。
1 实验材料与方法
1.1 人参皂苷F2及Rd的靶点预测
Swiss Target Prediction是一种基于与已知化合物的二维和三维结构的相似性来预测化合物的靶标的数据库。该数据库由280 381个小分子与2 686个靶标间的相互作用构成,其中大多数靶标是人的蛋白。Swiss Target Prediction为每个预测靶标提供一个分数,以评估预测正确的可能性。因此本实验通过Swiss Target Prediction (http://swisstargetprediction.ch/)数据库获得人参皂苷F2和Rd的潜在靶点。
1.2 胃癌相关基因的筛选
以“gastric cancer ”为关键词在Disgenet(http://www.disgenet.org/)、Malacards(http://www.malacards.org/)和Omim(https://omim.org/)数据库中获得胃癌的靶点,并对获得的靶点进行去重,得到疾病的潜在靶点。
1.3 核心靶点垂钓及PPI网络构建
BisoGenet旨在评估来自蛋白质组学或基因组学实验的基因或蛋白质组之间的功能关系的突出程度,通过Bisogenet内在整合数据库对输入的靶点进行拓展分析可以得到一组更全面的PPI网络。在Cytoscape 3.8.2软件中,将人参皂苷F2、Rd和胃癌的潜在靶点分别输入Bisogenet插件中,点击“Gene identifiers only”进入下一步“DataSettings”,勾选“Protein Protein Interaction”选项,点击确定分别构建人参皂苷F2、Rd和胃癌的PPI网络。然后利用Merged工具将人参皂苷F2、Rd的PPI网络分别与胃癌的PPI网络取交集获得人参皂苷Rd治疗胃癌的PPI网络和人参皂苷F2治疗胃癌的PPI网络。利用CytoNCA插件计算两组PPI网络的属性值。在人参皂苷Rd治疗胃癌的PPI网络中先利用Degree值的中位数筛选一次,再利用Degree、Betweenness和Clossness中位数进行三次筛选获得人参皂苷Rd治疗胃癌的核心靶点。同法获得人参皂苷F2治疗胃癌的核心靶点。
1.4 药物-核心靶点网络构建
利用Cytoscape 3.8.2软件分别对人参皂苷F2治疗胃癌的核心靶点和人参皂苷Rd治疗胃癌的核心靶点构建药物-核心靶点网络。
1.5 富集分析
分别将人参皂苷F2治疗胃癌的核心靶点和人参皂苷Rd治疗胃癌的核心靶点导入到Metascape(http://metascape.org/)数据库中,物种选择“homo sapiens”,点击Costom Analysis进入下一步。在Enrichment页面设置P≤0.05,勾选GO Biological Processes选项进行基因本体论(Gene Ontology,GO)生物学过程分析;勾选KEGG Pathway选项进行KEGG分析。得到GO分析结果和KEGG富集结果。
2 实验结果
2.1 人参皂苷F2、Rd及胃癌的潜在靶点
根据SwissTargetPrediction数据库得到人参皂苷F2靶点20个,人参皂苷Rd靶点23个。在disgenet、malacards和OMIM数据库中分别获得胃癌相关靶点34个、32个、140个,合并以上检索结果并删去重复值,共得到胃癌相关靶点189个。
2.2 人参皂苷F2及Rd治疗胃癌关键靶点筛选
2.2.1 人参皂苷Rd治疗胃癌关键靶点筛选
构建人参皂苷Rd的作用靶点PPI网络,其中包括节点1 269个,节点之间的相互关系28 398个;构建胃癌疾病相关靶点PPI网络,其中具有5 804个节点,节点之间的相互关系149 080个。随后使用Merge插件,提取人参皂苷Rd治疗胃癌起效的交集靶点网络,通过Degree、Betweenness和Clossness中位数进行筛选,具体参数如表1所示,最后得到人参皂苷Rd治疗疾病的关键靶点,例如NTRK1、Fibronectin 1、MCM2、AKT1 等64个靶点,如图1、表2所示。
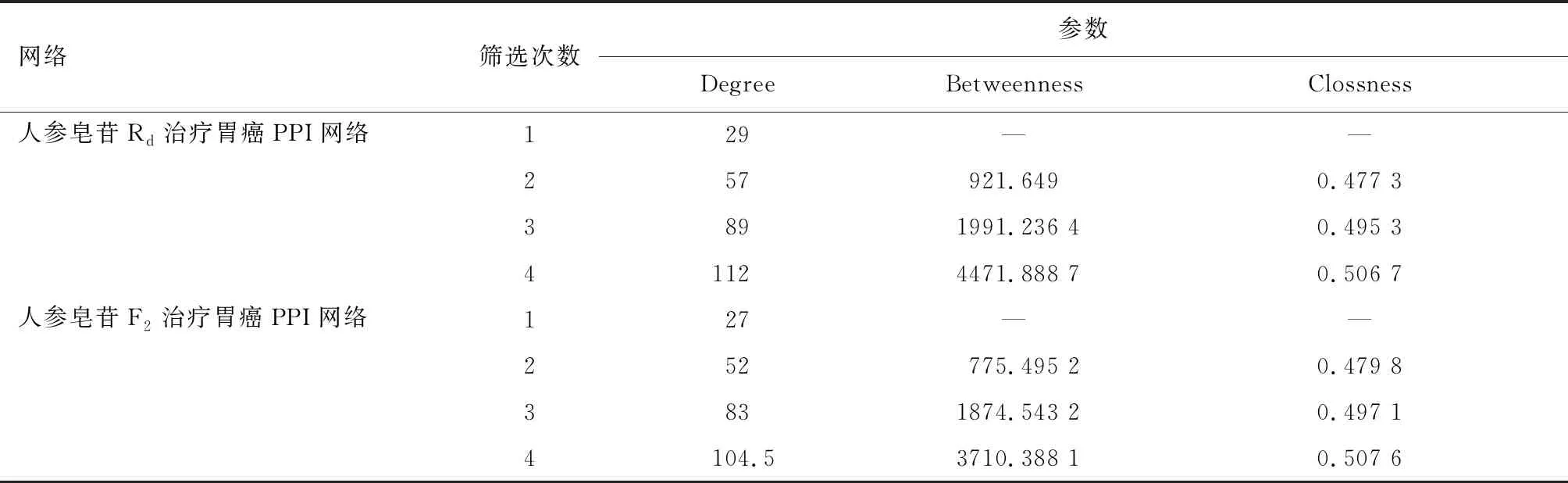
表1 人参皂苷Rd、F2治疗胃癌关键靶点筛选参数
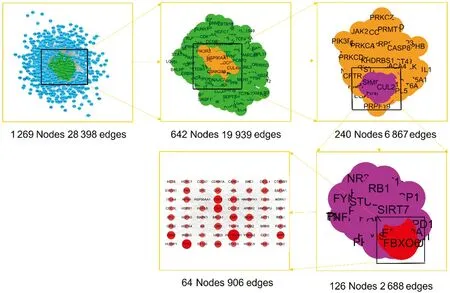
图1 人参皂苷Rd治疗胃癌关键靶点的拓扑网络

表2 人参皂苷Rd关键靶点详细信息
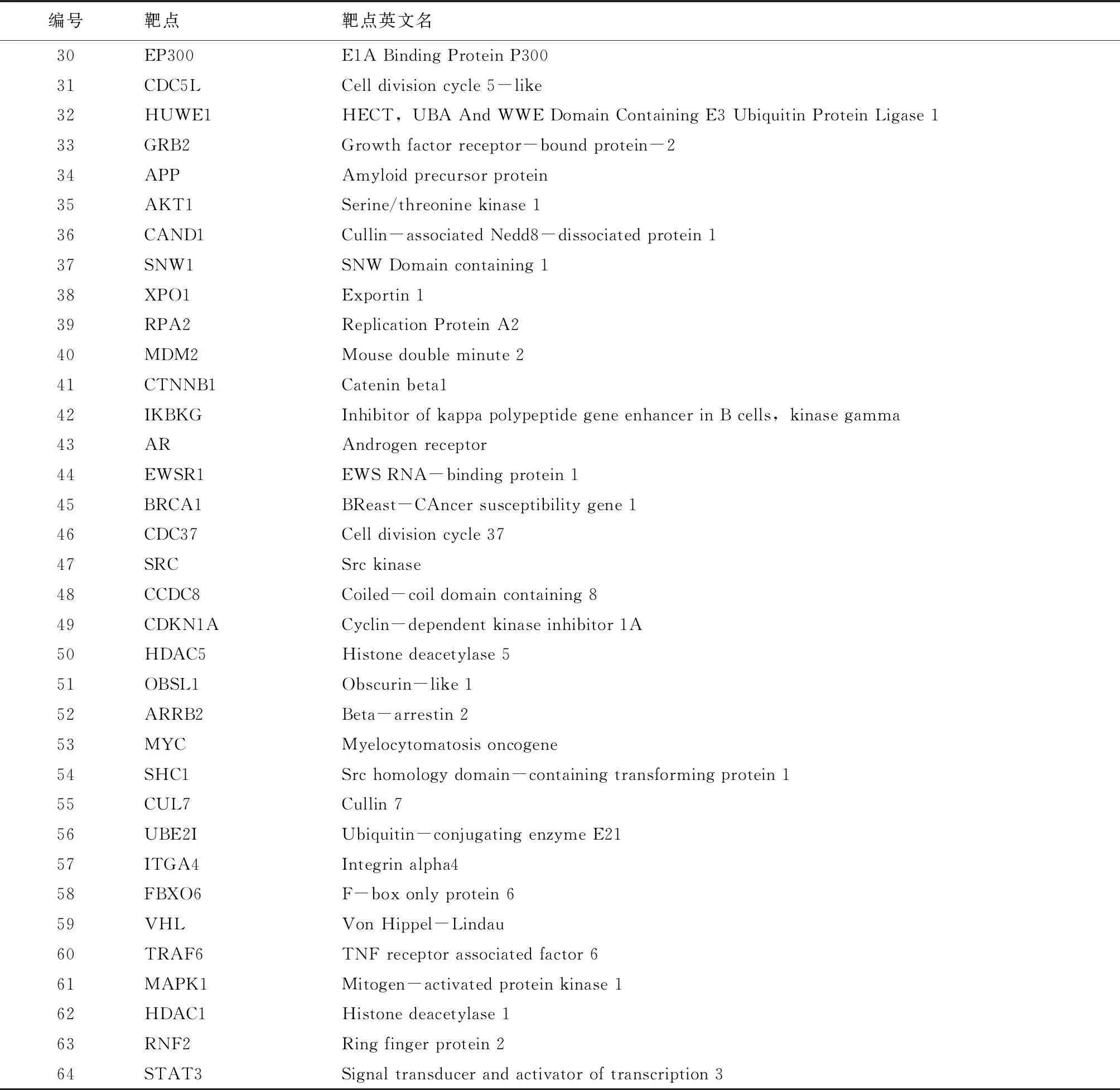
(见续表2) (续表2)
2.2.2 人参皂苷F2治疗胃癌关键靶点筛选
构建人参皂苷F2的作用靶点PPI网络,其中包括节点1 125个,节点之间的相互关系23 363个;构建胃癌疾病相关靶点PPI网络,其中具有5 804个节点,节点之间的相互关系149 080个。随后使用Merge插件,提取人参皂苷F2治疗胃癌起效的交集靶点网络,通过Degree、Betweenness和Clossness中位数进行筛选,具体参数如表1所示,最后得到人参皂苷F2治疗疾病的关键靶点,例如HNRNPU、AURKA、IKBKB、AKT1等56个靶点,如图2、表3所示。
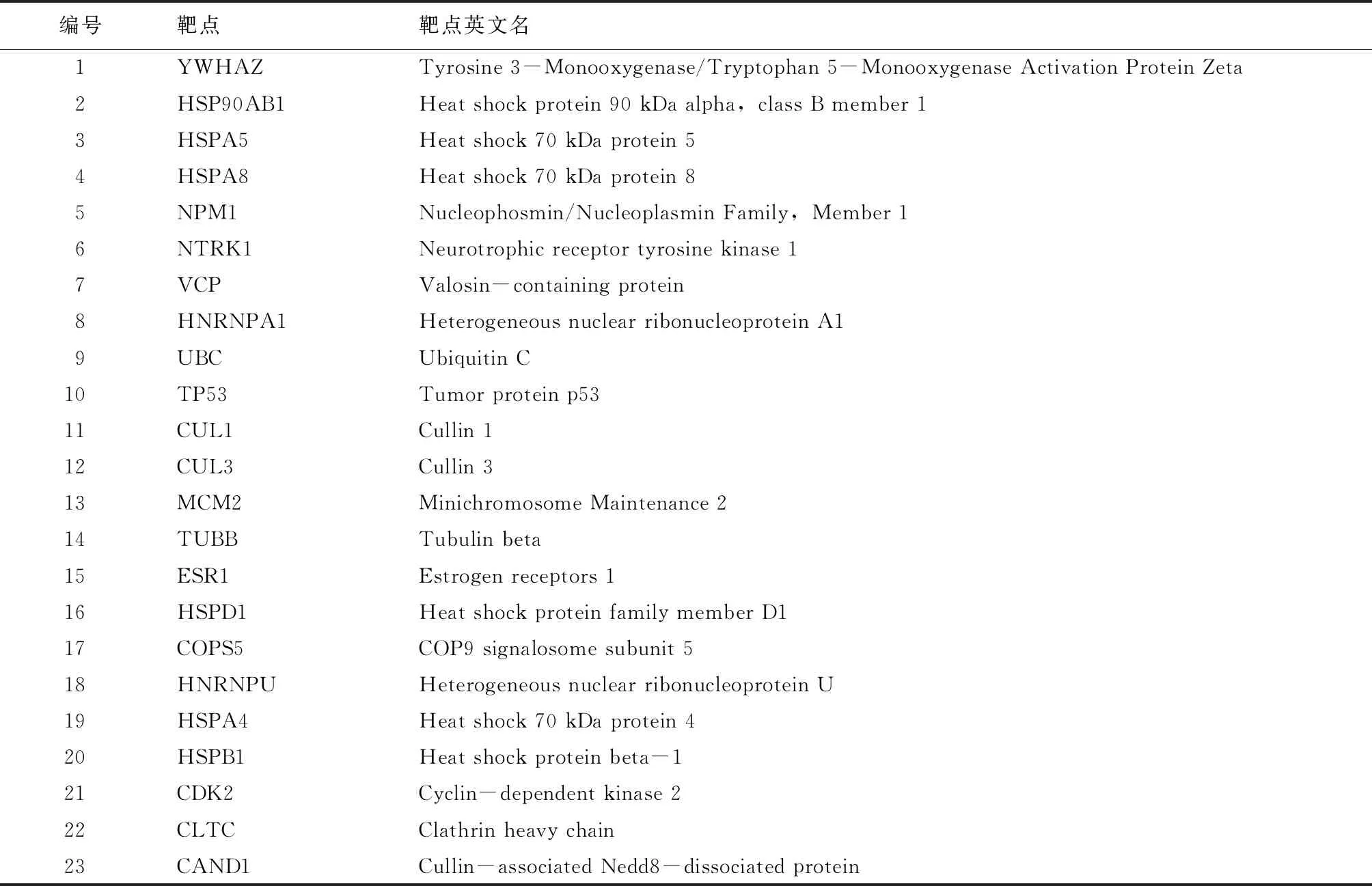
表3 人参皂苷F2关键靶点详细信息
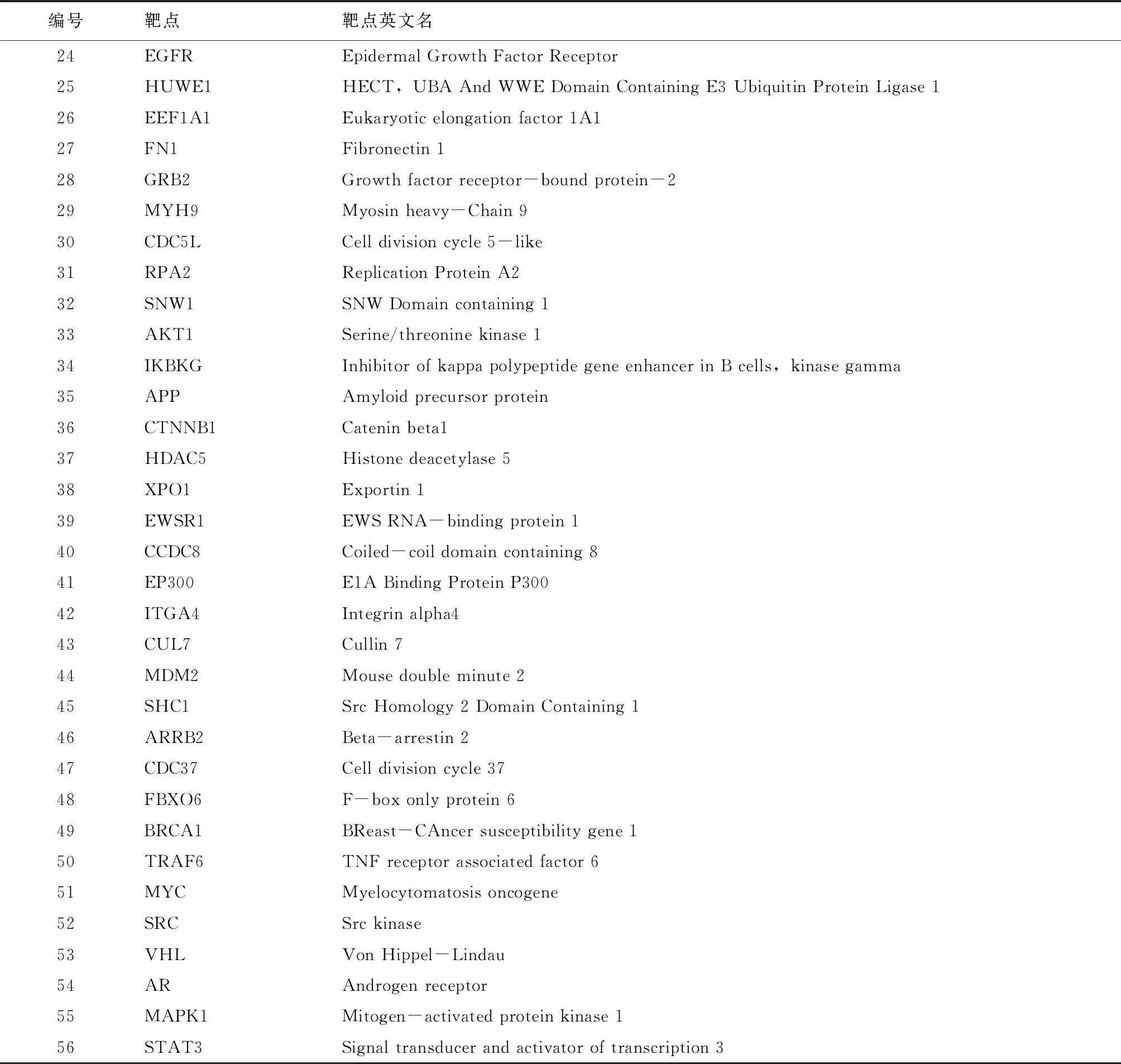
(见续表3) (续表3)
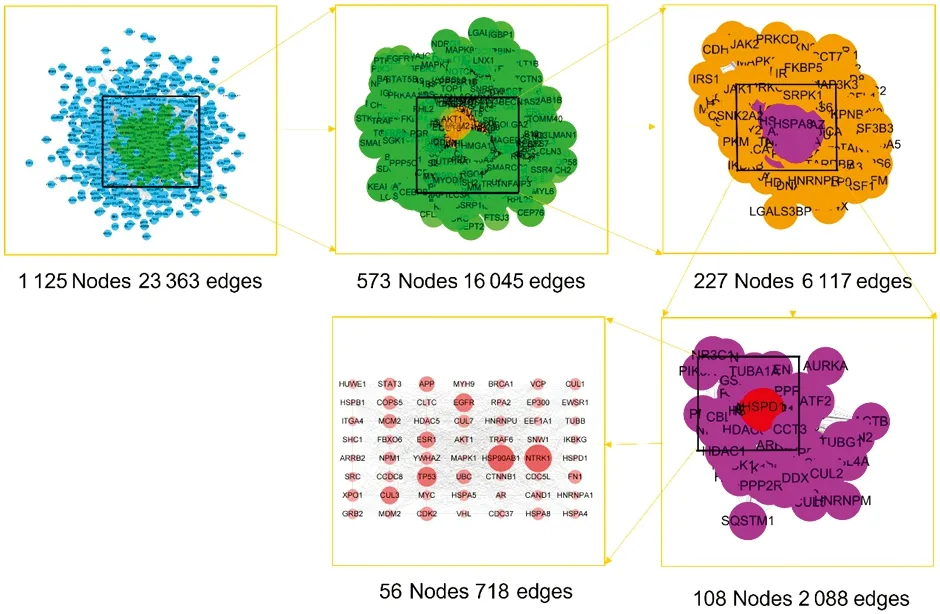
图2 人参皂苷F2治疗胃癌关键靶点的拓扑网络
2.3 人参皂苷Rd及人参皂苷F2-核心靶点网络构建
2.3.1 人参皂苷Rd-核心靶点网络构建
人参皂苷Rd-关键靶点网络如图3所示,包扩NTRK1、FN1、MCM2、IKBKG、AKT1等在内的64个靶点。
2.3.2 人参皂苷F2-核心靶点网络构建
人参皂苷F2-关键靶点网络如图4所示,包扩HNRNPU、AURKA、IKBKB、AKT1等在内的56个靶点。
2.4 人参皂苷Rd及人参皂苷F2关键靶点的GO和KEGG分析
2.4.1 人参皂苷Rd关键靶点的GO和KEGG分析
利用Metascape数据库进行GO分析,共包含了869个生物过程(BP),109个细胞组分(CC)以及104个分子功能(MF)。对富集排名靠前的BP10条,CC10条及MF10条进行可视化展示,如图5所示。其中,生物学过程细胞周期过程的调节、DNA代谢过程的调节、细胞对 DNA 损伤刺激的反应、细胞对氮化合物的反应、有丝分裂细胞周期的调节及有丝分裂细胞周期等;细胞组分涉及粘着斑、囊泡腔、细胞-基质连接、主轴及分泌颗粒管腔等;分子功能包括蛋白质结构域特异性结合、泛素蛋白连接酶结合、泛素样蛋白连接酶结合、激酶结合、蛋白激酶结合、转录因子结合、无序结构域特异性结合等等。KEGG分析结果显示了P<0.05的富集条目后制作气泡图(图6),包括PI3K-Akt 信号通路, FoxO信号通路,ErbB信号通路,HIF-1t信号通路,MAPK信号通路等等。

图3 人参皂苷Rd-核心靶点网络
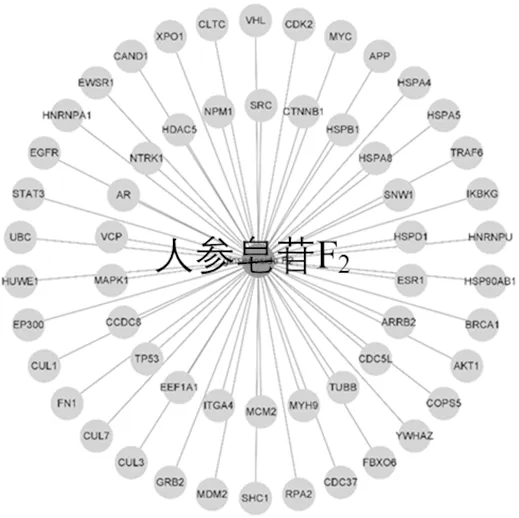
图4 人参皂苷F2-核心靶点网络
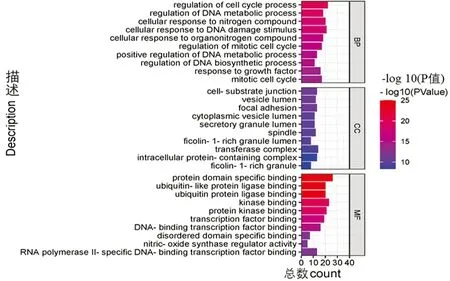
图5 人参皂苷Rd治疗胃癌关键靶点的GO生物功能富集分析

图6 人参皂苷Rd治疗胃癌关键靶点的KEGG通路富集分析
2.4.2 人参皂苷F2关键靶点的GO和KEGG分析
利用Metascape数据库进行GO分析,共包含了801个生物过程,93个细胞组分以及86个分子功能。对富集排名靠前的BP10条,CC10条及MF10条进行可视化展示,如图7所示。其中,生物学过程包括细胞对氮化合物的反应、细胞周期过程的调节、细胞对有机氮化合物的反应、细胞对 DNA 损伤刺激的反应、DNA代谢过程的调节、DNA结合转录因子活性的正调节、对生长因子的反应及细胞对有机环状化合物的反应等;细胞组分涉及粘着斑、细胞-基质连接、囊泡腔、主轴及分泌颗粒管腔等;分子功能包括泛素蛋白连接酶结合、泛素样蛋白连接酶结合、蛋白质结构域特异性结合、激酶结合、蛋白激酶结合、转录因子结合及DNA结合转录因子结合等等。KEGG分析结果显示了P<0.05的富集条目后制作气泡图(图8),包括PI3K-Akt信号通路,MAPK信号通路, NF-kB信号通路等等。

图7 人参皂苷F2治疗胃癌关键靶点的GO生物功能富集分析
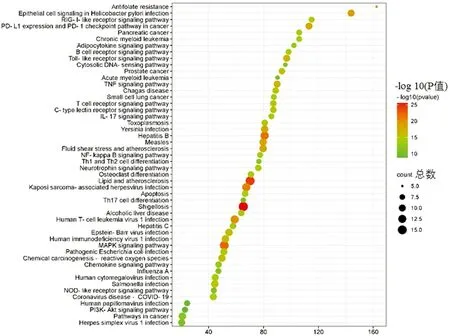
图8 人参皂苷F2治疗胃癌关键靶点的KEGG通路富集分析
3 讨论
本研究通过Swiss Target Prediction数据库得到人参皂苷Rd靶点23个,人参皂苷F2靶点20个;在disgenet、malacards和OMIM数据库中共筛选出胃癌相关靶点189个。随后将人参皂苷Rd、F2的PPI网络分别与胃癌的PPI网络取交集获得人参皂苷Rd治疗胃癌的PPI网络和人参皂苷F2治疗胃癌的PPI网络,经过筛选后得到人参皂苷Rd治疗胃癌的关键靶点64个以及人参皂苷F2治疗胃癌的关键靶点56个。GO分析结果显示人参皂苷Rd共包含了869个生物过程,109个细胞组分以及104个分子功能;人参皂苷F2包含了801个生物过程,93个细胞组分以及86个分子功能。此外,KEGG结果表明人参皂苷Rd治疗胃癌所涉及的通路包括PI3K-Akt 信号通路, FoxO信号通路,ErbB信号通路,HIF-1t信号通路,MAPK信号通路等等;而人参皂苷F2治疗胃癌所涉及的通路包括PI3K-Akt 信号通路,MAPK信号通路, NF-kB信号通路等等。
分析人参皂苷Rd及人参皂苷F2的生物学过程可知,上述两种人参皂苷的生物学过程主要与细胞对氮化合物的反应、细胞周期过程的调节、细胞对 DNA 损伤刺激的反应、DNA代谢过程的调节、DNA结合转录因子活性的正调节等有关。而这些生物学过程皆与细胞凋亡有所关联,表明上述两种人参皂苷的抗胃癌途径可能与凋亡途径相关。此外,KEGG结果表明人参皂苷Rd及人参皂苷F2调节胃癌的相关通路及其的一致。其中,PI3K-Akt 信号通路以及MAPK信号通路是调控胃癌的关键信号通路,已有相关实验证实上述两条通路在胃癌的发生发展中扮演了重要的角色。例如,PI3K-Akt通路的异常激活可诱导胃癌细胞存活和转移,也可通过诱导抗凋亡基因和促凋亡基因的失调而导致癌细胞逃脱凋亡[16,17];MAPK通路通过COX-2的诱导参与了NF-κB的激活,促进了GC细胞的增殖等[18]。此外,大量文献报道,通过调控PI3K-Akt 信号通路以及MAPK信号通路,可诱导胃癌细胞凋亡,从而发挥药物的抗胃癌活性[19-24]。例如,人参皂苷通过激活MAPK通路,促进细胞自噬,并在G2/M过渡期间阻断胃癌细胞周期,从而发挥抗胃癌活性;血竭素高氯酸盐抑制PI3K/Akt和NF-κB的激活,上调P53的表达,促进胃癌细胞凋亡等等。因此,笔者认为人参皂苷Rd及人参皂苷F2可能通过抑制PI3K-Akt 信号通路,MAPK信号通路, HIF-1t信号通路,ErbB信号通路,特别是PI3K-Akt 信号通路以及MAPK信号通路,促进胃癌凋亡、抑制增殖,从而发挥治疗胃癌的作用。然而,网络药理学结果仅是一种预测,且存在一定缺陷。故有必要进行体内外实验加以验证。网络药理学在实际应用时应注重与体内外实验和临床研究相结合,以验证网络药理学预测结果的准确性。
此外,网络药理学是预测药物与疾病靶点的学科,但并不能直接推测药物对疾病是否具有活性。笔者对已知的数据库进行了检索,并未发现人参皂苷Rb1抗胃癌的报道。人参皂苷Rb1的肠道菌群转化物-人参皂苷Rd及F2已被报道具有抗胃癌活性,但是其机制却并不清晰。因此,本研究是基于已知人参皂苷Rb1的肠道菌群转化物-人参皂苷Rd及F2具有抗胃癌活性的前提下,对其未知的抗癌机制的进行预测,为后续实验提供方向。值得注意的是,人参皂苷Rb1的肠道菌群转化物-人参皂苷Rd及F2在体内是同时存在的。尽管两者结构相似,但仍有所不同,两者之间的抗胃癌作用机制可能有所区别。因此,本课题分别对人参皂苷Rd及F2的抗胃癌机制进行网络药理学分析,结果表明除了共有通路PI3K-Akt信号通路与MAPK信号通路有相关性的差距外,人参皂苷Rd似乎还可以通过FoxO信号通路,ErbB信号通路和HIF-1t信号通路调控胃癌,而人参皂苷F2似乎还能通过NF-κB通路调控胃癌。上述结果表明两种人参皂苷可能因其结构差异导致其抗癌机制上的不同,尽管需要进一步的实验验证。
综上所述,人参皂苷Rd及人参皂苷F2治疗胃癌可能是通过参与机体的细胞对氮化合物的反应、细胞周期过程的调节、细胞对 DNA 损伤刺激的反应、DNA代谢过程的调节、DNA结合转录因子活性的正调节等生物过程,调控PI3K-Akt 信号通路,MAPK信号通路, HIF-1t信号通路,ErbB信号通路等发挥抗胃癌活性。本课题通过利用现代生物信息学技术,充分理解了蛋白与蛋白间的关系网络,并对人参皂苷Rd及人参皂苷F2治疗胃癌的可能作用机制进行探讨。该方法亦体现了中药活性成分治疗疾病的多靶点及多通路协同作用的特征。这为下一步研究人参皂苷Rd及人参皂苷F2治疗胃癌的分子机制提供方向,亦为临床合理应用人参皂苷提供了科学依据。
