余甘子总酚对动脉粥样硬化ApoE-/-小鼠肝脏保护作用机制的研究*
2022-10-13邓欣孟达吴静宜姜丙通张雅琼赵毅车彦云
邓欣, 孟达, 吴静宜, 姜丙通, 张雅琼, 赵毅, 车彦云
余甘子总酚对动脉粥样硬化-/-小鼠肝脏保护作用机制的研究*
邓欣, 孟达, 吴静宜, 姜丙通, 张雅琼, 赵毅, 车彦云△
(云南省高校药食同源养生产品工程研究中心,云南中医药大学,云南 昆明 650500)
研究余甘子总酚对载脂蛋白E基因敲除(-/-)动脉粥样硬化模型小鼠的肝脏保护作用,初步探讨其作用机制。建立高脂饮食诱导的-/-小鼠动脉粥样硬化模型,给予余甘子总酚灌胃8周后,酶联免疫法检测小鼠血清中天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)水平;观察小鼠肝脏病理模型切片;酶联免疫法检测小鼠肝脏组织匀浆中的总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、白细胞介素6(IL-6)、IL-1β和肿瘤坏死因子α(TNF-α)的水平;Western blot法检测小鼠肝脏组织相关蛋白的表达。余甘子总酚干预可降低-/-小鼠血清中AST和ALT水平(0.05),减缓小鼠肝脏脂肪性病变及炎症细胞浸润现象;同时,余甘子总酚可显著降低肝脏组织匀浆中TC、TG和LDL-C水平,提高HDL-C水平(0.05),显著降低炎症因子IL-6、IL-1β和TNF-α含量(0.05);此外,余甘子总酚还可显著升高模型小鼠肝脏组织ATP结合盒转运体A1(ABCA1)蛋白水平(0.05),降低小鼠肝脏组织清道夫受体CD36和类固醇受体RNA激活物1(SRA1),以及Toll样受体4(TLR4)和核因子κB(NF-κB) P65蛋白表达水平(0.05)。余甘子总酚可减少肝脏内胆固醇蓄积和炎症因子的释放,从而减轻动脉粥样硬化小鼠肝脏脂肪性病变和炎症反应。
余甘子总酚;动脉粥样硬化;肝;脂质代谢;炎症
动脉粥样硬化(atherosclerosis, AS)是一种发病机制复杂的慢性疾病,可诱发一系列心脑血管疾病,严重威胁人类生命安全[1-4]。研究发现AS发病机制与脂质代谢紊乱和炎症反应密切相关[5-11]。肝脏在脂质代谢及炎症反应中发挥重要作用,肝脏作为体内脂质代谢的重要场所之一,过多的脂质累积在肝脏,将引起肝脏细胞对脂质过度摄取及合成,当脂肪的合成速度大于其转运速度及氧化消耗后,会使肝脏产生脂肪性病变。同时,肝脏内堆积的大量游离脂肪酸及其他脂类代谢中间产物,将会进一步严重损伤肝脏细胞的正常功能,从而诱发一系列炎症反应、肝脏纤维化,病程加重后会致使肝脏细胞的坏死和凋亡。肝脏损伤后,体内缺乏正常脂质代谢,将会加速AS病变进程[12-14]。
余甘子为大戟科叶下珠属植物余甘子(L.)成熟干燥的果实,具有清热凉血,消食健胃,生津止咳的功效[15]。余甘子作为药食同源的中药材之一,在我国资源丰富且民间应用历史悠久,常用于治疗血热血瘀,消化不良,腹胀,咳嗽,喉痛,口干等[16-17]。现代药理研究发现,余甘子提取物具有抗氧化、降血糖、抗肿瘤、抗炎和保肝等生物活性[18-21]。临床研究表明,余甘子提取物具有明显的抗AS作用[22-23]。其中,余甘子总酚(total phenol fromL., PE)中的鞣质类成分对肝脏有较好的保护作用,可减缓非酒精性脂肪肝组织损伤及其诱发的炎症[24-30]。本实验拟观察PE对高脂饮食诱导的载脂蛋白E(apolipoprotein E,)基因敲除(-/-)小鼠AS模型肝脏脂肪性病变和炎症反应的作用,并初步探讨其机制。
材料和方法
1 材料与试剂
SPF级-/-雄性小鼠58只(体重18~22 g),SPF级C57小鼠18只(体重18~22 g),均由昆明楚商科技有限公司提供,生产许可证号为SCXK(湘)2019-0004。
余甘子(2020年购于云南省楚雄州),由云南中医药大学中药学院饶高雄教授鉴定为大戟科叶下珠属植物余甘子成熟干燥果实,其凭证标本保存于云南省高校药食同源养生产品工程研究中心;高脂饲料购于昆明楚商科技有限公司(其含有脂肪21%,胆固醇0.15%);阿托伐他汀钙片(辉瑞制药有限公司)。色谱级乙腈和甲醇(Fisher);单体对照品没食子酸(gallic acid)、鞣花酸(ellagic acid)、柯里拉京(corilagin)、老鹳草素(geraniin)、紫云英苷(astragalin)、没食子酸甲酯(methyl gallate)、金丝桃苷(hyperoside)和没食子酸乙酯(ethyl gallate)均购自国药集团化学试剂有限公司(纯度≥98.0%);D-101大孔树脂(青岛海洋化工厂);纯水为Milli-Q系统纯化水;其他试剂均为分析纯。
天冬氨酸转氨酶(asprtate transaminase, AST)、丙氨酸转氨酶(alanine aminotransferase, ALT)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)试剂盒均由南京建成生物工程研究所提供;小鼠肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) ELISA试剂盒、小鼠白细胞介素6(interleukin-6, IL-6) ELISA试剂盒和小鼠IL-1β ELISA试剂盒均由联科生物技术股份有限公司提供;CD36抗体、P65抗体、GAPDH抗体和山羊抗兔IgG抗体均购自武汉三鹰生物技术有限公司;ATP结合盒转运体A1(ATP binding cassette transporter A1, ABCA1)抗体购自Cell Signaling Technology;Toll样受体4(Toll-like receptor 4, TLR4)和类固醇受体RNA激活物1(steroid receptor RNA activator 1, SRA1)抗体购自Proteintech;β-actin抗体购自北京中杉金桥公司。
2 仪器
色谱柱:Shim-Pack GIST C18(2.1 mm × 50 mm,2 μm);超高效液相色谱三重四极杆串联质谱仪,型号为LCMS-8050 (SHIMADZU)。
3 实验方法
3.1PE的制备及其含量测定
3.1.1PE的制备新鲜余甘子切片,采用真空冷冻干燥器于-40 ℃下预冷15 min,然后于-25 ℃、50 Pa下冻干,得到含水量8%的干燥品;将干燥品全部投料于低温超微粉碎机中,设置-10 ℃条件下进行超微粉碎,收集粉末进行400目过筛,后得到了黄绿色的余甘子粉末。所得余甘子粉末,加入5倍量的50%乙醇超声提取3次,收集上清液合并,经减压回收乙醇后得粗提物,再烘干。烘干后的粗提物应用D-101型大孔树脂洗脱,收集70%乙醇洗脱物,经MCI纯化后,得PE提取物。供试品和对照品的制备:供试品和对照品用甲醇充分溶解,稀释至50 mg/L,过0.22 μm有机微孔滤膜即得,采用超高效液相色谱-高分辨飞行时间质谱联用技术(UPLC-Q-TOF-MS/MS)分析。
3.1.2UPLC-Q-TOF-MS/MS分析色谱柱:Shim-Pack GIST C18(2.1 mm × 50 mm,2 μm);柱温40 ℃;流动相A为超纯水,流动相B为色谱级甲醇溶液;洗脱程序:0~1 min:20% B; 1~5 min: 20%~80% B; 5~8 min: 80% B;进样量10 μL;流速0.3 mL/min。电喷雾离子源;扫描方式:负离子模式;正离子模式;MRM模式;离子源温度150 ℃;毛细管电压2.1 kV;锥孔电压40 V;脱溶剂气流速(N2) 800 L/h;脱溶剂气温度400 ℃;锥孔反吹气流速(N2) 150 L/h;碰撞氩气流速(Ar)0.13 mL/min;质量扫描范围m/z 100~1 200。
3.2高脂饮食诱导-/-小鼠AS模型建立饲养环境:室内温度(24±2) ℃,室内相对湿度(45±3)%,保持光照每天12 h。
雄性健康的-/-小鼠8只,雄性健康的C57小鼠8只,经专业人员体检后饲养于实验专用鼠笼,喂食标准饲料,正常饮水。适应环境喂养一周后,称重记录,C57小鼠作为正常组,-/-小鼠作为模型组,正常组继续用正常鼠料饲养,模型组给予特制的高脂饲料饲养,饲养8周后处死小鼠,完整分离受试的整根胸主动脉,进行油红O染色和Movat染色观察病理情况。
3.3PE对-/-小鼠AS模型的肝保护作用
3.3.1实验分组雄性健康的-/-小鼠50只,雄性健康的C57小鼠10只,经专业人员体检后于合格饲养环境及条件下适应性饲养1周,后利用随机数字表法将50只-/-小鼠分为AS模型组,阳性药物阿托伐他汀钙片(atorvastatin)组及低剂量PE(low-dose of PE,L-PE)、中剂量PE(medium-dose of PE,M-PE)、高剂量PE(high-dose of PE,H-PE)组等5个组(每组10只),另设10只C57小鼠作为正常对照(control)组。正常组和AS模型组分别给予0.02 mL/g体积的生理盐水,阳性药物(10 mg·kg-1·d-1)和低、中、高剂量(75,150,300 mg·kg-1·d-1)PE组连续按剂量给药8周(均为灌胃给药)。给药期间,正常组投喂定量的标准鼠料,其余5组均投喂定量的高脂饲料。
3.3.2待测样的制备及肝指标的测定6组小鼠均在第8周周末(最后一次给药)后,开始禁食(但不禁水),12 h后,小鼠眼球取血,分离血清,检测小鼠血清中AST和ALT水平;处死小鼠,无菌环境下打开胸腔,分离受试肝脏,左部整片肝叶用4%多聚甲醛固定,供组织病理学检查,右部肝叶部分制备成10%肝组织匀浆,用于测定相应生化指标(血脂四项以及炎症因子),其剩余部分制备肝脏总蛋白,用于相关蛋白含量的检测。
4 统计学处理
本实验数据均采用均数±标准差(mean±SD)来表示,采用IBM SPSS Statistics 26.0软件进行数据分析处理后采用GraPhPad Prism 8.0软件作图。分析时,多组间比较利用单因素方差分析(one-way ANOVA),两组间采用LSD检验或者Tukey检验进行比较。以0.05为差异有统计学意义。
结果
1 PE的含量测定
在负离子扫描模式下PE的总离子流图中,共检测到8种与对照品峰形和出峰时间十分相近的化合物,见图1及表1。各化合物的含量分别是37.853 8 mg/g(柯里拉京)、25.531 3 mg/g(老鹳草素)、19.127 3 mg/g(没食子酸)、1.510 5 mg/g(没食子酸甲酯)、0.000 4 mg/g(没食子酸乙酯)、0.247 7 mg/g(紫云英苷)、0.264 9 mg/g(金丝桃苷)和0.002 7 mg/g(鞣花酸)。

Figure 1. Total ion flow diagram of 8 chemical components.

表1 8种化学成分监测离子对及质谱参数
2 ApoE-/-小鼠AS模型建立
在大体油红O染色中:正常组主动脉血管上未观察到明显脂质沉积,模型组主动脉血管上可见脂质沉积;Movat染色中:正常组主动脉窦未见泡沫细胞堆积,模型组主动脉窦有大量的泡沫细胞堆积,说明-/-小鼠AS病理模型建立成功,见图2。
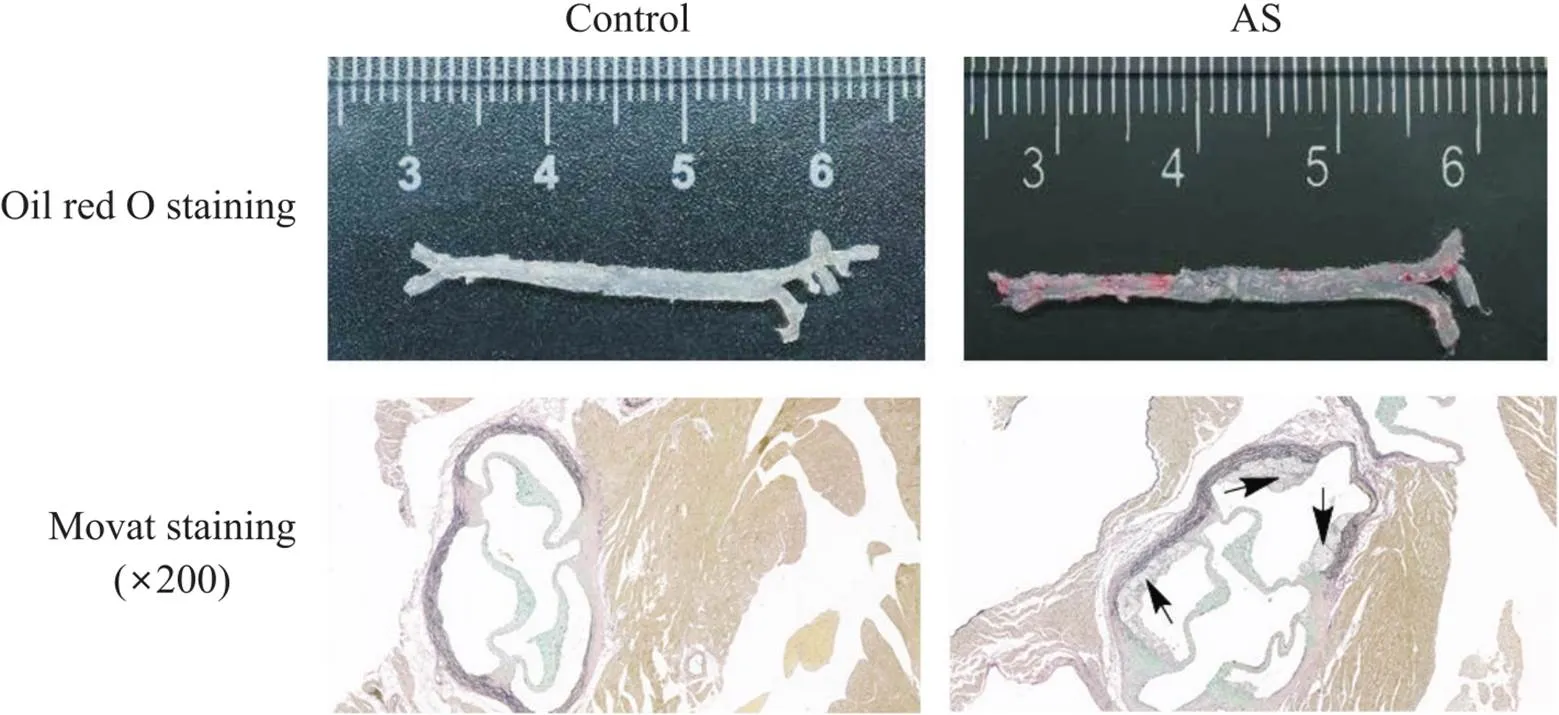
Figure 2. Histopathological changes of arteries in mice. Total aortic oil red O staining and Movat staining of aortic sinus were shown.
3 PE对ASApoE-/-小鼠的肝保护作用
3.1小鼠血清生化指标影响模型组小鼠血清中的AST和ALT含量较正常组显著升高(0.01),给予阳性药物干预后的小鼠血清AST和ALT含量较模型组显著降低(0.01),给予中、高剂量PE干预后的小鼠血清AST和ALT含量水平也显著降低(0.05),见表2。

表2 PE对小鼠血清中AST和ALT水平的影响
##<0.01control group;**<0.01AS group.
3.2小鼠肝脏病理情况模型组高脂饮食喂养的小鼠,其肝细胞排列紊乱、体积增大,细胞内有空泡出现,部分核空泡和胞浆内空泡融合,变成了大的脂肪空泡,表明高脂饮食可使小鼠肝脏产生脂肪性病变,肝脏组织汇管区及胆管周围出现了明显的炎症细胞浸润现象,表明高脂饮食可能致使小鼠肝脏炎症现象发生。给予阳性药物或中、高剂量PE治疗组,小鼠肝脏脂肪性病变和损伤性炎症现象减轻,见图3。

Figure 3. Effect of PE on pathological changes of the liver in ApoE-/- mice (×200).
3.3小鼠肝脏匀浆中TC、TG、LDL-C和HDL-C含量高脂饮食喂养的小鼠,其肝脏中TC、TG和LDL-C含量较正常饲料饲养组显著升高(0.05),而HDL-C含量较正常饲料饲养组显著降低(0.01)。给予阳性药物干预后的小鼠肝脏匀浆中TC、TG和LDL-C含量显著降低(0.01),HDL-C含量极其显著提高(0.01),给予中、高剂量PE干预后的小鼠肝脏匀浆中TC、TG和LDL-C含量也显著降低(0.05),HDL-C的含量显著提高(0.05),见图4。
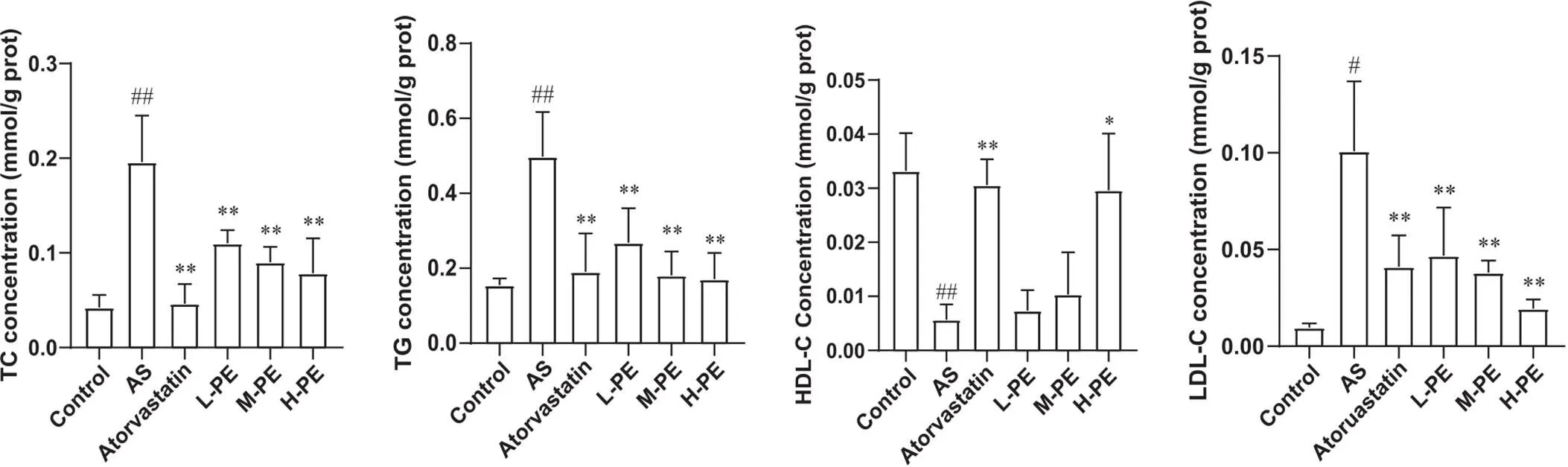
Figure 4. Effect of PE on TC, TG, LDL-C and HDL-C levels in the liver of ApoE-/- mice. Mean±SD. n=10. #P<0.05, ##P<0.01 vs control group; *P<0.05, **P<0.01 vs AS group.
3.4小鼠肝脏匀浆中IL-6、IL-1β和TNF-α含量高脂饮食喂养的小鼠肝脏匀浆中IL-6、IL-1β和TNF-α含量水平较正常饲料饲养组显著升高(0.05)。给予阳性药物干预后的小鼠肝脏匀浆中IL-6、IL-1β和TNF-α含量水平显著降低(0.01),给予中、高剂量PE干预后的小鼠肝脏匀浆中IL-6、IL-1β和TNF-α含量水平也显著降低(0.05),见图5。

Figure 5. Effect of PE on the levels of IL-6, IL-1β and TNF-α in the liver of ApoE-/- mice. Mean±SD. n=10. #P<0.05, ##P<0.01 vs control group; *P<0.05, **P<0.01 vs AS group.
3.5小鼠肝脏组织中相关蛋白表达水平
3.5.1小鼠肝脏组织中脂质代谢相关蛋白表达水平模型组小鼠肝脏组织ABCA1蛋白表达水平显著降低(0.01),而CD36和SRA1蛋白表达水平显著升高(0.01);阳性药物以及PE干预均显著升高小鼠肝脏组织ABCA1蛋白表达水平(0.05),显著降低小鼠肝脏组织CD36和SRA1蛋白表达水平(0.05),且呈剂量依赖性,见图6。

Figure 6. Effect of PE on lipid metabolism-related protein expression in the liver of ApoE-/- mice. Mean±SD. n=10. #P<0.05, ##P<0.01 vs control group; *P<0.05, **P<0.01 vs AS group.
3.5.2小鼠肝脏组织中炎症相关蛋白表达水平模型组小鼠肝脏组织TLR4和NF-κB P65蛋白表达水平显著升高(0.01);而阳性药物以及PE干预组小鼠肝脏组织TLR4和NF-κBP65蛋白表达水平均显著降低(0.05),且成剂量依赖性,见图7。
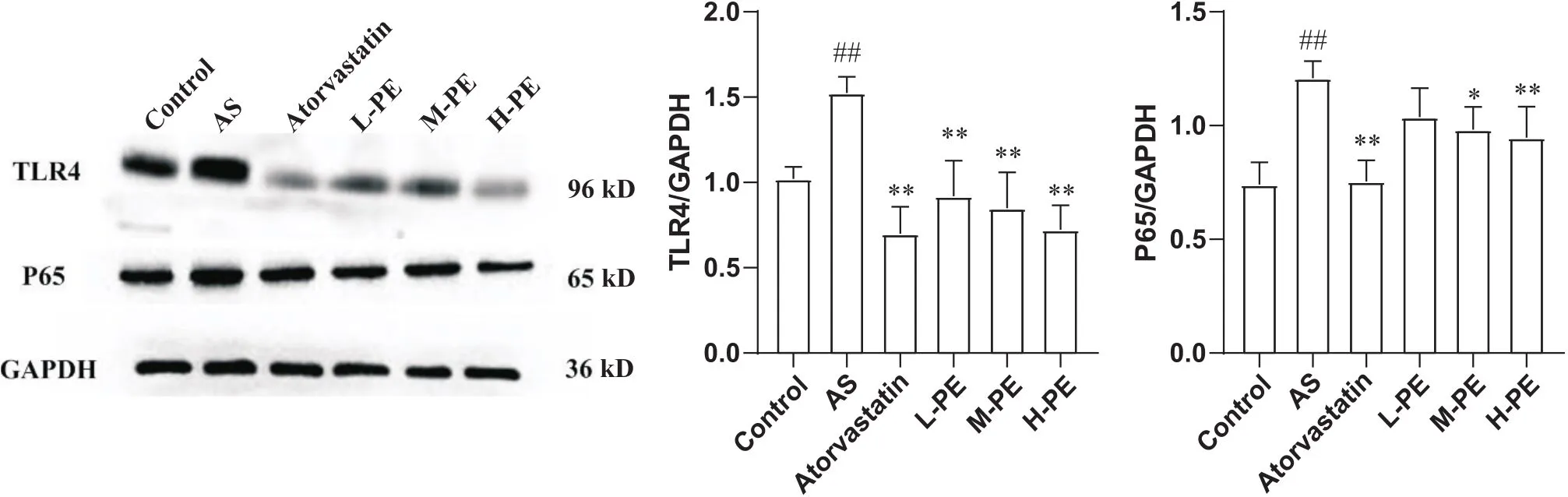
Figure 7. Effect of PE on inflammation-related protein expression in the liver of ApoE-/- mice. Mean±SD. n=10. #P<0.05, ##P<0.01 vs control group; *P<0.05, **P<0.01 vs AS group.
讨论
ApoE是一种多功能蛋白,且具有显著的基因多态性,因其可直接影响脂蛋白的功能,故对人体脂质代谢有重要意义。近年来学者们常以ApoE小鼠模型作为研究预防或治疗AS、糖尿病、神经退化性疾病等的病理模型[31-32]。本实验通过高脂饲料喂养ApoE小鼠8周,成功获得了ApoE小鼠AS模型,为研究的开展提供了前提条件。血清中ALT和AST含量水平的变化,常用来反映肝脏损伤的程度,AST活性增高,提示肝细胞线粒体受损伤;ALT活性增高,提示肝细胞膜破坏和细胞膜通透性增加[33-34]。本实验结果显示,PE中、高剂量组小鼠血清ALT和AST水平显著低于模型组,且具有剂量依赖性,提示PE具有保护肝脏组织的作用。应用HE染色和测定肝脏组织匀浆TC、TG、LDL-C、HDL-C、IL-6、IL-1β和TNF-α含量水平进一步验证,结果显示,PE中、高剂量组小鼠肝脏脂肪性病变以及炎症情况明显减轻,肝脏组织匀浆中TC、TG和LDL-C含量显著降低,HDL-C的含量显著提高,同时,肝脏组织匀浆中炎症因子指标IL-6、IL-1β和TNF-α含量水平也显著降低,提示PE既改善了-/-小鼠肝脏脂质代谢,又抑制了肝损过程中的炎症反应。本实验模型组肝脏组织仅出现了脂肪病变以及炎症反应,暂无坏死的情况发生,对于肝脏组织的进一步病理形态变化的研究,还需增加实验时长进行观察。
肝脏是胆固醇代谢的中心器官,研究发现[35-38],胆固醇代谢紊乱可引起肝脏脂肪病变以及AS发生,而CD36、SRA1和ABCA1蛋白与胆固醇代谢密切相关,清道夫受体CD36和SRA1蛋白可调控巨噬细胞对胆固醇的吸收,ABCA1可促进细胞内游离胆固醇的外流。本实验对CD36、SRA1和ABCA1蛋白水平分别进行检测,发现PE可显著降低小鼠肝脏组织CD36和SRA1蛋白表达水平,同时,还可显著升高小鼠肝脏组织ABCA1蛋白表达水平,提示PE既可以抑制胆固醇吸收,又可以促进胆固醇进行逆向运转排出。SRA1蛋白作为A族清道夫受体之一,是一个多功能受体,可以促进巨噬细胞对脂质的摄取。现代药理研究发现[39-40],SRA可诱导MyD88依赖的toll样受体4信号通路的激活,并抑制TLR4依赖的IRF3激活。当TLR4信号通路被激活后,会诱导NF-κB通路的激活,NF-κB作为炎症最重要的调节因子之一,被激活后,会导致炎症的发生,加重AS进程[41-43]。本实验中,仅检测了NF-κB通路中的两个代表性蛋白表达水平,其通路上下游的蛋白表达情况,有待进一步的实验研究。
综上所述,PE通过抑制胆固醇吸收和促进胆固醇进行逆向运转排出,来缓解小鼠肝脏脂质代谢异常。同时,PE还可以通过下调TLR4和NF-κB P65蛋白水平,抑制肝脏的炎症反应,提示余甘子对预防AS所致的肝脏损伤有一定的作用。
[1] Virani SS, Alonso A, Benjamin EJ, et al. Heart disease and stroke statistics-2020 update: a report from the American Heart Association[J]. Circulation, 2020,141(9):e139-e596.
[2] Balarastaghi S, Rezaee R, Hayes AW, et al. Mechanisms of arsenic exposure-induced hypertension and atherosclerosis: an updated overview[J/OL]. Biol Trace Elem Res, 2022 (2022-02-15) [2022-04-25]. https://link.springer.com/article/10.1007/s12011-022-03153-2.
[3] Chen L, Bi Y, Su J, et al. Physical activity and carotid atherosclerosis risk reduction in population with high risk for cardiovascular diseases: a cross-sectional study[J]. BMC Public Health, 2022, 22(1):250.
[4]北京高血压防治协会, 北京糖尿病防治协会, 北京慢性病防治与健康教育研究会, 高血压联盟(中国),中国老年保健协会养老与健康专业委员会, 国家老年疾病临床医学研究中心中国老年心血管病防治联盟. 基层心血管病综合管理实践指南2020[J]. 中国医学前沿杂志(电子版), 2020, 12(8):1-73.
Beijing Hypertension Association, Beijing Diabetes Prevention and Treatment Association, Beijing Research for Chronic Diseases Control and Health Education. Practice guideline(2020) for integrated management of cardiovascular diseases in prumary hospitals[J]. Chin J Front Med Sci (Electron Version), 2020, 12(8):1-73.
[5] Zeb I, Jorgensen NW, Blumenthal RS, et al. Association of inflammatory markers and lipoprotein particle subclasses with progression of coronary artery calcium: the multi-ethnic study of atherosclerosis[J]. Atherosclerosis, 2021, 339:27-34.
[6] Poznyak AV, Nikiforov NG, Starodubova AV, et al. Macrophages and foam cells: brief overview of their role, linkage, and targeting potential in atherosclerosis[J]. Biomed, 2021, 9(9):1221.
[7] Patriki D, Saravi SSS, Camici GG, et al. PCSK 9: a link between inflammation and atherosclerosis[J]. Curr Med Chem, 2022, 29(2):251-267.
[8] Kotlyarov S, Kotlyarova A. The Role of ABC transporters in lipid metabolism and the comorbid course of chronic obstructive pulmonary disease and atherosclerosis[J]. Int J Mol Sci, 2021, 22(13):6711.
[9] Xu M, Lv C, Wang H, et al. Peanut skin extract ameliorates high-fat diet-induced atherosclerosis by regulating lipid metabolism, inflammation reaction and gut microbiota in-/-mice[J]. Food Res Int, 2022, 154:111014.
[10] 冷雪, 吴瑶, 王莹, 等. 动脉粥样硬化小鼠肝脏脂质代谢相关的PPAR-γ/LXR-α/ABCG1通路及炎症因子的变化和化瘀祛痰方在其中的作用[J]. 中国病理生理杂志, 2020, 36(4):637-643.
Leng X, Wu Y, Wang Y, et al. Changes of liver lipid metabolism-related PPAR-γ/LXR-α/ABCG1 pathways and inflammatory factors in atherosclerotic mice and role of HuayuQutan recipe[J]. Chin J Pathophysiol, 2020, 36(4):637-643.
[11] 于永慧, 董瑞红, 刘剑刚, 等. 不同阶段-/-小鼠动脉粥样硬化炎症差异基因表达的比较研究[J]. 中国病理生理杂志, 2019, 35(9):1694-1699.
Yu YH, Dong RH, Liu JG, et al. Preliminary comparison of inflammatory differential gene expression during atherosclerosis in-/-mice[J]. Chin J Pathophysiol, 2019, 35(9):1694-1699.
[12] Popov SS, Kryl'skii ED, Shulgin KK, et al. Inflammation is associated with impairment of oxidative status, carbohydrate and lipid metabolism in type 2 diabetes complicated by nonalcoholic fatty liver disease[J/OL]. Minerva Endocrinol (Torino), 2022 (2022-02-23) [2022-04-25]. https://www.minervamedica.it/en/journals/minerva-endocrinology/article.php?cod=R07Y9999N00A22022301. DOI: 10.23736/S2724-6507.20.03257-5.
[13] 陈玄晶, 吴炳鑫, 吴焕林, 等. 温胆汤通过调节胆固醇逆转运相关膜蛋白表达抑制-/-小鼠动脉粥样硬化斑块形成[J]. 中国病理生理杂志, 2020, 36(12):2123-2132.
Chen XJ, Wu BX, Wu HL, et al. Inhibitory effect of Wendan decoction on atherosclerotic plaque formation in-/-mice by regulating expression of membrane proteins involved in reverse cholesterol transport[J]. Chin J Pathophysiol, 2020, 36(12):2123-2132.
[14] 吴瑶, 宋囡, 贾连群, 等. 丹参酮A对-/-小鼠肝脏脂质沉积及铁死亡相关蛋白表达的影响[J]. 中国病理生理杂志, 2020, 36(7):1261-1268.
Wu Y, Song N, Jia LQ, et al. Effect of tanshinone IIA on liver lipid deposition and ferroptosis-related protein expression in-/-mice[J]. Chin J Pathophysiol, 2020, 36(7):1261-1268.
[15] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2020:186.
National Pharmacopoeia Commission. Chinese Pharmacopoeia: Part One[M]. Beijing: China Medical Science Press, 2020:186.
[16] 杨崇仁, 张颖君, 王海涛, 等. 余甘子应用源流考[J].亚太传统医药, 2021, 17(2):197-200.
Yang CR, Zhang YJ, Wang HT, et al. Study on the source of fruit emblic[J]. Asia Pac Tradit Med, 2021, 17(2):197-200.
[17] 刘雄芳, 李太强, 李正红, 等. 重要食药两用植物余甘子遗传改良研究进展[J]. 分子植物育种, 2018, 16(7):2300-2305.
Liu XF, Li TQ, Li ZH, et al. Research progress of genetic improvements in the important medical and edible plantL.[J]. Mol Plant Breed, 2018, 16(7):2300-2305.
[18] Iamsaard S, Arun S, Burawat J, et al. Phenolic contents and antioxidant capacities of Thai-Makham Pom (L.) aqueous extracts[J]. J Zhejiang Univ Sci B, 2014, 15(4):405-408.
[19] 兰杨, 姜红, 张仕瑾, 等. 余甘子化学成分、药理活性及质量控制提升的研究进展[J]. 中国药业, 2020, 29(7): 156-159.
Lan Y, Jiang H, Zhang SJ, et al. Research progress on chemical constituents, pharmacological activities and quality control of[J]. Chin Pharm, 2020, 29(7):156-159.
[20] 关陟昊, 单治易, 王雪,等. 基于“成分-靶点-通路”的余甘子网络药理学研究[J]. 中华医学图书情报杂志, 2021, 30(9):13-23.
Guan ZH, Shan ZY, Wang X, et al. “Ingredients-targets-pathways” based network pharmacology of emblic leafflower fruit[J]. Chin J Med Libr Inf Sci, 2021, 30(9):13-23.
[21] 陈静梅, 郝二伟, 杜正彩, 等. 基于化学成分、药理作用和网络药理学的余甘子质量标志物(Q-Marker)预测分析[J]. 中草药, 2022, 53(5):1570-1586.
Chen JM, Hao EW, Du ZC, et al. Predictive analysis on quality marker ofLinn based on chemical composition, pharmacological effects and network pharmacology[J]. Chin Tradit Herb Drugs, 2022, 53(5):1570-1586.
[22] Usharani P, Merugu PL, Nutalapati C. Evaluation of the effects of a standardized aqueous extract ofLinn fruits on endothelial dysfunction, oxidative stress, systemic inflammation and lipid profile in subjects with metabolic syndrome: a randomised, double blind, placebo controlled clinical study[J]. BMC Complement Altern Med, 2019, 19(1):97.
[23] 刘文杰. 余甘子防治动脉粥样硬化活性成分及机制研究[D]. 济南: 齐鲁工业大学, 2021.
Liu WJ. Study on the active components and mechanism ofL. for preventing atherosclerosis[D]. Jinan: Qilu University of Technology, 2021.
[24] Huang CZ, Tung YT, Hsia SM, et al. The hepatoprotective effect ofL. fruit on high fat diet-induced non-alcoholic fatty liver disease (NAFLD) in SD rats[J]. Food Funct, 2017, 8(2):842-850.
[25] 张毅. 基于现代药理的余甘子藏医药理论研究[J]. 中国民族医药杂志, 2021, 27(9):55-56.
Zhang Y. Study on the theory ofL. based on modern pharmacology[J]. J Med Pharm Chin Minorities, 2021, 27(9):55-56.
[26] 刘晓丽, 杨冰鑫, 陈柳青, 等. 余甘子多酚对体外酒精性肝损伤的保护作用[J].中国食品学报, 2021, 21(10):108-115.
Liu XL, Yang BX, Chen LQ, et al. Protective effect of polyphenols fromL. on alcoholic liver injury[J]. J Chin Inst Food Sci Technol, 2021, 21(10):108-115.
[27] 林敏华, 欧宇轩, 邓桂清, 等. 余甘子提取物对幼鼠非酒精性脂肪肝病的防治作用[J]. 解剖学研究, 2019, 41(5):412-417.
Lin MH, Ou YX, Deng GQ, et al. The preventive and therapeutic effect ofLinn extractive on nonalcoholic fatty liver disease in young rats[J]. Anat Res, 2019, 41(5):412-417.
[28]朱炜, 俞宏斌 ,戴闯, 等. 余甘子对大鼠非酒精性脂肪肝疾病中肝损伤和炎症的抑制作用研究[J]. 医学研究杂志, 2012, 41(2):140-143.
Zhu W, Yu HB, Dai C, et al. Study on the inhibitory effect ofLinn on liver injury and inflammation in rats with nonalcoholic fatty liver disease[J]. J Med Res, 2012, 41(2):140-143.
[29]张艳鹤, 郑亚云, 芦超, 等. 余甘子鞣质对代谢相关脂肪性肝病小鼠脂质代谢及肠道菌群的调节作用[J]. 药物评价研究, 2022, 45(2):287-293.
Zhang YH, Zheng YY, Lu C, et al. Effect and mechanism of tannin part ofon lipid metabolism and intestinal flora in MAFLD mice[J]. Drug Eval Res, 2022, 45(2):287-293.
[30] 尹可欢, 罗晓敏, 丁翼, 等. 余甘子及其活性成分肝保护作用及机制的研究进展[J]. 中草药, 2022, 53(1):295-307.
Yin KH, Luo XM, Ding Y, et al. Research progress on hepatoprotective effect and mechanism ofLinn and its active components[J]. Chin Tradit Herb Drugs, 2022, 53(1):295-307.
[31] 宋珂, 侯彦宏, 杨会, 等.基因敲除小鼠疾病模型的研究进展[J]. 中国医药导报, 2019, 16(18):42-44, 48.
Song K, Hou YH, Yang H, et al. Advances in research on disease model ofknockout mice[J]. China Med Her, 2019, 16(18):42-44, 48.
[32]董文娟, 辛效毅, 王记鹏. 降浊升清法对抗动脉粥样硬化炎症反应及干预NF-κB的动物实验研究[J]. 吉林中医药, 2012, 32(1):70-72.
Dong WJ, Xin XY, Wang JP. Experimental study on anti-inflammatory response and NF-κB intervention in atherosclerosis by reducing turbidity and promoting clarity[J]. Jilin J Chin Med, 2012,32(1):70-72.
[33] 曹庆生, 李志超, 杨宝友, 等. 矮地茶黄酮对四氯化碳致小鼠急性肝损伤的保护作用[J]. 华西药学杂志, 2016, 31(1):43-45.
Cao QS, Li ZC, Yang BY, et al. Protective influence of the flavonoids of ardisia japonica on acute liver injury in the mice caused by carbon tetrachloride[J]. West Chin J Pharm Sci, 2016, 31(1):43-45.
[34] 杨佳明, 孟宪兰, 王丹萍, 等. 柳蒿化学成分的含量测定及肝损伤保护作用的研究[J]. 人参研究, 2020, 32(4):40-44.
Yang JM, Meng XL, Wang DP, et al. Determination the constituents ofLinn study the protective effect of injury[J]. J Ginseng Res, 2020, 32(4):40-44.
[35] 林洁, 陈玉霞, 章卫平. 肝脏调节胆固醇代谢稳态的研究进展[J]. 中国动脉硬化杂志, 2022, 30(9):737-743.
Lin J, Chen YX, Zhang WP. Progress in liver regulation of cholesterol homeostasis[J]. Chin J Arterioscler, 2022, 30(9):737-743.
[36] 孟达, 邓欣, 饶高雄, 等. 余甘子总酚对RAW264.7巨噬细胞源泡沫细胞胆固醇代谢的影响研究[J]. 中药药理与临床, 2022, 38(1):77-81.
Meng D, Deng X, Rao GX, et al. Effects of total phenols ofon cholesterol metabolism of RAW264.7 macrophage-derived foam cells[J]. Pharmacol Clin Chin Mater Med, 2022, 38(1):77-81.
[37] Moore KJ, Sheedy FJ, Fisher EA. Macrophages in atherosclerosis: a dynamic balance[J]. Nat Rev Immunol, 2013, 13(10):709-721.
[38] Zeng Y, Peng Y, Tang K, et al. Dihydromyricetin ameliorates foam cell formation via LXRα-ABCA1/ABCG1-dependent cholesterol efflux in macrophages[J]. Biomed Pharmacother, 2018, 101:543-552.
[39] 李嘉慧, 王欣佩 ,冷静. TLR4/NF-κB参与动脉粥样硬化发生发展机制的研究进展[J]. 中国比较医学杂志, 2021, 31(4):137-142.
Li JH, Wang XP, Leng J. The mechanism of TLR4/NF-κB in atherosclerosis[J]. Chin J Comp Med, 2021, 31(4):137-142.
[40] Ozment TR, Ha T, Breuel KF, et al. Scavenger receptor class a plays a central role in mediating mortality and the development of the pro-inflammatory phenotype in polymicrobial sepsis[J]. PLoS Pathog, 2012, 8(10):e1002967.
[41] Song R, Han S, Gao H, et al. Crocin alleviates cognitive impairment associated with atherosclerosis via improving neuroinflammation in-/-mice fed a high fat/cholesterol diet[J]. Phytother Res, 2022, 36(3):1284-1296.
[42] Bai Y, Li Z, Liu W, et al. Biochanin a attenuates myocardial ischemia/reperfusion injury through the TLR4/NF-κB/NLRP3 signaling pathway1[J]. Acta Cir Bras, 2019, 34(11):e201901104.
[43] Zhou Z, Yang B, Li X, et al. Lysophosphatidic acid promotes expression and activation of matrix metalloproteinase 9 (MMP9) in THP-1 cells via toll-like receptor 4/nuclear factor-κB (TLR4/NF-κB) signaling pathway[J]. Med Sci Monit, 2018, 24: 4861.
Total phenols fromL. alleviate fatty deposition and inflammation in liver of atherosclerotic-/-mice
DENG Xin, MENG Da, WU Jing-yi, JIANG Bing-tong, ZHANG Ya-qiong, ZHAO Yi, CHE Yan-yun△
(,,650500,)
To study the liver protective effect and mechanism of total phenols fromL. (PE)in-/-atherosclerosis mice.The atherosclerosis-/-mice were induced by a high-fat diet for 8 weeks. The levels of aspartate transaminase (AST) and alanine aminotransferase (ALT) in serum of mice were detected by ELISA. Meanwhile, the pathological sections of liver of mice were observed. The levels of total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C), high-density lipoprotein cholesterol (HDL-C), interleukin-6 (IL-6), IL-1β, and tumor necrosis factor-α (TNF-α) in mouse liver tissue homogenate were measured by enzyme-linked immunoassay. The expression of related proteins in liver tissues of mice was detected by Western blot.Serum AST and ALT levels in-/-mice were decreased by PE intervention (0.05).Lipid deposition and inflammatory factors were alleviated. The contents of TC, TG and LDL-C in liver homogenate were significantly decreased (0.05), while the content of HDL-C was increased (0.05). Meanwhile, the levels of IL-6, IL-1β and TNF-α were obviously suppressed by PE (0.05). In addition, the protein level of ATP binding cassette transporter A1 (ABCA1) in liver tissue of mice was significantly increased (0.05), while the levels of CD36 and steroid receptor RNA activator 1 (SRA1) in liver tissues were reduced. Moreover, the protein expression of Toll-like receptor 4 (TLR4) and nuclear factor-κB (NF-κB) P65 were decreased (0.05).Treatment with PE reduces the accumulation of cholesterol and the release of inflammatory factors in the liver, thus attenuating the fatty deposition and inflammation in the liver of atherosclerotic mice.
Total phenols fromL.; Atherosclerosis; Liver; Lipid metabolism; Inflammation
1000-4718(2022)09-1608-10
2022-04-27
2022-07-13
18213538189; E-mail: checpu@163.com
R543.5; R363.2
A
10.3969/j.issn.1000-4718.2022.09.010
[基金项目]云南省科技厅-云南中医药大学应用基础联合研究专项项目重点项目(No. 2019FF002-012);云南省科技厅-云南中医药大学应用基础联合研究专项项目面上项目(No. 202101AZ070001-212)
(责任编辑:宋延君,余小慧)
