稳定低表达GSNOR细胞系Neuro-2a的构建及其对S-亚硝基化的影响*
2022-10-13严洁萍韩臻平李婷婷王思懿高立罗双李汉兵黄萍
严洁萍, 韩臻平, 李婷婷, 王思懿, 高立, 罗双, 李汉兵, 黄萍,3
稳定低表达细胞系Neuro-2a的构建及其对-亚硝基化的影响*
严洁萍1,2,3△, 韩臻平1, 李婷婷2, 王思懿1, 高立2, 罗双2, 李汉兵1, 黄萍2,3
(1浙江工业大学药学院,浙江 杭州 310014;2浙江省人民医院/杭州医学院附属人民医院临床药学中心药学部,浙江 杭州 310014;3浙江省内分泌腺体疾病诊疗重点实验室,浙江 杭州 310014)
探讨转染慢病毒载体构建稳定低表达-亚硝基谷胱甘肽还原酶(-nitrosoglutathione reductase,)的小鼠神经母细胞瘤Neuro-2a细胞系,并考察稳定低表达对-亚硝基化修饰水平的影响。构建靶向的慢病毒载体,用LipoFiter™脂质体转染Neuro-2a细胞,并用嘌呤霉素筛选稳定低表达的细胞系。光镜观察Neuro-2a细胞的形态变化,CCK-8法检测转染不同时间后的细胞活力,RT-qPCR和Western blot检测GSNOR的mRNA和蛋白表达水平。生物素转换法检测转染后Neuro-2a细胞内总-亚硝基化蛋白水平。HBLV-m-ADH5-shRNA1-PURO慢病毒载体序列与目的序列结果一致,提示慢病毒载体构建成功。嘌呤霉素筛选后,光镜观察Neuro-2a细胞形态良好,CCK-8实验结果显示在24、48、72和96 h时点细胞活力无显著差异,提示转染对细胞活力无明显影响。转染第2、4和6代后细胞内GSNOR mRNA水平分别是空载病毒组的37.02%、40.66%和30.13%,均显著降低(<0.01),GSNOR蛋白表达水平较空载病毒组亦显著下降(<0.01)。此外,稳定低表达的Neuro-2a细胞中蛋白-亚硝基化修饰水平显著上调(<0.01)。稳定低表达的Neuro-2a细胞系构建成功,低表达可上调胞内总蛋白的-亚硝基化修饰水平。
-亚硝基谷胱甘肽还原酶;慢病毒;Neuro-2a细胞;-亚硝基化
-亚硝基谷胱甘肽还原酶(-nitrosoglutathione reductase, GSNOR)被认为是乙醇脱氢酶(alcohol dehydrogenase, ADH)家族成员之一,为主要代谢乙醇的酶系。是编码GSNOR的基因,位于人类4号染色体上(4q23-Chr4: 99993567-10000985)[1-2]。GSNOR的底物相较于其它类型的ADH有显著区别,其主要底物是-亚硝基谷胱甘肽(-nitrosoglutathione, GSNO)和-羟甲基谷胱甘肽(-hydroxymethylglutathione, HMGSH)[3]。
-亚硝基化(-nitrosylation)是由一氧化氮(nitric oxide, NO)介导的基于氧化还原反应的一种修饰,作用位点在半胱氨酸(cysteine, Cys)巯基(‒SH),Cys巯基被氧化修饰为-亚硝基硫醇(-nitrosothiols, SNOs),是一种常见的蛋白翻译后信号转导机制[3]。GSNO是机体-亚硝基化的主要调控因子。GSNOR介导的去亚硝基化就是NO基团从Cys巯基脱离,是NO信号通路的重要组分。GSNOR由NADH供能将GSNO催化转换为中间产物GSNHOH,进一步转换为二硫键形式的氧化型谷胱甘肽(oxidized glutathione, GSSG),GSSG再次还原为含疏基形式的谷胱甘肽(glutathione, GSH),这一过程被称为去亚硝基化[1, 4]。-亚硝基化水平因生理刺激而发生变化,一般由细胞表面受体转导,信号介导的NOS激活与蛋白-亚硝基化程度增加之间的关联广泛存在。内源性-亚硝基化具有很高的时空特异性,使有游离巯基的蛋白发生翻译后-亚硝基化修饰,具有激活特定蛋白活性、核质分布、蛋白稳定性以及蛋白间相互作用,参与损伤修复、应激状态激活信号通路等生物活性,参与心脑血管疾病、神经退行性疾病、肿瘤等众多疾病的发生、发展过程[1-2]。
GSNOR是目前脑中ADH主要成员,其参与大脑发育、神经分化、血管生成及损伤保护等众多病理生理过程。研究表明,过度表达可导致幼年和成年小鼠神经元分化减少,这与组蛋白脱乙酰酶2(histone deacetylase 2, HDAC2)的去亚硝基化作用相关[5];过表达通过调控神经生长因子(nerve growth factor, NGF)抑制神经突触生长,降低神经细胞分化比例;相反,敲除促进神经元分化,间接调节染色质重塑和控制神经元分化的基因表达[6]。上述研究均提示GSNOR参与神经系统疾病的发生、发展和预后,提示GSNOR可作为神经系统疾病发生发展的重要潜在靶点。
Neuro-2a细胞来源于小鼠神经母细胞瘤,具有神经生物学特性和内分泌功能,一般用于毒性筛选、神经分化、细胞损伤和药物干预的体外模型[7]。GSNOR调控去亚硝基化的作用,已见文献报道其下游靶蛋白参与神经发育、分化及损伤调控等重要过程[8-9]。本研究通过细胞转染和药物筛选等方法,获得稳定低表达的Neuro-2a细胞系,对细胞系中GSNOR表达进行验证,并检测转染后Neuro-2a细胞内S-亚硝基化水平,为进一步深入发掘GSNOR的调控靶蛋白,研究其调控靶蛋白、细胞损伤保护和毒性筛选等作用机制提供体外细胞模型。
材料和方法
1 主要试剂及仪器
DMEM培养液购自Gibco;和胎牛血清购自杭州四季青生物工程材料有限公司;PBS购自浙江森瑞生物技术有限公司;胰酶-EDTA购自HyClone;二甲基亚砜(dimethyl sulfoxide, DMSO)购自Sigma;LipoFiter™转染试剂和嘌呤霉素购自汉恒生物技术(上海)有限公司;Cell Counting Kit-8 (CCK-8)、RNA快速提取试剂盒和SYBR Green qPCR Mix等购自上海奕杉生物科技有限公司;支原体预防去除试剂购自上海碧云天生物技术有限公司;Biotin Switch Assay Kit (-nitrosylation)和抗GSNOR抗体购自Abcam;抗β-actin抗体和辣根过氧化物酶(horseradish peroxidase, HRP)标记的Ⅱ抗购自Cell Signaling Technology。
倒置显微镜(Nikon);Synergy LX酶标仪(BioTek);RT-qPCR仪(Roche);高速低温离心机(Thermo Fisher);Ion Torrent 3500基因测序仪(Thermo Fisher Scientific);电泳仪电源和凝胶成像分析系统(Bio-Rad)。
2 细胞系和质粒
小鼠Neuro-2a细胞系(批号:CCL-131)购自中国科学院上海细胞所。pHBLV-U6-MCS-PGK-PURO载体、psPAX2载体、pMD2G载体、基因干扰慢病毒及引物序列均由汉恒生物技术(上海)有限公司提供。
3 主要方法
3.1pHBLV-U6-MCS-PGK-PURO质粒的提取与鉴定将pHBLV-U6-MCS-PGK-PURO载体、psPAX2载体和pMD2G载体共转染293T细胞,转染后分别在48和72 h收集病毒上清液,并将病毒上清液超速离心,得到最终的慢病毒保存液,于-80 ℃冰箱保存。采用Ion Torrent 3500基因测序仪对质粒进行测序,并与目标基因片进行比对。
3.2pHBLV-U6-MCS-PGK-PURO质粒的转染及嘌呤霉素筛选将生长状态良好的Neuro-2a细胞接种到12孔板,每孔1×105个,放入37 ℃、5% CO2培养箱中培养过夜。待细胞汇合率为30%~50%,加入50 μL病毒进行感染,同时加入适量聚凝胺。感染约24 h后,弃去含有病毒的培养液,换上常规细胞培养液。感染48 h后,加入嘌呤霉素(4.0 mg/L)筛选。慢病毒感染48~72 h后,感染效率约在80%左右,且细胞状态稳定,汇合率在60%~70%时,加入嘌呤霉素(4.0 mg/L)进行处理。加药约48 h后观察对照组细胞的存活率,若对照组细胞死亡率在90%以上,撤掉嘌呤霉素换新鲜的培养液培养。
3.3稳定低表达的Neuro-2a细胞活力的检测将生长状态良好的Neuro-2a细胞经胰酶消化后,以6×107/L的密度重悬接种于96孔板。贴壁培养24 h后按照CCK-8试剂盒说明书操作,并在450 nm处检测吸光度()值。
3.4RT-qPCR法检测GSNOR的mRNA表达采用RNA快速提取试剂盒提取总RNA,逆转录成cDNA。加40 μL DEPC水(即浓度为10 mg/L)于cDNA,取2 μL加入八联管中,再加上、下游引物(序列见表1)各0.5 μL,SYBR Green 5 μL,DEPC水2 μL。94 ℃变性10 min;40个循环依次做94 ℃变性10 s、60 ℃退火15 s和72 ℃延伸20 s;最后在72 ℃延伸90 s,并根据产物的溶解曲线,得到Ct值。用2-ΔΔCt法计算GSNOR mRNA的相对表达水平。

表1 RT-qPCR引物序列
3.5Western blot法检测GSNOR的蛋白表达采用细胞蛋白裂解液对细胞裂解,进行SDS-PAGE分离(10%分离胶),将蛋白质转到PVDF膜,5%脱脂牛奶封闭,摇床1~2 h,分别加入抗GSNOR(1∶500)和抗β-actin(1∶3 000)抗体,摇床4 ℃过夜;再用T-TBS洗涤3次,每次10 min;加入Ⅱ抗。ECL显色曝光。
3.6生物素转换法检测-亚硝基化水平转染后细胞用不含二硫苏糖醇(1,4-dithio-DL-threitol, DTT)的细胞裂解液裂解,按生物素转换法试剂盒说明书操作。通过离心清洗细胞并使其成沉淀。加入封闭缓冲液A,在4 ℃下离心30 min。取上清液,用冷丙酮沉淀。沉淀物用含有还原和标记试剂的缓冲液B重悬后,再用冷丙酮沉淀,重悬后HRP标记的Ⅱ抗进行Western blot。
4 统计学处理
数据用GraphPad Prism 8.0软件进行统计分析。计量资料以均数±标准差(mean±SD)表示。组间均数比较采用检验或单因素方差分析。以<0.05为差异有统计学意义。
结果
1 pHBLV-U6-MCS-PGK-PURO质粒鉴定结果
基因测序结果显示质粒序列中包含5'-GATCCGACGAATTTGTGACCGGCAATCTCGAGATTGCCGTCACAAATTCGTCTTTTTTG-3'的碱基序列,结果与目的序列一致,提示质粒构建成功,见图1。

Figure 1. Sanger sequencing peak map of lentivirus transfer vector shRNA1-ADH5 fragment. DNA sequencing showed the sequence of recombinant plasmids of HBLV-m-ADH5 shRNA1 Puro lentivirus vector accorded with ADH5 gene sequence.
2 转染后细胞形态及活力的变化
细胞转染后,通过光镜观察细胞形态,发现第2、4和6代的转染细胞形态与对照组均无明显差异,见图2A。CCK-8结果显示在24、48、72及96 h时点细胞活力无显著差异,见图2B。

Figure 2. Morpholocical observation and cell viability were measured in the Neuro-2a cells after HBLV-m-ADH5-shRNA1 transfection. A: light microscopic micrographs were performed at the 2nd (P2), 4th (P4) and 6th (P6) passages; B: cell viability was assessed at the designated time points (24, 48,72 and 96 h) by CCK-8 assay. Mean±SD. n=6.
3 RT-qPCR法检测GSNOR的mRNA表达水平
RT-qPCR结果显示,与对照组相比,第2、4和6代细胞系中GSNOR mRNA的表达量分别为空载病毒组的37.02%、40.66%和30.13%,均显著降低(<0.01),见图3。
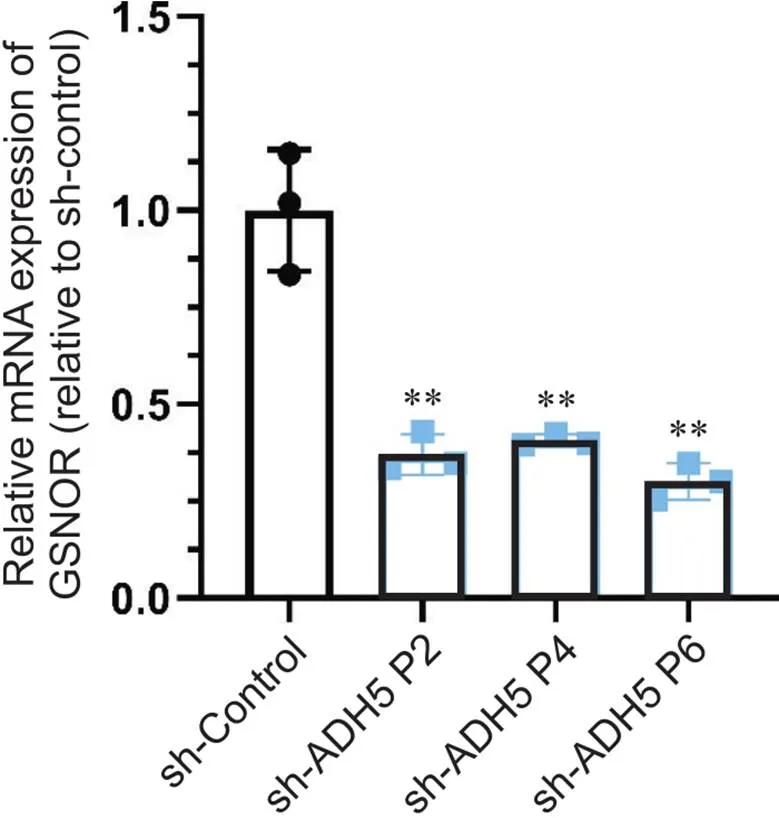
Figure 3. The mRNA expression of GSNOR was determined by RT-qPCR. Mean±SD. n=3. **P<0.01 vs sh-Control group.
4 Western blot检测GSNOR的蛋白表达水平
Western blot结果显示,与对照组相比,第2、4和6代细胞系中GSNOR蛋白的表达量均显著降低(<0.01),见图4。

Figure 4. The protein expression of GSNOR in transfected Neuro-2a cells at the 2nd (P2), 4th (P4) and 6th (P6) passages was detected by Western blot. Mean±SD. n=3. **P<0.01 vs sh-Control group.
5 胞内S-亚硝基化水平变化
生物素转换法结果显示,与sh-Control组相比,sh-ADH5转染后Neuro-2a细胞胞内-亚硝基化水平显著上调(<0.01),见图5。

Figure 5. Cellular S-nitrosylation level was upregulated in transfected Neuro-2a cells. The S-nitrosylation level was detected by biotin switch method. Mean±SD. n=3. **P<0.01 vs sh-Control group.
讨论
GSNOR介导的去亚硝基化是一种细胞受特殊刺激而产生的信号转导方式,其可维持蛋白-亚硝基化的平衡,从而维持机体内稳态,成为研究神经退行性疾病关注的热点之一。有研究报道敲除可显著上调GSNO水平,从而影响-亚硝基化水平[10]。内源性NO可促使一些特殊靶蛋白发生-亚硝基化,从而影响神经元的活性和功能。
GSNOR作为脑中主要的ADH成员,对大脑发育和神经分化过程十分重要。研究表明,过表达导致幼年和成年小鼠神经元分化减少,降低神经细胞分化比例,抑制神经突触生长;而低表达促进神经元分化,其调控机制均由-亚硝基化修饰异常导致[5]。GSNOR还可间接调节染色质重塑和控制神经元分化的基因表达[6]。这些研究均提示,GSNOR参与神经发育、分化及神经病变过程。
虽然GSNOR介导特殊靶蛋白-亚硝基化的调控机制及特异性还未完全阐明,但越来越多的研究表明,parkin、Drp-1和CaMKIIα等蛋白的-亚硝基化已经成为神经退行性疾病病变过程的重要参与者。研究报道,老年人群的海马体中GSNOR蛋白表达显著上调,而衰老小鼠海马中CaMKIIα Cys280和Cys289位点-亚硝基化水平降低,并导致其在海马突触体中的累积量减少,上述现象可通过在小鼠模型上敲除得到逆转[11]。另有研究报道,阿尔茨海默病患者大脑和外周血液中均存在Drp1的-亚硝基化,Drp1 Cys644位点的-亚硝基化激活GTP水解酶并形成二聚体,导致线粒体的过度碎片化,因能量代谢失调而最终导致树突棘丢失和神经元死亡[12]。此外,帕金森病(Parkinson disease, PD)小鼠模型中parkin蛋白-亚硝基化上调Drp-1蛋白表达,Drp-1及parkin的-亚硝基化修饰参与PD病变过程[13]。在PD细胞模型中,敲除可降低SH-SY5Y神经细胞毒性,起神经保护作用[14]。上述研究均提示,进一步探讨GSNOR介导去亚硝基化修饰的分子机制研究,将有助于挖掘神经退行性疾病的潜在新靶点。
构建稳定低表达神经细胞模型有助于深入探讨GSNOR调控神经的生物学特性及-亚硝基化异常表达疾病的机制研究。短发夹RNA(short hairpin RNA, shRNA)由含有特定核苷酸片段的质粒表达,进入细胞内随着细胞增殖而复制,在细胞中稳定表达[15]。与小干扰RNA(small interfering RNA, siRNA)相比,其优点在于能稳定表达特异性核苷酸干扰片段,使得细胞特定基因和蛋白稳定低表达,适用于靶蛋白的后续研究[16]。本研究中,基因测序结果证实质粒包含干扰序列后,将质粒转入Neuro-2a细胞中,GSNOR的mRNA和蛋白表达水平均显著降低,表明稳定低表达的Neuro-2a细胞系构建成功。该细胞模型将为研究GSNOR调控神经的生物学特性和神经疾病模型的探索提供稳定的体外模型。同时,表达shRNA-的Neuro-2a细胞系呈现总蛋白-亚硝基化修饰水平上调,为-亚硝基化修饰异常修饰参与神经系统疾病的研究提供了潜在的细胞模型[17-18]。
本研究采用质粒转染技术,基因测序结果证实质粒包含干扰序列后将shRNA质粒转染至Neuro-2a细胞,构建的Neuro-2a细胞系能稳定低表达并易化细胞内-亚硝基化水平,可用于后续GSNOR调控去亚硝基化的生物学作用及下游信号通路的研究。
[1] Benhar M, Forrester MT, Stamler JS. Protein denitrosylation: enzymatic mechanisms and cellular functions[J]. Nat Rev Mol Cell Biol, 2009, 10(10):721-732.
[2] Gusarov I, Nudler E. Protein-nitrosylation: enzymatically controlled, but intrinsically unstable, post-translational modification[J]. Mol Cell, 2018, 69(3):351-353.
[3] Rizza S, Filomeni G. Chronicles of a reductase: biochemistry, genetics and physio-pathological role of GSNOR[J]. Free Radic Biol Med, 2017, 110:19-30.
[4] Fernando V, Zheng X, Walia Y, et al.-nitrosylation: an emerging paradigm of redox signaling[J]. Antioxidants (Basel), 2019, 8(9):404-435.
[5] Wu K, Ren R, Su W, et al. A novel suppressive effect of alcohol dehydrogenase 5 in neuronal differentiation[J]. J Biol Chem, 2014, 289(29):20193-20199.
[6] Wu K, Zhang Y, Wang P, et al. Activation of GSNOR transcription by NF-κB negatively regulates NGF-induced PC12 differentiation[J]. Free Radic Res, 2014, 48(9):1011-1017.
[7] Zhang J, Zhou R, Cao G, et al. Guhong injection prevents ischemic stroke-induced neuro-inflammation and neuron loss through regulation of C5ar1[J]. Front Pharmacol, 2022, 13:818245-818257.
[8] Cirotti C, Rizza S, Giglio P, et al. Redox activation of ATM enhances GSNOR translation to sustain mitophagy and tolerance to oxidative stress[J]. EMBO Rep, 2021:22(1):e50500.
[9] Montagna C, Cirotti C, Rizza S, et al. When-nitrosylation gets to mitochondria: from signaling to age-related diseases[J]. Antioxid Redox Signal, 2020, 32(12):884-905.
[10] Rizza S, Cardaci S, Montagna C, et al.-nitrosylation drives cell senescence and aging in mammals by controlling mitochondrial dynamics and mitophagy[J]. Proc Natl Acad Sci U S A, 2018, 115(15):3388-3397.
[11] Zhang Y, Wu K, Su W, et al. Increased GSNOR expression during aging impairs cognitive function and decreases-nitrosation of CaMKIIα[J]. J Neurosci, 2017, 37(40):9741-9758.
[12] Cho DH, Nakamura T, Fang J, et al.-nitrosylation of Drp1 mediates β-amyloid-related mitochondrial fission and neuronal injury[J]. Science, 2009, 324(5923):102-105.
[13] Zhang Z, Liu L, Jiang X, et al. The essential role of Drp-1 and its regulation by-nitrosylation of Parkin in dopaminergic neurodegeneration: implications for Parkinson's disease[J]. Antioxid Redox Signal, 2016, 25(11):609-622.
[14] Rizza S, Cirotti C, Montagna C, et al.-nitrosoglutathione reductase plays opposite roles in SH-SY5Y models of Parkinson's disease and amyotrophic lateral sclerosis[J]. Mediators Inflamm, 2015, 2015:536238.
[15] 钟娃, 夏忠胜, 于涛, 等. 利用Tet-On系统构建稳定表达的小鼠ESC细胞株[J]. 中国病理生理杂志, 2021, 37(1):187-192.
Zhong W, Xia ZS, Yu T, et al. Construction of mouse ESC line stably expressingby Tet-On system[J]. Chin J Pathophysiol, 2021, 37(1):187-192.
[16] 赵良渊, 候晓敏, 秦小江. 慢病毒介导转染基因shRNA对大鼠主动脉血管平滑肌细胞钙离子和钙调蛋白的影响[J]. 中国病理生理杂志, 2018, 34(7):1306-1310.
Zhao LY, Hou XM, Qin XJ. Effects of lentivirus-mediated transfection of shRNA targetinggene on calcium and calmodulin in rat aortic vascular smooth muscle cells[J]. Chin J Pathophysiol, 2018, 34(7):1306-1310.
[17] Khan M, Kumar P, Qiao F, et al. Targeting GSNOR for functional recovery in a middle-aged mouse model of stroke[J]. Brain Res, 2020, 1741:146879-146886.
[18] Dyer RR, Ford KI, Robinson RAS. The roles of-nitrosylation and-glutathionylation in Alzheimer's disease[J]. Methods Enzymol, 2019, 626:499-538.
Construction ofknockdown stable Neuro-2a cell line and its effect on-nitrosylation
YAN Jie-ping1,2,3△, HAN Zhen-ping1, LI Ting-ting2, WANG Si-yi1, GAO Li2, LUO Shuang2, LI Han-bing1, Huang Ping2,3
(1,,,310014,2,,,,310014,3,310014,)
To construct a mouse neuroblastoma Neuro-2a cell line with stable knockdown of-nitrosoglutathione reductase (), and to investigate its effect on-nitrosylation.The Neuro-2a cells were transfected with lentivirus-mediated short hairpin RNA (shRNA) targetingby LipoFiter™ liposomes, and those with stable knockdown ofwere screened with puromycin. Morphological changes of the cells were observed by light microscopy. The cell viability was detected by CCK-8 assay. The mRNA and protein expression levels of GSNOR were revealed by RT-qPCR and Western blot. Biotin switch method was used to detect the intracellular total-nitrosylation level in the cells.The fragment sequence inserted in the recombinant lentivirus was identical to the designed oligo sequence, and the HBLV-m-ADH5-shRNA1-PURO lentiviral vector was successfully constructed. After puromycin screening, transfected Neuro-2a cells were observed with normal morphological characteristics under light microscope. No significant difference in cell viability was observed at the time points of 24, 48, 72 and 96 h. The mRNA levels of GSNOR at the 2nd, 4th and 6th passages were 37.02%, 40.66% and 30.13% of those in the scrambled group, respectively (<0.01), and GSNOR protein expression was significantly lower than that in the scrambled group (<0.01). Moreover,shRNA significantly increased intracellular-nitrosylation levels in Neuro-2a cells (<0.01).The Neuro-2a cell line with stable low expression ofwas successfully constructed. Knockdown ofin Neuro-2a cells increased-nitrosylation levels of intracellular total protein.
-Nitrosoglutathione reductase; Lentivirus; Neuro-2a cells;-Nitrosylation
1000-4718(2022)09-1547-06
2022-04-24
2022-06-23
0571-85893117; E-mail: yanjieping@hmc.edu.cn
R741.02; R363.2
A
10.3969/j.issn.1000-4718.2022.09.002
[基金项目]国家自然科学基金资助项目(No. 81903597);浙江省自然科学基金资助项目(No. LQ16H310003);浙江省医药卫生科技项目(No. 2021KY016; No. 2022KY061)
(责任编辑:宋延君,李淑媛)
