胚胎停育肝郁证患者血管生成因子表达特征研究*
2022-10-12黄琰钰林雪娟陈杭兰萌吴冬梅刘文杰刘艳红
黄琰钰,林雪娟,陈杭,兰萌,吴冬梅,刘文杰,刘艳红
1.福建中医药大学,福建 福州 350122; 2.福建省中医健康状态辨识重点实验室,福建 福州 350122;3.福建省2011中医健康管理协同创新中心,福建 福州 350122; 4.福建中医药大学附属第二人民医院,福建 福州 350122; 5.福建中医药大学附属晋江中医院,福建 晋江 362200
1 资料与方法
1.1 一般资料选取2019年7月至2020年12月就诊于福建中医药大学附属晋江中医院门诊及住院的胚胎停育患者45例,年龄(30.82±5.05)岁。另选择同期自愿要求终止妊娠的正常早孕女性15例为对照组,年龄(27.86±4.21)岁。
1.2 诊断标准
1.2.1 西医诊断标准参考《妇产科学》[4]胚胎停育的诊断标准及《早期妊娠稽留流产专家共识》[5]的诊断标准。
1.2.2 中医证素诊断标准依据《证素辨证学》[6],根据采集的四诊信息在诊断中的权重,以加权阈值法确定证素。将各项四诊信息对某证素的贡献度进行累积相加,所得的贡献度之和,作为该证素的积分。积分<70分为0级,说明基本无病理变化;积分 70~100分为1级,说明存在轻度病理变化;积分101~150分为2级,说明存在中度病理变化;积分≥150分为3级,说明存在严重病理变化。
1.3 病例纳入标准
1.3.1 胚胎停育组纳入标准妊娠7~12周内并符合胚胎停育西医诊断标准;自愿加入并签署知情同意书后可配合完成四诊问卷者。
1.2.1 细胞培养 NCI-N87细胞株常规在含10%胎牛血清的0.1%DMSO培养基,于37℃、5%CO2的孵箱中培养,用0.25%胰蛋白酶消化,在显微镜下观察细胞形态,待细胞长满至80%融合度时,以1:3比例进行传代。使活细胞数>95%,取对数生长期的细胞用于实验。
1.3.2 对照组纳入标准妊娠7~12周内早期妊娠超声诊断有胎心者;自愿加入并签署知情同意书,可配合完成调查问卷者。
1.4 病例排除标准①因跌扑损伤、染色体异常致胚胎停育者;②生化妊娠、试管婴儿失败后流产患者;③患有阴道炎、生殖道感染者;④合并高血压、免疫系统疾病、心脑血管病、糖尿病、血液系统疾病、肿瘤等重大器质性疾病或严重精神疾病者。
1.5 四诊信息采集及证素提取
1.5.1 四诊信息由2名经过专业培训且考核合格的中医科研人员按照标准,规范地采集研究对象的四诊信息。
1.5.2 证素数据提取使用“中医健康状态辨识系统”[7]将采集到的四诊信息录入系统,后台对四诊信息进行处理并输出相关证素及其积分。
1.6 试验方法
1.6.1 辨证分型将证素、气滞积分≥100分的组纳入肝郁证,证素、气滞积分<100分纳入非肝郁证。
1.6.2 组织取材所有研究对象行清宫术后,立即在无菌状态下取子宫蜕膜组织,用无菌生理盐水清洗,直到组织表面无明显血迹,用无菌剪刀将子宫蜕膜组织分别剪成两部分,迅速放入无RNA酶的EP管中,液氮速冻,-80 ℃冰箱保存。
1.6.3 仪器和设备电子天平(上海梅特勒-托利多仪器上海有限公司);微型漩涡混合仪XW-80A(上海沪西分析仪器厂有限公司);迷你离心机LX-200(海门其林贝尔仪器制造有限公司);微型冷冻离心机5424R(德国Eppendorf公司);超低温冰箱(美国Thermo Scinetific公司);移液器(德国EPPENDORF);高通量自动研磨仪Tissuelyser II(德国Qiagen公司);超微量紫外分光光度计Nandrop2000(美国Thermo Scientific公司);基因扩增仪Veriti、荧光定量PCR仪 Quant Studio6 Flex(美国Applied Biosystems 公司);化学发光凝胶成像仪 ChemiDox TM XRS+(美国Bio-Rad公司)。
1.6.4 试剂及耗材体积分数95%乙醇、无水乙醇(西陇化工股份有限公司);氯化钠(上海沪试实验室器材股份有限公司);Gapdh一抗、兔抗、Anti-pan-VEGF 一抗(北京Proteintech公司);超敏ECL化学发光试剂盒(万类生物科技);半干转膜液、湿转转膜液、电泳液、BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);RNA提取试剂、SYBR Green RT-PCR 试剂盒、逆转录试剂盒(日本TAKARA公司)。
1.6.5 实时荧光定量PCR检测mRNA表达
1.6.5.1 RNA逆转录使用超微量紫外分光光度计检测RNA浓度及纯度,并根据RNA的浓度计算逆转录时所需的RNA量。在1.0 %非变性琼脂糖凝胶电泳上分析RNA完整性,其纯度完整性达到要求后,进行RNA逆转录。在冰上配制RT反应液分别装于反应管中,再加入灭菌蒸馏水,使得总体积为18 μL,42 ℃,2 min后放置冰上。反应管中直接添加入5×qRT SuperMixⅡ 6 μL,50 ℃,15 min;85 ℃,5 s,得到的cDNA放置-20 ℃冰箱中备用。
1.6.5.2 引物设计选用人的GAPDH为内参基因,采用Primer Premier 5.0设计目标基因和内参基因的特异性引物,用Oligo 6.0检验其特异性。引物由上海博尚生物工程技术有限公司合成。见表1。
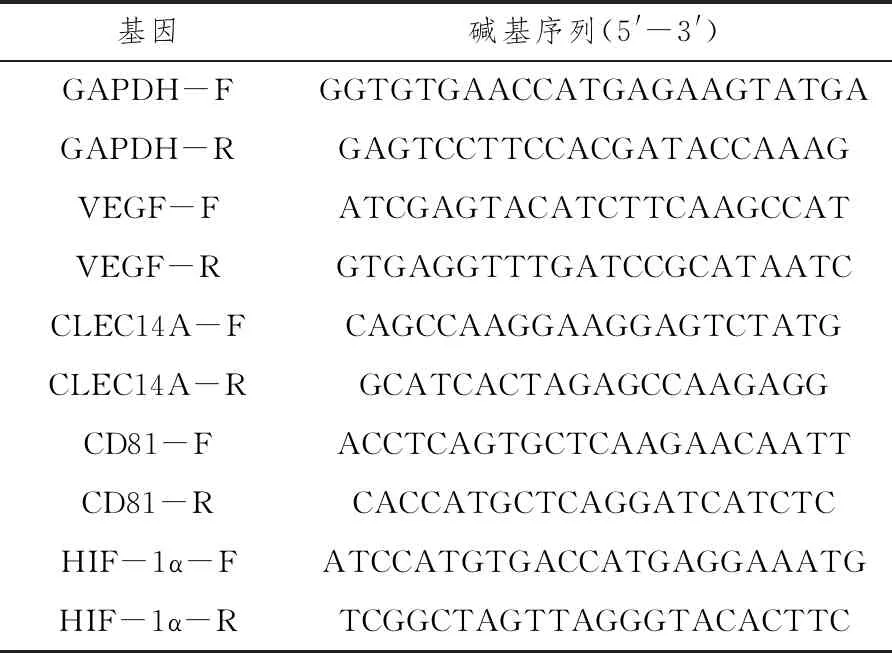
表1 引物序列
1.6.5.3 qPCR反应在冰上配制反应液,2×ChamQ SYBR qPCR Master Mix 10 μL,上下游引物各0.5 μL,加灭菌蒸馏水至20 μL。吸取11 μL到每个反应管中,再添加cDNA溶液1 μL。每个反应重复3次,设计实验组和阴性对照,配制反应液时先配制总的反应液,再各个分装。反应步骤为95 ℃×30 s;循环反应:95 ℃×5 s,60 ℃×30 s,40个循环;Melt Curve:95 ℃×15 s,60 ℃×60 s。最后得到样本扩增曲线、溶解曲线和ct值,计算基因表达。
1.6.6 蛋白表达量检测
1.6.6.1 BCA法检测蛋白浓度按照BCA试剂盒说明书的操作步骤检测蛋白浓度,可以得到标准曲线算出线性关系,再根据已知的样本体积算出样品的蛋白浓度。用含有PMSF的RIPA稀释样品,使各样本浓度一致为5 g·L-1。
1.6.6.2 Western Blot法进行SDS-PAGE凝胶配制后,将蛋白样品和上样缓冲液混匀,100 ℃或沸水加热5 min,以充分变性蛋白,后装入电泳槽内,湿法转印蛋白至PVDF膜上,湿转转膜条件:恒流 400 mA,电压75 V,转膜时间2 h。分别加入VEGF、C型凝集素家族14A(C-type lectin clomain containing 14A,CLEC14A)、CD81、GAPDH一抗(浓度比分别为11 000、11 000、12 000、15 000)。用TBST稀释辣根过氧化物酶标记的二抗(浓度14 000)37 ℃在摇床上缓慢摇动孵育1 h。化学发光凝胶成像仪扫描结果后进行灰度分析,应用Image lab软件分析此条带的灰度值,并将其与之相对应的内参条带进行比较。

2 结果
2.1 两组患者子宫蜕膜组织中CLEC14A、CD81、HIF-1α及VEGF mRNA表达水平比较两组患者子宫蜕膜组织中均有VEGF、CLEC14A、CD81、HIF-1α mRNA的表达。与对照组比较,胚胎停育组子宫蜕膜组织中VEGF mRNA表达下降,差异具有统计学意义(P<0.05),CLEC14A、CD81、HIF-1α mRNA表达水平有改善,但差异无统计学意义(P>0.05),见表2。

表2 两组患者子宫蜕膜组织中CLEC14A、CD81、VEGF、HIF-1α mRNA表达水平比较
2.2 各证型子宫蜕膜组织中 CLEC14A、CD81、VEGF、HIF-1α mRNA表达水平比较与肝郁证比较,非肝郁证子宫蜕膜组织中VEGF mRNA表达升高,差异具有统计学意义(P<0.05),CD81、CLEC14A、HIF-1α mRNA表达水平降低,但差异无统计学意义(P>0.05),见表3。

表3 各证型子宫蜕膜组织中CLEC14A、CD81、VEGF、HIF-1α mRNA表达水平比较
2.3 两组患者子宫蜕膜组织中HIF-1α、CD81、CLEC14A和VEGF蛋白表达水平比较与对照组比较,胚胎停育组子宫蜕膜组织中CLEC14A、VEGF蛋白表达水平下降,差异具有统计学意义(P<0.05),CD81、HIF-1α蛋白表达水平无明显变化,差异无统计学意义(P>0.05),见表4。

表4 两组患者子宫蜕膜组织中HIF-1α、CD81、CLEC14A和VEGF蛋白表达水平比较
2.4 各证型子宫蜕膜组织中HIF-1α、CD81、CLEC14A和VEGF蛋白表达水平比较与肝郁证比较,非肝郁证子宫蜕膜组织中CD81蛋白表达水平升高,差异具有统计学意义(P<0.05),VEGF、CLEC14A、HIF-1α蛋白表达水平变化不明显,差异无统计学意义(P>0.05),见表5。

表5 各证型子宫蜕膜组织中HIF-1α、CD81、CLEC14A和VEGF蛋白表达水平比较
3 讨论
胚胎停育患者子宫蜕膜组织中VEGF mRNA和蛋白表达水平均低于对照组,说明妊娠过程中胚胎的血管生成异常可能是胚胎停育的重要发病机制,与国内外研究基本一致。良好的胎盘血管发育是胎盘与母体物质交换功能的基础,只有胎盘生成强大的血管网才能确保胚胎的营养、血液、氧气供给[8]。付昱等[9]研究发现,胚胎停育与妊娠早期的胎盘血管结构异常、血管生成数量不足等密切相关。胚胎血管内皮细胞的迁移、侵袭、增殖功能受到VEGF表达水平的调控,血管生成的相关活性因子表达降低,绒毛的滋养细胞浅植入,导致胚胎蜕膜及绒毛的血管生成减少,胎盘血管网络构建不完善,直接影响母胎间物质交换及血液、氧气供应,最终导致胚胎停育[10]。国外学者[11]对母体螺旋动脉重塑及滋养细胞侵入的过程进行研究,发现HIF-1α、VEGF在调节胚胎血管生成中发挥重要作用。黄凌佳等[12]研究发现,胚胎中HIF-1α/VEGF信号通路的异常表达与不良妊娠有关,胎盘血管的发育可能是通过激活HIF-1α信号通路及其靶基因VEGF来实现。值得注意的是,VEGF与早期妊娠的维系和胚胎血管的生成密切相关,在内膜基质的细胞产生蜕膜化中有重要意义[13]。Santi等[14]通过实验研究发现,VEGF及其特异性受体在胚胎着床点附近的基质细胞中呈高表达状态。此外,在早期妊娠妇女的子宫蜕膜组织中同样被检测到VEGF及相关受体的高表达。Rabbani等[15]使用原位杂交技术检测VEGF mRNA表达,发现其主要高表达位于胚胎着床位点附近的动脉壁、母胎界面及细胞滋养层等腺上皮中,并在早期、中期、晚期妊娠中均能找到[16],说明VEGF在早期妊娠过程中参与了重要角色[17]。早期妊娠失败与VEGF低表达密切相关,其低表达可能是引起胚胎停育的主要因素[18]。
本研究结果显示,各组均存在HIF-1α mRNA及蛋白表达,但是对照组较胚胎停育组明显降低,虽然差异无统计学意义,但蛋白条带及表达量趋势一致。HIF-1α信号通路是特异性的低氧反应通路,根据机体氧含量来调节蛋白活性。HIF-1α在人体正常有氧条件下容易降解,其表达量相对稳定,但在低氧环境下降解快速减少,可迅速累积、聚合,使活性增强,并启动下游靶基因转录[19]。研究表明[20],HIF-1α可以通过诱导血管生成而发挥作用。正常妊娠也存在低氧状态,低氧启动HIF-1α,上调VEGF表达,胚胎血管网络逐渐形成减轻胚胎缺氧状态,维系正常妊娠[21]。本研究结果提示,胚胎停育患者子宫蜕膜组织中HIF-1α表达较对照组更高,但VEGF表达却下降,HIF-1α与VEGF呈负相关性,说明胚胎停育组患者VEGF的低表达可引起胚胎停育,是研究VEGF与胚胎停育关系的重要依据。由此可以预测,胚胎停育患者中存在更严重的低氧状态,血管生成的动态平衡被打破,HIF-1α表达异常升高,负反馈抑制了VEGF等血管生成因子的表达,促进血管生成的因子减少,抑制血管生成的因子增加,导致血管生成大量减少,胚胎缺乏足够的氧气和营养物质供养,最终发生胚胎停育。杨跃涛[22]认为,气郁证患者静脉血氧含量降低,二氧化碳含量升高,使机体处于二氧化碳潴留及缺氧状态,体内氧代谢状况差,这与本研究肝郁证引起低氧启动HIF-1α/VEGF信号通路表达导致胚胎缺血缺氧的理论存在相似性。
本研究中,胚胎停育组子宫蜕膜组织中CLEC14A蛋白及mRNA表达水平低于对照组,但mRNA表达差异无统计学意义(P>0.05),可见高表达的CLEC14A可以促进血管的生成,与VEGF的作用可能相似,可将其均归为促进血管生成的因子。CLEC14A和VEGF都表达于子宫蜕膜组织中,两者都参与妊娠早期的血管新生,间接通过调控VEGF信号通路来实现血管的生成。
本研究结果显示,仅有肝郁证子宫蜕膜组织中CD81蛋白表达均低于非肝郁证,差异具有统计学意义(P<0.05),其他组之间比较,差异无统计学意义(P>0.05),提示CD81可能与VEGF的表达存在负性相关,而胚胎停育组与对照组子宫脱膜组织中CD81 mRNA和蛋白表达水平比较,差异无统计学意义(P>0.05),但其负相关的趋势与国内外学者的研究基本一致。CD81的高表达表现为抑制血管新生或增加无效血管的生成,使滋养细胞的侵袭能力在一定程度上降低,引起新生血管腔直径变小,血液供应减少,从而发展为胚胎停育。因此,CD81也可作为评估胚胎停育发生的指标。研究表明[23],CD81表达升高,会抑制滋养细胞的侵袭能力来影响子宫螺旋动脉重塑,使胎盘着床位置较浅。Shen等[24]研究发现,CD81在妊娠最早期开始出现,随妊娠时间增长,表达量递减,而使同时期不良妊娠患者血液中仍有高表达量的CD81。CD81作为四次跨膜蛋白,表达有一定的不稳定性,其磷酸化过程或半衰期不同时间段检测会存在一定的差异。因此,对CD81的分组检测存在一定的难度和不稳定性。
本研究中,肝郁证胚胎停育的子宫蜕膜组织中VEGF mRNA的表达水平低于非肝郁证,说明肝郁在血管生成中扮演着重要角色。有学者[25]研究抑郁组和正常对照组的VEGF、HIF-1α表达,发现抑郁组及正常对照组存在差异,抑郁组患者血清中HIF-1α表达显著增加。HIF-1α的增加正是由于机体缺氧所诱导,说明抑郁障碍患者血液中氧含量低于正常人[26],存在不良情绪的患者可能长期处于低氧状态。目前,HIF-1α与肝郁证的研究尚处于初期阶段,蒋莉娅等[27]采用清胰醒脑颗粒治疗肝郁气滞证小鼠,检测模型组与肝郁证小鼠脑部组织HIF-1α mRNA,结果显示,治疗组HIF-1α mRNA表达较低。有学者[28]发现,抑郁状态下的大鼠脑、心肌组织中HIF-1α蛋白显著増高,抑郁状态下的大鼠重要器官处于相对缺氧状态,会诱导HIF-1α蛋白活化、上调,从而引发其他脏器组织的损伤。HIF-1α是维持机体内氧稳定的一个主要调节因素[29],被认为是机体在缺氧时编码应答基因的重要转录因子,可促使VEGF基因表达的启动、激活[30],并通过相关靶基因调节细胞的增殖、能量的代谢、血管的生成、细胞的凋亡等,确保机体适应或改变缺氧状态[31]。
综上所述,正常的生理功能都离不开气血阴阳的调和畅达,血管生成也离不开气血阴阳的调和。若妇女备孕时情志不畅或所求不遂日久,会出现不同程度的肝郁气滞现象,情绪异常会导致机体处于缺氧状态,会诱导HIF-1α、VEGF表达下调,影响血管生成,使胚胎处于缺血、缺氧中,最终导致胚胎停育。低分子肝素或阿司匹林可用来治疗胚胎停育,并非为了抗凝血,其目的是改善胚胎及子宫的血液供应,促进胚胎发育,与血管生成理论有许多共通之处,但是肝郁证导致的缺氧状态应该是胚胎停育更上游的因素。在今后研究中,可对HIF-1α、VEGF信号通路其他指标进行检测,以期对胚胎停育、肝郁证、HIF-1α、VEGF之间的关系进行深入研究。
