羊肚菌胞外多糖液态发酵培养基配方优化及其体外降血糖活性
2022-10-11付云娜冯佩瑶李浩哲夏兴兴
林 杉,赵 萍,付云娜,刘 冰,冯佩瑶,李浩哲,夏兴兴
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
羊肚菌()属于子囊菌亚门(Ascomycotina)、盘菌纲(Discomycete)、盘菌目(Pezizales)、羊肚菌科(Morchellacea)、羊肚菌属()。羊肚菌是我国境内十分珍稀的食药用菌种之一,有“食用菌皇后”的美称。羊肚菌多糖(polysaccharide)是从羊肚菌子实体、菌丝体或发酵液中分离出的一类天然活性产物,具有广泛的药理活性。近年来羊肚菌多糖因其保健功能良好而成为研究热点,如羊肚菌多糖可以通过清除自由基、提高抗氧化酶活性,对机体起到免疫调节作用。
糖尿病主要是由于胰岛素的显著缺乏和胰岛素抵抗而产生的,最主要的病理表现是血液中葡萄糖含量高,血液中过量的葡萄糖会降低细胞对葡萄糖的吸收和利用效率。明建等发现羊肚菌子实体多糖对高脂小鼠的血清甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)和动脉粥样硬化指数(AI)等指标有显著的降低作用,从而证明了羊肚菌多糖对于高血脂症、冠心病、动脉硬化等疾病的发生有一定的预防作用。
现阶段,羊肚菌野生资源有限,人工栽培条件探究仍不清晰,液态深层发酵技术仍然是羊肚菌扩大规模培养的一个很好选择。已有研究发现深层发酵培养羊肚菌具有生产周期短、产量高、成本低等优势,可以得到大量的羊肚菌胞外多糖。且菌丝体发酵胞外多糖生产周期短、方便易得,现研究对三地羊肚菌菌株和羊肚菌胞外多糖降血糖评价鲜有报道。
因此,本研究在单因素实验基础上,首次通过Box-Behnken 响应面方法优化液态深层发酵培养三地羊肚菌菌株胞外多糖的培养基配方,分离提取发酵液中羊肚菌胞外粗多糖(extracellular polysaccharides,MEP),评价其体外降血糖活性,为开发羊肚菌相关保健食品、加强羊肚菌多糖类的应用,改善羊肚菌的科学和综合利用提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
羊肚菌 由兰州理工大学生命科学与工程学院赵萍老师课题组分离纯化得到,经鉴定为三地羊肚菌(KT819369.1);琼脂、尿素、磷酸二氢钾、硫酸镁、磷酸二氢钠 天津大茂化学试剂厂;氢氧化钠 天津益仁达化工有限公司;葡萄糖天津市致远化学试剂有限公司;浓硫酸、苯酚 天津市富宇精细化工有限公司;-淀粉酶(2000 U/g)、-葡萄糖苷酶(300000 U/g) 源叶生物;A832719 阿卡波糖水合物 98%,上海麦克林生化科技有限公司;对硝基苯--D-葡萄糖(4-nitrophenyl-D-glucopyranoside,PNPG) 上海阿拉丁试剂有限公司;马铃薯、红糖、玉米粉、黄豆粉 市售;所有试剂 均为分析纯。
DHP-9082 电热恒温培养箱 上海恒一科学仪器有限公司;FA2004 电子天平 上海良平仪器仪表有限公司;YX280B 压力蒸汽灭菌锅 上海三申医疗器械有限公司;SHZ-82 恒温振荡器 上海贺帆仪器有限公司;TG22-WS 台式高速离心机 上海秉越电子仪器有限公司;RE52-86A 旋转蒸发器 上海亚荣生化仪器厂;Cary50 紫外分光光度计 美国瓦里安公司;680 i-Mark 酶标仪 美国伯乐公司。
1.2 实验方法
1.2.1 羊肚菌液态摇瓶培养
1.2.1.1 培养基配制 基础培养基:采用PDA 培养基,具体配方:马铃薯(去皮)200 g,葡萄糖20 g,琼脂20 g,加水至1000 mL。液态发酵基础培养基:200 g 马铃薯碎丁,煮软后滤去残渣,加葡萄糖20 g,磷酸二氢钾0.5 g,硫酸镁0.25 g,水1000 mL。
1.2.1.2 菌株活化 将高压灭菌后的PDA 固态培养基倾倒到培养皿中,待冷却凝固后,从冰箱中取出保藏的三地羊肚菌菌株,挑取菌丝接到基础培养基上,24 ℃培养7 d,待菌丝长满平面。经5 次如上操作,完成菌种活化。
1.2.1.3 摇瓶培养 取250 mL 三角瓶,每瓶装入100 mL 液态发酵基础培养基,经120 ℃、121 kPa 灭菌30 min。将活化后的菌块接种三角瓶中,26 ℃,150 r/min 条件下进行摇瓶培养。
1.2.2 羊肚菌胞外多糖发酵培养基优化
1.2.2.1 单因素实验 取250 mL 三角瓶21 个,分7 组,每瓶装入100 mL 基础培养基,其他条件保持不变。按(A)红糖添加量:1.6、1.8、2.0、2.2、2.4 g/L;(B)玉米粉添加量:1.2、1.6、2.0、2.4、2.8 g/L;(C)黄豆粉添加量:1.1、1.2、1.3、1.4、1.5 g/L;(D)葡萄糖添加量:1.2、1.6、2.0、2.4、2.8 g/L;(E)硫酸铵添加量:2.6、2.8、3.0、3.2、3.4 g/L;(F)蛋白胨添加量:1.6、2.0、2.4、2.8、3.2 g/L 和(G)尿素添加量:2.6、2.8、3.0、3.2、3.4 g/L 的比例加入分装好的培养基中,将活化后的菌落块接入120 ℃、121 kPa 灭菌30 min 的培养基中,26 ℃,150 r/min 条件下进行摇瓶培养。具体发酵操作同1.2.1。
1.2.2.2 Plackett-Burman 试验 在单因素实验基础上,对发酵培养基中的7 种成分进行研究。每个因素取高(+1)、低(-1)两个水平(见表1),以胞外多糖含量为响应值,进行Plackett-Burman 试验。具体发酵操作同1.2.1。
我被她说服了。因为是同代人,很容易理解各自的苦衷。更重要的是,这次交谈使我学会了换位思考。如果你试着站在大妈们的立场上去思考一下,或许就会理解当今老年妇女内心的酸甜苦辣,甚至会对她们忍辱负重、甘于奉献,苦苦支撑着一个个家庭的毅力、韧性和无私,寄予无限同情和敬意了。做儿女的想过吗,母亲们多半辈子都在操劳,与其责怪她们,何不平时善待她们,有空多带她们到各处走一走看一看?见多识广,走过了、见过了、尝过了,她们还会少见多怪么?

表1 羊肚菌胞外多糖Plackett-Burman 试验设计与水平Table 1 Plackett-Burman experiment design and level of exopolysaccharide in Morchella
1.2.2.3 Box-Behnken 响应面设计试验 在单因素实验的基础上,于100 mL 的液态培养基中接入菌种,摇瓶培养6 d,根据Box-Behnken 中心组合设计的原理,采用Design-Expert 8.0.6 分析软件设计对红糖、尿素、玉米粉进行三因素三水平的响应面分析试验,以此来确定获得胞外多糖的最佳的条件。以红糖添加量(1.8、2.0、2.2 g/L)、玉米粉添加量(2.0、2.4、2.8 g/L)、尿素添加量(3.0、3.2、3.4 g/L)为自变量,胞外多糖含量为响应值,设计水平见表2。
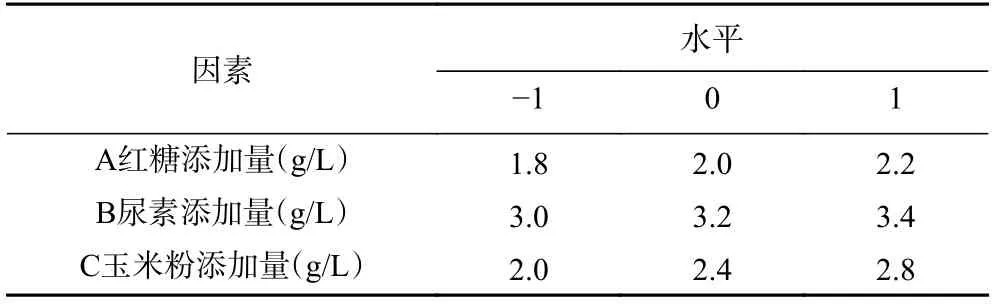
表2 羊肚菌胞外多糖Box-Behnken 试验的因素和水平Table 2 Factors and levels of Box-Behnken experiment of exopolysaccharides from Morchella
1.2.2.4 多糖含量测定 采用苯酚硫酸法测定。首先对进行葡萄糖标准曲线测定。配制出浓度为0.01 mg/mL 的葡萄糖标准溶液,取0.1、0.2、0.3、0.4、0.5 mL 该标准液于5 支试管中,加入蒸馏水使试管溶液达0.5 mL,再分别加入5%的0.5 mL 苯酚和2.5 mL 浓HSO,振荡混匀,室温下静置20 min。在分光光度计490 nm 波长处测定吸光值,以葡萄糖浓度为X 轴,吸光值为Y 轴,绘制葡萄糖标准曲线。苯酚硫酸法测定葡萄糖标准曲线为y=0.1099x-0.156(=0.9971)。羊肚菌发酵液多糖含量:通过测定吸光值,比对标准曲线得到羊肚菌发酵液中多糖含量,具体操作同标准曲线方法测定。
1.2.3 体外降血糖活性测定
1.2.3.1 羊肚菌胞外粗多糖的制备 收集液态发酵后得到的发酵液,4200 r/min,20 min 离心取上清液,旋转蒸发至原体积1/10,加入3 倍体积无水乙醇,4 ℃条件下静止24 h,沉淀多糖。加无水乙醇,4200 r/min,20 min 条件下离心充分洗涤沉淀,直至沉淀无色,冻干得到羊肚菌胞外粗多糖,将得到粗多糖复溶,Sevag 法除蛋白,考马斯亮蓝法和紫外检测至无蛋白。再次醇沉、离心,加蒸馏水复溶,冷冻干燥得到羊肚菌胞外粗多糖(extracellular polysaccharides,MEP)。将多糖用去离子水复溶,制成0.1、0.25、0.50、0.75 和1.0 mg/mL 的多糖溶液。
1.2.3.2-淀粉酶抑制活性 37 ℃条件下,将0.4 mL的-淀粉酶(2 U/mL)溶液与0.2 mL 多糖溶液混合10 min。加0.3 mL 的淀粉溶液(5%),反应10 min,加入2 mL 的DNS 试剂,并沸水浴加热15 min。冷却后,在540 nm 处测量吸光度,阿卡波糖作阳性对照。
-淀粉酶抑制活性的计算如下:

式中:A为样品溶液;A为空白对照(水);A为磷酸盐缓冲液+样品;A为水+磷酸盐缓冲液。磷酸盐缓冲溶液(pH6.8)配制:取7.2 g 磷酸二氢钠和0.68 g 氢氧化钠,加水定容至1 L。
1.2.3.3-葡萄糖苷酶抑制活性 37 ℃条件下,100 μL-葡萄糖苷酶溶液(0.5 U/mL)添加到50 μL 的样品溶液中,反应10 min 后再加入100 μL PNPG(5 mmol/L),反应20 min。加入1 mL NaCO溶液(1 mol/L)终止反应,波长405 nm 下测吸光度,阿卡波糖作对照,并使用以下公式计算-葡萄糖苷酶的抑制率:

式中:A为PNPG 溶液+样品;A为空白对照(水);A为磷酸盐缓冲液+样品;A为水+磷酸盐缓冲液。磷酸盐缓冲溶液配制同1.2.3.2。
1.3 数据处理
有效数据均用三组平行实验的平均值表示,用SPSS Statistics 21、OriginPro 2019b、Design-Expert 8.0.6 等软件进行数据处理和分析。
2 结果与分析
2.1 羊肚菌胞外多糖液态发酵培养基优化结果
2.1.1 单因素实验结果 羊肚菌胞外多糖是羊肚菌生长发酵过程中代谢产生的重要活性物质。不同含量添加物对胞外多糖含量的影响存在一定差异。随着不同物质的添加量的增加,胞外多糖含量均呈现先增加后减小的趋势。如图1 所示,不同物质的最佳添加量分别为:红糖2.0 g/L、玉米粉2.4 g/L、黄豆粉1.2 g/L、葡萄糖2.0 g/L、硫酸铵3.2 g/L、蛋白胨2.4 g/L 以及尿素3.2 g/L。可能是因为在如上条件下,培养基达到最合适的碳氮比,对羊肚菌胞外多糖的生成有促进作用。如金朝霞等在对羊肚菌液态发酵进行碳源筛选时,发现当玉米粉、黄豆粉添加量为2%时,羊肚菌菌丝体、胞外多糖含量均为最高,与本实验结果相符。因此选择单因素实验中的最佳添加浓度进行Plackett-Burman 分析。
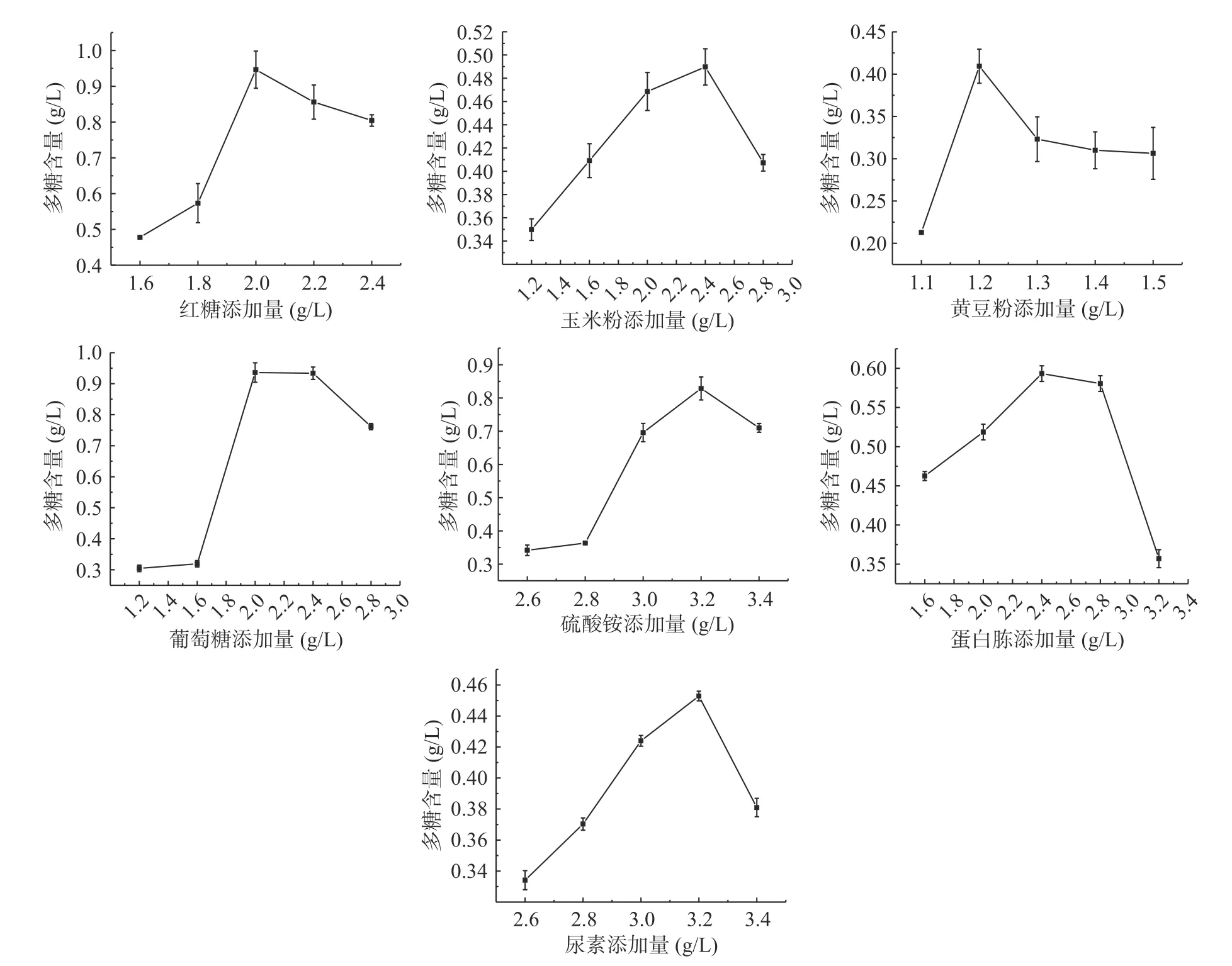
图1 不同添加物浓度对羊肚菌胞外多糖的影响Fig.1 Effects of different contents of additives on exopolysaccharides from Morchella
2.1.2 Plackett-Burman 试验 根据单因素实验得到的最佳添加量,确定每个因素的高(+1)、低水平(-1)。Plackett-Burman 分析结果表明(表3),根据值,对胞外多糖影响最显著的三个因子依次是A>B>E,即红糖>玉米粉>尿素,确定这三个因素进行下一步响应面试验。
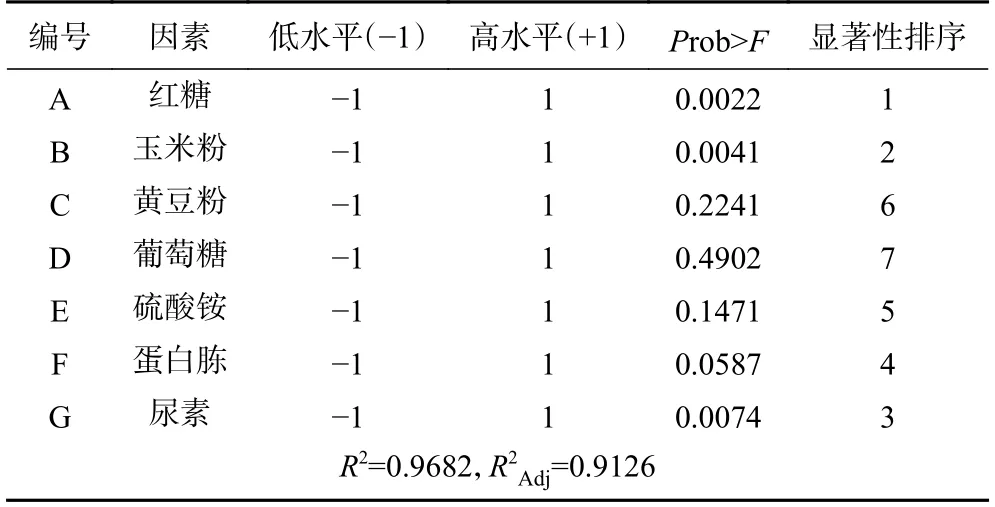
表3 Plackett-Burman 试验设计与结果Table 3 Design and results of Plackett-Burman experiment
2.1.3 Box-Behnken 响应面优化试验结果
2.1.3.1 响应面试验结果及方差分析 Box-Behnken响应面优化试验结果如表4 所示。利用Design-Expert 8.0.6 软件对实验数据进行多元回归拟合分析得实验因子红糖添加量(A)、尿素添加量(B)、玉米粉添加量(C)间的二次多项回归方程:

表4 Box-Behnken 响应面试验设计与结果Table 4 Design and results of Box-Behnken response surface methodology

由表5 可知,模型值为13.13,<0.01,该模型拟合程度达到极显著水平;失拟项=0.4703>0.05,失拟项不显著;由方差分析表可知:A、B、C对胞外多糖含量影响极显著(<0.01),A、B、C、AB、AC 有显著影响(<0.05),BC 对胞外多糖含量量无显著影响(>0.05)。对回归方程进行检验,调整模型决定系数=0.8722,说明该模型能解释约87.22%响应值的变化,总决定系数=0.9441,说明该模型的拟合程度较好,实验误差小;因此,此回归模型可以对胞外多糖进行准确预测和分析。
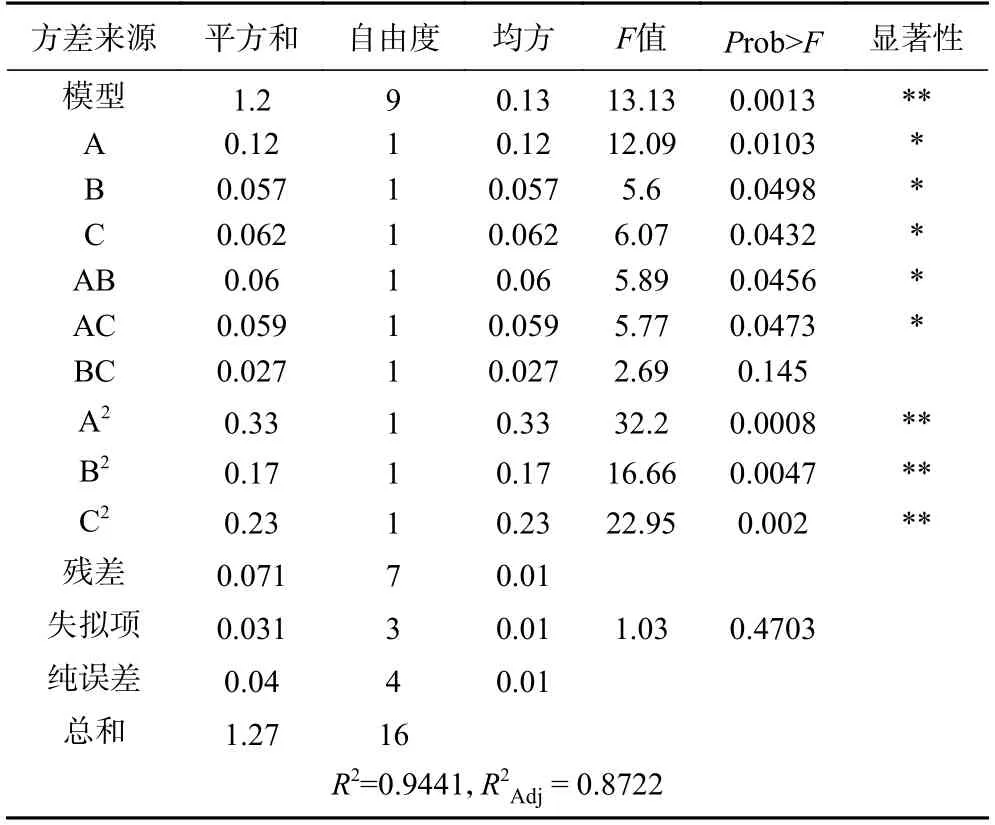
表5 Box-Behnken 响应面试验结果方差分析Table 5 Analysis of variance of Box-Behnken response surface methodology
2.1.3.2 响应面不同因素间交互作用分析 根据所得回归方程绘制不同因素间交互作用对胞外多糖含量影响大小的等高线图和响应面立体分析图,结果如图2 所示。
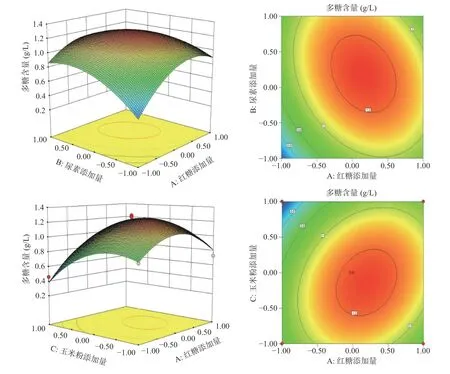
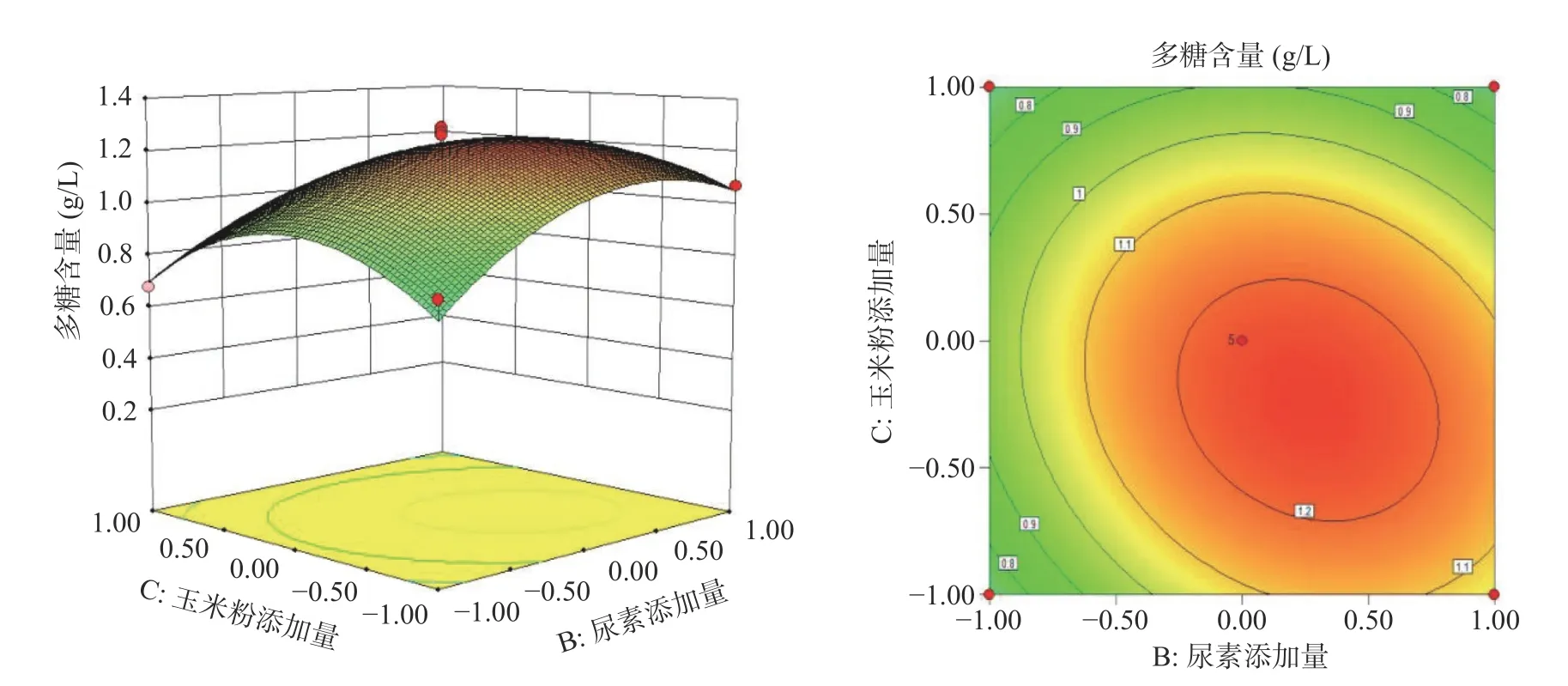
图2 不同因素间交互作用对羊肚菌液态发酵产胞外多糖的影响Fig.2 Effect of interaction between different factors of exopolysaccharides from Morchella
由两两等高线的疏密和形状来分析其交互作用,发现而AB、AC、BC 的等高线中心均呈椭圆形,说明交互作用明显。其中AB、AC 中心椭圆形状更为明显,说明尿素添加量和玉米粉添加量之间交互作用较弱。AB 较AC 相比,等高线更为密集,形成的曲面较陡,说明红糖添加量与尿素添加量之间交互作用强于红糖添加量和玉米粉添加量。
2.1.3.3 验证试验 由响应面法优化得到最佳液态发酵培养基理论配方为:红糖添加量2.20 g/L、尿素添加量3.18 g/L、玉米粉添加量2.40 g/L,胞外多糖含量可到达1.29 g/L。在此条件下,实际操作测得到胞外多糖含量为1.20 g/L,误差为6.9%。证明该模型合理,优化的培养基配方切实可行。
2.2 羊肚菌胞外多糖的体外降血糖活性
2.2.1-葡萄糖苷酶抑制活性 市面上一些常见的降血糖药物往往可以通过抑制小肠黏膜刷状缘的-葡萄糖苷酶活性以延缓碳水化合物的吸收。因此,测定MEP 对-葡萄糖苷酶的抑制活性也是验证其降血糖功能是否良好的检测方法之一。由图3可知,MEP 对-葡萄糖苷酶有很好的抑制效果,IC值为0.38 mg/mL。在一定浓度范围内,随着多糖浓度的增大,对-葡萄糖苷酶活性抑制效果越来越明显,且在0.5~1.0 mg/mL 范围内随着浓度增加,其抑制增长率趋于稳定,说明MEP 对α-葡萄糖苷酶的活性抑制作用有饱和效应,并在1.0 mg/mL 时达到73.46%。Ye 等报道榆黄菇菌丝体多糖的半抑制浓度值为0.371 mg/mL,与阿卡波糖(0.289 mg/mL)相比,黄菇菌丝体多糖活性较低。王梦雅等对桦褐孔菌胞外多糖进行研究,报道其得到的两种多糖在-葡萄糖苷酶抑制活性实验中的IC值分别为0.392、0.299 mg/mL,与本次实验结果相符。实验结果表明,羊肚菌胞外多糖在降血糖相关产品研发方面有较好的应用前景,为研制羊肚菌胞外多糖相关-葡萄糖苷酶抑制剂提供参考。
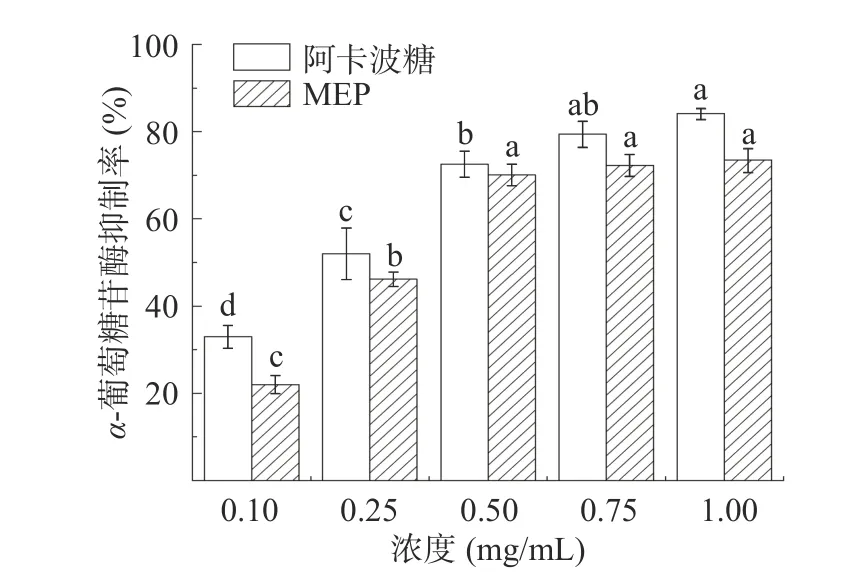
图3 羊肚菌胞外多糖的α-葡萄糖苷酶抑制活性Fig.3 Inhibitory activity of α-glucosidase of MEP
2.2.2-淀粉酶抑制活性 由图4 可知,MEP 具有一定的抑制-淀粉酶活性。随着质量浓度升高,阿卡波糖、MEP 对-淀粉酶的抑制率均增强,但随着浓度的增加,抑制率增长趋于稳定,可能是因为当多糖浓度在0.75~1.0 mg/mL 范围内,多糖的抑制作用趋于饱和导致。在质量浓度为1.0 mg/mL 时,MEP的抑制率达到36.67%,IC值为1.16 mg/mL,但活性仍低于阿卡波糖(IC值为0.263 mg/mL)。柏秋月等对4 种羊肚菌的胞外多糖-淀粉酶抑制活性进行研究,发现4 种羊肚菌的胞外多糖在到1.0 mg/mL 时,其抑制率分别为47.38%、35.04%、32.91%、32.20%、25.97%,但均显著(<0.05)低于阳性对照,与本实验结果相近。但相同浓度下,羊肚菌多糖的-淀粉酶抑制活性显著(<0.05)低于-葡萄糖苷酶抑制活性。

图4 羊肚菌胞外多糖的α-淀粉酶抑制活性Fig.4 Inhibitory activity of α-amylase of MEP
3 结论
本研究表明,不同添加物的最佳添加量分别为:红糖2.0 g/L、玉米粉2.4 g/L、黄豆粉1.2 g/L、葡萄糖2.0 g/L、硫酸铵3.2 g/L、蛋白胨2.4 g/L 以及尿素3.2 g/L;其中对胞外多糖含量影响最显著的三个因子为红糖>玉米粉>尿素。此外,最佳理论液态发酵配方是:玉米粉添加量2.4 g/L、红糖添加量2.2 g/L、尿素添加量3.18 g/L,测得出的胞外多糖含量可到达1.20 g/L,提取分离羊肚菌液态发酵得到的MEP,发现其在浓度为1.0 mg/mL 时对-葡萄糖苷酶和-淀粉酶活性均具有一定的抑制作用,对-葡萄糖苷酶和-淀粉酶的抑制率则分别达到73.46%和36.67%,该结果证明羊肚菌多糖有较好的降血糖活性,为羊肚菌多糖的开发和应用奠定了基础。
