Ca2+胁迫下越南槐种子萌发响应的比较代谢组学研究
2022-10-10李伟忠马洪娜吴依琳梁春波檀龙颜
李伟忠,马洪娜,吴依琳,梁春波,周 英,檀龙颜
(贵州中医药大学药学院,贵阳 550025)
喀斯特地区土壤中,高浓度的Ca2+能够显著抑制植物的生长、种类和群落的分布[1]。种子萌发过程是植物生活史中最重要的阶段,与幼苗的成活率密切相关。关于Ca2+胁迫对种子萌发影响的研究方面,吕朝燕和田维怡[2]观察了Ca2+胁迫对白车轴草(Trifoliumrepens)、紫云英(Astragalussinicus)、紫花苜蓿(Medicagosativa)种子萌发的影响,发现钙胁迫下紫花苜蓿种子的萌发率恢复较好,对高浓度Ca2+环境的适应能力要好于白车轴草和紫云英,是喀斯特地区较为适宜的栽培牧草品种。同时,檀龙颜等[3]观察了Ca2+胁迫对金荞麦(Fagopyrumdibotrys)种子萌发的影响,显示在低浓度Ca2+胁迫时,萌发种子主要受到渗透胁迫,细胞通过抗氧化酶清除活性氧自由基,而在高浓度Ca2+胁迫时,萌发种子可能受到离子毒害作用。此外,黄丽容等[6]研究了Ca2+胁迫下越南槐(Sophoratonkinensis)种子萌发过程中的生理特性,显示钙胁迫下主要产生渗透胁迫。这些结果对植物种子萌发过程响应钙胁迫的机制有一定的认识,但尚不明确。
在后基因组时代,植物对环境刺激的响应可能有所不同,因此利用系统生物学方法提高作物耐受性已成为人们关注的焦点。植物代谢组学无疑已成为深入了解非生物胁迫下适应性代谢反应调控不可或缺的系统生物学工具[4-5]。通过代谢产物的变化来了解Ca2+胁迫响应的全面调控系统,为确定在Ca2+耐受过程中发挥重要作用的特定代谢产物提供了可能,这可以作为未来育种和生物技术应用的生物标志物。特别是考虑到在喀斯特环境下评估大量基因型表现所产生的瓶颈,这种基于生物标记物的筛选作为一种使作物具备Ca2+耐受性的替代方法,越来越具有可信度。本试验旨在研究不同浓度Ca2+胁迫下越南槐种子萌发阶段的代谢调节,探索在种子萌发阶段存在的遗传变化,以确定具有影响的代谢物,并开发作为候选的Ca2+耐受性生物标记物,为进一步了解越南槐种子萌发对Ca2+胁迫的响应机制提供基础资料。
1 材料与方法
1.1 试验材料
越南槐种子于2021年9月采自贵州省紫云县种植基地,经贵州中医药大学檀龙颜副教授鉴定为豆科槐属(Sophora)越南槐(Sophoratonkinensis)的种子。室内干燥后,4 ℃保存备用。
1.2 种子消毒和胁迫处理
以2%次氯酸钠溶液浸泡20 min对越南槐种子进行消毒;以蒸馏水为对照(ck),50、100 mmol/L CaCl2溶液作为钙胁迫处理条件;将50粒大小均匀、饱满的种子置于直径15 cm的培养皿中,基质为2层定性滤纸,分别用蒸馏水、50、100 mmol/L CaCl2溶液润湿基质,每天09:00时补充溶液;培养皿置于人工智能气候箱中培养,黑暗,25 ℃。发芽标准为胚根突破种皮1 mm以上,不超过3 mm,发芽结束以连续5 d无新发芽种子为标准,本实验观察20 d,实验过程中及时补充处理液[6]。收集萌发种子于5 mL冻存管,每个样品3粒种子,液氮速冻,置-80 ℃保存,用于提取代谢物。
1.3 试 剂
校正液(AB Sciex集团公司,美国);乙腈,色谱级(Merck技术有限公司,德国);甲醇,色谱级(Merck技术有限公司,德国);甲酸,色谱级(科密欧化学试剂有限公司,中国);蒸馏水(广州屈臣氏食品饮料公司,中国)。
1.4 仪 器
岛津超高效液相色谱仪30 A(岛津,日本);AB Sciex Triple TOF 5600+质谱仪(AB Sciex集团公司,美国);Peak View 软件(AB Sciex集团公司,美国);Master View 软件(AB Sciex集团公司,美国);KDC-160 HR型高速低温离心机(科大创新股份公司,中国);VX-Ⅱ多管涡旋振荡器(北京踏锦科技有限公司,中国);PB 1501-N型电子分析天平(梅特勒·托利多仪器(上海)有限公司,中国);KQ-250 DB型数控超声波清洗器(昆山市超声仪器有限公司,中国);SL-1000 XLS移液器(梅特勒·托利多仪器(上海)有限公司,中国)。
1.5 样本制备
取各个样本进行称量,加入10倍量的甲醇,充分研磨后,超声30 min,离心15 min(10 000 r/min,4 ℃),取上清液,过0.22 μm滤膜过滤,即得样本品溶液。同时分别取各个供试品样本各50 μL,混合成用一个样本作为QC样本。
1.6 液相条件
色谱柱:ACQUITY UPLCTM HSS C 18(5 mm×2.1 mm i.d.,1.8 μm)(Waters集团公司,美国);流动相A为0.1%甲酸-水,流动相B为0.1%甲酸-乙腈;柱温:40 ℃;流速:0.3 mL/min;进样量:3 μL;梯度洗脱为0~3.5 min,5%~20% B;3.5~6 min,20%~40% B;6~6.5 min,40% B;6.5~12 min,40%~70% B;12~12.5 min,70% B;12.5~18 min,70%~100% B;18~25 min,100% B。色谱仪流出液不经分流直接注入质谱仪进行全扫描。
1.7 质谱条件
质谱分析采用电喷雾电离源在正负离子模式下进行。MS (m/z)的扫描范围为100~1 200 amu。MSMS的扫描范围(m/z)为50~1 200 amu。源参数设置如下:扫描类型TOF;源温度600 ℃;解簇电压100 V;气源1为55 psi;气源2为65 psi;气帘气为35 psi;离子喷射电压为5 500 V/4 000 V;碰撞能量,MS模式下15 eV,MSMS模式下35 eV/~35 eV;碰撞电压差为20 eV。
1.8 潜在生物标记物筛选及鉴定
采用主成分分析和基于正交偏最小二乘判别分析(OPLS-DA)模型对投影值(VIP)中的变量重要度进行分析。用SPSS数据软件进行多重比较分析。同时采用VIP值>1,p<0.05,筛选差异表达的代谢物。使用Peak View软件和Progenesis QI软件鉴定代谢物。每个实验重复6次。
2 结果与分析
2.1 差异代谢物鉴定
前期研究发现,随着CaCl2溶液浓度的增加,萌发种子的萌发率和含水量逐渐降低,但总可溶性糖和丙二醛含量增加,过氧化氢酶、过氧化物酶和超氧化物歧化酶活性增加[6]。基于上述结果,对0、50、100 mmol/L CaCl2溶液处理条件下萌发的种子进行了比较代谢组学分析。
本试验通过主成分分析(PCA)以确定不同处理样品和质量检测(QC)样品之间的代谢物的变化,结果表明,四组样本间分离明显(图1)。为识别潜在的变量,通过比较变量重要度投影(VIP)评分(>1.0)来筛选差异代谢物,p<0.05,然后利用在线数据库对这些差异代谢物进行鉴定。
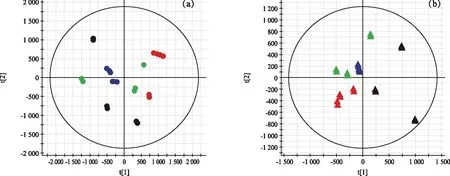
注:(a)为正极模式;(b)为负极模式;用不同颜色的圆圈或三角形表示样品,黑色代表0 mmol/L CaCl2处理样品,红色代表50 mmol/L CaCl2处理样品,绿色代表100 mmol/L CaCl2处理样品,蓝色代表QC样品。图1 不同处理样本和QC样本的PCA评分图Fig.1 PCA scores map of different treatment samples and QC samples
2.2 CaCl2溶液浓度为0、50 mmol/L处理组之间的差异代谢物
共鉴定出36种差异表达代谢物。与0 mmol/L组相比,50 mmol/L组21种代谢物表达上调,15种表达下调(见表1)。上调的代谢物中,有5种异黄酮类化合物(glycitin;prunetin;calycosin;3′,4′-Dimethoxy-7-hydroxyisoflavone;6,7,4′-trihydroxyisoflavone)、11种黄酮类化合物(naringenin-7-O-glucoside;vitexin-2″-O-rhamnoside;Apigenin 7-O-(2 G-rhamnosyl)gentiobioside;apigenin 7-glucoside;pinocembrin;naringenin;luteolin;isoliquiritin;pectolinarigenin;8-prenylnaringenin;oroxin A)、1个β-sitosterol,1个2-linoleoylglycerol,1个L-isoleucine,1个reduced L-glutathione,1个frangulin B。下调的代谢物中,2个生物碱(adenosine;oxymatrine),4个磷酸胆碱化合物(1-palmitoyl-sn-glycero-3-phosphocholine;1-oleoyl-sn-glycero-3-phosphocholine;1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine;1-hexad-ecanoyl-2-octadecadienoyl-sn-glycero-3-phosphocholine),1个1,2-dioleoyl-sn-glycero-3-phosphatidylcholine,4个磷酸乙醇胺化合物(1,2-dipalmitoyl-sn-glycerol-3-phosphoethanolamine-N,N-dimethyl;1-palmitoyl-2-hydroxy-sn-glycero-3-Phosphoethanolamine;1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine;1-stearoyl-2-hydroxy-sn-glycero-3-phosphoethanolamine),4种有机酸化合物(3-furancarboxylic acid;DL-malic acid;citric acid;deoxycholic acid)。
2.3 CaCl2溶液浓度为0、100 mmol/L处理组之间的差异代谢物
共鉴定出14种差异表达代谢物。与0 mmol/L组相比,100 mmol/L组有9种代谢物表达上调,5种代谢物表达下调(见表2)。上调的代谢物中,有2种异黄酮化合物(calycosin;6,7,4′-trihydroxyisoflavone),5类黄酮化合物(luteolin;pectolinarigenin;fustin;oroxin A;vitexin-2″-O-rhamnoside)1个 phytosphingosine,1个1-oleoyl-sn-glycero-3-phosphocholine。下调的代谢物中,3个有机酸化合物(3-furancarboxylic acid;DL-malic acid;citric acid)1个1-Palmitoyl-2-hydroxy-sn-glycero-3-phosphoethanolamine,1个2-Palmitoyl-rac-glycerol。
2.4 CaCl2溶液浓度为50、100 mmol/L处理组之间的差异代谢物
鉴定出24种差异表达代谢物。与50 mmol/L组相比,100 mmol/L组有10种代谢物表达上调,14种代谢物表达下调(见表3)。上调的代谢物中,1个fustin,2个异黄酮类化合物(6,7,4′-Trihydroxyisoflavone;Genistein),2个磷酸胆碱化合物(1-oleoyl-sn-glycero-3-phosphocholine;1-Hexadecanoyl-2-octadecadienoyl-sn-glycero-3-phosphocholine),1个1,2-dioleoyl-sn-glycero-3-phosphatidylcholine,1个1-Stearoyl-2-hydroxy-sn-glycero-3-phosphoethanolamine,2个有机酸(deoxycholic acid;3 β-Hydroxy-5-cholenoic acid),1个phytosphingosine。下调的代谢物中,2个异黄酮类化合物(glycitin;3′,4′-Dimethoxy-7-hydroxyisoflavone),9个黄酮类化合物(pinocembrin;naringenin;isoliquiritin;8-prenylnaringenin;oroxin A;naringenin-7-O-glucoside;vitexin-2″-O-rhamnoside;7-Hydroxyflavanone;homobutein),1个frangulin B,1个2-Palmitoyl-rac-glycerol,1个ricinoleic acid methyl ester。

表1 50 mmol/L组萌发种子和0 mmol/L组萌发种子差异代谢物Table 1 Differential metabolites of germinated seeds in 50 mmol/L group and 0 mmol/L group
2.5 代谢调解途径
为了全面了解种子在钙胁迫下代谢组的变化情况,构建了种子代谢网络,突出钙胁迫反应中所涉及的特定途径和网络的变化。这些途径主要是从KEGG数据库和文献中检索到的信息构建的(图2 a~图2 c,图3 a~图3 c)。钙胁迫显著改变了种子代谢组,其中类黄酮和异黄酮类化合物合成、脂类化合物合成和有机酸合成的变化幅度最大。
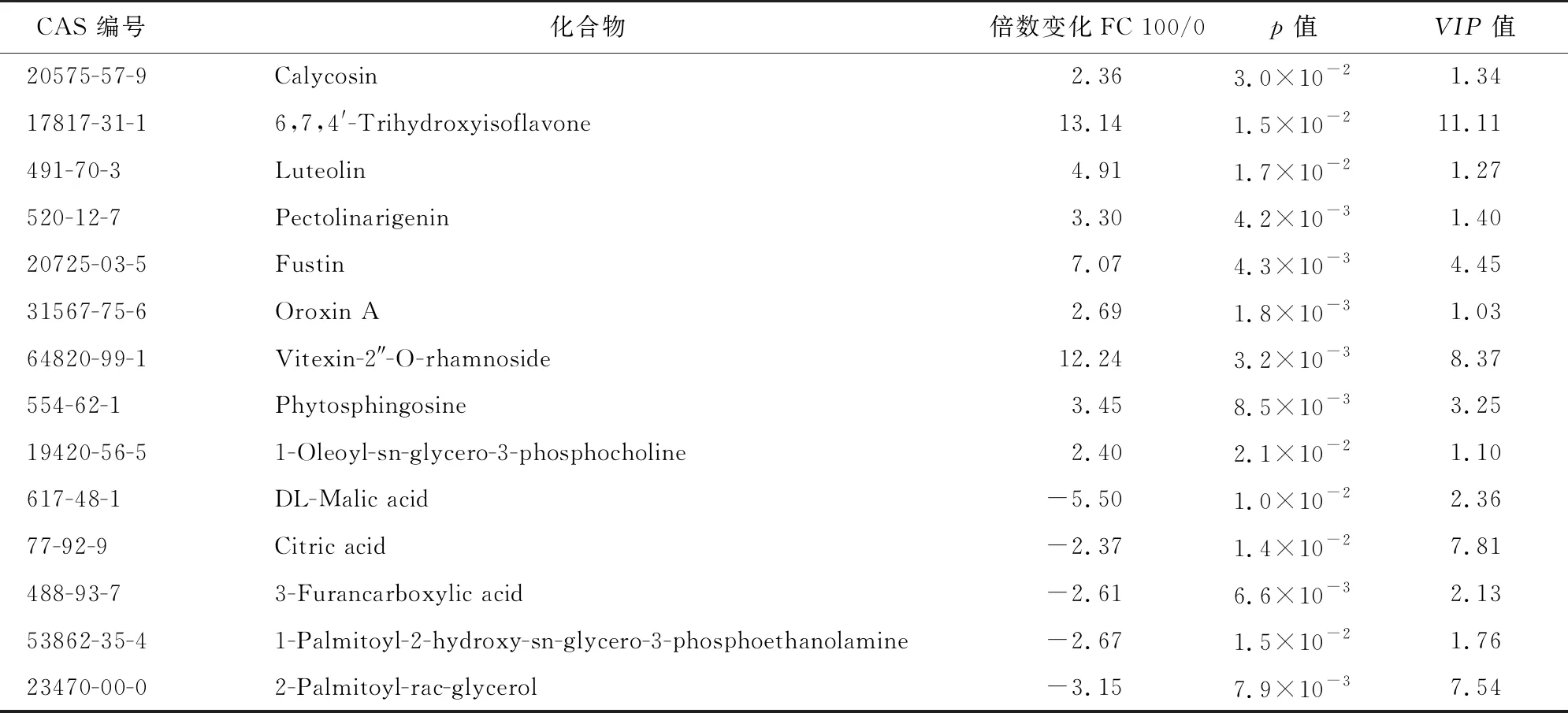
表2 100 mmol/L组萌发种子和0 mmol/L组萌发种子差异代谢物Table 2 Differential metabolities of germinated seeds in 100 mmol/L group and 0 mmol/L group

表3 100 mmol/L组萌发种子和50 mmol/L组萌发种子差异代谢物Table 3 Differential metabolites of germinated seeds in 100 mmol/L group and 50 mmol/L group
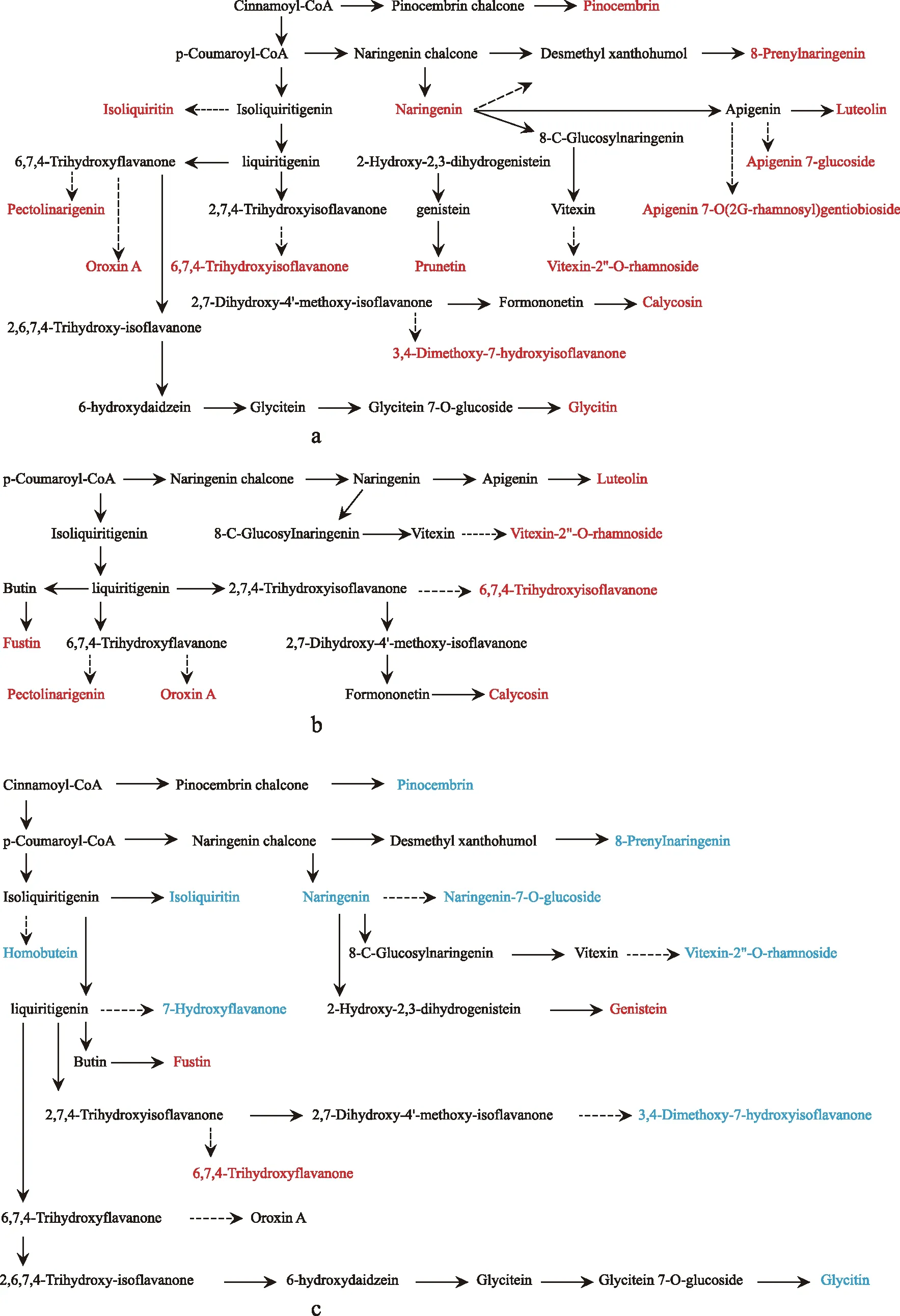
注:黑色化合物为KEGG和文献中发现。红色和蓝色化合物是本研究中鉴定的代谢物,红色代表上调,蓝色代表下调。实箭头表示确定路径,虚线箭头表示可能的路径。a为50 mmol/L处理组与对照组比较;b为100 mmol/L处理组与对照组比较;c为100 mmol/L处理组与50 mmol/L处理组比较。下同。 图2 类黄酮和异黄酮生物合成途径Fig.2 Biosynthetic pathway of flavonoids and isoflavones

图3 脂质和有机酸的生物合成途径Fig.3 Biosynthetic pathways of lipids and organic acids
3 讨 论
3.1 胁迫种子中类黄酮和异黄酮含量的变化
胁迫种子中黄酮类化合物和异黄酮类化合物水平的总体变化表明萌发种子在钙胁迫下存在一种普遍的代谢紊乱。黄酮类化合物是植物的次生代谢物,能够参与植物对环境胁迫的反应,其主要功能是由于其具有较强的抗氧化性[7]。黄酮类化合物通过抑制单线态氧、抑制产生活性氧(ROS)的酶、螯合可能催化ROS过渡产生的金属离子、猝灭脂质过氧化中自由基反应的级联以及“循环”其他抗氧化剂来清除ROS[8-13]。同时,黄酮类化合物具有较低的氧化还原电位[14],可降低强自由基的活性。异黄酮类化合物的抗氧化性是其最重要的生物学特性之一[15]。在本研究中,与0 mmol/L Ca2+处理的种子相比,50 mmol/L Ca2+处理的种子在萌发过程中积累了更高浓度的5种黄酮类化合物和11种异黄酮化合物(图2 a)。此外,与0 mmol/L Ca2+处理的种子相比,100 mmol/L Ca2+处理的种子在萌发过程中2种黄酮类化合物和5种异黄酮化合物表达上调(图2 b)。但与50 mmol/L Ca2+处理相比,100 mmol/L Ca2+处理的种子,2种黄酮类化合物和9种异黄酮化合物表达量显著下调,只有1种黄酮类化合物和2种异黄酮表达上调(图2 c)。这些代谢物表达量的增加可能反映了萌发种子需要清除活性氧来应对钙胁迫。但100 mmol/L Ca2+处理的种子中这些代谢物含量的下降可能表明,高浓度的Ca2+产生了严重的渗透胁迫。
3.2 胁迫种子脂质含量的变化
胆碱是植物合成磷脂酰胆碱的重要代谢物[16]。磷酸乙醇胺可转化为磷脂酰乙醇胺,也可甲基化生成磷酸胆碱,磷酸胆碱又可转化为胆碱[17]。此外,胆碱经两步氧化后可生成甜菜碱[18]。甜菜碱具有较强的抗渗性能,并具有耐受性[19]。本实验结果显示,与0 mmol/L Ca2+处理的种子相比,50 mmol/L Ca2+处理的种子在萌发过程中,4个磷酸胆碱化合物、4个磷酸乙醇胺化合物和1个磷脂酰胆碱化合物表达下调(图3 a)。表明50 mmol/L Ca2+处理的种子通过合成甜菜碱,延缓了甘油磷脂的合成,维持了细胞的渗透平衡。但是,当Ca2+胁迫程度达到100 mmol/L,甘油磷脂的合成可能恢复,与50 mmol/L Ca2+处理组相比,100 mmol/L Ca2+处理的种子中2个磷酸胆碱化合物和1个磷脂酰胆碱化合物表达上调(图3 c)。因此,在100 mmol/L Ca2+条件下,膜脂可能已被严重破坏,急需修复。此外,与对照组相比,50 mmol/L Ca2+处理的种子中β-sitosterol和2-linoleoylglycerol表达上调,同时,与对照和50 mmol/L Ca2+处理的种子相比,phytosphingosine表达上调(图3 a~c)。β-sitosterol可通过提高膜稳定性指数来缓解盐胁迫对向日葵的伤害效应,同时,在盐胁迫下施用β-sitosterol可提高向日葵植株的可溶性糖和脯氨酸含量,从而部分缓解了盐胁迫的抑制作用[20]。同时,Senthil-Kumar等[21]也报道,sitosterol可能通过增强膜稳定性而在非生物胁迫耐受性中发挥作用。此外,2-linoleoylglycerol还有助于不饱和脂肪酸的生物合成。因此,在50 mmol/L Ca2+处理的种子中,β-sitosterol和2-linoleoylglycerol的表达上调可能具有增强膜稳定性的作用。植物鞘脂不仅是质膜和其他内膜系统的结构成分,而且在生物和非生物胁迫中起信号分子的作用[22]。研究表明,phytosphingosine是一种天然存在的具有生物活性的鞘脂分子,外源添加phytosphingosine可快速诱导长链碱基、ROS和乙烯瞬时合成的转录,表明植物免疫系统中获得性抗性的形成[23]。因此,phytosphingosine的增加表明phytosphingosine可能具有信号分子的功能。
3.3 胁迫种子中有机酸和其他化合物含量的变化
有机酸可以为多种生物活性和不同生物合成途径的前体提供能量,从而在逆境条件下维持植物的细胞功能[24]。有机酸可以平衡过量的离子,调节细胞pH值和渗透电位[25-26]。此外,有研究表明,有机酸在活性氧清除和细胞完整性中发挥重要作用[27-29]。在本研究结果中,与对照相比,50 mmol/L和100 mmol/L Ca2+胁迫下的萌发种子中,citric acid,DL-malic acid,3-furancarboxylic acid的表达均下调(图3 a~图3 b)。柠檬酸和苹果酸在柠檬酸循环中起重要作用,这两种有机酸在钙胁迫下的减少可能是由于柠檬酸循环被扰乱所致。研究表明,3-furancarboxylic acid参与螯合过程,如吡啶或吡嗪环的氮原子[30]。同时,苹果酸可以合成3-furancarboxylic acid,说明3-furancarboxylic acid的螯合功能可能受到了间接干扰[31]。Ignacio Barrasa等[32]报道,deoxycholic acid可通过氧化应激诱导细胞凋亡。在本研究中,deoxycholic acid在50 mmol/L Ca2+胁迫下含量降低,但在100 mmol/L Ca2+胁迫下增加到对照水平(图4 a~图4 c)。结果表明,在100 mmol/L Ca2+胁迫条件下,某些严重损伤的细胞可被诱导凋亡。在干旱胁迫诱导下,鹰嘴豆(Cicerarietinum)耐性品系的L-isoleucine水平升高,表明鹰嘴豆对干旱胁迫的适应性反应,提示L-isoleucine可能作为脯氨酸等代谢生物标志物[33]。Paidi等[34]报道了L-isoleucine作为渗透保护剂,在盐胁迫下保护Aeluropus lagopoides的膜和蛋白质免受ROS的损害。在本研究结果中,L-isoleucine在50 mmol/L Ca2+胁迫下增加显示了类似的功能。Reduced L-glutathione在植物的许多生理过程中发挥重要作用,是细胞内对抗氧化应激的主要防御分子[35]。因此,50 mmol/L Ca2+胁迫下增加的Reduced L-glutathione可能具有清除ROS的作用。
