家种柳叶白前种子特性研究
2022-10-10易沭远王湛昌阳永学李秀丽陈艳清陈法志
易沭远,王湛昌,刘 忠,阳永学,李秀丽,陈艳清,陈法志
(武汉市农业科学院林业果树研究所,湖北 武汉 430073)
柳叶白前为萝藦科鹅绒藤属植物,又名鹅管白前,为中国药典收录的两种白前之一[1]。全株药用,有清热解毒,降气下痰之功效[2]。目前,关于柳叶白前的功能成分有不少研究,根茎包含的化学成分如甾体、脂肪酸、甾醇、多糖及其他挥发性物质等均已有广泛研究,各类成分在镇咳、抗炎等方面的药理学功能也逐渐有了明确的解析[3]。柳叶白前的根茎常被用来治肺病、小儿疳积、感冒咳嗽及慢性支气管炎等,冬季需求量较大,近年来价格持续走高[4]。
柳叶白前在南方多省均有分布,多为野生,虽然产区较大,但各地柳叶白前资源的品种、性状和生长势都有明显差别,导致药材的品质不一[5]。有研究证实,不同来源的柳叶白前,其发挥药理功能的资源浸出物和多糖含量均不一致,无法匹配工业需求[6-7]。而且,野生柳叶白前的生长范围较小,资源分散,产量不足,采挖难度较大。目前,只有人工驯化栽培的家种白前总体品质均一、产量和性状稳定,可满足市场需要。
在中药材的人工栽培过程中,种子是决定采收后药材质量的关键因素[8],种子的特性与田间出苗率密切相关,但柳叶白前的种子生理特征研究目前尚未见报道。因此,本研究开展了柳叶白前种子的相关实验,拟阐明柳叶白前种子的生物学特性和表征,研究种子的发芽适宜条件,为提高柳叶白前种子的萌发率和出苗率提供依据。
1 材料与方法
1.1 材 料
本试验使用的柳叶白前角果购于武汉市白前堂药材种植专业合作社;白菜种子为武汉九头鸟种苗有限公司的四季中其小白菜,水稻种子为常规籼稻品种黄华占。试剂2,3,5-氯化三苯基四氮唑(TTC)和CaCl2为国产分析纯;GA3购自上海源叶生物科技有限公司。
1.2 方 法
1.2.1角果特征与种子数量的测定
随机选取30个柳叶白前角果,除去果壳和种缨,观察角果内的种子饱满度,统计饱满粒和干瘪粒的数量;依次用游标卡尺测量角果长度、结节宽度、中段宽度、尾段宽度,取平均值,得到角果的平均长度和宽度;将30个角果剥出种子,统计每个果实的种子粒数。
1.2.2千粒重的测定
将纯净、饱满种子分为4份,从每份中随机选取250粒,1 000粒为1组,用万分之一电子天平称重。
1.2.3透水性和浮水率的测定
选取200粒种子,称取重量,在无菌水中浸泡,在25 ℃恒温条件下吸胀,每隔1 h取出种子称重,至种子恒重为止;称重时用滤纸吸干表面水分后,在万分之一电子天平上称重,重复3次。
吸水率(%)=[(浸种后重量-浸种前重量)/浸种前重量]×100%。
选取100粒种子,投入水中,充分搅拌震荡后静置5 min,统计下沉的种子数量,计算浮水率,重复3次。
1.2.4含水率的测定
在电子天平上称取5 g白前种子粉末3份,称取5 g白前种子3份,共6份种子样品分别放入烘干后称重的称量瓶中,在110 ℃开盖烘干6 h后,取出盖上盖子称重,并计算含水率。
含水率(%)=[(烘干前重量-烘干后重量)/烘干前重量]×100%。
1.2.5柳叶白前种子生活力的测定
采用TTC法[9],用30~35 ℃温水浸种12 h,使种子充分吸胀。然后将种子沿胚的中线纵切成两半,100粒为1个重复,3次重复,置于0.5%TTC 溶液中,在30~35 ℃条件下避光染色1 h、2 h、3 h、4 h、5 h,去离子水反复冲洗至不再洗出颜色为止,观察种子胚部的染色情况,胚染成红色的为有生活力的种子,计算种子的生活力。
1.2.6柳叶白前种子的微形态观察
将柳叶白前种子用浓度为3%的戊二醛固定过夜,清洗后用系列梯度酒精脱水后干燥,在扫描电镜(HITACHI SU-8010)下观察,观察面长5~6 mm,厚度约2 mm。该部分操作由武汉普奈斯生物科技有限公司完成。
1.2.7柳叶白前种子萌发实验
将柳叶白前种子用 0.3%高锰酸钾水溶液消毒15 min,用无菌水冲洗干净,并用滤纸将种子表面水分吸干。将消毒后的种子均匀排布在培养皿内,设定光照周期为光照12 h/黑暗12 h,分别在25 ℃/15 ℃、30 ℃/20 ℃、35 ℃/25 ℃等5组变温处理下观察发芽情况,每组为50粒种子,重复3组。发芽标准为待突破种皮的胚轴长度达到2 mm以上。每天统计发芽率直到稳定。
1.2.8柳叶白前种子的引发实验
以GA3和CaCl2为引发剂,各设置3个浓度梯度,其中GA3浓度分别为50 mg/L、100 mg/L、200 mg/L,CaCl2浓度分别为100 mg/L、200 mg/L、400 mg/L。将种子浸泡在20 mL引发剂中,在20 ℃黑暗条件下引发处理24 h,引发结束后,用去离子水冲洗2 min,用吸水纸吸干表面水分,在自然条件下回干24 h,均匀放置到培养皿中,每个浓度下设置3个培养皿,每个培养皿放置15粒种子,然后在光照培养箱中开展25 ℃/15 ℃昼夜变温发芽试验。以ddH2O引发为对照,统计每天发芽率。重复3组。
1.2.9柳叶白前种子浸提物抑制白菜和水稻种子萌发实验
将柳叶白前种子去掉绢毛后称取5 g研磨成粉末,置于锥形瓶内,加入80%甲醇溶液50 mL,在4 ℃下浸提36 h,滤除残渣,重复提取3次,合并滤液。甲醇浸提液用旋转蒸发仪将溶剂蒸干后,加入蒸馏水,分别调节剩余物质质量浓度至0.01 g/mL、0.05 g/mL、0.1 g/mL;将白菜种子和水稻种子用0.5%高锰酸钾溶液浸泡消毒30 min,蒸馏水冲洗干净,用滤纸吸干种子表面水分;取不同浓度浸提液10 mL,将白菜种子和水稻种子浸泡24 h后,将种子均匀放置于铺有2层滤纸的培养皿中,每个处理重复3次,每个重复50粒种子,以蒸馏水处理为对照,放在25 ℃光照培养箱内发芽,统计5 d发芽率,并测量根高和苗长。

注:1~3为种子表皮形态;4~6为种子横切面形态。图1 柳叶白前种子的微形态Fig.1 Microstructural features of Cynanchum stauntonii seed

表1 不同温度下柳叶白前种子萌发率Table 1 Seed germination rate of Cynanchum stauntonii
2 结果与讨论
2.1 柳叶白前角果与种子特征
柳叶白前的果实中,每个角果内饱满粒约为1.2粒,干瘪粒约为16.5粒;角果平均长度约为11.6 cm,结节宽度约为0.4 cm,中段宽约1.1 cm,尾段宽约0.4 cm。每个角果内种子约为17粒。种子平均长度为1.7 cm,宽度为0.3 cm,厚度为0.09 cm。种子的千粒重为6.25 g,透水率为46%,浮水率为23.33%,含水率为22.9%。TTC染色1~5 h,柳叶白前种子的生活力分别为43%、63%、74%、75%和77%。
柳叶白前角果呈狭长卵形,头部带有白色绢毛,种子呈披针形,表面为褐色[10]。如图1所示,柳叶白前种子表皮呈现鹅绒藤属植物种子的典型特征:细胞的边缘略微隆起,表面凹陷呈网状,且网孔不规则。种子的横切面有明显的沟槽。
2.2 柳叶白前种子萌发率
由表1可看出,在25 ℃/15 ℃下,柳叶白前种子从培养第4天开始发芽,有绢毛的种子4 d萌发率为1.9%,7 d时增加到6.8%;无绢毛的种子4 d萌发率为8.5%,7 d时增加到13.3%。在30 ℃/20 ℃下,柳叶白前种子从培养第3天开始发芽,有绢毛的种子3 d萌发率为3.8%,7 d时增加到34.3%;无绢毛的种子3 d萌发率为2.9%,7 d时增加到30.5%。在35 ℃/25 ℃下,柳叶白前种子从培养第3天开始发芽,有绢毛的种子3 d萌发率为12.3%,7 d时增加到54.3%,5~7 d的种子萌发率与3 d萌发率差异极显著。无绢毛的种子3 d萌发率为15.4%,7 d时增加至60%,且6 d和7 d时种子萌发率与3 d时差异极显著(图2 A)。
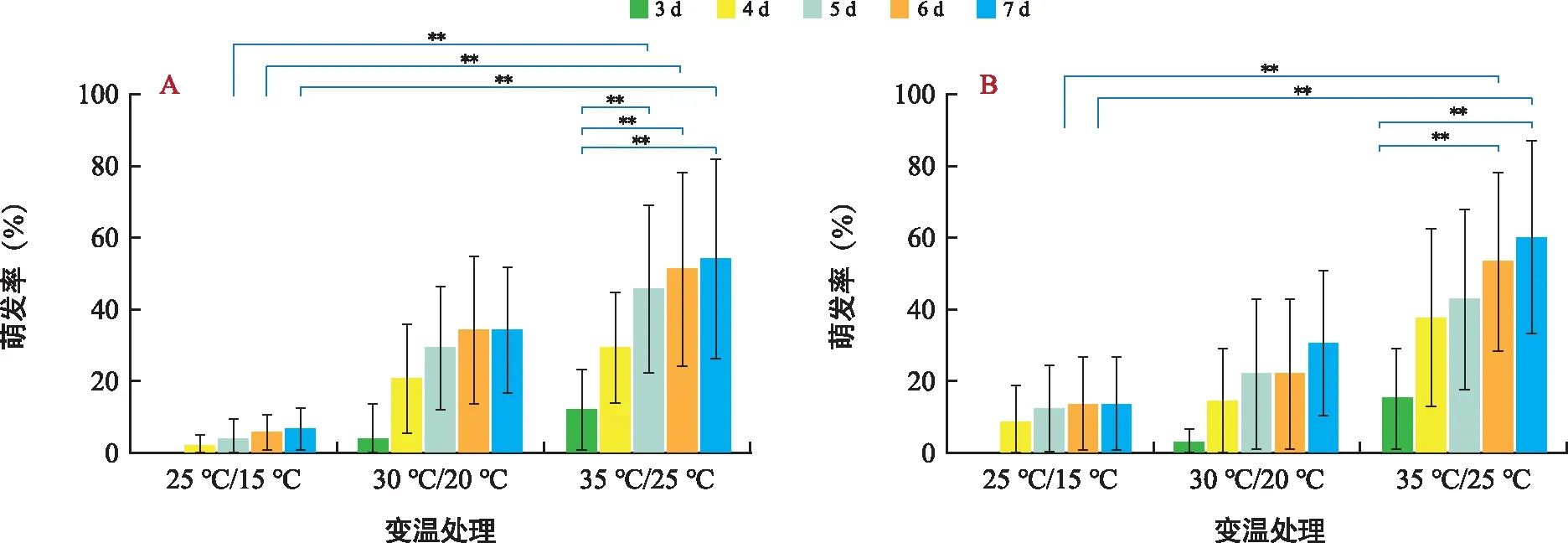
注:A为有绢毛种子的萌发率;B为无绢毛种子的萌发率;“**”代表p<0.01水平的显著性差异。下同。图2 不同温度梯度下柳叶白前种子的萌发率Fig.2 Germination rate of Cynanchum stauntonii seeds under various temperature gradient
有绢毛的种子,在35 ℃/25 ℃下,5 d、6 d和7 d的萌发率与25 ℃/15 ℃温度下同一时期的种子萌发率表现出极显著差异(图2 A);无绢毛的种子在6 d和7 d,35 ℃/25 ℃下种子萌发率与另外2个温度梯度下种子6 d和7 d的萌发率表现出显著差异(图2 B)。实验结果表明,在不同的温度梯度下,无绢毛和有绢毛柳叶白前种子的萌发率均随着培养天数的增加而增加,且以35 ℃/25 ℃下种子萌发率最高,30 ℃/20 ℃次之,25 ℃/15 ℃下最低。

表2 不同浓度GA3处理对柳叶白前种子萌发的影响Table 2 Effects of gibberellin with various concentrations on Cynanchum stauntonii seed germination
2.3 引发剂对柳叶白前种子萌发的影响
由表2可知,与未用GA3处理的种子相比,培养2 d时,在50 mg/L、100 mg/L浓度下培养的种子萌发率较为一致,在200 mg/L浓度下萌发率增加了38.7%;培养3 d后,在50 mg/L,100 mg/L和200 mg/L的GA3处理下,萌发率分别增加了15.1%,21.6%和43.6%;在50 mg/L、100 mg/L和200 mg/L的GA3处理下,培养4 d后,萌发率分别增加了12.5%、25.4%和46.7%;培养5 d后,萌发率分别增加了5.9%、22.1%和38.0%;培养6 d后,萌发率分别增加了3.0%、21.2%和44.2%;培养7 d后,萌发率分别增加了1.8%、20.8%和41.4%。
如图3所示,在不同GA3浓度下,培养2 d种子的萌发率并无明显差异,但在200 mg/L的GA3处理下,培养6 d的种子与培养2 d的种子萌发率出现显著差异。以上结果说明,GA3可促进柳叶白前种子的萌发,以200 mg/L的GA3处理效果最佳。

注:“*”代表p<0.05水平的显著性差异。下同。图3 不同浓度GA3处理下柳叶白前种子的萌发率Fig.3 Effects of gibberellin with various concentrations on Cynanchum stauntonii seed germination
由表3可见,与对照相比,在CaCl2浓度为100 mg/L时,各培养2 d、3 d、4 d、5 d后,种子的萌发率分别下降了55.6%、10.1%、9.9%和4.4%,培养6 d后,萌发率与未处理的种子相同,培养7 d后,种子萌发率增加了3.0%;在CaCl2浓度为200 mg/L时,培养2 d后,种子的萌发率下降了17.0%,培养3 d时,种子的萌发率升高了6.6%,培养4 d、5 d、6 d、7 d时,种子萌发率分别下降了6.1%、3.0%、3.0%和4.5%;在CaCl2浓度为400 mg/L时,培养2 d时,种子的萌发率下降了44.4%,培养3 d时,种子的萌发率下降了10.1%,培养4 d、5 d、6 d、7 d时种子萌发率分别下降了10.1%、7.5%、3.0%和4.5%。

表3 不同浓度CaCl2对柳叶白前种子萌发的影响Table 3 Effects of calcium chloride with various concentrations on Cynanchum stauntonii seed germination
如图4所示,用3种不同浓度CaCl2处理的种子,培养2~3 d时萌发率均与培养5 d时的种子萌发率有极显著差异,而未用CaCl2处理的种子2~3 d的萌发率与培养5 d时的种子萌发率无显著差异。以上结果说明,培养2~3 d时,大部分种子萌发率出现略微下降,且不同浓度的CaCl2溶液对种子萌发的作用水平一致,CaCl2处理对柳叶白前种子萌发率无明显促进作用。
2.4 柳叶白前种子浸提液对白菜种子和水稻种子的影响
由表4可知,当浸提液浓度为0时,白菜种子发芽率仅为40.7%。随着浸提液浓度增大,白菜种子发芽率增加趋势明显。 浸提液浓度为0.01 g/mL时,白菜种子萌发率为74.2%;浸提液浓度为0.05 g/mL时,白菜种子萌发率为76.3%;当浸提液浓度为0.1 g/mL时,白菜种子萌发率增加到了88.3%,与浸提液浓度为0时相比,分别增加了33.5%,35.6%和47.6%。
在3种浸提液浓度下,白菜种子发芽率与浸提液浓度为0时的发芽率均呈显著差异(图5 A);根高分别增加了6.6%,32.4%和22.3%(表4,图5 B),苗长分别增加了17.2%,12.6%和25.2%(表4,图5 C)。说明柳叶白前种子浸提液能够促进白菜种子萌发。

表4 不同浓度柳叶白前种子浸提液对白菜种子发芽的影响Table 4 Effects of Cynanchum stauntonii seed extract with various concentrations on cabbage seed germination

图4 不同浓度CaCl2处理下柳叶白前种子的萌发率Fig.4 Effects of calcium chloride with various concentrationson seed germination of Cynanchum stauntonii
如表5所示,当浸提液浓度为0时,水稻种子5 d发芽率为84%;浸提液浓度为0.01 g/mL、0.05 g/mL和0.1 g/mL时,水稻种子的发芽率分别下降了10.7%、7.7%和11.9%。浸提液浓度为0时,水稻种子的根高和苗长分别为2.77 cm和2.27 cm;浸提液浓度为0.01 g/mL、0.05 g/mL和0.10 g/mL时,水稻种子根高分别下降了12.3%,56.3%,5.1%,芽长分别下降了48.5%,69.2%和58.6%。

表5 不同浓度柳叶白前种子浸提液对水稻种子发芽的影响Table 5 Effects of Cynanchum stauntonii seed extract with various concentrations on rice seed germination
不同浓度浸提液对水稻种子的发芽率无明显影响(图6 A),但水稻种子发芽后,在0.05 g/mL浸提液浓度下的根高与其他3个浓度下的根高差异极显著(图6 B);3种浸提液浓度下,苗长与未用浸提液处理时水稻种子的差异极显著(图6 C)。说明柳叶白前种子浸提液对水稻种子生长有抑制作用,以浸提液浓度为0.05 g/mL时最为明显。
3 讨 论
3.1 柳叶白前种子外观特性
根据《中国植物志》(第63卷)中对鹅绒藤属的分类,柳叶白前属于鹅绒藤属中的催吐白前组。本研究结果表明,柳叶白前的种子外观与表面纹饰与其他几类属于催吐白前组的植物如合掌消、潮风草、大理白前和毛白前等差异不大[11],但种子大小有较大差异。
3.2 柳叶白前种子萌发最适温度条件
柳叶白前种子萌发受温度的影响较为显著,温度较低时,种子不萌发;最适萌发温度为25~35 ℃。在实际生产中,柳叶白前的播种时间一般在2月上旬,环境温度较低[12]。播种过程可采用温水浸泡种子,播种后喷洒温水,利用塑料薄膜等增温方式促进种子快速萌发。

图5 不同浓度柳叶白前种子浸提液对白菜种子发芽的影响Fig.5 Effects of Cynanchum stauntonii seed extract with various concentrations on cabbage seed germination

图6 不同浓度柳叶白前种子浸提液对水稻种子发芽的影响Fig.6 Effects of Cynanchum stauntonii seed extract with various concentrations on rice seed germination
3.3 柳叶白前种子适用引发剂
对不同类型的中药材种子进行针对性的有效处理后能提高种子的活力,达到增加出苗率的效果[13]。GA3和CaCl2都是广泛应用的能促进种子萌发的化学试剂,本研究证明,GA3可促进柳叶白前种子的萌发,在200 mg/L GA3浓度下,种子的发芽率达71.4%,接近本研究中最高值77%,说明高浓度的GA3作用能够激发柳叶白前种子潜在的萌发能力;而CaCl2处理对种子萌发无促进作用,种子萌发率反而下降。因此,柳叶白前在播种时可辅以GA3处理提高发芽率。
3.4 柳叶白前种子浸提液对白菜和水稻种子发芽的影响
柳叶白前种子的浸提物对白菜种子发芽有促进作用;对水稻种子萌发率影响不大,但影响根高和苗长。可以推测柳叶白前种子内同时含有促进白菜种子发芽和抑制水稻种子萌发生长的化学成分。
