人参皂苷Rd对MGH大鼠乳腺组织保护作用及促凋亡机制
2022-10-09兴伟刘远徐曌徐志峰宋易华
兴伟 刘远 徐曌 徐志峰 宋易华
(河北省中医院普外科,河北 石家庄 050000)
乳腺增生(MGH)是育龄妇女的常见疾病,属中医学乳癖范畴,其发病率占育龄妇女的40%左右,病程长且具有一定的癌变倾向,严重威胁广大妇女的身心健康〔1〕。现代医学认为,MGH主要与内分泌功能紊乱密切相关,西医临床以内服激素和手术治疗为主。人参皂苷(GS)Rd在人参属植物中的含量较低,但却具有较强的生物活性,如改善微循环、调节免疫、抗炎和镇痛等药理作用〔2,3〕。本研究主要观察GSRd对雌孕激素诱导MGH大鼠血清性激素水平、B细胞淋巴瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)和Ki-67等表达影响,探讨其诱导凋亡的可能机制。
1 材料与方法
1.1仪器与试剂 GSRd(成都曼思特生物科技有限公司,质量分数≥98%);雌二醇(E2)苯甲酸注射液和孕酮(P)注射液(浙江宁波,三生制药有限公司)提供;E2、P、促黄体激素(LH)、促卵泡激素(FSH)、催乳素(PRL)、睾酮(T)酶联免疫吸附测定试剂盒(江苏南京,建成生物工程研究所);细胞核增殖指数(Ki)-67、Bax、Bcl-2、β-actin抗体(美国,Danvers);SZX10显微镜(日本,奥林巴斯公司);ChemiDoc-XRS成像系统(美国,BioRad)。
1.2实验动物 60只Wistar雌性大鼠,重180~220 g,购自北京维通利华实验动物技术有限公司〔SCXK(京)2015-0011〕,使用许可证号〔SYXK(冀)2015-0023〕,适应性喂养1 w,进行正常饮食和自由饮水。将大鼠随机分为对照组(10只)和模型组(50只),对照组不做任何处理,模型组建模方法:大鼠后腿内侧肌肉注射雌激素〔0.5 mg/(kg·d)〕25 d,随后5 d注射孕激素〔5 mg/(kg·d)〕诱导动物模型生长。从第31天开始,将60只大鼠分为6组,每组10只,分别处理如下:对照组(等量生理盐水)、模型组(等量生理盐水)、阳性对照组(三苯氧胺,1.5 mg/kg)、GSRd-低剂量组(10 mg/kg)、GSRd-中剂量组(20 mg/kg)、GSRd-高剂量组(40 mg/kg)。所有药物在使用前溶于蒸馏水中,以10 ml/kg体重灌胃给药,连续给药30 d。在实验过程中于预定时间测量大鼠乳头直径。实验结束后,禁食一晚,经腹主动脉采集血样,离心分离血清,然后在-80℃下储存,用于激素测定。将部分乳腺组织固定在4%多聚甲醛中,以备后续实验。本研究经单位动物保护与利用委员会批准。
1.3乳头直径和器官系数的测定 实验开始第1天、第30天、第45天和最后1 d,用游标卡尺测量乳头直径。实验结束时,子宫和卵巢完全分离并称重,以子宫或卵巢重量除以体重计算器官系数。
1.4酶联免疫吸附试验(ELISA)检测MGH大鼠血清性激素水平 血清中E2、P、LH、FSH、PRL和T的含量检测,按试剂盒(南京建城生物工程研究所)说明书操作。
1.5苏木素-伊红(HE)染色观察大鼠乳腺组织病理变化 取乳腺组织在4%多聚甲醛中处理48 h后,经乙醇梯度脱水、石蜡包埋,切成4 μm厚的切片,然后用HE染色,用显微镜观察乳腺组织的病理变化。
1.6免疫组化法检测大鼠乳腺Bcl-2蛋白表达 将石蜡切片(4 μm)在二甲苯中脱蜡,水化,并在3%过氧化氢中孵育20 min,将切片在微波炉中加热两次,在0.01 mol/L柠檬酸盐缓冲液中加热5 min,室温封闭1 h。Bcl-2一抗4℃ 孵育过夜,用辣根过氧化物酶(HRP)二级抗体洗涤和孵育30 min。二氨基联苯胺(DAB)染色后,苏木精复染,乙醇分级脱水,最后用中性树胶封片,切片在显微镜下拍照观察。
1.7Western印迹检测乳腺Bcl-2、Bax和Ki-67蛋白表达 提取乳腺组织中总蛋白,用二喹啉甲酸(BCA)法测定蛋白质浓度,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的蛋白质(50 μg),然后转移到聚偏氟乙烯(PVDF)膜上。用5%脱脂奶粉在TBS-T中封闭2 h,分别加Bcl-2、Bax和Ki-67一抗于4℃下孵育过夜,在室温下与HRP结合的二级抗体孵育2 h后,用电化学发光(ECL)显色。用ImageJ软件定量分析蛋白质条带的强度,实验重复3次。
1.8统计学分析 采用SPSS18.0软件进行方差分析、t检验。
2 结 果
2.1GSRd对MGH大鼠子宫和卵巢器官系数的影响 与对照组相比,模型组实验30、45、60 d乳头直径及子宫系数明显升高(P<0.05)。与模型组相比,GSRd-中、高剂量组和阳性对照组子宫系数及实验45、60 d乳头直径明显下降(P<0.05)。而各组间卵巢系数无显著差异(P>0.05),见表1。
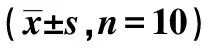
表1 各组乳头直径、子宫及卵巢系数
2.2GSRd对模型大鼠乳腺组织病理形态学的影响 对照组大鼠乳腺组织未发现病理学改变。模型组乳腺上皮细胞组织有明显的增生性病变,包括大多数小叶增生,腺泡和导管数目增加,腺上皮增厚。三苯氧胺和GSRd高剂量连续给药4 w后,乳腺小叶增生程度及腺泡、导管数目明显减少。与模型组相比,TSP中、低剂量组均不同程度上减少乳腺腺泡和导管的管腔面积和数量,见图1。
2.3免疫组化检测乳腺组织中Bcl-2表达 与对照组相比,模型组Bcl-2蛋白表达上调,而与模型组相比,GSRd-中、高剂量组及阳性对照组均下调Bcl-2蛋白表达水平,而低剂量组则无影响,见图2。
2.4GSRd改善MGH大鼠血清性激素水平 与对照组相比,模型组E2、PRL含量明显升高,而P、T含量明显下降(P<0.05,P<0.01);与模型组相比,不同浓度GSRd组及阳性对照组E2、PRL水平明显下降,而T、P水平明显上升(P<0.05,P<0.01),各组间FSH、LH含量无明显变化(P>0.05),见表2。
2.5Western印迹检测乳腺组织中凋亡相关蛋白表达 与对照组相比,模型组Bcl-2、Ki-67表达明显上调,Bax表达明显下调(P<0.05)。而与模型组相比,GSRd-中、高剂量组及阳性对照组均明显下调Bcl-2、Ki-67蛋白表达,明显上调Bax表达(P<0.05),低剂量组Bcl-2、Ki-67蛋白表达无影响,见图3、表3。

图1 各组乳腺组织病理形态学(HE染色,×200)
图2 各组乳腺组织中Bcl-2蛋白表达(免疫组化染色,×100)
表2 GSRd对各组血清性激素水平的影响

1~6:对照组、模型组、阳性对照组、GSRd-低剂量组、GSRd-中剂量组、GSRd-高剂量组图3 Western印迹检测乳腺组织中Bcl-2、 Bax和Ki-67表达

表3 各组Bcl-2、Ki-67和Ki-67蛋白相对表达
3 讨 论
MGH是妇女乳腺组织既非炎症又非肿瘤的良性增生性疾病,以乳房肿物和疼痛为主要症状,常随着月经周期或情绪变化而消长,有发展为乳腺癌的可能性。MGH妇女患乳腺癌的概率是健康妇女的1.3~2.69倍〔4〕。
GSRd首先其对正常细胞具有无毒性,其次还具有广泛的药理活性,不仅对中枢神经系统显示出良好的神经保护效应,而且对肾脏功能、免疫系统、心血管系统等具有保护作用,目前已受到国内外学者的广泛关注〔5~7〕。
本研究结果提示,从乳房形态观察,GSRd对MGH有明显的治疗作用;HE染色观察发现,对照组乳腺没有组织学变化,而模型组大鼠乳腺上皮细胞组织有明显的增生性病变。服用三苯氧胺和GSRd高剂量连续4 w后乳腺小叶增生程度及腺泡、导管数目明显减少。这也说明GSRd对雌、孕激素诱导的MGH大鼠有治疗作用。
现代医学认为乳腺是性激素的靶器官,导致MGH的主要原因是激素代谢紊乱,E2绝对值或相对值增加,P持续缺乏,因此在E2和P的联合作用下,腺垂体远端产生的亲核细胞促进了乳腺的生长和发育,甚至导致过度增生〔8,9〕。少量T促进乳腺,相反大量T起到抑制作用〔10〕。本研究说明GSRd可调节MGH大鼠血清E2、P、PRL和T水平,发挥抗MGH作用。
细胞凋亡又称程序性细胞死亡,是指细胞死亡的一种生理形式,主要受基因控制〔11,12〕。Bcl-2家族在细胞凋亡研究领域中具有重要地位,包括凋亡的关键调控因子,如抗凋亡蛋白Bcl-2和促凋亡蛋白Bax等,它们通常被认为是凋亡的重要分子蛋白〔13〕。Ki-67是与细胞增殖密切相关的核抗原,其分布、表达状况可较准确地反映出细胞增殖活性,是应用最广泛的增殖细胞标志之一〔14,15〕。本研究结果表明,GSRd可以显著地促进MGH大鼠细胞凋亡,其机制可能与下调Bcl-2表达,上调Bax表达有关,同时GSRd还可能通过下调Ki-67表达,起到抑制细胞增殖作用,从而减轻MGH。
综上,GSRd对雌孕激素诱导的大鼠MGH具有显著的保护作用,其机制可能通过纠正性激素紊乱,抑制乳腺组织细胞增殖,促进细胞凋亡有关,更具体的治疗机制有待研究。
