黔产不同海拔野生型刺梨原汁对2型糖尿病小鼠糖脂代谢及氧化应激的干预作用
2022-10-09陈珍任廷远谭书明
陈珍,任廷远,2*,谭书明
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025)(2.贵州省农业科学院,贵州贵阳 550006)
糖尿病(Diabetes Mellitus,DM)是以持续高血糖和脂代谢异常为特征的代谢综合征[1]。近年来,糖尿病的发病率正在上升,据国际糖尿病联合会(IDF)估计,到2040年,将有6.24亿人患有糖尿病[2]。糖尿病可分为1型糖尿病(T1DM)、2型糖尿病(T2DM)、妊娠糖尿病(GDM)和其他类型糖尿病[3]。其中,T2DM是最为常见的类型,在患病人群中就有超过90%的患者被诊断为T2DM[4]。T2DM的发生机理主要是由于患者长时间高脂高能量膳食造成胰岛素产生不足或是由于患者的效应细胞对胰岛素并不敏感,而产生胰岛素抵抗,导致脂代谢异常[5-8]。氧化应激是糖尿病发展的重要危险因素,研究表明,糖尿病患者持续高血糖会导致机体内自由基代谢异常形成氧化应激,加速糖尿病发展[9]。因此,纠正糖尿病的糖脂代谢紊乱及如何从代谢机制上确定T2DM的发生机制,并依此预防、延缓、控制糖尿病的发生具有重要意义。
刺梨(Rosa roxburghiiTratt),属蔷薇科落叶灌木植物,广泛分布于我国贵州、四川、云南等海拔500~2 500 m的山区和丘陵中[10,11]。刺梨富含Vc、多酚、多糖、黄酮等多种活性成分[12-14]。近年来,有研究发现黄酮、多酚、多糖具有降糖、降脂、抗氧化和治疗糖尿病等功效[15-17]。陈晓琪等[18]研究发现桑寄生总黄酮可降低T2DM小鼠的血糖水平、调节血脂代谢平衡;张晓波[19]研究发现毛酸浆多糖可降低STZ诱导糖尿病小鼠的血糖值及小鼠肝、肾中MDA含量,增强SOD、CAT、GSH-Px活性,提高其抗氧化能力;Liu等[20]研究发现玫瑰多酚对糖尿病小鼠引起的氧化应激具有抑制作用。前期课题组以龙里、盘州两个地区刺梨汁进行浓缩、复配,发现刺梨汁具有降血脂、降血糖、治疗T1DM等功效[21,22],随后进一步对贵州省22个地区刺梨进行品质分析,发现高、中、低海拔对野生刺梨营养品质影响较大,而煎茶、以那、摆所是野生高、中、低海拔中最具有代表性的,其特点是野生刺梨分布广、集中连片多,也是贵州采食和加工野生刺梨最具代表性的区域[23]。故本研究在前期海拔差异影响刺梨品质的基础上进一步探讨不同海拔地区刺梨原汁对T2DM小鼠糖脂代谢及氧化应激的影响。同时,进一步发掘我省刺梨资源的综合效应,提高我省刺梨产业的全面发展,为后续食品刺梨产业开发提供理论依据。
1 材料与方法
1.1 材料与试剂
不同海拔野生刺梨分别采集于贵州省黔南布依族苗族自治州长顺县摆所镇、贵州省铜仁市德江县煎茶镇、贵州省毕节市织金县以那镇;栽培品种“贵龙5号”,采自贵州省黔南布依族苗族自治州龙里县国级刺梨示范园区,产地环境概况见表1。昆明种雄性小鼠,SPF级,22~24 g,70只,由长沙市天勤生物技术有限公司提供,生产许可证号:SCXK(湘)2019-0013;链脲佐菌素(STZ),美国Sigma公司;基础饲料由重庆腾鑫生物技术有限公司提供;糖化血清蛋白(GSP)试剂盒、糖化血红蛋白(GHb)试剂盒、糖原试剂盒、总蛋白定量测试盒(BCA法)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、丙二醛(MDA)、谷胱甘肽还原酶(GSH-Px)、过氧化氢酶(CAT)、SOD等试剂盒均购于南京建成生物科技有限公司。

表1 刺梨产地环境概况Table 1 Environmental conditions of Rosa roxburghii producing areas
1.2 仪器与设备
L5S紫外分光光度计,上海仪电分析仪器有限公司;750血糖仪与配套血糖试纸,江苏鱼跃医疗设备股份有限公司;pectraMax190连续波长多功能酶标仪,美国Molecular Devices公司;YH-A5003分析天平,五星衡器有限公司;FSH-2可调高速匀浆器,江苏省金坛市环宇科学仪器厂;H1-16KB高速冷冻离心机,湖南可成仪器设备有限公司;Eclipse Ci-L光学显微镜,日本Nikon公司。
1.3 方法
1.3.1 刺梨原汁制备
每个地区随机挑选新鲜成熟、无霉烂变质的刺梨鲜果,经去蒂、去籽及表面杂质,采用机械破碎和压榨,经过滤、灭菌后的清汁,通过无菌灌装后,分装于-20 ℃保存,37 ℃解冻后灌胃。
1.3.2 动物分组与处理
小鼠基础饲料饲养1 w后,按体质量随机分为空白组(n=10)和高脂高糖组(n=60),空白组饲喂基础饲料,高脂高糖组饲喂高脂高糖饲料(高脂高糖饲料配方参考《保健食品功能学评价程序和检验方法》配制,配方(质量分数)为:78%基础饲料+1.5%胆固醇+10%猪油+0.5%胆盐+10%蔗糖)。6 w后,小鼠禁食不禁水12 h,腹腔注射60 mg/kg(以小鼠质量为基准计)STZ建模,建模期间自由摄食、饮水。建模7 d后,禁食12 h,尾尖采集血测FBG值,当FBG值高于11.10 mmol/L时,视为建模成功[24]。将建模成功的50只小鼠分为5组(n=10),即模型组(MC),野生型刺梨汁织金以那(高海拔组,HF)、黔南长顺(中海拔组,MF)、德江煎茶(低海拔组,DF)和人工种植刺梨汁对照组(黔南龙里,PC)。为确保每只小鼠为等剂量灌胃(10 g体质量小鼠灌胃0.1 mL剂量),NC组、MC组灌胃等剂量的生理盐水;HF组、MF组、DF组和PC组分别灌胃织金以那、长顺、煎茶野生型刺梨汁和龙里栽培刺梨汁,于每日上午9:00灌胃。实验期间小鼠均自由摄食、饮水,除NC组饲喂基础饲料外,其余各组给予高脂高糖饲料,每周记录摄食量、饮水量和体质量,并据体质量调整灌胃剂量,持续饲喂28 d。动物饲养末期,将小鼠禁食不禁水12 h后,在麻醉状态下眼眶取血后解剖。取出腹部脂肪、肝脏、心脏等脏器,用冰冻生理盐水洗净,吸水纸除去表面水滴,进行称重后转移至-80 ℃。
1.3.3 指标测定
1.3.3.1 空腹血糖浓度测定灌胃后的第0、7、14、21、28 d,禁食不禁水6 h,剪尾采血测定空腹血糖浓度[25]。
1.3.3.2 口服糖耐量测定
灌胃28 d后,禁食不禁水12 h,按照每千克体质量2.00 g灌胃葡萄糖溶液,剪尾取血测定0、0.5、1 h和2 h时的血糖水平[26],观察各组小鼠血糖浓度变化情况。血糖曲线下面积(area under the cure,AUC)根据公式(1)计算[27]。
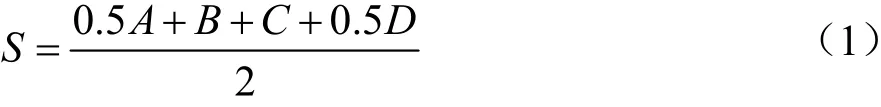
式中:
S——血糖曲线下面积AUC,hmmol/L;
A、B、C、D——灌胃葡萄糖溶液后0、0.5、1 h和2 h的血糖值。
1.3.3.3 小鼠脏器指数测定
小鼠脏器指数按公式(2)计算[28]

式中:
F——脏器指数,%
W1——小鼠脏器质量,g;
W2——小鼠体质量,g。
1.3.3.4 理化指标测定
小鼠糖化血红蛋白(GHb),糖化血清蛋白(GSP),糖原水平,血清、肝脏和肾脏中脂代谢(TG、TC、HDL-L、LDL-C)和氧化应激(MDA、CAT、SOD、GSH-Px)含量的测定具体步骤参考试剂盒说明书。
1.3.4 HE染色
解剖摘取各组小鼠肝脏,经4%多聚甲醛固定,固定状态良好后,进行修剪、脱水、包埋、切片、染色、封片制作切片,苏木精-伊红(Hematoxylin- eosinstaining,HE)染色,光学显微镜下观察肝脏组织结构。
1.4 数据处理
实验数据均采用均数±标准差(±s)表示,组间分析比较用单因素方差分析,全部统计学分析均由SPSS 22.0完成,并用LSD、Duncan法进行组间两两比较,以p<0.05表示差异,具有统计学意义。
2 结果与分析
2.1 不同海拔刺梨原汁对T2DM小鼠体质量、摄食量及饮水量的影响
T2DM小鼠摄食量、饮水量及体质量分别见图1a与图1b。与NC组相比,小鼠摄食量、饮水量在注射STZ后都有所增加,糖尿病症状明显(多饮、多食、多尿)。由图1a所示,与NC组相比,MC组小鼠体质量一直呈下降趋势,提示T2DM小鼠建模成功。与MC组相比,经28 d灌胃后不同海拔刺梨组均能抑制小鼠体质量减少,其中HF组、MF组、DF组和PC组均分别显著(p<0.05)增加23.64%、20.59%、21.93%、17.19%。由图1b知,与NC组相比,T2DM小鼠MC组摄食量与饮水量均显著升高,进一步验证了糖尿病的症状,但经过不同海拔刺梨原汁灌胃治疗28 d后,剂量组摄食量及饮水量均有所改善,提示不同海拔刺梨原汁均能改善T2DM小鼠症状。
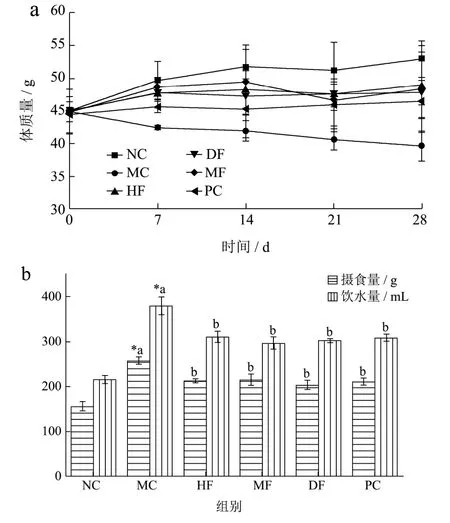
图1 各组小鼠摄食量、饮水量及体质量的变化(n=10)Fig.1 The changes of food intake, water intake and body weight in each group were observed (n=10)
2.2 不同海拔刺梨原汁对T2DM小鼠FBG的影响
T2DM小鼠FBG浓度见图2,NC组FBG浓度一直处于正常范围,相比NC组,在给药处理前(0 d),其余各组小鼠FBG值均大于11.1 mmol/L,提示糖尿病模型造模成功。与NC组相比,MC组FBG浓度较高,最高可达23.2 mmol/L,说明MC组小鼠糖尿病严重。相比MC组,不同海拔刺梨原汁治疗组FBG浓度明显下降,经28 d灌胃治疗后,小鼠FBG浓度分别下降了31.03%、47.28%、43.84%、12.96%,总体效果MF组>DF组>HF组>PC组。

图2 各组小鼠空腹血糖的变化(n=10)Fig.2 Changes of fasting blood glucose in mice of each group(n=10)
2.3 不同海拔刺梨原汁对T2DM小鼠口服耐糖量及AUC的影响
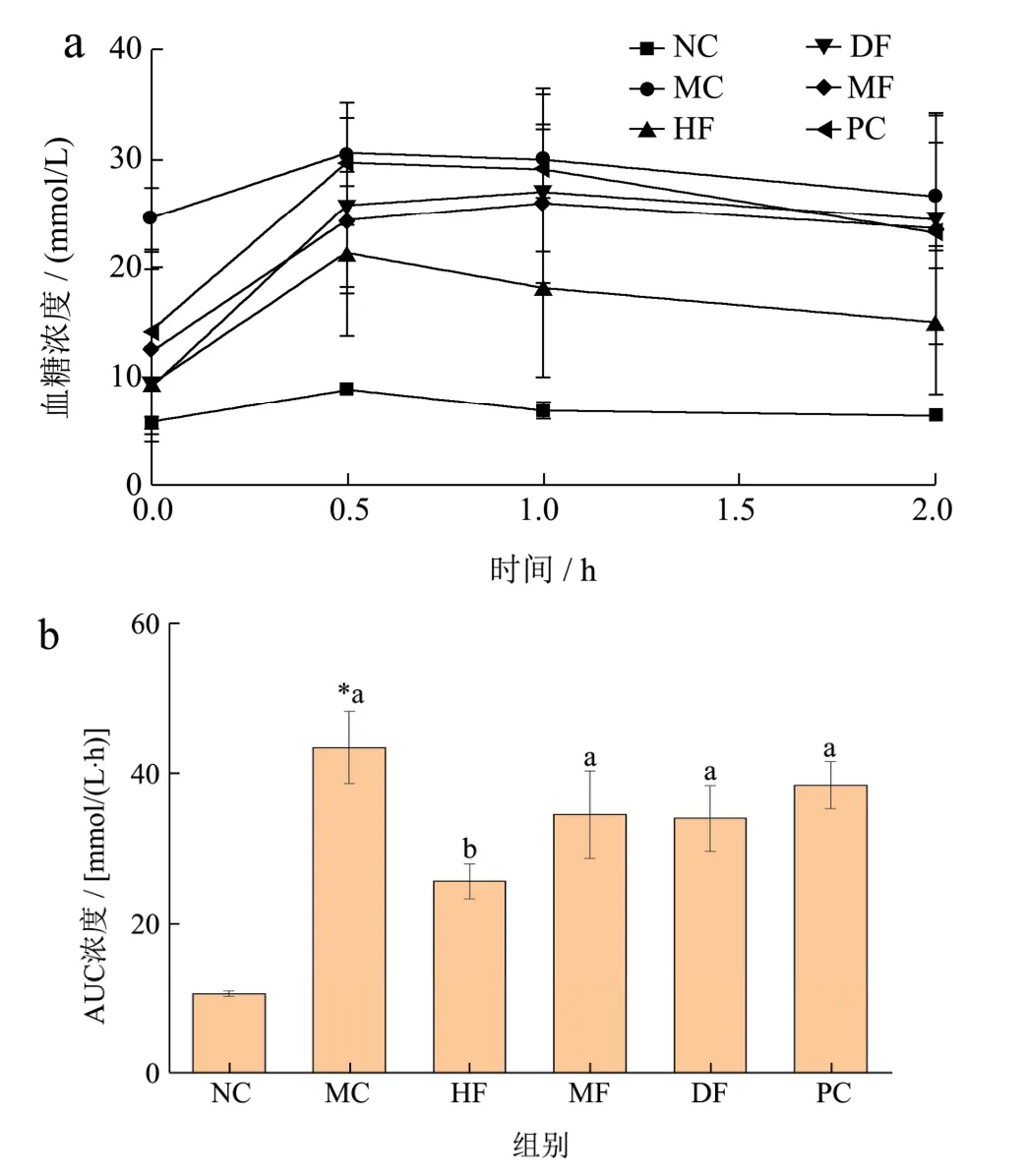
图3 各组小鼠糖耐量(a)及AUC(b)的变化(n=10)Fig.3 Changes of glucose tolerance (a) and area under curve in mice of each group (n=10)
T2DM小鼠口服耐糖量见图3a,在灌胃葡萄糖溶液后,NC组小鼠血糖水平很快升高,在0.5 h达到最高,随后又迅速下降,2 h后降至正常水平。MC组小鼠血糖水平在0.5 h达到最高水平。与MC组相比,不同海拔刺梨原汁组在0.5 h时也达到最高水平,但过后都有不同程度的下降趋势,虽不能回到初始水平,但也能证实不同海拔刺梨原汁可改善T2DM小鼠的糖耐量。图3b显示,MC组AUC显著(p<0.05)高于NC组。与MC组相比,不同海拔刺梨原汁组AUC均降低,但MF组、DF组和PC组差异不显著(p>0.05)。结果表明,不同海拔刺梨原汁可提高T2DM小鼠的糖耐量,总体效果HF组>DF组>MF组>PC组。
2.4 不同海拔刺梨原汁对T2DM小鼠脏器指数的影响
T2DM小鼠脏器指数见表2,与NC组相比,MC组小鼠肝脏、肾脏、心脏及脾脏指数分别显著(p<0.05)升高了76.88%、26.32%、33.33%、43.48%。与MC组相比,不同海拔刺梨原汁组脏器指数均有所降低,但心脏指数HF组、MF组、DF组和PC组小鼠肝脏指数差异不显著(p>0.05),且DF组、PC组小鼠肾脏指数也无显著性差异,这与陈小敏、陆敏涛等[22,29]研究结果相一致。

表2 各组小鼠脏器指数(%,n=10)Table 2 Organ index of mice in each group (%, n=10)
2.5 不同海拔刺梨原汁对T2DM小鼠血清GHb与GSP水平的影响
T2DM小鼠血清GHb与GSP的变化分别见图4a与4b,与NC组相比,MC组小鼠血清GHb与GSP分别显著(p<0.05)增加116.68%、73.87%。与MC组相比,不同海拔刺梨原汁组GHb与GSP水平均显著(p<0.05)下降,其中HF组、MF组、DF组、PC组GHb水平分别下降58.45%、53.63%、47.18%、36.80%,且呈现出一定的剂量效应;GSP水平分别下降25.28%、28.24%、32.18%、16.45%,总体效果DF组>MF组>HF组>PC组。

图4 各组小鼠GHb(a)与GSP(b)的变化(n=10)Fig.4 Changes of GHb (a) and GSP (b) levels in mice of each group (n=10)
2.6 不同海拔刺梨原汁对T2DM小鼠肝糖原与肌糖原含量的影响

图5 各组小鼠肝糖原与肌糖原含量的变化(n=10)Fig.5 Changes of glycogen content in liver and muscle of mice in each group (n=10)
T2DM小鼠肝糖原与肌糖原含量见图5,相比NC组,MC组小鼠肝糖原与肌糖原含量分别下降59.64%、43.66%。与MC组相比,不同海拔刺梨原汁组的肝糖原与肌糖原含量均有所提高,其中HF组、MF组、DF组、PC组肝糖原含量分别提高129.61%、122.63%、78.94%、113.69%,总体效果HF组>MF组>PC组>DF组;肌糖原含量分别提高14.17%、16.66%、21.63%、19.15%,总体效果DF组>PC组>MF组>HF组,但差异均不显著(p>0.05)。
2.7 不同海拔刺梨原汁对T2DM小鼠脂代谢的影响
T2DM小鼠脂代谢水平分别见图6a、b、c和d,与NC组相比,MC组小鼠血清、肝脏与肾脏中TG、TC、LDL-C水平均显著(p<0.05)上升,HDL-C水平显著(p<0.05)下降,提示T2DM小鼠引发了脂代谢紊乱。当采用不同海拔刺梨原汁灌胃治疗28 d后,与MC组相比,T2DM小鼠血清中HF组、MF组、DF组、PC组TG水平均分别下降27.29%、9.44%、12.55%、2.73%,差异均不显著(p>0.05),总体效果HF组>DF组>MF组>PC组;TC水平均分别下降35.09%、17.44%、9.63%、1.65%,除PC组不显著外,其余各组均有显著差异性,且有剂量效应;LDL-C水平均分别显著(p<0.05)下降84.57%、83.52%、75.99%、84.57%,总体效果HF组>PC组>MF组>DF组;HDL-C水平均分别上升107.10%、74.23%、51.59%、126.37%,其中、低海拔组差异不显著,总体效果PC组>HF组>MF组>DF组。此外,T2DM小鼠肝脏与肾脏中不同海拔组TG、TC、LDL-C水平均下降,HDL-C水平均上升,说明不同海拔刺梨原汁在一定程度上可以改善T2DM小鼠脂代谢紊乱。


图6 各组小鼠血清、肝脏、肾脏脂代谢相关指标的变化(n=10)Fig.6 Changes of lipid metabolism indexes in serum, liver and kidney of mice in each group (n=10)
2.8 不同海拔刺梨原汁对T2DM小鼠氧化应激的影响
氧化应激是糖尿病及其并发症发生与发展的因素之一。T2DM小鼠糖尿病氧化应激的含量见图7a、7b、7c和7d,与NC组相比,MC组小鼠血清、肝脏及肾脏中CAT、GSH-Px、SOD含量均显著(p<0.05)下降,MDA含量均分别显著(p<0.05)升高57.50%、96.37%、41.86%。与MC组相比,不同海拔刺梨原汁组血清、肝脏及肾脏中CAT、GSH-Px、SOD含量均升高,MDA含量均显著(p<0.05)下降,其中,HF组、MF组、DF组、PC组T2DM小鼠肝脏CAT含量均分别显著(p<0.05)升高151.27%、101.38%、87.46%、91.13%,总体效果HF组>MF组>PC组>DF组。小鼠血清与肾脏中CAT含量只有HF组显著(p<0.05),其他海拔组均不显著(p>0.05)。而GSH-Px含量除了血清与肾脏中HF组、DF组显著外,其余组差异均不显著。结果表明,经不同海拔刺梨原汁灌胃治疗28 d后,对T2DM小鼠氧化应激的损伤具有修复作用,可提高抗氧化能力。

图7 各组小鼠血清、肝脏、肾脏氧化应激相关指标的变化(n=10)Fig.7 Changes of oxidative stress related indexes in serum, liver and kidney of mice in each group (n=10)
2.9 T2DM小鼠肝脏、肾脏病理学分析
如图8所示,NC组小鼠肝细胞结构清晰,未见明显的炎症。MC组小鼠肝细胞排列松散,大量脂肪空泡变性,肝细胞气球样变,胞质疏松淡染,可见炎性细胞灶性浸润。经刺梨原汁干预后,治疗组小鼠空泡变性量均有所减少,未见明显炎症,形态有所改善。
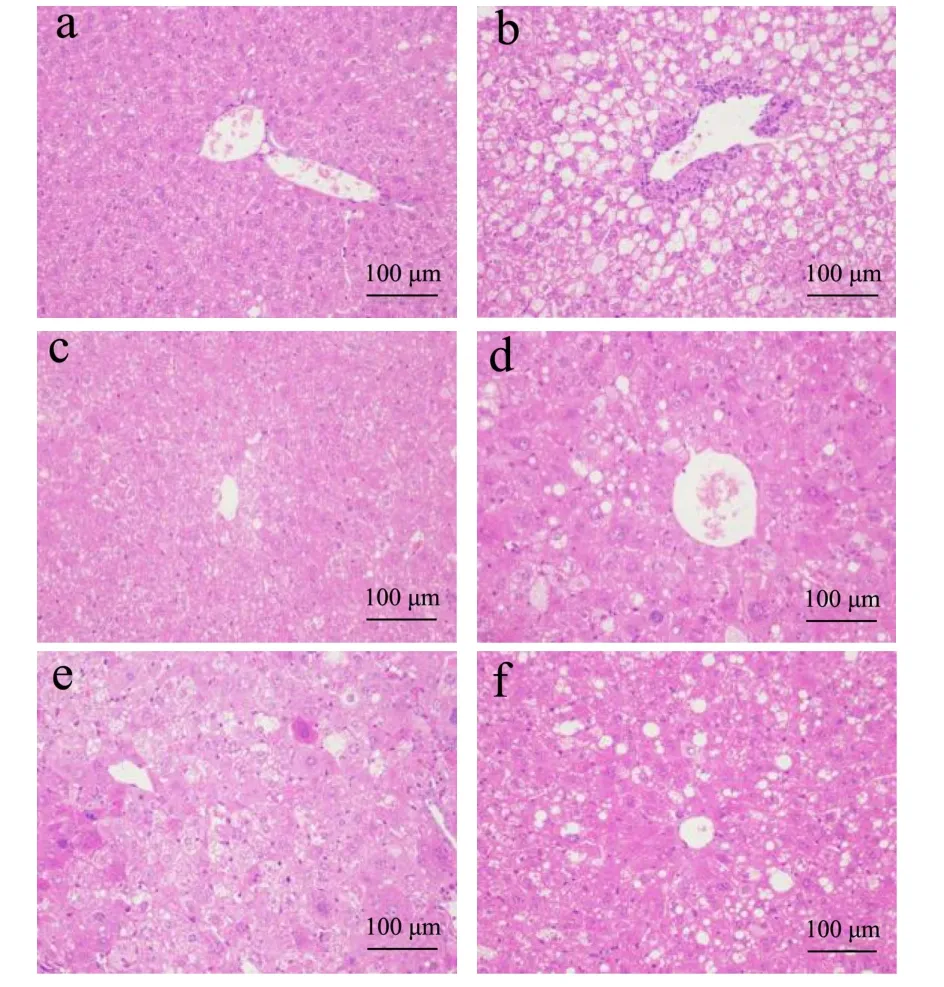
图8 肝脏病理学分析Fig.8 Liver pathology
3 讨论
为了解基于不同海拔差异的刺梨原汁对T2DM建模小鼠血糖、脂代谢和氧化应激水平的作用情况,本研究以昆明种雄性小鼠为研究对象,利用高脂高糖饮食配合STZ构建T2DM模型,通过测量小鼠血糖、脂代谢和氧化应激等关键指标的变化情况,分析该海拔差异对于小鼠糖尿病及其并发症的作用效果。
糖尿病是一种以高血糖为主要特征的代谢性疾病[30,31],长期高血糖会使机体产生糖化反应,对各个脏器造成损害[32-34]。结果显示,不同海拔刺梨原汁对高脂高糖联合STZ诱导T2DM小鼠的摄食量、饮水量及体质量减轻等症状具有明显的改善效果,还可降低T2DM小鼠的脏器指数,提示刺梨原汁对T2DM小鼠的脏器具有保护和修复作用,能抵抗高血糖对器官造成的慢性损害,抑制代谢器官的肿大,这与陆敏涛等[35]研究结果一致。T2DM是一种慢性内分泌疾病,血糖水平升高是该疾病的典型特征[36]。目前,国际糖尿病诊断显示正常人FBG在3.3~6.1 mmol/L之间,若大于11.1 mmol/L则视为血糖超标,而血糖浓度又与GHb、GSP和糖耐量相关,其中糖尿病患者GHb和GSP水平均高于正常人[37-39]。结果显示,不同海拔刺梨原汁均可降低高脂高糖联合STZ诱导T2DM小鼠的血糖水平,提高糖耐受量。此外,与MC组相比,不同海拔刺梨原汁组GHb与GSP浓度均显著(p<0.05)下降,其中HF组、MF组、DF组、PC组GHb水平分别下降58.45%、53.63%、47.18%、36.80%,且存在剂量效应。糖尿病的糖代谢与糖原的含量密切相关,糖原的含量可以间接反应血糖水平[40]。结果显示,不同海拔刺梨原汁组均能提高小鼠糖原含量,但差异不显著(p>0.05),而血糖水平的降低也证实了不同海拔刺梨原汁可通过提高糖原含量,降低血糖水平,纠正T2DM小鼠糖代谢异常,起到降血糖作用,进而达到预防或治疗糖尿病症状,这与王婧茹等[41]采用番石榴叶总三萜(TTPGL)治疗高糖高脂+腹腔注射小剂量STZ诱导T2DM大鼠发现TTPGL剂量组能显著(p<0.05)降低T2DM大鼠FBG浓度,提高GHb含量,达到降糖、降脂作用结果相一致。
脂代谢异常是糖尿病的独立危险因素,脂代谢紊乱会伴随糖尿病的发展愈发明显[42]。T2DM的脂代谢异常一般呈现出TG、TC、LDL-C升高,HDL-C降低。结果显示,MC组小鼠血清、肝脏及肾脏中TG、TC、LDL-C水平明显增加,而HDL-C水平显著(p<0.05)降低,提示由高脂高糖饮食诱导联合腹腔注射STZ构建的T2DM模型小鼠脂代谢已经发生紊乱,在经过不同海拔刺梨原汁灌胃治疗7 w后,不同海拔组小鼠血清、肝脏及肾脏中TG、TC、LDL-C水平明显下降,HDL-C水平明显增加,说明脂代谢紊乱得到了控制,这与陈萍等[43]研究结果相一致。推测可能是刺梨中的活性成分能促进T2DM小鼠胰岛β细胞的修复和再生,进而改善胰岛素分泌,在一定程度上缓解T2DM小鼠的代谢紊乱[44]。其中HF组对LDL-C、HDL-C、TC、TG改善效果均显著(p<0.05),DF组对肝、肾TG、TC、LDL-C改善效果显著(p<0.05),MF组对肾TG、TC、LDL-C改善效果显著(p<0.05),PC组对肝HDL-C、TG改善效果显著(p<0.05)。总体治疗效果:HF组>DF组>MF组>PC组。
研究表明,糖尿病患者的高血糖水平与自由基引发的氧化应激有关[45]。随着病程的发展,糖尿病患者清除自由基的能力会减弱,因此针对糖尿病防治的一个重要机制是提高机体内抗氧化的稳定性[46]。通过测定MDA可以较直观地反映机体的抗氧化能力,其中抗氧化酶活性越强,MDA含量越低。CAT、SOD、GSH-Px作为生物体内重要的抗氧化酶,具有抑制自由基产生、减少氧化损伤的作用[47,48]。结果显示,MD组小鼠CAT、SOD、GSH-Px活性下降,MDA含量升高,说明高脂高糖联合STZ诱导的T2DM小鼠可使体内血清、肝脏及肾脏的抗氧化能力受到明显损伤。在通过不同海拔刺梨原汁灌胃治疗后可显著(p<0.05)提升T2DM小鼠体内CAT、SOD、GSH-Px的抗氧化酶活性,降低MDA含量,其中HF组小鼠血清、肝脏、肾脏MDA含量分别显著(p<0.05)降低71.84%、51.89%、30.74%,提示不同海拔组刺梨原汁可增强机体内抗氧化系统的活性,降低机体氧化应激,进而发挥缓解糖尿病的作用[49],这与高雪婧等[50]实验结果相一致。不同海拔地区的刺梨在不同品质指标上各有优势和劣势,研究表明,刺梨黄酮、Vc、SOD和还原糖等活性成分具有明显的抗氧化活性[51,52],前期研究发现刺梨在海拔690~1468 m范围内除海拔在1412 m和692.9 m地区的刺梨类黄酮含量最高(22.26 mg/100 g)和最低(3.55 mg/100 g)之外,其余地区在9.18~15.60 mg/100 g之间;刺梨Vc含量除海拔在960 m地区含量最高(2725.32 mg/100 g)之外,其余地区Vc含量大都在1000~2000 mg/100 g之间;刺梨SOD活性主要分布在330.05 ~446.50 U/g;刺梨还原糖主要分布在3.14%~5.48%之间,其含量与海拔差异都不大,但针对T2DM而言,研究发现不同海拔组对小鼠血清、肝脏及肾脏中的SOD及MDA的改善效果均显著(p<0.05),其中HF组对小鼠体内CAT、GSH-Px活性改善效果均显著(p<0.05),DF组和MF组分别对小鼠血清和肾脏中GSH-Px活性改善效果显著(p<0.05),PC组对小鼠体内血清GSH-Px活性改善效果不显著(p>0.05)。总体治疗效果:HF组>DF组=MF组>PC组,推测可能与刺梨中SOD、还原糖等两种活性成分增强了T2DM小鼠体内抗氧化系统的活性有关,另外与其它未检测(如刺梨槲皮素、多酚类物质及刺梨精油等)的活性成分也可能有关。因此,还需继续深入研究黔产刺梨不同海拔、活性成分、功能差异这三者的内在关联。
4 结论
不同海拔刺梨原汁均能缓解T2DM小鼠“三多一少”的症状,提高糖耐量,降低体内TG、TC、LDL-C水平和MDA含量,增加HDL-C水平和SOD、CAT、GSH-Px活性,使T2DM小鼠的血脂紊乱和氧化损伤得到改善,此外,HE染色结果显示不同海拔刺梨原汁能减轻肝组织的病理损伤。表明不同海拔刺梨原汁对T2DM小鼠引发的糖代谢、脂代谢及氧化应激都有一定的防治作用,为后期刺梨品种筛选、大规模种植及药食商品加工提供科学依据。
