粪菌移植对慢性帕金森病小鼠模型黑质区炎症反应的影响
2022-10-09陈薪旭王埮张填
陈薪旭 王埮 张填
(海南医学院第一附属医院神经内科,海南 海口 570102)
帕金森病(PD)是最常见的神经退行性疾病之一〔1〕。由于人口增长及人口老龄化,根据已发表的流行病学研究数据计算,10年后我国PD人数将达到500万〔2〕。肠道菌群已被认为是包括PD在内的许多神经退行性疾病发病机制的一个组成部分〔3,4〕。然而,肠道微生物菌群失调与PD发病机制之间的机制尚不清楚,也没有公认的治疗方法可以阻止或减缓PD进展。粪菌移植(FMT)作为重建肠道菌群最有效的方法之一,已显示出对PD的潜在治疗作用,但其有效性及安全性有待进一步确定〔5〕。神经炎症在PD的神经退行性过程中起主导作用〔6,7〕。本研究用1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)构建慢性PD小鼠模型,探讨FMT对PD小鼠模型黑质区炎症反应的影响。
1 资料与方法
1.1实验动物 本实验选用8周龄、体重20 g左右雄性SPF级C57BL/6小鼠〔浙江省医学科学院,许可证号:SCXK(苏)2019-0002〕。饲养环境:室内温度控制在24℃左右、相对湿度50%~60%,每日光照时间12 h,黑暗时间12 h。
1.2实验试剂 MPTP、丙舒磺(美国Sigma); 4′,6-二脒基-2-苯基吲哚(DAPI)染色、二喹啉甲酸(BCA)蛋白测量试剂盒、辣根过氧化物酶(HRP)抗小鼠抗体、HRP抗兔抗体、HRP抗山羊抗体(碧云天);Triton X-100、牛血清白蛋白(BSA)、四甲基乙二胺(TEMED)、蛋白marker(Solarbio);聚偏氟乙烯(PVDF)膜(Millipore);ECL发光液(Tanon);精氨酸(Arginase)抗体、离子钙结合衔接分子(Iba)-1抗体、p-张力蛋白同源物基因(PTEN)、PTEN(abcam);SYBR green溶液、逆转录试剂盒、RNAiso Plus(Takara)。
1.3实验设备 转棒测试仪(上海欣软);组织脱水机、组织包埋机、组织摊片机(睿普思星);显微镜、成像系统(日本尼康);激光扫描共聚焦显微镜(蔡司);十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳仪、湿法转膜仪(BioRad);化学发光检测系统(Tanon);荧光定量PCR仪(Applied Biosystems)。
1.4实验分组与造模 小鼠适应性喂养7 d后,随机分为对照组、PD模型组、PD+FMT组,每组6只。MPTP腹腔注射构建慢性PD小鼠模型:MPTP 20 mg/kg腹腔注射,观察1 h,再予丙磺舒250 mg/kg腹腔注射;此后每3.5 d注射一次,造模时间为35 d。对照组每日予等量生理盐水腹腔注射;自由饮用纯净水。第36天开始,PD+FMT组每天给予200 μl新鲜粪菌悬液(108CFU/ml)灌胃1次,共14 d;对照组、PD模型组每天给予等量生理盐水灌胃。
1.5行为学检测 转棒实验:使用Rotamex装置测量旋转脚架性能测试。旋转脚架系统的参数包括启动速度、加速和最高速度〔1 r/min,加速12 r/(min·2 s),50 r/min〕。小鼠进行3个连续试验,每个试验之间的休息时间为30 min。在最后两次试验中,从旋转杆上掉下来的平均等待时间用于分析。
爬杆实验:爬杆高50 cm,直径1 cm,顶端有直径35 mm的圆球。测试过程中,将老鼠放置在圆球上,分析老鼠头朝下的时间(T-turn),如果老鼠在圆球上停留超过30 s,则引导其爬下杆,并将 T-turn 计为 30 s;分析爬到杆底时间(T-LA)。每只老鼠在测试前1 d进行3次训练。测试当天,每只老鼠重复爬杆2次,记录平均值。
1.6肠道菌群检测 用1.5 ml无菌EP管收集新鲜粪便,收集完成后将粪便立即置于-80℃冰箱保存。行16 S rDNA 基因测序技术检测小鼠肠道菌群,通过多样性指数chao1、observed species进行多样性比较,从肠道菌群属水平对比进行菌群结构分析。
1.7苏木素-伊红(HE)染色检测小鼠盲肠黏膜组织形态学变化 取盲肠顶部1.5 cm(包括盲肠扁桃体)进行脱水、包埋、切片后,予苏木素染细胞核、伊红染细胞质,显微镜镜检,图像采集分析。
1.8免疫荧光染色检测黑质酪氨酸羟化酶(TH)、Iba-1、诱导型一氧化氮合酶(iNOS)、Arginase表达 每只小鼠按体重给予100 mg/kg剂量的戊巴比妥钠腹腔注射处死,开颅取脑后将脑至于-80℃速冻5 min,分离挖取黑质。4%多聚甲醛固定小鼠脑标本24 h以上,在4℃冰箱予15%蔗糖溶液、30%蔗糖溶液进行2次脱水,随后OCT包埋、切片,切片厚度为6 μm。固定切片,5%BSA溶液滴在切片上并温育30 min,将第一抗体(1∶200稀释度)滴在切片上4℃孵育过夜,第二抗体(1∶200稀释度)滴在切片,室温避光孵育30 min,最后用DAPI染核10 min,每个步骤均用磷酸盐缓冲液(PBS)溶液清洗3次。染色成功后进行荧光照片。
1.9Western印迹检测黑质TH、Iba-1、iNOS、Arginase表达 分离小鼠中脑黑质,液氮速冻,以50 mg/ml比例加入含有苯甲基磺酰氟(PMSF)裂解液,经超声裂解后得到总蛋白。采用BCA试剂盒测蛋白浓度,取部分蛋白溶液,加入上样缓冲液,沸水中变性3 min。微量器加量,SDS-PAGE,PVDF膜转膜,一抗(抗TH)4℃孵育过夜,5%脱脂奶粉封闭1 h,加入二抗,室温孵育2 h,凝胶成像仪显影拍照,使用Image J进行灰度值分析。
1.10实时定量PCR检测小鼠黑质白细胞介素(IL)-1β、IL-10 分离小鼠中脑黑质,液氮速冻后磨成粉末,取出组织,提取RNA,根据通过Nano Drop和OD230,OD260和OD280检测的浓度确定RNA纯度。采用逆转录试剂盒按步骤逆转录,随后进行荧光定量PCR,根据仪器收集的数值对数据进行分析。
1.11统计处理 采用SPSS20.0软件进行t检验、单因素方差分析。
2 结 果
2.1各组行为学及TH表达情况 转棒实验:与对照组〔(99±6.94)s〕相比,PD模型组转棒掉落的潜伏期〔(46±5.11)s〕明显缩短(P<0.01);与PD模型组相比,PD+FMT组转棒掉落时间〔(69±7.10)s〕明显延长(P<0.05)。爬杆实验:与对照组T-turn〔(1.75±0.22)s〕及T-LA〔(3.83±0.27)s〕相比,PD模型组T-turn〔(9.83±2.03)s〕及T-LA〔(8.42±0.6)s〕明显延长(P<0.01);PD+FMT组T-turn〔(5.25±0.68)s〕及T-LA〔(6.42±0.5)s〕均较PD模型组明显缩短(P<0.05)。免疫荧光检测PD模型小鼠中脑黑质TH表达,PD模型组脑内黑质区TH表达显著下调,PD+FMT组较PD模型组黑质区TH表达回升。见图1。

图1 各组黑质中TH表达(免疫荧光染色,×100)
2.2各组肠道菌群情况 与对照组相比,PD模型组肠道菌群多样性指数chao1(1 104±50.46 vs 807±53.67)、observed species(1 043±58.25 vs 791±54.89)均明显升高(P<0.05),PD+FMT组多样性指数chao1(942±50.12)、observed species(896±41.96)相比PD模型组下降,但无明显差异(P>0.05)。与对照组比较,PD模型组厌氧菌属(0.946±0.149 vs 0.070±0.029)、双歧杆菌属(0.046±0.004 vs 0.000±0.000)、杆菌属(0.038±0.009 vs 0.004±0.001)、ASF356属(0.166±0.040 vs 0.016±0.012)和瘤胃球菌属(0.137±0.030 vs 0.003±0.001)的构成比显著上升,布劳特菌属(0.090±0.011 vs 0.374±0.063)的构成比显著下降(均P<0.01);PD+FMT组厌氧菌属(0.191±0.066)、双歧杆菌属(0.006±0.002)、杆菌属(0.197±0.008)、ASF356(0.012±0.003)和瘤胃球菌属(0.011±0.003)的构成比较PD模型组显著下降(P<0.01),布劳特菌属(0.322±0.076)的构成比较PD模型组显著上升(P<0.05)。对照组与PD+FMT组比较,以上菌属丰度占比无明显差异(P>0.05)。
2.3各组肠道炎症情况 HE染色可见,对照组盲肠黏膜形态正常,而PD模型组盲肠黏膜下有炎症细胞浸润,PD+FMT组炎症细胞较PD模型组明显减少。见图2。

图2 各组盲肠HE染色(×100)
2.4各组黑质区小胶质细胞的表达 免疫荧光检测发现,PD模型组黑质中M1型小胶质细胞数目(Iba1+iNOS+)〔(34±3)个〕明显高于对照组〔(4±1)个〕,M2型小胶质细胞数目(Iba1+Arginase+)〔(14±2)个〕明显高于对照组〔(3±0)个〕,M1/M2比值(2.45±0.17)大于1;与较PD模型组比较,PD+FMT组中M1型小胶质细胞数目〔(20±2)个〕下降,M2型小胶质细胞数目上升〔(29±2)个〕,M1/M2比值(0.68±0.06)小于1。见图3、图4。实时定量 PCR法检测发现,与对照组(1.00±0.19、1.00±0.18)相比,PD模型组黑质组织中炎症因子IL-1β表达上调(2.37±0.20),抗炎因子IL-10表达下调(0.61±0.19),FMT处理后炎症因子IL-1β表达下调(1.47±0.34),抗炎因子IL-10表达上升(0.77±0.05)。
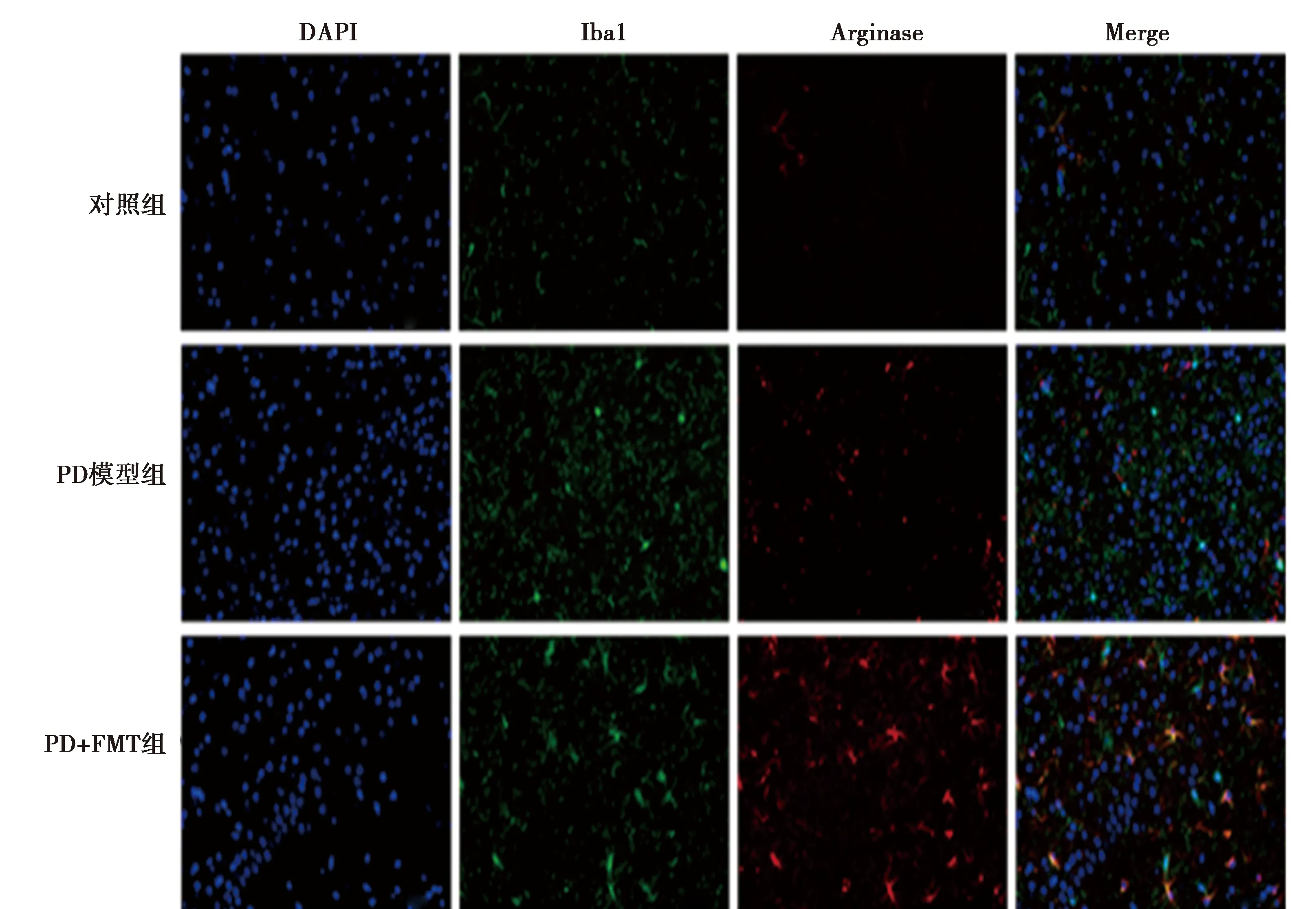
图3 各组黑质Iba-1、Arginase表达(×400)
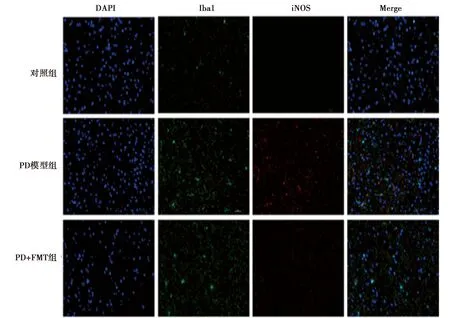
图4 各组黑质Iba-1、iNOS表达(×400)
Western印迹检测发现,与对照组(0.48±0.10、0.32±0.06、0.51±0.08)相比,PD模型组黑质中Iba-1、iNOS、Arginase表达(1.02±0.13、0.90±0.09、0.83±0.03)上调,FMT处理后Iba-1、iNOS表达(0.76±0.08、0.61±0.07)有所下调,Arginase表达(1.00±0.08)进一步上升。见图5。
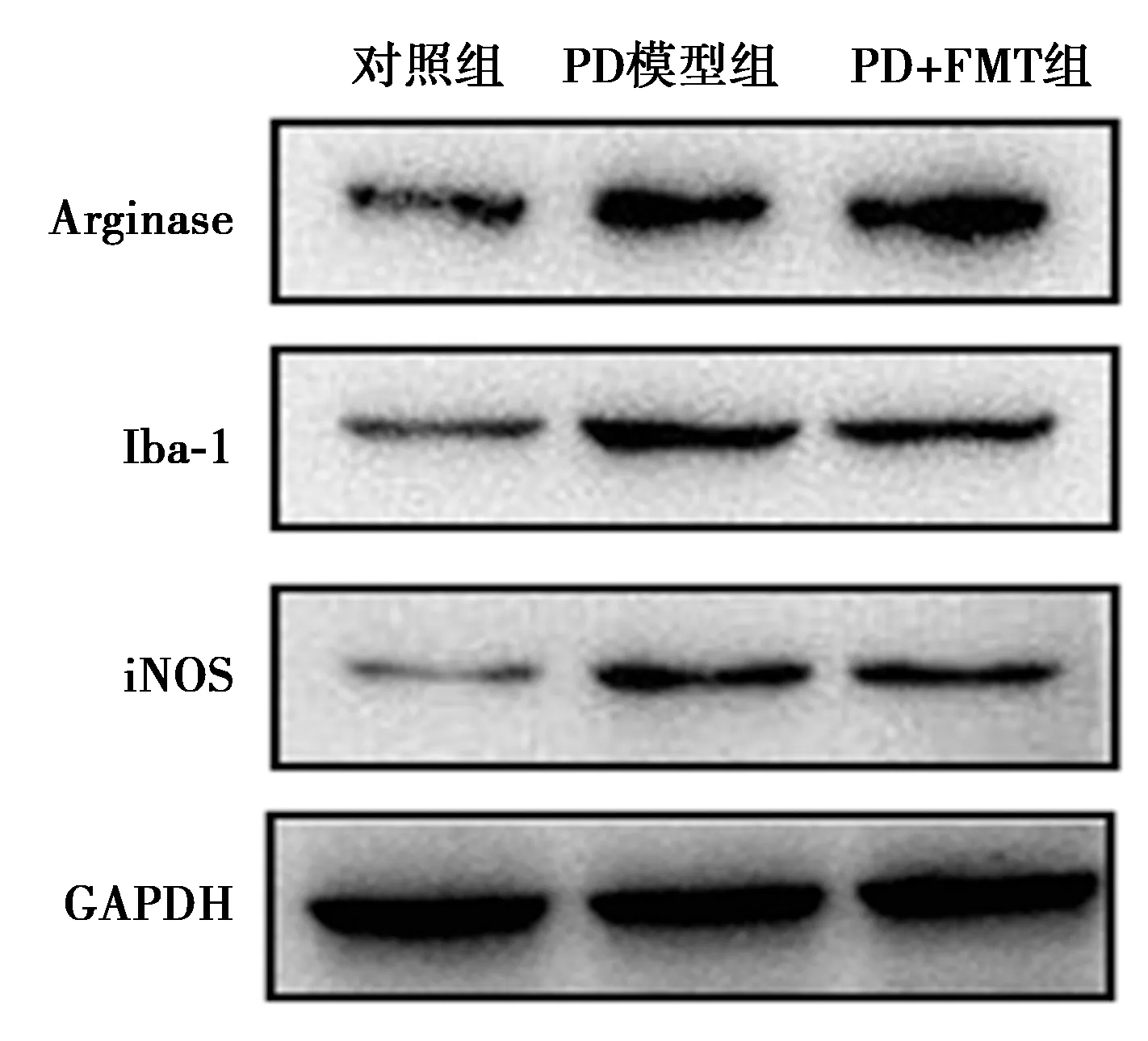
图5 各组黑质Iba-1、iNOS、Arginase表达
3 讨 论
研究发现,约有80%的PD患者合并胃肠功能障碍,常见的临床特征包括便秘、异常流涎、吞咽障碍、恶心、胃排空障碍〔8〕。此外,其他已知的可增加肠道通透性的疾病,最近也证实增加了罹患PD的风险〔9〕。大量证据表明,PD患者肠道菌群改变,PD发病、进展与肠道菌群密不可分〔8~11〕。Lubomski等〔10〕回顾研究发现,PD组与健康对照组之间存在显著差异,且与非PD对照组相比,PD患者的整体粪便菌群组成在总体上也显示出显著差异。本实验也验证了MTPT致慢性PD小鼠模型中肠道菌群组成的明显改变,同时PD模型小鼠出现肠道及黑质区炎症反应。MTPT致慢性PD小鼠模型较完整的模拟了人类PD的疾病特征。
本研究发现,FMT通过恢复PD小鼠的肠道菌群组成结构进而减轻肠道炎症,同时促进黑质区小胶质细胞向M2抗炎表型极化,使炎症因子表达减少,抗炎因子表达增加,从而减轻小鼠运动障碍症状。现有研究表明〔11〕,紊乱的肠道菌群会破坏胃肠道保护性屏障的稳定,肠道菌群或其微生物代谢物如脂多糖(LPS)等的移位,继而诱发肠道氧化应激和炎症,从而诱导黏膜通透性的增加及ENS中的α-Syn聚集。Toll样受体(TLR)4是一种存在于在免疫细胞中的模式识别受体,是LPS的唯一受体,革兰阴性细菌释放其表面LPS,后者与TLR4结合,将信号转到免疫细胞内部,分泌细胞因子肿瘤坏死因子(TNF)-α、干扰素(INF)-γ、IL-6和IL-1β等导致炎症反应〔11〕。Colonna等〔12〕也在PD患者结肠组织中发现了更多的CD3+T细胞和TLR4,且在PD小鼠病理模型中敲除TLR4后,肠道炎症、肠道和运动功能障碍、神经炎症和神经退行性变有所缓解。LPS、IFN-γ可触发TLR信号通路和IFN-γ信号通路,诱导小胶质细胞M1型活化〔12〕,向小鼠肠道内注射LPS,发现中枢神经系统小胶质细胞M1型激活,产生神经炎症〔12〕。LPS可能是肠道菌群影响PD肠道炎症、小胶质细胞M1型活化及脑内炎症反应的桥梁。本实验中,PD模型小鼠肠道厌氧菌、双歧杆菌、杆菌、球菌丰度增加,其中双歧杆菌属、杆菌属以革兰阴性细菌为主。本研究结果提示,肠道菌群对PD模型组小鼠黑质区小胶质细胞影响的机制可能是PD小鼠革兰阴性杆菌比例增加,LPS产生增多,诱发肠道炎症、黑质区炎症反应,FMT后,相关细菌占比下降,LPS产生减少,肠道炎症及黑质区炎症反应减轻,多巴胺神经元凋亡减少,PD症状改善。目前本研究仅探讨了现象,肠道菌群如何影响黑质区炎症反应的机制需要深入研究。
FMT是将从健康供体的粪便中获得的肠道微生物群引入(移植)到患者的胃肠道中重建患者整体肠道菌群的方法。这种疗法广泛用于治疗由病原微生物或条件病原微生物活动引起的胃肠道疾病,且效果良好〔13〕。最近越来越多的研究报道了FMT用于治疗代谢综合征、糖尿病、癌症和阿尔茨海默病等也取得良好效果〔14,15〕。在非PD便秘患者中进行正常人群FMT后,发现患者的便秘得到明显改善〔15〕。本研究发现,给予FMT后小鼠行为学改善,肠道炎症好转,黑质区炎症反应减轻,小胶质细胞以M2抗炎表型占主导。而现有临床病例显示,FMT并没有影响PD核心症状,最多可能改变相关的疾病特征,如便秘、焦虑及抑郁〔16〕。健康粪菌来源、移植方式及饮食习惯、药物使用都有可能是PD患者FMT治疗的影响因素,仍需要进一步研究探讨。
