心脏磁共振Native T1在Takotsubo综合征和左前降支梗阻型急性心肌梗死中的鉴别诊断价值
2022-10-09苏燕萍卢陈英吕玲春郑沈菲王君禾陈敏江纪建松
苏燕萍,卢陈英,吕玲春,郑沈菲,王君禾,陈敏江,纪建松,
1.丽水市中心医院 放射科,浙江 丽水 323000;2.丽水市中心医院 心内科,浙江 丽水 323000;3.丽水市中心医院 浙江省影像诊断与介入微创研究重点实验室,浙江 丽水 323000;4.温州医科大学 第一临床医学院(信息与工程学院),浙江 温州 325035
Takotsubo综合征(Takotsubo syndrome, TTS)是一类以可逆性室壁运动异常及急性左心功能不全为特征的综合征[1-2],最初被认为是一种良性疾病,然而最新的研究表明,TTS每年住院病死率约1.8%,长期病死率约3.5%[3],约5.9%的患者在病程中发生心脏骤停[4],约21.8%的患者在住院期间发生重大临床事件[5-6],这均表明,TTS并非是一种良性疾病,其病死率并不亚于急性心肌梗死(acute myocardial infarction, AMI)[7-8]。TTS首诊症状常表现为急性胸痛、胸闷、呼吸困难等,同时伴有肌钙蛋白(cardiac troponin, CTN)、B型脑利钠肽(brain natriuretic peptide, BNP)等心脏标志物的升高,心电图以ST段抬高常见[9],与AMI的临床表现相似,在临床征象上较难区分,尤其是左前降支梗阻型AMI(acute myocardial infarction with left anterior descending coronary artery obstruction, AMI-LAD)[1],TTS国际指南将两者作为重要鉴别诊断对象[10-11]。因此,TTS临床鉴别诊断的难度较大,左心室造影和冠脉造影仍然是确诊TTS和排除AMI-LAD的金标准[11],但该诊断方法作为有创检查,仍具备一定风险,且随诊顺应性较差。因此,如能在影像学层面建立一种特征性的TTS鉴别诊断策略,这对于临床诊疗方案的及时制定和干预具有重要意义。心脏磁共振成像(cardiac magnetic resonance, CMR),因其较高的时间、空间分辨力、良好的软组织对比度、多参数多序列后处理方式等优势,可以明确心肌水肿、纤维化,尤其是钆对比剂延迟增强序列,在TTS与AMI-LAD的精准鉴别诊断方面具备一定的优势[12]。然而,由于CMR检查时间长、需要注射对比剂等缺点,急性期伴有左心功能不全的TTS患者往往难以耐受。Native T1-mapping具有无需对比剂、成像时间短、客观真实反映心肌状态等优点,本研究笔者将重点针对Native T1在TTS和AMI-LAD的精准鉴别诊断中的价值进行探索。
1 资料和方法
1.1 一般资料 选取2018年1月至2022年2月于丽水市中心医院就诊的TTS患者13例,AMI-LAD患者26例,均行CMR检查。TTS纳入标准:①急性期超声心动图表现为心尖部运动乏力,恢复期消失,运动异常区域超出单一冠脉供血范围;②发病前存在心理或躯体压力诱因;③出现新的心电图异常表现;④心肌损伤标志物升高;⑤排除冠脉梗阻(狭窄>50%);⑥CMR排除心肌炎等其他疾病。AMI-LAD纳入标准:①急性期超声心动图表现为节段性室壁运动异常,恢复期存在;②出现新的心电图异常表现;③心肌损伤标志物升高;④左前降支冠脉梗阻(狭窄>50%);⑤CMR延迟增强序列强化区域与梗阻冠脉供血范围一致。排除标准:①生命体征不稳定;②不能配合CMR或存在检查禁忌证;③既往存在心肌梗死或心肌炎等病史。本研究获丽水市中心医院伦理委员会批准[(2021)第(226)号]。
1.2 实验室检查 患者入院24 h内完成血样采集,检测肌钙蛋白I(cardiac troponin I, CTNI)、肌红蛋白(myohemoglobin, MYO)、肌酸激酶(creatine kinase, CK)、肌酸激酶同工酶(creatine kinase isoenzyme MB, CKMB)、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspertate aminotransferase, AST)、C反应蛋白(c-reactive protein, CRP)、乳酸脱氢酶(lactic dehydrogenase,LDH)、BNP等实验室指标。
1.3 影像学检查 患者入院14 d内完成CMR检查,采用飞利浦Ingenia 3.0T磁共振仪,18通道表面相控阵线圈,MRI兼容PERU心电门控板,Medtron Injektor Accutron MR高压注射器。扫描前被检者进行呼吸训练,扫描时心率整齐、呈平静状态。所有患者扫描参数如下:①电影序列(Cine):采用真实稳态自由进动快速(B-TFE)序列进行左心室长轴(二、三、四腔心)及短轴Cine序列采集,主要参数:TR:shortest,TE:shortest,FA 45°,层厚 8 mm。②T2-STIR:在短轴及长轴四腔心上使用STIR序列采集,主要参数:TR 2倍RR间期,TE 75 ms, FA 90°,层厚8 mm。③T1-mapping:运用MOLLI序列进行Native T1-mapping采集,对比剂注射后9~12 min采集Enhanced T1-mapping,主要参数TR:shortest,TE:shortest,FOV:300 mm×300 mm,矩阵:144×142,层厚8 mm。④T2-mapping:采用多回波SE序列进行T2-mapping采集,TR为1倍的心动周期,TE使用shortest,Echoes:9,设备计算生成T2/R2 map图。⑤延迟增强序列(LGE):采用相位敏感反转恢复(PSIR)序列进行钆对比剂延迟增强磁共振序列采集,主要参数:TR shortest,TE 3 ms, FA 25°,层厚8 mm。
1.4 CMR图像处理分析 图像扫描完成后导入后处理分析软件(Circle cvi42),勾画Cine序列心内、外膜轮廓,在Short 3D及Tissue Tracking模块得到左心室各项心功能参数及心肌应变参数:EF、EDV、ESV、SV、HR、CO、CI、GSR、GSC、GSL。在T2模块勾画Native T2-mapping心内外膜轮廓得到 Native T2值;在T1模块勾画Native T1-mapping及Enhanced T1-mapping心内外膜轮廓,标记各层面血池感兴趣区(region of interest, ROI),输入红细胞比容得到Native T1及ECV值;软件根据美国心脏协会(American Heart Association, AHA)分段法得到各参数16节段数据。在LGE/T2-STIR序列中勾画正常心肌ROI,定义高于正常心肌平均值5个标准差的区域为强化区域,高于正常心肌平均值3个标准差的区域为水肿区域,定义强化/水肿面积大于相应节段50%为阳性节段,计算每例病例T2-STIR及LGE阳性节段数量。将每例病例根据是否水肿节段分为两组,计算水肿节段及非水肿节段Native T1、ECV、Native T2平均值。所有图像均采用双盲法处理分析,由2名经验丰富的放射科医师独立完成,参数结果取平均值。
1.5 观察指标 研究观察指标具体如下:①一般资料,如性别、年龄、BMI、临床症状、病史、吸烟史,心电图表现包括ST-T抬高、T波倒置、QTc延长、房室传导阻滞等;②实验室检查结果、左室心功能参数、左室心肌应变参数及Native T1、ECV、Native T2。
1.6 统计学处理方法 采用SPSS25.0统计分析软件。符合正态分布的计量资料以±s表示,组间比较采用两独立样本t检验,不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Wilcoxon检验。计数资料以例数(%)表示,组间比较采用Fisher 精确概率法。将差异有统计学意义的指标纳入单因素Logistic回归分析后,利用多因素Logistic回归分析筛选独立危险因素;采用受试者工作特征(receiver operating characteristic, ROC)曲线比较各独立危险因素及联合模型对TTS及AMI-LAD的鉴别诊断效能,计算曲线下面积(area under curve, AUC)、灵敏度、特异度。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较结果 TTS组与AMI-LAD组年龄差异无统计学意义(P>0.05)。TTS组较AMI-LAD组女性患者比例较高(P=0.012),BMI值较低(P= 0.043),见表1。2组患者心电图大多表现为ST段抬高,均存在不同程度的胸痛、胸闷、呼吸困难,部分TTS患者病程中伴发心跳骤停,差异无统计学意义(P>0.05)。实验室检查结果表明,TTS组患者CTNI、CKMB较AMI-LAD组低,但BNP、CK、LDH、CRP较AMI-LAD高(P<0.05),见表2。

表1 2组患者的基本临床资料
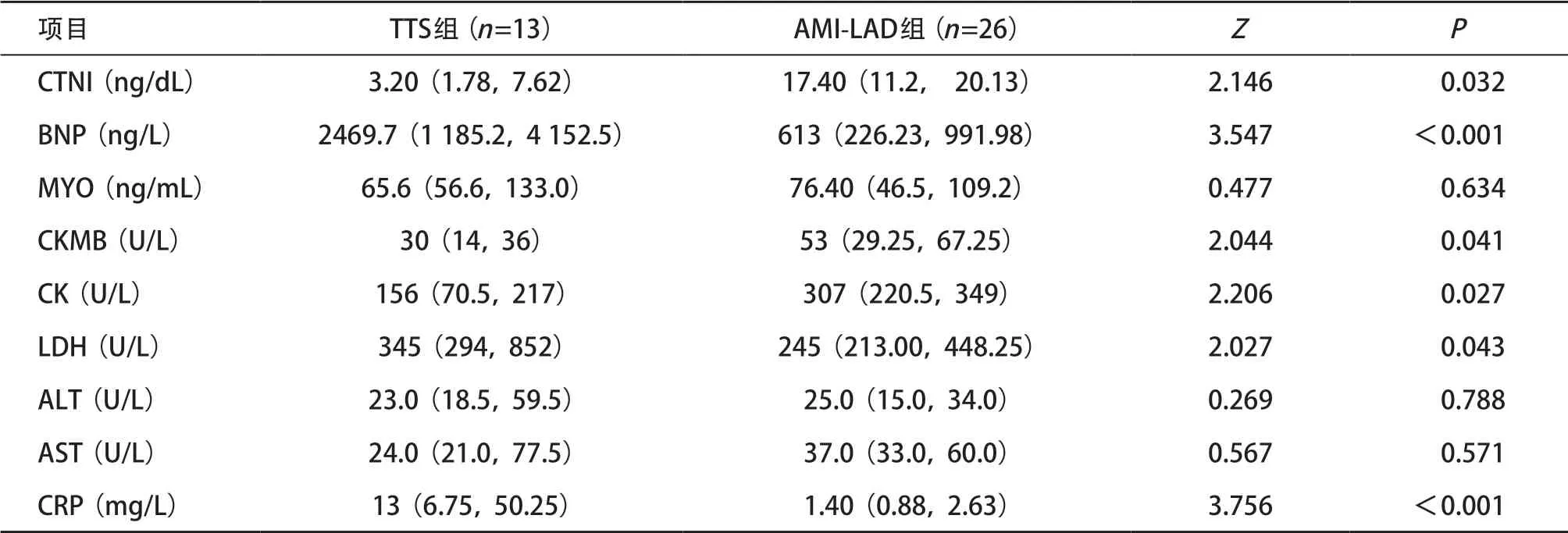
表2 2组患者的血液检查结果[ M(P25,P75)]
2.2 影像学参数比较结果 左室心功能结果表明,2组患者各项心功能指标差异无统计学意义(P>0.05),见表3。2组均表现为心尖部运动乏力,收缩末期呈“气球样”扩张,相应区域出现大面积水肿,TTS组无明显延迟强化,而AMI-LAD组存在与水肿区域一致的延迟强化(见图1)。CMR后处理结果表明,2组间左室心肌应变GSR、GSC、GSL及T2-STIR阳性节段差异无统计学意义(P>0.05),TTS组Native T1、Native T2高于AMI-LAD组(P<0.001),ECV、LGE阳性节段少于AMI-LAD(P<0.001),见表4。
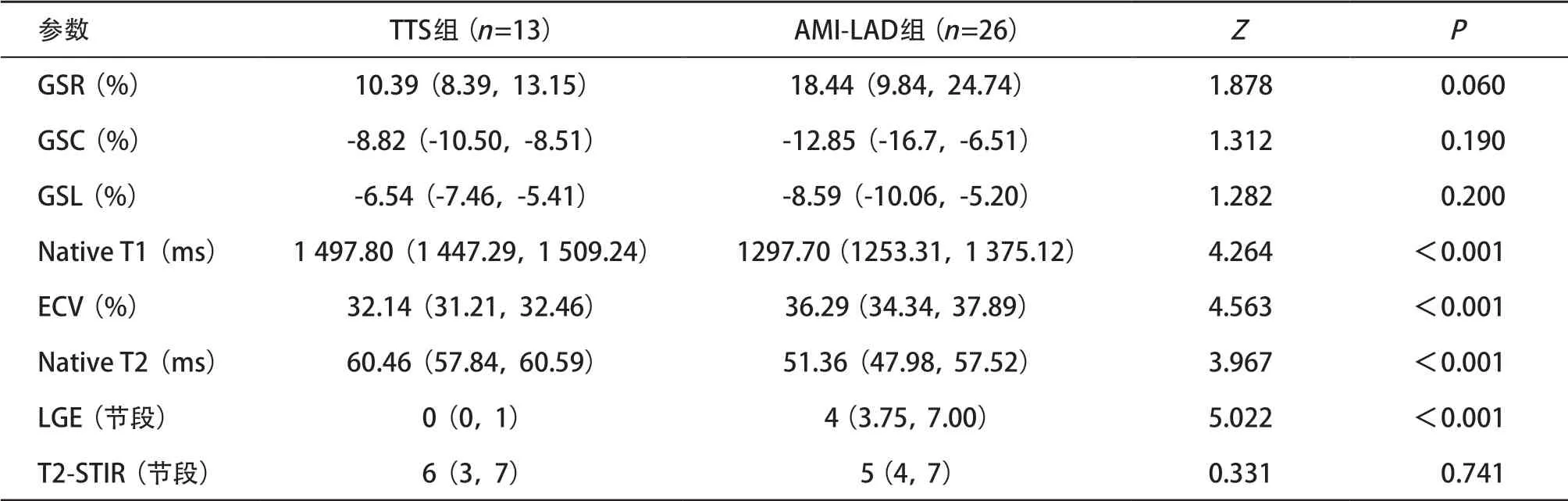
表4 2组患者CMR后处理结果

图1 60岁女性AMI-LAD患者和61岁女性TTS患者的CMR影像

表3 2组患者的左室心功能检查结果
CMR后处理结果显示,2组组内水肿节段Native T1、ECV、Native T2值均高于非水肿节段(P<0.001),TTS组水肿节段相较于AMI-LAD组水肿节段Native T1、Native T2值高(P<0.05),ECV值低(P<0.05),TTS组非水肿节段Native T1、T2值均高于AMI-LAD组非水肿节段,而ECV值低于AMI-LAD非水肿节段(P<0.05),见表5;AMI-LAD各值变化集中于心尖部,而TTS则表现为整体性改变(见图2、图3)。
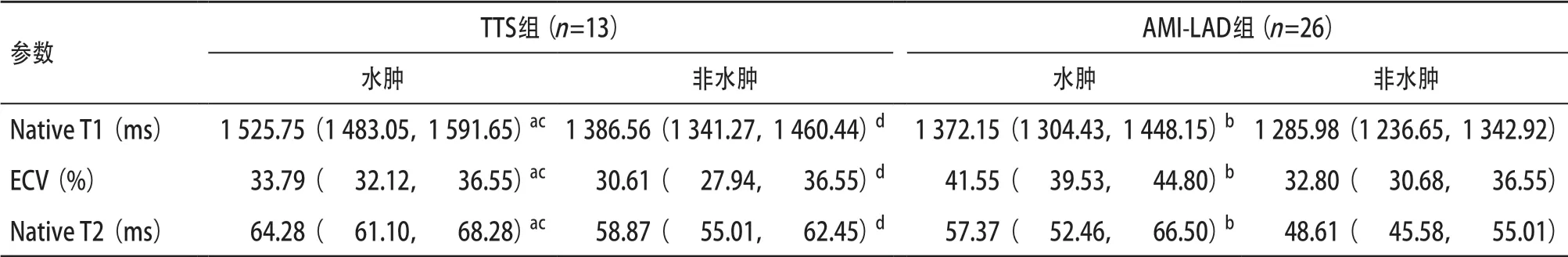
表5 2组患者水肿、非水肿节段Native T1、ECV、Native T2结果
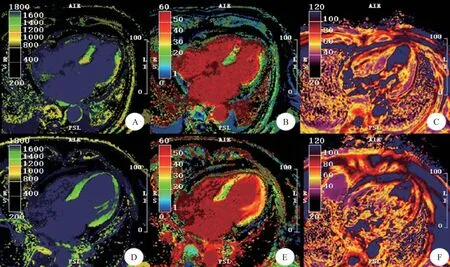
图2 60岁女性AMI-LAD患者和61岁女性TTS患者的CMR后处理图像

图3 60岁女性AMI-LAD患者和61岁女性TTS患者的Native T1-mapping、ECV-mapping、Native T2-mapping牛眼图
2.3 鉴别诊断效能比较 经单因素Logistic回归分析后将性别、BNP、Native T1纳入多因素Logistic 回归分析,最终确认BNP、水肿节段Native T1是TTS鉴别于AMI-LAD的独立危险因素(见表6)。对BNP、水肿节段Native T1及两者联合模型绘制ROC曲线(见图4),BNP、Native T1、联合模型诊断两者的AUC分别为0.852(95%CI=0.702~0.945)、0.911(95%CI=0.776~0.978)、0.920(95%CI=0.787~0.983),灵敏度分别为84.62%、84.62%、84.62%,特异度分别为76.92%、84.62%、96.15%。

图4 BNP、Native T1及两者联合模型的ROC曲线
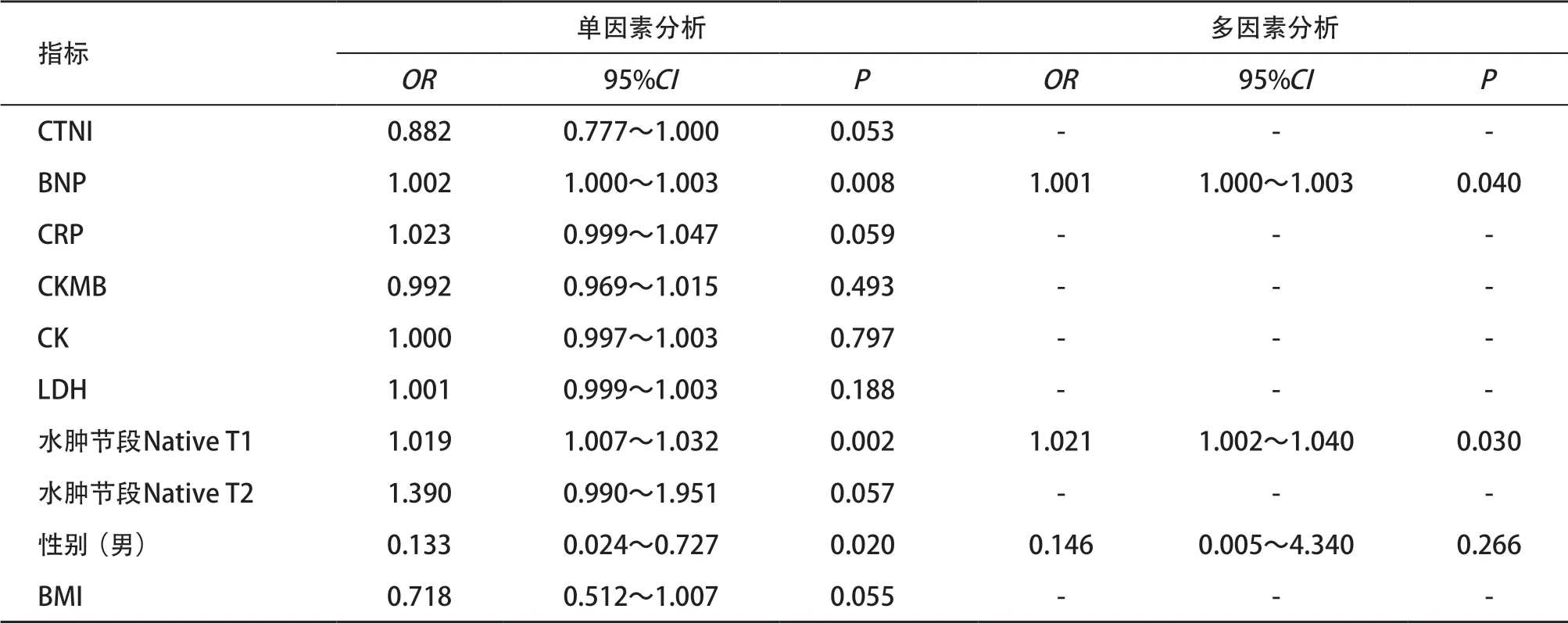
表6 单因素及多因素Logistic回归筛选TTS鉴别AMI-LAD的独立危险因素
3 讨论
TTS是一类急性心力衰竭综合征,好发于绝经后女性,拥有与AMI-LAD极其相似的临床特征,有研究报道称疑似AMI-LAD就诊的患者中,约2%被诊断为TTS,在女性患者中,该比例可能为10%[13]。近年来,随着CMR技术的发展,其在TTS诊断中的地位逐渐提高,虽然CMR延迟增强序列可以根据心肌坏死与否鉴别TTS与AMI-LAD[1],但因其检查时间过长且需要注射对比剂等限制,实际操作难度较高,急性期患者鲜少可以耐受。本研究利用无需对比剂的快速成像序列Native T1-mapping对TTS及AMI-LAD进行诊断,发现Native T1对于两者的鉴别具有较高的敏感度与特异度,对临床诊断具有重要价值。
TTS与AMI-LAD的CMR均表现为心尖部心肌收缩乏力、大面积水肿及严重的左心功能障碍。左室心肌应变根据心肌不同方向的形变呈现运动情况,可以有效识别局部异常运动[14],但无法在TTS与AMILAD之间进行有效鉴别,这与STIERMAIER等[15]的研究结果一致。TTS患者存在大面积的心肌水肿、损伤,CRP值明显高于AMI-LAD,SCALLY等[16]发现,TTS的水肿与全身性炎症显著相关。AMI-LAD心肌水肿节段与TTS虽差异无统计学意义,但CRP却明显低于TTS,说明AMI-LAD的心肌水肿并非由炎症引起,而是由于心肌缺血,正因如此,损伤心肌较为局限,这可能也是AMI-LAD患者BNP值比TTS患者低的原因。此外,TTS与AMI-LAD最大的区别是,AMI-LAD存在大面积心肌组织坏死,而TTS无心肌坏死,两者的CTNI水平、心肌延迟强化差异及ECV值的不同全面展现了这一点[17],ECV在TTS水肿节段的中位数为33.79%(40%>损伤>30%),而在AMI-LAD水肿节段的中位数为41.55%(纤维化>40%),明显高于TTS组。
心肌含水量的增加可以延长T1、T2弛豫时间,这使得Native T1、T2具备量化心肌水肿的能力[18]。TTS患者不论是心肌整体Native T1、T2,还是水肿节段NativeT1、T2均高于AMI-LAD患者,提示TTS心肌水肿程度更高。此外,在T2-STIR显示无水肿的节段,TTS患者Native T1、T2值也高于AMI-LAD患者,说明Native T1、T2发现心肌损伤的能力比T2-STIR更强。Native T1对细胞内外游离水含量的变化十分敏感,在急性炎症、血管扩张和充血期间[19],可以更加敏锐地检测到微小损伤,有效替代Native T2的功能[20],展现了其在心肌损伤领域的诊断潜力。
本研究也存在一定的缺陷。首先,由于TTS发病率低,本研究纳入的患者人群较小。在后续研究中,笔者将进一步收集相关患者,进一步扩充样本量,在条件允许的情况下,开展多中心研究。另外,本研究只关注了AMI与TTS的鉴别诊断,对于其他类型的AMI没有研究,需要进一步探索,全面了解 Native T1在心肌损伤中的诊断价值。
综上所述,BNP、水肿节段Native T1以及两者联合模型的AUC分别为0.852、0.911、0.920, Native T1可以有效鉴别TTS与AMI-LAD,联合BNP可提高鉴别诊断效能。Native T1值具有客观、精准、成像时间短、无需对比剂等优点,在TTS与AMI-LAD的鉴别中代替钆对比剂延迟增强扫描的作用,缩短检查时间,使之为更多急性期TTS患者所耐受,为肾功能不全患者提供更多选择,争取黄金治疗时间,提高患者预后。此外,Native T1对于T2-STIR无法识别的细微损伤也有良好的识别能力,这提示我们,这项技术可能可以应用于更早期心肌损伤的识别、诊断之中,有望于成为诊断心肌损伤的可靠方法。
