门静脉栓塞术治疗III型及IV型肝门部胆管癌患者后肝再生情况的影响因素
2022-10-09刘艺飘郭志英刘家兴樊海宁卢倩
刘艺飘,郭志英,刘家兴,樊海宁,卢倩
1.青海大学附属医院 肝胆外科,青海 西宁 810016;2.清华大学附属北京清华长庚医院 肝胆胰中心,北京 102218
肝门部胆管癌(hilar cholangiocarcinoma,HCCA)是累及肝总管、左右肝管及其汇合部的胆管黏膜上皮癌[1-2]。Bismuth-Corlett分型中的III型和IV型HCCA的解剖部位特殊,呈浸润性生长以及与肝门部血管关系密切等特点,给手术切除造成极大的困难。因此亟需一种有效的术前微创介入方法辅助治疗,以减少患肝体积,促进健肝再生,从而提高手术的临床获益率[3-4]。门静脉栓塞术(portal vein embolization, PVE)被认为是肝大部分切除术前实施以增加预保留肝容积(future liver remnant, FLR)并降低肝大部分切除术后肝功能衰竭和死亡风险的最佳手段之一[5-6],尤其适用于Bismuth-Corlett分型中的III型和IV型HCCA患者[7]。但是,目前尚缺乏PVE后对肝再生的影响因素研究。本研究回顾性分析Bismuth-Corlett III型、IV型HCCA患者的一系列临床资料,为HCCA患者采用PVE治疗提供一些经验,以期待实现更好的肝脏再生功能,争取更长的生存时间。
1 资料和方法
1.1 一般资料 收集2016年6月至2021年12月清华大学附属北京清华长庚医院肝胆胰中心完成的72例通过PVE术治疗的Bismuth-Corlett III型、IV型HCCA患者的临床资料,按照PVE术后第3周FLR再生率中位数分组,分为高再生组(38例)、低再生组(34例)。本研究通过清华大学附属北京清华长庚医院伦理委员会审批。纳入条件:①术后病理诊断或影像学报告为HCCA;②接受PVE治疗的病例;③拟接受肝大部分切除术的HCCA患者,预保留肝容积率(future liver remnant rate, FLRR)在40%以下;④HCCA患者的临床分型Bismuth-Corlett III型、IV型(以法国Bismuth-Corlett分型法为准)。排除条件:①未采用PVE治疗的HCCA患者;②术前或术中发现已有远处内脏器官转移;③门静脉高压、腹腔积液或任何其他肝硬化严重导致的肝外并发症;④患者重要的临床资料缺失导致无法完整回顾收集。
1.2 PVE治疗指征 在预行肝切除术前,需要根据患者CT进行3D重建下预估肝大部分切除术后所剩余的肝体积来决定是否先行PVE术。目前研究认为:在拟行肝切除的HCCA患者中,预估FLR占全肝体积的40%以下或99mTc-甲溴苯宁肝胆显像肝功能低于2.7%/(min·m2),应行PVE治疗[7]。
1.3 PVE治疗方法 患者在DSA及超声引导下经皮肝穿门静脉造影及门静脉分支栓塞。主要操作过程如下:CT下确认肝内门脉左、右支,根据肿瘤位置确定要栓塞的门静脉分支,在确定皮肤穿刺位点后,进行导丝导管引导下造影,根据血管直径注入不同直径栓塞材料。在PVE术后第3周复查CT计算肝脏体积变化,符合手术标准后再行肝切除手术治疗。PVE及切除术后给予规律的保肝治疗。
1.4 观察方法 记录患者基本情况,在PVE术前及实施PVE后第3周各进行1次CT增强扫描及肝脏体积测定,使用IQQA-Liver软件(由美国EDDA公司开发)进行这两次观察点的3D重建,分别计算出肝脏总体积(total liver volume, TLV)、标准肝脏体积(standardized liver volume, SLV)及两次观察点FLR。详细记录患者基本情况、肝再生情况、肝再生的影响因素等。
1.5 肝体积计算方法 采用中国人适用的体表面积(body surface area, BSA)计算通式计算SLV。SLV=1267.28×BSA-794.41 mL。FLRR=FLR/TLV。ΔFLR(FLR增长量)=FLRpost-PVE-FLRpre-PVE,FLR再生 率(%)=[(FLRpost-PVE-FLRpre-PVE)/FLRpre-PVE]×100%。
1.6 统计学处理方法 采用SPSS17.0软件进行数据分析。正态分布计量资料用±s表示,两组间差异用两独立样本t检验,非正态分布用中位数(95%CI)表示,采用Mann-WhitneyU检验;计数资料用例(%)表示,两组间比较采用χ2检验。用Kaplan-meier绘制生存曲线,两组生存率的比较用Log-rank检验。采用多因素Logistic回归分析影响患者术后肝再生情况的独立影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 PVE前后FLR变化及结果 72例HCCA患者在术前均顺利进行了选择性PVE术处理,术后无血肿、胆道出血、未栓塞侧门静脉血栓等PVE术相关并发症出现。PVE术前经影像学检查测量及肝体积3D重建计算得到HCCA患者SLV为(1 171.09± 105.45)mL,TLV为(1 334.56±210.08)mL。PVE前FLR为(447.97±99.93)mL,FLRR中位数为33.83%(32.29%~35.39%),小于40%的临界值。PVE术后3周患者FLR增长到了(582.80±106.60)mL,FLRR中位数为44.32%(42.17%~46.49%)。ΔFLR为(134.83±48.73)mL,FLR再生率中位数为27.60%(24.79%~35.00%)。PVE术后第3周FLR再生率>27.6%为高再生组,FLR再生率<27.6%为低再生组。高再生组38例,低再生组34例。高再生组ΔFLR为(171.01±35.35)mL,低再生组ΔFLR为(94.38± 29.62)mL,两组差异有统计学意义(P<0.05)。高再生组与低再生组FLRR差异显著,经PVE术后高再生组肝脏体积明显增加,差异有统计学意义(P<0.05),见表1。

表1 PVE术前及术后肝体积再生资料
2.2 两组PVE术后一般资料比较 共72例,男41例,女31例,肿瘤长径(4.32±2.41)cm,其中7例患者肿瘤长径>7 cm,8例患者肿瘤长径<3 cm,其他均为3~7 cm。肿瘤均侵犯肝总管及左右肝管汇合部, 同时累及左或右肝管;部分患者双侧肝管均受累,并侵犯肝门部纤维脂肪组织,与肝实质界限模糊不清。59例患者实施PVE术后联合肝大部分切除治疗,13例患者由于肝再生不良,PVE术后未行手术治疗。PVE与手术间隔时间为(28.98±12.22)d。两组间PVE前Bismuth-Corlett分型、区域淋巴结转移、CA19-9水平及肝纤维化差异有统计学意义(P<0.05),其他指标差异无统计学意义(P>0.05),见表2。
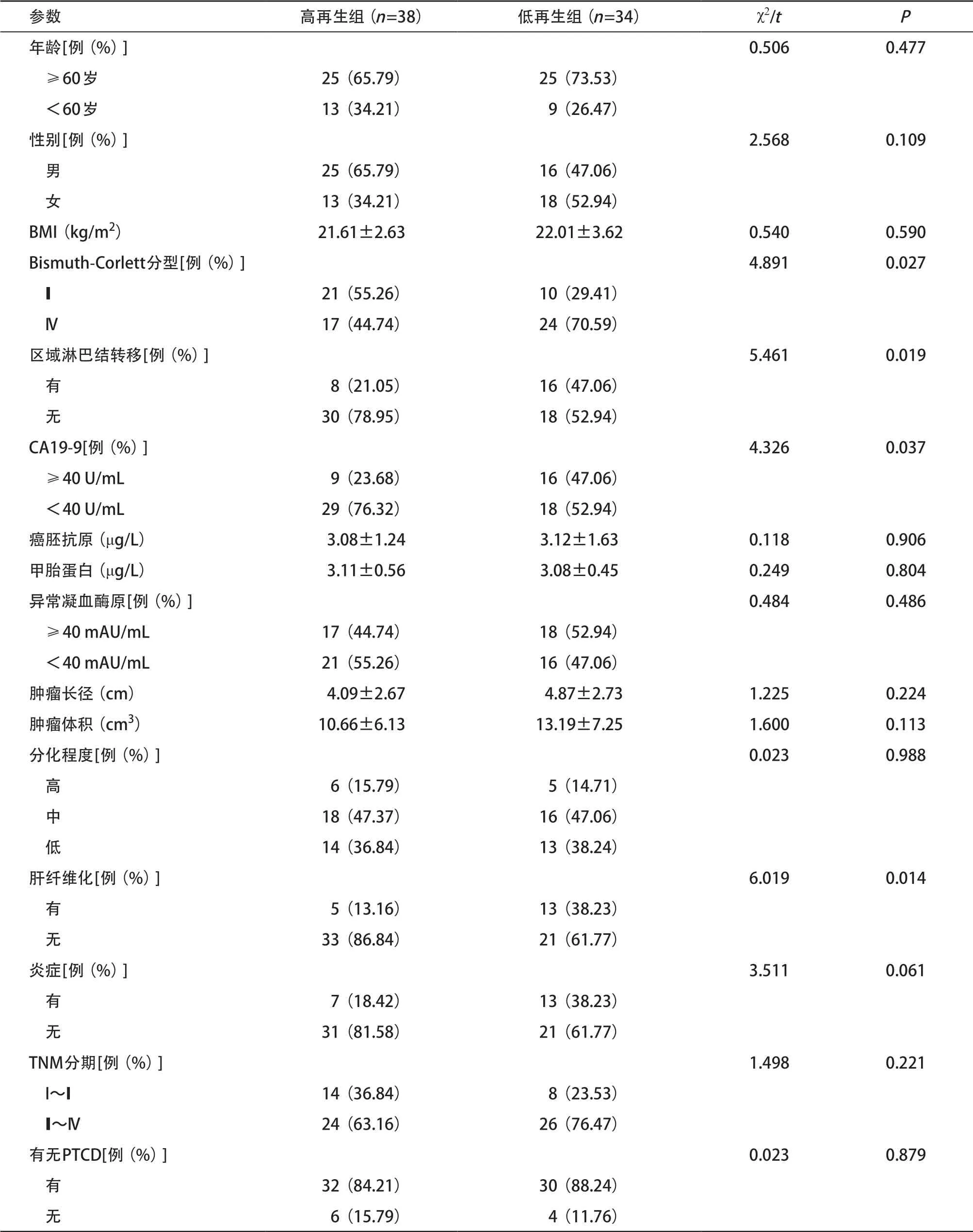
表2 两组一般资料比较
2.3 两组PVE术前血生化指标分析 高再生组与低再生组总胆红素、直接胆红素、总蛋白和白蛋白差异有统计学意义(P<0.05),见表3。
表3 两组患者PVE术前血生化指标比较(±s)

表3 两组患者PVE术前血生化指标比较(±s)
参数 高再生组(n=38) 低再生组(n=34) t P谷丙转氨酶(U/L) 123.97±110.33 127.49±83.02 0.152 0.880谷草转氨酶(U/L) 134.95±137.58 101.94±87.18 1.200 0.234总胆红素(μmol/L) 63.20±31.48 104.01±24.99 6.044 <0.001直接胆红素(μmol/L) 50.33±29.18 86.17±17.59 6.219 <0.001总蛋白(g/L) 74.57±3.80 68.76±9.01 3.633 <0.001白蛋白(g/L) 37.93±2.92 36.14±4.59 1.996 <0.050
2.4 影响患者PVE术后肝再生情况的单因素及多因素Logistic回归分析 将纳入的HCCA患者按照年龄、性别、胆管癌分型、淋巴结转移、CA19-9、分化程度、纤维化等因素分别纳入单因素回归模型进行变量筛选。见表4。

表4 影响患者PVE术后肝再生情况的单因素回归分析结果
将对PVE术后肝再生情况有意义的影响因素纳入多因素Logistic回归模型进行分析,肝纤维化程度高是影响PVE术后肝再生的独立危险因素。PVE术前有纤维化的患者在术后出现低肝再生情况的概率是术前无肝纤维化患者的3.534倍。见表5。
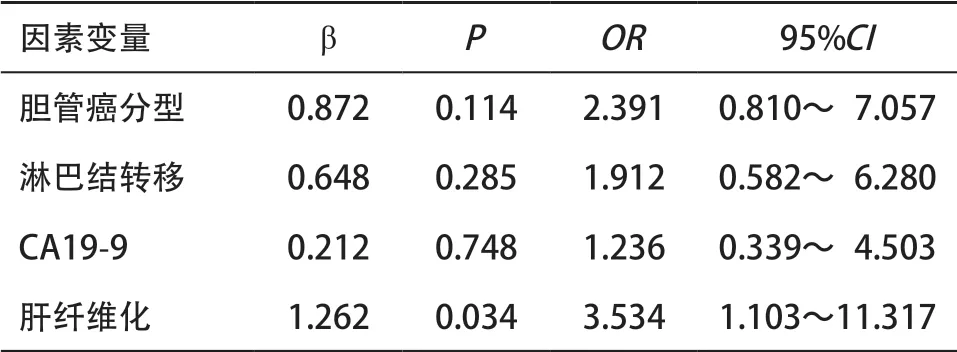
表5 影响患者PVE术后肝再生情况的多因素Logistic回归分析结果
2.5 PVE术后两组术中情况对比 HCCA患者中实施PVE术病例共72例。其中59例患者实施PVE术后联合肝大部分切除治疗,13例患者由于肝再生不良,PVE术后未行手术根治治疗。因此术中情况包括高再生组38例,低再生组21例。其中高再生组中完成手术的患者肝脏切除方式为:左半肝切除术5例(13.16%),右半肝切除术18例(47.37%),扩大左半肝/左三叶切除术8例(21.05%),扩大右半肝/右三叶切除术7例(18.42%)。低再生组中完成手术的患者肝脏切除方式为:左半肝切除术3例(14.29%),右半肝切除术10例(47.62%),扩大左半肝/左三叶切除术3例(14.29%),扩大右半肝/右三叶切除术5例(23.80%)。PVE术后高肝再生组与低肝再生组术中出血量、术中输入血浆量、切除体积存在差异 (P<0.05)。见表6。
表6 PVE术后两组肝大部分切除术中情况比较(±s)

表6 PVE术后两组肝大部分切除术中情况比较(±s)
参数 高再生组(n=38) 低再生组(n=21) t P肝门阻断最长持续时间(min) 90.87±15.16 93.37±16.82 0.583 0.562出血量(mL) 545.71±147.50 660.38±210.66 2.447 0.017术中输入血浆(mL) 368.28±167.65 505.70±196.54 2.834 0.006手术时间(min) 734.13±232.80 779.34±253.75 0.692 0.492切除体积(cm3) 623.16±89.60 831.90±98.34 8.276 <0.001淋巴结清扫数量(枚) 7.67±3.65 8.98±3.32 1.361 0.178
2.6 2组PVE术后生存时间比较 随访最久达42个月时患者出现死亡结局,随访期间72例患者中有49例患者出现死亡结局。所有患者中位生存时间12.2个月,95%CI=7.934~16.406。高再生组的中位生存时间18.0个月,95%CI=9.384~26.616,删失13例;低再生组中位生存时间5.8个月,95%CI=0.001~12.368,删失10例。比较两组总体生存时间,差异有统计学意义(P=0.041)。高再生组6、12、18个月总体生存率为72.3%、57.8%、47.6%、低再生组分别为46.5%、38.8%、16.4%。见图1。

图1 2组PVE术后的生存曲线
3 讨论
近年来PVE被认为是肝大部分切除术之前使残肝再生的首选方案。HCCA患者通过PVE栓塞门静脉分支进行血流改道,令肝体积在数周内适度再生。大范围肝切除术前增加FLR可减少手术局限性,并且避免肝切除术后肝衰竭的发生[8]。本研究共纳入72例行PVE的Bismuth-Corlett III型及IV型HCCA患者,所有患者到我院治疗前均未接受任何针对肿瘤的治疗。HCCA患者经PVE后肝体积均有不同程度的肝再生,经影像学检查测量及肝体积3D重建计算得到HCCA患者PVE前FLRR中位数小于40%的临界值。PVE术后3周患者FLRR中位数大于40%的临界值。PVE后高再生组与低再生组FLRR存在差异。
HCCA患者就诊时常伴有肝门梗阻及高胆红素血症,严重的梗阻性黄疸会导致肝功能、肾功能、凝血功能、免疫功能等异常及增加手术风险,术后并发症增多,预后差等情况。本研究中纳入患者采用PTCD进行术前减黄,减缓黄疸梗阻症状,改善肝脏基本功能。高再生组中有32例(占84.21%)实施PTCD,低再生组中有30例(占88.24%)实施PTCD,两组间差异无统计学意义。比较高再生组与低再生组PVE前血生化指标发现:高再生组较低再生组整体肝功能趋于稳定,黄疸程度减轻,蛋白总体合成能力较强。
此外本研究发现高再生组较低再生组的生存时间中位数延长,高再生组具有更好的代偿能力,延长患者生存时间。既往研究表明:PVE使肝脏代谢产物发生显著的变化,促进健侧肝脏再生。肝再生是由各种细胞因子和生长因子精确调控的过程。INOUE等[9]发现,肝再生速率在术后1周达到高峰,之后逐渐下降,在术后第5个月左右趋于稳定。在肝再生时期,多种转录因子基因、细胞调控基因等被快速诱导激活,门静脉血不仅含有多种细胞内环境所需的营养物质,而且富含多种促进肝细胞生长的调节因子,比如肝细胞生长因子、表皮生长因子、胰岛素等。这些营养物质和促进肝细胞生长的调节物都是肝脏再生的基础,它们激活了促进肝再生的复杂信号转导网络[10-12]。
肝纤维化影响患者肝再生程度,肝纤维化患者发生肝脏功能储备不足的概率增加。普通肝切除术后FLRR在40%以下时考虑行PVE,但对于肝硬化HCCA患者,FLRR在50%以下应考虑行PVE[13]。与HCCA中无纤维化患者比,HCCA中存在肝纤维化患者,出现肝再生的程度明显下降且再生不完全;因此肝纤维化程度是肝再生的主要预测指标[14-15]。本研究结果与以上报道结果相似,肝纤维化在高再生组与低再生组间存在显著差异,高再生组中出现肝纤维化患者5例,低再生组为13例。回归分析表明肝纤维化会独立影响PVE后的肝脏再生情况,肝细胞再生能力受限。
有研究结果表明:肝纤维化患者行肝脏相关手术后能量补充与消耗失衡,ATP明显下降,肝细胞摄取营养不足,致使剩余肝脏再生困难,术后肝衰竭发生率明显升高[16]。肝纤维化影响肝再生可能的原因是:①肝纤维化导致肝脏结构重建和血管不均导致肝组织血液供应困难,影响肝脏再生;②纤维化患者肝脏合成、代谢和排泄能力下降,促进再生的蛋白及生长因子表达减少;③胆汁及胆汁酸等代谢产物的淤积抑制肝脏再生。严重的肝纤维化会发展为肝硬化;肝纤维化发展的同时,可并发肝内门静脉等异常血管增生,交通吻合支增多,门静脉、肝动脉、肝静脉关系失衡等,导致供给肝细胞营养出现障碍。
治疗Bismuth-Corlett III型、IV型HCCA患者进行PVE术可以促进肝再生。高再生组较低再生组的生存时间的中位数延长。肝再生的影响因素有胆管癌分型、淋巴结转移、CA19-9、纤维化,其中肝纤维化是影响肝再生的主要危险因素。
