低温微创冷冻减脂动物模型的构建
2022-10-09胡大利曹卫红朱莉莉仇灵江林威钢蔡卫超杨霖璟叶超
胡大利,曹卫红,朱莉莉,仇灵江,林威钢,蔡卫超,杨霖璟,叶超
温州医科大学附属台州医院 整形美容科,浙江 台州 317000
脂肪组织分皮下脂肪组织(subcutaneous adipose tissue, SAT)和内脏脂肪组织(visceral adipose tissue, VAT),它们在形态学和功能学上均存在明显差异。全身过多的脂肪堆积容易导致肥胖、胰岛素抵抗、血脂代谢紊乱、糖尿病和心血管疾病[1]。局部脂肪堆积可影响患者的轮廓及外观,给 部分患者产生自卑等心理问题[2]。近年来随着微创美容技术的发展,冷冻减脂技术越来越多地为大众所接受。然而,因缺乏脂肪微创冷冻减脂模型,所以鲜有冷冻减脂和脂肪冷损伤的相关分子机制的研究。虽已有学者通过冰浆注入猪皮下脂肪研究冰浆减脂疗效[3],但因冰浆本身成分复杂,难以作为微创冷冻减脂的基础实验模型。本研究拟通过不同低温探针干预条件下,造成SD大鼠腹股沟区皮下脂肪局部冷损伤,以期建立合适的脂肪微创冷冻减脂动物模型,并初步探讨脂肪冷损伤的可能机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:SPF级雄性SD大鼠180只,鼠龄6~8周,体质量(250±50)g,购自上海斯莱克实验动物有限公司,动物许可证号:SCXK(沪)2017-0005。动物饲养场所为浙江省台州医院实验动物中心,两鼠一笼饲养,严格按照SPF级大鼠饲养要求饲养,实验期间自由饮水摄食。所有动物实验操作均遵循 《实验动物管理条例》以及医院实验动物中心的操作指南,同时经医院动物伦理委员会审核批准。
1.1.2 实验试剂及仪器:组织包埋机、全自动组织脱水机、石蜡切片机购自英国Shandon公司;荧光显微成像系统购自日本Olympus公司;光学显微镜、倒置荧光显微镜购自日本尼康公司。NF-κB-P65及TGF-β1抗体购自美国Abcam公司;TNUEL试剂盒购自杭州诺扬生物技术有限公司。
1.2 方法
1.2.1 实验动物分组及模型建立:180只大鼠随机分为低温组(0 ℃组、-20 ℃组、-40 ℃组、-60 ℃ 组、-80 ℃组)以及室温对照组(Control组),每组30只。腹腔注射0.6%水合氯醛溶液(0.3 mL/100 g) 麻醉后,订制4 mm直径探针[4]穿刺入腹股沟区皮下脂肪中层。电子控温条件下建立稳定的液氮冷冻式探针触点温度,可控点温度为(0±0.56)℃、 (-20± 1.86)℃、 (-40±2.08)℃、 (-60±2.56)℃、 (-80± 2.15)℃。在室温、0 ℃、-20 ℃、-40 ℃、-60 ℃、 -80 ℃不同温度条件下,探针接触右侧腹股沟皮下局部脂肪时间为30 s,左侧腹股沟接触时间为 60 s[4],原理见图1。干预完后放回饲养笼内,自由饮水摄食。
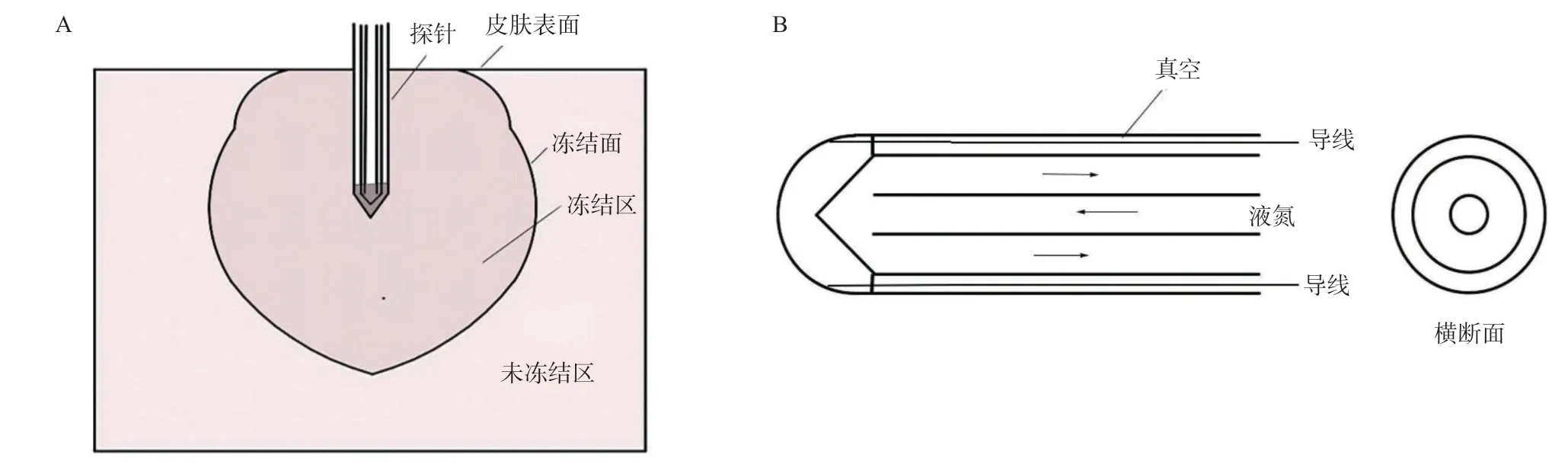
图1 液氮冷冻式探针原理图
1.2.2 动物大体观察及影像学观察:干预前、干预后(1 d、3 d、2周、4周、6周)观察干预前后实验部位局部皮肤情况并称取体质量,抽血检测血脂和肝功能,并行超声检测相同部位低温干预前后双侧腹股沟皮下脂肪厚度。
1.2.3 苏木精-伊红(HE)染色:不同温度(室温、0 ℃、-20 ℃、-40 ℃、-60 ℃、-80 ℃)干预后,各观察时间点取6只大鼠,提取双侧腹股沟皮下脂肪,每个样本一部分液氮冷冻,一部分置于10%中性甲醛固定24 h以上。样本脱水,将脱水后的组织浸蜡15 min并包埋;蜡块固定在病理切片机上连续切片;60 ℃烤片50 min后,依次放入二甲苯I、甲苯II溶液、梯度乙醇以及蒸馏水中进行清洗;最后HE染色,脱水封固,光学显微镜观察病理变化。
1.2.4 免疫组织化学染色:脂肪石蜡样本脱蜡至水,置于抗原修复缓冲液进行抗原修复,10%胎牛血清白蛋白封闭30 min,加入一抗,室温孵育过夜,加入二抗,室温下孵育60 min,分别DAB溶液显色、Mayer苏木素复染,最后脱水至透明封片,切片于显微镜下观察并采集图像。应用Image-Pro Plus免疫组化定量扫描分析NF-κB-p65及TGF-β1抗体阳性区域累计光密度值,每张切片分别选取病变区域内的5个高倍视野,计算其平均积分光密度值。
1.2.5 脂肪组织凋亡TUNEL法检测:各组脂肪组织分别用10%中性甲醛固定,石蜡包理,5 μm厚连续切片后备用。按照TUNEL法检测试剂盒操作,检测切片脂肪组织细胞凋亡。
1.3 主要观察指标 ①大鼠体质量、肝功能、血脂等变化;②大鼠腹股沟皮下脂肪厚度的变化;③局部皮肤及皮下脂肪组织学变化;④局部皮下脂肪组织NF-κB-p65、TGF-β定位及表达情况;⑤局部皮肤皮下脂肪细胞凋亡情况。
1.4 统计学处理方法 采用SPSS23.0统计软件进行数据分析,计量数据用±s表示多组间比较用单因素方差分析,组间两两比较用LSD-t法检验。P<0.05为差异有统计学意义。
2 结果
2.1 建模情况 实验过程中死亡7只,散在分布于各观察时间点,无集中现象,存活大鼠均进入结果分析。分析死亡原因与麻醉后低体温有关:低温-20 ℃组死亡1只(占3.33%),低温-40 ℃组死亡1只(占3.33%),低温-60 ℃组死亡2只(占6.67%),低温-80 ℃组死亡3只(占10%),符合动物模型构建条件,见表1。

表1 不同温度干预后各组大鼠死亡情况[只(%)]
2.2 不同温度干预下大鼠体质量的变化 大鼠苏醒后饮水摄食正常,不同温度干预大鼠体质量变化趋势基本一致。干预3 d后大鼠较少饮食,体质量轻微降低;所有存活大鼠干预6周后体质量明显增加,与干预前比差异有统计学意义(P<0.01),见图2。

图2 不同温度干预下大鼠不同时间点的体质量变化
2.3 不同温度干预条件下大鼠肝功能和血脂的变化 2组在不同温度干预条件下血糖、丙氨酸转氨酶、天冬氨酸转氨酶、甘油三酯、低密度脂蛋白、高密度脂蛋白、总胆固醇、总胆红素和白蛋白差异无统计学意义(P>0.05),见表2。

表2 Control组和-80 ℃组大鼠肝功能和血脂值
2.4 不同温度干预下大鼠皮肤及组织病理学损伤情况 对照组各观察时间点大鼠腹股沟皮下脂肪结构完整,无明显炎症细胞浸润。-20 ℃组炎症细胞浸润较轻微,皮肤组织未见改变。-60 ℃组干预 60 s 2周后,大鼠腹股沟皮下脂肪炎症细胞浸润明显,较干预30 s 2周后明显,差异有统计学意义(P<0.01),但局部皮肤未见红斑、水肿发生。-80 ℃组干预30 s 2周后除了脂肪组织变化外,皮肤组织开始出现明显冷损伤表现,60 s 2周后局部损伤更为明显,见图3-5。
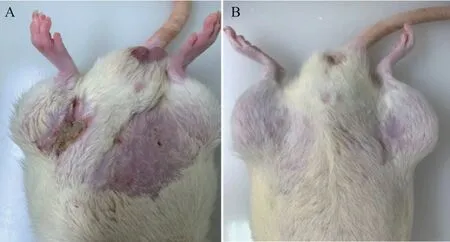
图3 不同低温干预2周后皮肤组织情况
2.5 超声下不同温度对大鼠腹股沟皮下干预60 s 6周对脂肪损伤的影响 与术前比,各低温组(-20 ℃ 组、-40 ℃组、-60 ℃组、-80 ℃组)大鼠腹股沟皮下干预60 s 6周后,大鼠腹股沟皮下脂肪厚度减少量分别为(0.15±0.05)mm、 (0.47±0.05)mm、(0.80±0.06)mm、 (0.85±0.05)mm。随着干预温度降低,大鼠腹股沟皮下脂肪厚度减少程度越明显。与-20 ℃组比,-60 ℃组6周后皮肤无损伤和无皮肤凹陷等情况下大鼠腹股沟皮下脂肪减少程度达到峰值,差异有统计学意义(P<0.01)。-80 ℃组6周后大鼠腹股沟皮下脂肪凹陷明显,但脂肪与表皮隔开,可见一阴影区,组织凹陷,见图6。

图6 大鼠腹股沟皮下脂肪厚度在不同温度干预前后变化
2.6 -60 ℃组大鼠脂肪组织NF-κB-p65和TGF-β1的表达量 -60 ℃组干预60 s 2周后和4周后脂肪组织NF-κB-p65蛋白表达量较Control组明显增多,差异有统计学意义(P<0.01);-60 ℃组干预60 s 4周后脂肪组织TGF-β1蛋白表达量较干预2周后和Control组明显增多,差异有统计学意义(P<0.01)。见图7、图8。

图4 大鼠腹股沟皮下脂肪在不同温度干预30 s、60 s 3 d后组织变化(HE染色,比例尺=50 μm)

图7 脂肪组织不同温度干预下NF-κB-p65蛋白免疫组化结果

图8 脂肪组织不同温度干预下TGF-β1蛋白免疫组化结果
2.7 不同温度干预60 s 3 d后对大鼠脂肪细胞凋亡的影响 -20 ℃以下组脂肪细胞随温度降低凋亡逐渐增多;与Control组比,-40 ℃组至-80 ℃组干预60 s 3 d后细胞凋亡明显增加,差异有统计学意义(P<0.01),见图9。

图5 大鼠腹股沟皮下脂肪在不同温度干预30 s、60 s 3 d后炎症细胞水平
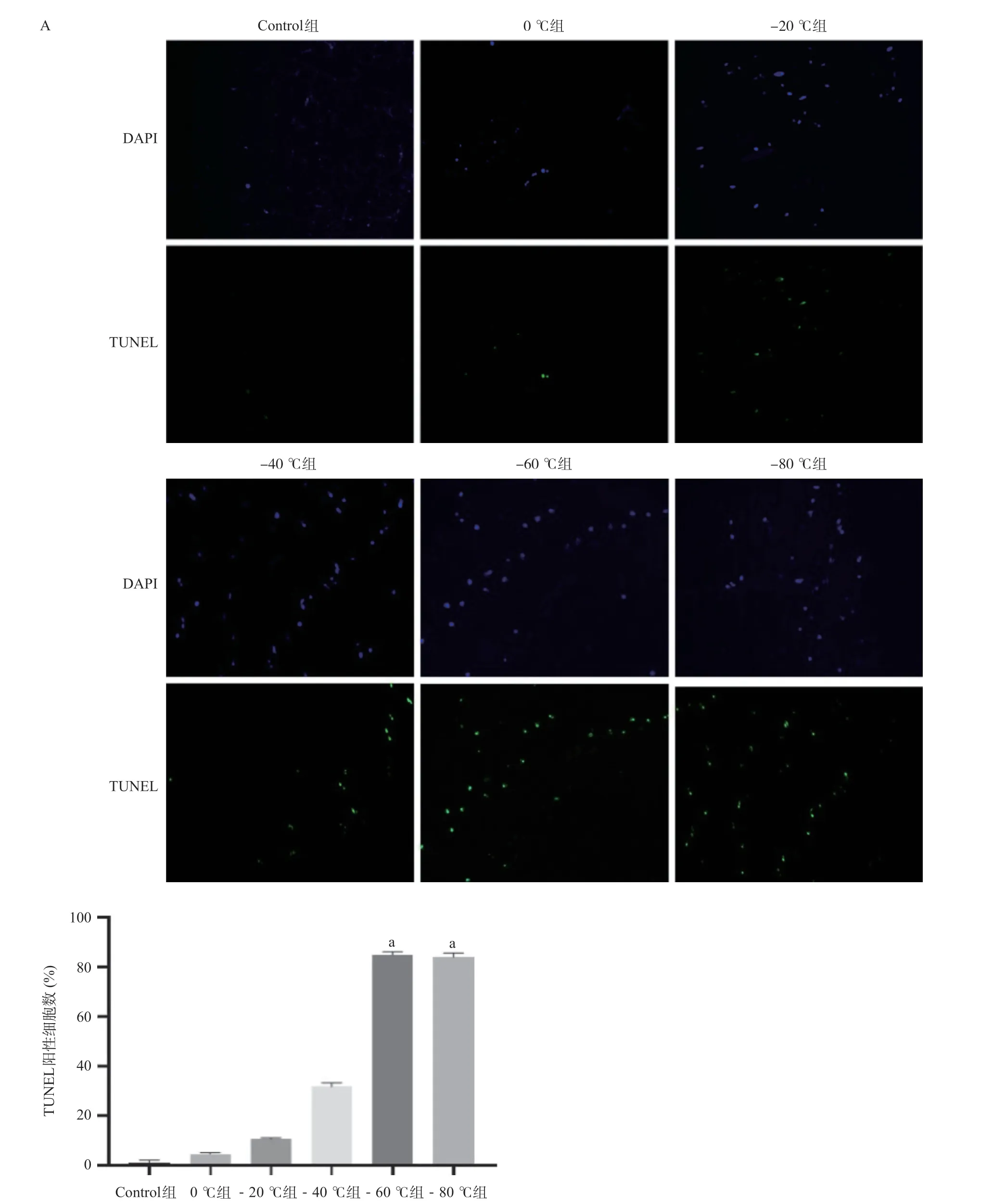
图9 不同温度干预3 d后脂肪细胞凋亡水平
3 讨论
局部脂肪堆积分为腹部脂肪堆积、大腿脂肪堆积、下颌脂肪堆积、颈部脂肪堆积等[5-6]。脂肪堆积不仅影响人们的身体健康及生活质量,还影响了患者的轮廓及外观,给部分患者产生自卑等心理问题。目前,微创冷冻溶脂技术逐渐引起大家的关注。通过PubMed、中国知网、万方等数据库搜索冷冻溶脂,可发现相关临床应用文章逐步增加[7-9]。但脂肪冷损伤的基础研究很少,其中一个重要原因是缺乏用于微创脂肪冷损伤的稳定的动物模型,这也进一步限制了脂肪冷损伤分子机制的研究。因此,建立良好稳定的皮下脂肪微创冷冻减脂模型是进行下一步机制研究的基础。
本研究通过在温度为-60 ℃,干预60 s条件下,成功建立了稳定的SD大鼠皮下快速脂肪冷损伤微创冷冻减脂动物模型。在温度为-60 ℃,干预60 s条件下,可造成局部脂肪组织明显损伤,炎症反应明显,细胞凋亡增加,但对局部皮肤组织、肌肉组织及脏器功能未产生明显影响,这与脂肪细胞对冷损伤相对敏感有关,其动物死亡率低于20%,符合动物实验模型需求。在建立脂肪冷损伤稳定动物模型的基础上,发现局部炎症反应与脂肪损伤之间有一定的关联性。低温干预大鼠腹股沟皮下脂肪后,脂肪冷损伤过程遵循炎症-纤维化-愈合的创伤愈合规 律[10-13]。正常脂肪组织中相关炎症因子NF-κB-p65及TGF-β1的表达量较低;不同低温干预大鼠腹股沟皮下脂肪组织时,NF-κB-p65的表达量均有不同程度增加,在低温干预第2周时表达最明显,且与室温对照组相比差异有统计学意义;而TGF-β1则干预4周后TGF-β1表达量明显增加,与Control组相比差异有统计学意义;这与以往研究一致[3,14-15]。
本研究免疫组化结果表明低温干预2周后,大鼠腹股沟皮下脂肪组织的炎症因子NF-κB-p65表达明显增高,大鼠脂肪组织炎症反应明显,在低温干预4周后纤维化指标因子TGF-β1表达明显升高,表明脂肪组织冷冻损伤修复具有纤维化直至伤口愈合的脂肪冷损伤规律特点,符合组织损伤愈合的标准,验证了模型的可靠性。
综上,在温度为-60 ℃,干预60 s条件下,可建立稳定的SD大鼠皮下脂肪微创冷冻减脂动物模型。
