基于sFlt-1/PlGF构建预测双胎妊娠子痫前期发生的风险模型*
2022-10-08沈婕沈树娜邓森灵林元李炼廖薇薇
沈婕,沈树娜,邓森灵,林元,李炼,廖薇薇
(海南西部中心医院妇产科,海南儋州 572700)
子痫前期是一种常见的妊娠期并发症,发病率为5%~8%,严重影响母婴结局[1]。随着辅助生殖技术的日益成熟及国家生殖政策的调整,作为高危妊娠范畴之一的双胎妊娠发生率明显升高,较单胎妊娠相比,其母婴不良预后明显增加,且发生子痫前期的风险提高2~3 倍[2]。目前对单胎妊娠子痫前期的预测及预防研究较多,尚缺乏双胎妊娠的研究。在预测子痫前期发生时,临床综合评估、血流动力学及血清学标志物检测较受关注,但有研究发现单独采用临床综合评估预测子痫前期的效果并不理想。血清可溶性血管内皮生长因子受体1(soluble fms-like tyrosine kinase 1, sFlt-1)/胎盘生长因子(placental growth factor, PlGF)表达水平是评价胎盘血管功能及损伤的重要指标,有研究认为子痫前期属胎盘源性疾病,推测该指标在子痫前期发生、发展中具有重要作用[3]。本课题采用酶联免疫吸附试验检测双胎妊娠孕妇血清sFlt-1/PlGF,同时收集其相关临床资料及血流动力学检查结果,构建风险模型,为双胎妊娠子痫前期的预测、预防提供理论依据,从而改善母婴预后。
1 资料与方法
1.1 研究对象
选取2018年12月—2021年6月在海南西部中心医院和儋州市人民医院就诊的双胎妊娠孕妇216 例,随访至分娩或人为终止妊娠,根据是否发生子痫前期将其分为正常组(170 例)、子痫前期组(46 例),根据子痫前期发生时间将子痫前期组分为早发型子痫前期组(21 例)、晚发型子痫前期组(25 例)。本研究经医院医学伦理委员会批准,孕妇及家属均对研究内容知情同意,并签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准①双胎妊娠;②年龄18~45 岁;③精神正常,可正常沟通。
1.2.2 排除标准①死胎,胎儿畸形;②心脏病、肝病等严重内科病史;③确诊子痫前期前使用降压药物史;④合并其他妊娠期疾病;⑤各种原因失访的孕妇。
1.3 方法
1.3.1 子痫前期的诊断符合《妇产科学》[4]子痫前期诊断标准,妊娠20 周后首次出现收缩压≥140 mmHg 或舒张压≥90 mmHg,尿蛋白≥0.3 g/24 h;发生于妊娠<34 周者为早发型,妊娠≥34 周者为晚发型。
1.3.2 酶联免疫吸附试验检测血清sFlt-1/PlGF在受试者妊娠12~14 周、20~24 周、28~32 周空腹抽取静脉血,采用酶联免疫吸附试验检测血清sFlt-1/PlGF,按照试剂盒说明书进行操作,用酶标仪测定570 nm 波长处吸光度值,绘制标准曲线。
1.3.3 临床资料收集收集受试者临床资料,包括年龄、伴侣年龄、孕前BMI、受孕方式、孕产次、绒毛膜性、高血压、糖尿病、高脂血症、高磷血症、肾病、子痫前期病史、高血压家族史、自然流产史、血流动力学指标[平均动脉压(mean arterial pressure,MAP)、子宫动脉搏动指数(pulsatility index, PI)、阻力指数(resistance index, RI)、收缩期与舒张期血流速度比值(systolic/diastolic ratio,S/D)]。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析,进一步两两比较用LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating curve,ROC)曲线。影响因素的分析采用逐步多因素Cox风险比例回归模型,双侧检验水准α=0.05。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组孕妇不同妊娠时期血清sFlt-1/PlGF 的变化
正常组、早发型子痫前期组、晚发型子痫前期组孕妇12~14 周、20~24 周、28~32 周血清sFlt-1/PlGF 比较,采用重复测量设计的方差分析,结果:①不同时间点血清sFlt-1/PlGF 有差异(F=385.642,P=0.000);②3 组孕妇血清sFlt-1/PlGF 有差异(F=267.241,P=0.000),早发型子痫前期组血清sFlt-1/PlGF 较高;③3 组孕妇血清sFlt-1/PlGF 变化趋势有差异(F=342.524,P=0.000)。见表1。
表1 3组孕妇不同妊娠时期血清sFlt-1/PlGF比较 (±s)

表1 3组孕妇不同妊娠时期血清sFlt-1/PlGF比较 (±s)
注:①与正常组比较,P <0.05;②与早发型子痫前期组比较,P <0.05。
组别正常组早发型子痫前期组晚发型子痫前期组28~32周11.02±2.10 52.45±7.15①39.97±5.10①②n 170 21 25 12~14周42.16±8.19 43.07±8.22①42.51±9.10①②20~24周17.42±2.18 36.85±4.91①25.14±3.96①②
2.2 正常组、子痫前期组临床资料及sFlt-1/PlGF 比较
两组孕妇年龄、伴侣年龄、受孕方式、孕产次、绒毛膜性、糖尿病、高脂血症、高磷血症、肾病、子痫前期病史、高血压家族史、自然流产史、RI、S/D 及12~14 周血清sFlt-1/PlGF 比较,差异无统计学意义(P>0.05)。两组孕前BMI、高血压、MAP、PI 及20~24 周、28~32 周血清sFlt-1/PlGF 比较,差异有统计学意义(P<0.05),子痫前期组孕前BMI、高血压、MAP、PI 及20~24 周、28~32 周血清sFlt-1/PlGF 升高。见表2。

表2 两组临床资料及sFlt-1/PlGF比较
2.3 双胎妊娠孕妇发生子痫前期的危险因素分析
对正常组、子痫前期组的可能影响因素进行赋值,以子痫前期(无=0,有=1)为因变量,以其他因素为自变量,行逐步多因素Cox 风险比例回归模型分析,结果显示,高血压[H^R=2.963(95% CI:1.854,2.939)]、孕前BMI [ H^R=3.662(95% CI:2.104,5.220)]、MAP [H^R=3.515(95% CI:1.523,5.507)]、PI[H^R=2.683(95% CI:1.359,4.007)]、20~24 周血清sFlt-1/PlGF[H^R=4.674(95% CI:2.379,6.969)]、28~32 周血清sFlt-1/PlGF 高[H^R=3.706(95% CI:1.654,5.758)]是双胎妊娠孕妇发生子痫前期的危险因素(P<0.05)。见表3、4。
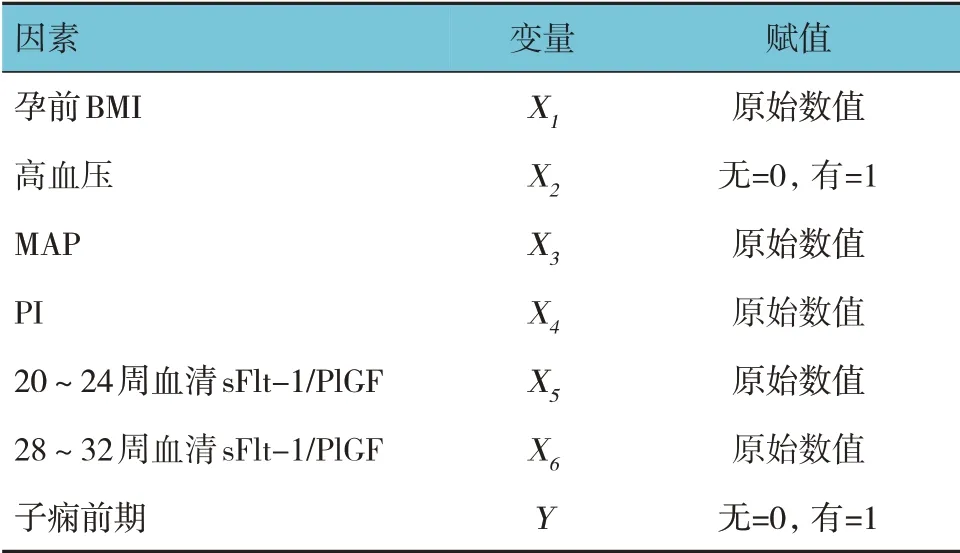
表3 赋值表
2.4 双胎妊娠孕妇发生子痫前期的预测模型
根据逐步多因素Cox 风险比例回归模型结果,拟合双胎妊娠孕妇发生子痫前期的指数方程为PI=0.412X1+ 0.579X2+ 0.485X3+ 0.418X4+ 0.167X5+0.879X6(X1:孕前BMI;X2:MAP;X3:PI;X4:20~24 周血清sFlt-1/PlGF;X5:28~32 周血清sFlt-1/PlGF;X6:高血压)。PI 值越大,发生子痫前期的风险越高。将各单独危险指数作为检验变量,将本组孕妇是否发生子痫前期作为状态变量,绘制ROC 曲线,结果显示AUC 为0.861(95% CI:0.752,0.970),敏感性为92.2%(95% CI:0.887,0.957),特异性为86.3%(95%CI:0.785,0.941),约登指数为0.785。见图1。
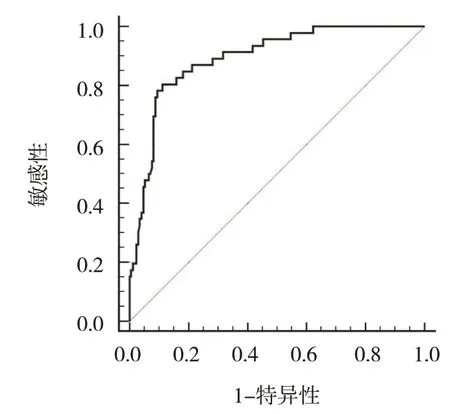
图1 双胎妊娠孕妇发生子痫前期预测模型的ROC曲线
2.5 校准度评价
图中虚线为参考线,实线为拟合曲线,可理解为子痫前期发生率。当子痫前期发生率在26%、29%、60%、72%、82%和90%时,模型的预测值与观察值基本一致。整体上看本模型构建的准确度较好。见图2。

图2 双胎妊娠孕妇发生子痫前期的逐步多因素Cox风险比例回归模型校准曲线
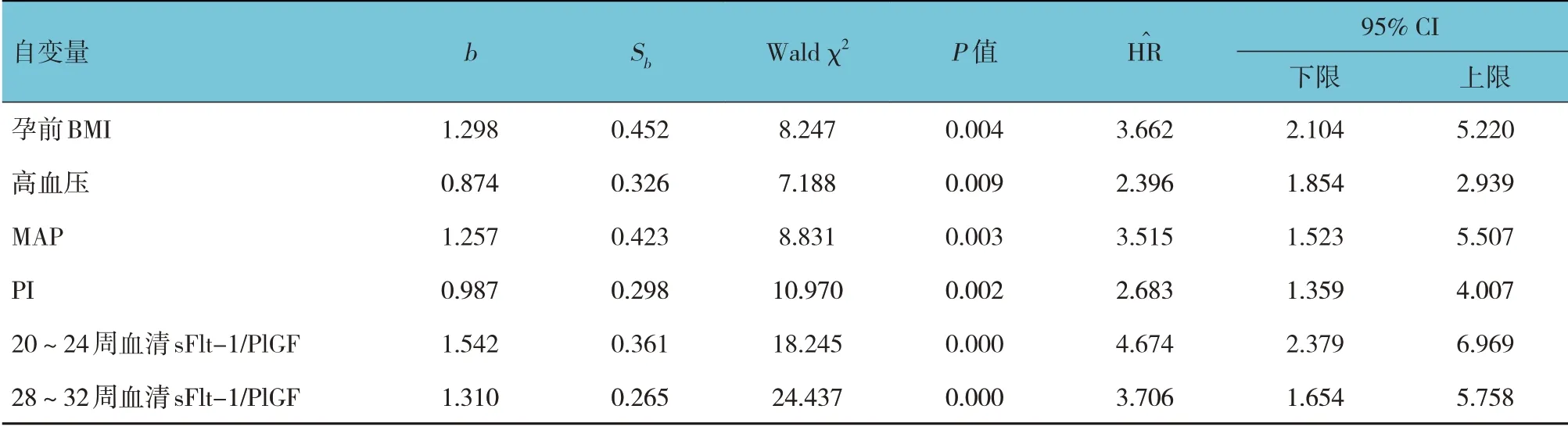
表4 双胎妊娠孕妇发生子痫前期危险因素的逐步多因素Cox风险比例回归模型分析参数
3 讨论
子痫前期以妊娠中后期血压升高、蛋白尿、胎盘功能异常及胎儿宫内生长受限等为主要临床症状,是导致母婴死亡的主因之一。因此,有效预测子痫前期的发生,采取干预措施,延长妊娠孕周,对改善母婴预后具有重大意义。目前子痫前期的发病机制尚处于探索阶段,有研究指出,其发生与妊娠早期子宫胎盘动脉发生缺氧缺血有关,滋养细胞浸润子宫螺旋动脉的能力降低,细胞发生凋亡、坏死及合体化现象,释放大量毒性因子,进入母体中损伤血管内皮细胞,最终发展为子痫前期[5-6]。
本研究结果显示,早发型子痫前期组及晚发型子痫前期组20~24、28~32 周血清sFlt-1/PlGF高于正常组,且早发型子痫前期组各时间段均高于晚发型子痫前期组。逐步多因素Cox 风险比例回归模型分析结果显示,高血压,孕前BMI、MAP、PI、20~24周血清sFlt-1/PlGF、28~32周血清sFlt-1/PlGF 高是双胎妊娠孕妇发生子痫前期的危险因素。分析其原因为:①孕前BMI 高提示孕妇肥胖,肥胖将导致胰岛素抵抗、糖耐量或糖脂代谢异常,导致滋养层细胞障碍及胎盘缺血,缺氧缺血类胎盘因子释放量增加,内皮对胎盘因子的敏感性增强。国外多因素Logistic 回归分析结果表明,孕前BMI高的孕妇子痫前期发生风险比BMI 正常的孕妇高1.6 倍[7]。②在内科基础性疾病,如高血压的基础上,胎盘发生病理及生理改变,导致全身血管内皮损伤及小动脉痉挛,引发子痫前期[8]。③子痫前期的发生导致子宫动脉末梢小血管损伤,引发子宫血管痉挛及绒毛退行性病变,胎盘功能降低,血流动力学指标发生变化。MAP 主要反映心脏功能及外周大动脉阻力情况。在子痫前期发病初期,血管可能已经发生病理性改变,为适应胎盘组织缺氧状态血压升高,且与子痫前期病变程度呈正相关[9]。有研究表明,MAP 预测子痫前期发生的AUC 为0.755,但在预测重度与轻度、早发型与晚发型时AUC 分别为0.547 和0.558,但整体效能明显优于单独采用收缩压或舒张压预测[10]。④PI 升高表明血管阻力发生异常变化,而血管阻力是敏感性最高的血流动力学指标,子痫前期时胎盘水肿,滋养细胞侵蚀不全,螺旋血管重铸障碍,子宫动脉管腔狭窄,子宫动脉末梢阻力增强[11-12]。⑤PlGF主要表达于胎盘组织中,可在血液中检出,其通过影响胎盘的血管形成和滋养细胞生长,调节胎盘形成。当滋养细胞血氧不足时,PlGF 水平将明显下降,影响胎盘的发育和生理功能,引起子痫前期。KWIATKOWSKI 等[13]研究表明,PlGF 下降与子痫前期相关,在亚洲人群中,PlGF 的中位数总体较欧洲人群低11%。sFlt-1 是VEGF、PlGF 高亲和性和特异性的络氨酸酶受体,可与两者结合传递信号,影响新生血管正常生长、重塑、再植,以及促绒毛细胞增殖、侵袭和迁移。特异性受体sFlt-1 与PlGF 结合产生抵抗作用,导致滋养细胞对子宫内膜的侵袭不足,螺旋小动脉重铸障碍,加速血管内皮损伤,破坏血管壁完整性及通透性,胎盘灌注量减少,导致子痫前期发生、发展。有动物实验证明,抗sFLT1 是阻滞子痫前期进展的候选药物之一,通常与胎儿生长受限相关,若给予sFlt-1 将导致胎盘血管痉挛,发生螺旋化及重塑化,子痫前期发生风险升高[14]。另有研究指出,sFlt-1/PlGF 比值升高,子痫前期的发生概率将增加到78%[15]。妊娠中晚期sFlt-1/PlGF 值还可预测子痫前期和胎儿不良结局。JEON 等[16]根据疑似子痫前期单胎孕妇的sFlt-1/PlGF 比值将其分为低风险组(<38)、中风险组(38~<85)和高风险组(>85),结果显示高风险组妊娠周数更短,平均体重更轻,重症监护病房住院时间也更长,提示sFlt-1/PlGF 比值可作为预测子痫前期不良妊娠结局的有效指标。此外,在关于子痫前期严重程度与sFlt-1/PlGF 比值的关系研究中,赵晟隆等[17]发现子痫前期孕妇Flt-1/PLGF 比值显著高于正常对照孕妇,且与发病时间呈负相关,可作为监测子痫前期严重程度的新型血清标志物。
本研究根据多因素分析结果建立双胎妊娠孕妇发生子痫前期的指数方程模型,结果显示AUC为0.861,提示基于危险因素建立预测子痫前期的指数方程有利于提高预测准确性,可为预测子痫前期发生提供依据,从而为临床制订针对性的预防与治疗方案提供参考。
