系统性红斑狼疮外周血T淋巴细胞PD-1和Tim-3表达和意义①
2022-10-07黄自坤李俊明南昌大学第一附属医院检验科南昌330006
罗 清 黄自坤 李 雪 李俊明(南昌大学第一附属医院检验科,南昌 330006)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多因素自身免疫病,严重危害人类健康,其特征为出现多种自身抗体(anti-dsDNA、anti-Sm、anti-nucleosome等),补体活化和免疫复合物沉积造成多个组织器官损伤,进而出现多样化的临床症状[1]。临床研究证实,虽然目前出现新型的生物制剂和更有效的SLE治疗策略,但其缓解率仍不高,造成这种状况的原因之一是SLE病因及发病机制尚未完全被解析。研究表明,T淋巴细胞在多个方面参与SLE发病过程[2-4]。
近年来,共刺激分子在SLE免疫应答中的作用受到研究者极大关注,尤其是PD-1(programmed death 1)和Tim-3(T cell Ig and mucin domaincontaining molecule 3)。一方面有证据显示,SLE患者免疫细胞上异常表达的PD-1可参与疾病的发生发展[5-7];另一方面研究表明,异常表达的Tim-3参与SLE致病[8-9]。近期,有研究者提出,肿瘤浸润T淋巴细胞上共表达PD-1与Tim-3的百分比与肿瘤的侵袭表型和肿瘤大小有关[10]。此外,有研究显示,PD-1和Tim-3中位数以上的共表达可增加复发风险,且36个月的总生存率较差[10]。目前,对于SLE患者T淋巴细胞表面上PD-1+Tim-3+、PD-1-Tim-3+、PD-1+Tim-3-的表达情况,以及PD-1+Tim-3+、PD-1-Tim-3+、PD-1+Tim-3-表达与临床指标的相关性尚不清楚。本研究通过检测SLE患者和健康对照者外周血T淋巴细胞表面PD-1和Tim-3的共表达(包括平均荧光强度和百分比),分析其与自身抗体、实验室指标、临床表现、治疗的关系,探讨PD-1+Tim-3+、PD-1-Tim-3+、PD-1+Tim-3-T淋巴细胞在SLE中的作用。
1 资料与方法
1.1 资料
1.1.1 一般资料41例SLE患者来自于南昌大学第一附属医院风湿免疫科2017年6月至2017年12月就诊的患者,其中男3例,女38例,平均年龄(40.0±15.6)岁,临床诊断符合美国风湿病学会(ARA)1997年修订的分类标准,并排除糖尿病、心脑血管疾病、血栓性疾病等其他严重疾病患者。健康对照组33例,均为健康志愿者,排除其他自身免疫性疾病和炎症,男2例,女31例,平均年龄(41.0±9.8)岁。SLE疾病组与健康对照组(HC)年龄、性别差异无统计学意义。详细收集SLE患者临床资料及相关实验室检查数据,并计算其SLE疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)。本实验经南昌大学第一附属医院伦理委员会批准。
1.1.2 试剂和仪器流式细胞抗体异硫氰酸荧光素标记的PD-1抗体(fluorescein isothiocyanate-PD-1,FITC-PD-1)和藻红蛋白标记的Tim-3抗体(phycoerythrin-Tim-3,PE-Tim-3)购自美国eBioscience公司;藻红蛋白-得克萨斯红标记的CD3抗体(phycoerythrintexas red,ECD-CD3)及相应的同型对照PEIgGl、FITC-IgGl和ECD-IgGl均购自美国Beckman-Coulter公司;Cytomics FC 500流式细胞仪购自美国Beckman Coulter公司;分析软件为仪器自带的CXP分析系统。
1.2 方法
1.2.1 SLE治疗41例SLE患者中6例治疗前抽取空腹EDTA抗凝静脉血用于流式细胞术检测。SLE患者根据病情严重程度选取治疗方案:①病情轻度活动(SLEDAI<9分)者用泼尼松或糖皮质激素+羟氯喹/甲氨蝶呤/来氟米特治疗;②病情中度活动(SLEDAI 10~14分)者用糖皮质激素+环磷酰胺/霉酚酸酯治疗;③病情重度活动(SLEDAI≥15分)者先用糖皮质激素冲击加环磷酰胺,再按病情中度活动治疗方案治疗。入选的6例SLE患者至少治疗1周后抽取患者空腹EDTA抗凝静脉血用于流式细胞检测。
1.2.2 外周血单个核细胞(peripheral blood mononuclear cells,PBMC)提取采集SLE患者和健康对照者2 ml清晨空腹EDTA抗凝外周血,6 h内送检。采用密度梯度离心法分离获取PBMC,把分离获取的PBMC用生理盐水洗涤后重悬备用。
1.2.3 流式细胞术检测人外周血CD3+T淋巴细胞PD-1和Tim-3表达各取100µl重悬的PBMC加入2支试管,分别加入3种单克隆抗体FITC-PD-1、ECD-CD3、PE-Tim-3和相应的同型对照各10µl,4℃避光孵育30 min,加入1 ml生理盐水,室温1 500 r/min离心5 min,弃上清,生理盐水洗涤1次,用500µl生理盐水重悬上机检测;Cytomics FC 500流式细胞仪进行分析,CXP分析软件检测CD3+T淋巴细胞PD-1和Tim-3表达水平。
1.3 统计学处理分析运用SPSS17.0软件对数据进行描述和分析。首先进行正态性检验,符合正态分布数据,两组间比较采用t检验,否则采用非参数检验。两变量相关性采用Spearman相关分析。SLE患者治疗前后以配对t检验分析组间差异,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 SLE患者组和健康对照组外周血T淋巴细胞PD-1和Tim-3表达水平比较采用流式细胞术分别检测T淋巴细胞(CD3+)PD-1和Tim-3的表达水平,结果如图1所示,SLE患者组PD-1+T淋巴细胞百分比显著高于健康对照组,分别为(33.77±17.59)%和(22.76±12.87)%,差异有统计学意义(t=3.0,P=0.004);SLE患者组T淋巴细胞PD-1表达的平均荧光强度(mean fluorescence intensity,MFI)显著高于健康对照组,分别为3.19±2.02和1.71±0.34,差异有统计学意义(U=110.5,P<0.001);SLE患者组Tim-3+T淋巴细胞百分比显著高于健康对照组,分别为(8.03±12.41)%和(2.21±3.22)%,差异有统计学意义(U=325.5,P<0.001);SLE患者组和健康对照组的T淋巴细胞Tim-3表达的MFI分别为3.22±2.43和2.86±1.69,差异无统计学意义(U=557.5,P=0.198)。
2.2 SLE患者组和健康对照组外周血PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及其PD-1、Tim-3表达MFI比较根据T淋巴细胞上PD-1和Tim-3表达可将其分为3群,分别为PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞。如图2所示,SLE患者组PD-1+Tim-3-T淋巴细胞百分比显著高于健康对照组,分别为(31.80±16.02)%和(21.97±12.26)%,差异有统计学意义(t=2.9,P=0.005);SLE患者组PD-1+Tim-3+T淋巴细胞百分比显著高于健康对照组,分别为(4.00±6.26)%和(0.62±1.05)%,差异具有统计学意义(U=247.0,P<0.001);SLE患者组PD-1-Tim-3+T淋巴细胞百分比显著高于健康对照组,分别为(4.18±7.34)%和(1.55±2.49)%,差异具有统计学意义(U=403.5,P=0.003)。进一步分析这3群细胞PD-1和Tim-3表达的MFI,发现SLE患者组PD-1+Tim-3-T淋巴细胞PD-1表达的MFI显著高于健康对照组,分别为3.06±1.93和1.68±0.31,差异有统计学意义(t=2.9,P<0.001);而PD-1+Tim-3+T淋巴细胞PD-1、Tim-3表达的MFI和PD-1-Tim-3+T淋巴细胞PD-1表达的MFI差异无统计学意义(P>0.05)。
2.3 SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI与自身抗体的关系SLE患者血清中可出现anti-dsDNA、anti-Sm、anti-nucleosome、anti-SSA、anti-Ro52、anti-RIB-P等自身抗体,分析SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及其PD-1、Tim-3表达MFI与SLE患者自身抗体的关系表明:如图3所示,anti-nucleosome阳性的SLE患者PD-1+Tim-3-T淋巴细胞PD-1表达MFI明显高于阴性者,分别为4.41±3.01和2.51±0.67,差异有统计学意义(U=72.0,P=0.005);anti-Ro52阳性的SLE患者PD-1-Tim-3+T淋巴细胞百分比明显高于阴性者,分别为(5.85±9.31)%和(1.99±1.98)%,差异有统计学意义(U=121.5,P=0.044);而未见以上指标与其他自身抗体存在关系。
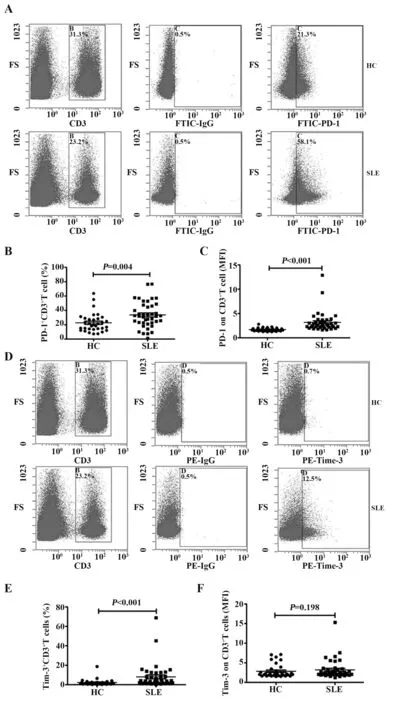
图1 SLE患者和健康对照组外周血T淋巴细胞PD-1和Tim-3表达Fig.1 Expressions of PD-1 and Tim-3 on peripheral T lymphocyte from SLE patients and HC
2.4 SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI相关性分析将能反映SLE疾病严重程度和活动性的相关指标(SLEDAI、ESR、CRP、IgG、C3、C4、WBC、RBC、RDW、HGB、HCT、PLT、MPV、PCT、PDW、L、L%、M、M%、N、N%、NLR、PLR、LMR等)与SLE患者PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI进行相关性分析,如图4所示,PD-1+Tim-3+T淋巴细胞百分比与L呈负相关(rs=-0.404,P=0.009);PD-1+Tim-3-T淋巴细胞PD-1表达MFI与WBC(rs=-0.399,P=0.010)、RBC(rs=-0.615,P<0.001)、HGB(rs=-0.571,P<0.001)、HCT(rs=-0.602,P<0.001)、L(rs=-0.403,P=0.009)、N(rs=-0.348,P=0.026)、C3(rs=-0.400,P=0.011)、C4(rs=-0.324,P=0.041)呈负相关,与PLR(rs=0.369,P=0.018)、RDW(rs=0.318,P=0.043)呈正相关。而未发现PD-1+Tim-3-、PD-1-Tim-3+T淋巴细胞百分比与以上指标相关。

图2 SLE患者和健康对照组外周血PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及其PD-1、Tim-3表达MFI水平Fig.2 Percentage of PD-1+Tim-3-,PD-1+Tim-3+,PD-1-Tim-3+T lymphocyte and MFI of PD-1,Tim-3 on these cells from SLE patients and HC

图3 PD-1+Tim-3-T淋巴细胞PD-1表达MFI与自身抗体的关系Fig.3 Correlation of MFI of PD-1 on PD-1+Tim-3-T lymphocyte in SLE patients with autoantibody
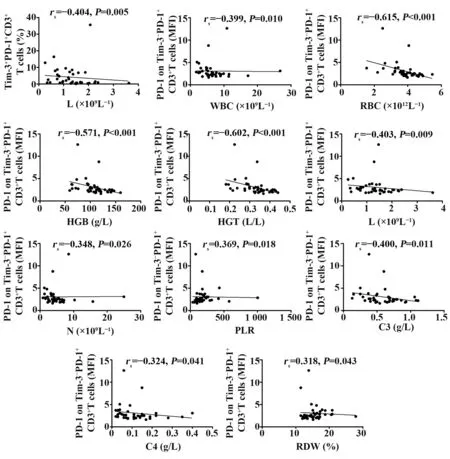
图4 PD-1+Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI与SLE患者实验室指标的关系Fig.4 Correlation of percentage of PD-1+Tim-3+T lymphocyte,MFI of PD-1 on PD-1+Tim-3-T lymphocyte in SLE patients with laboratory index
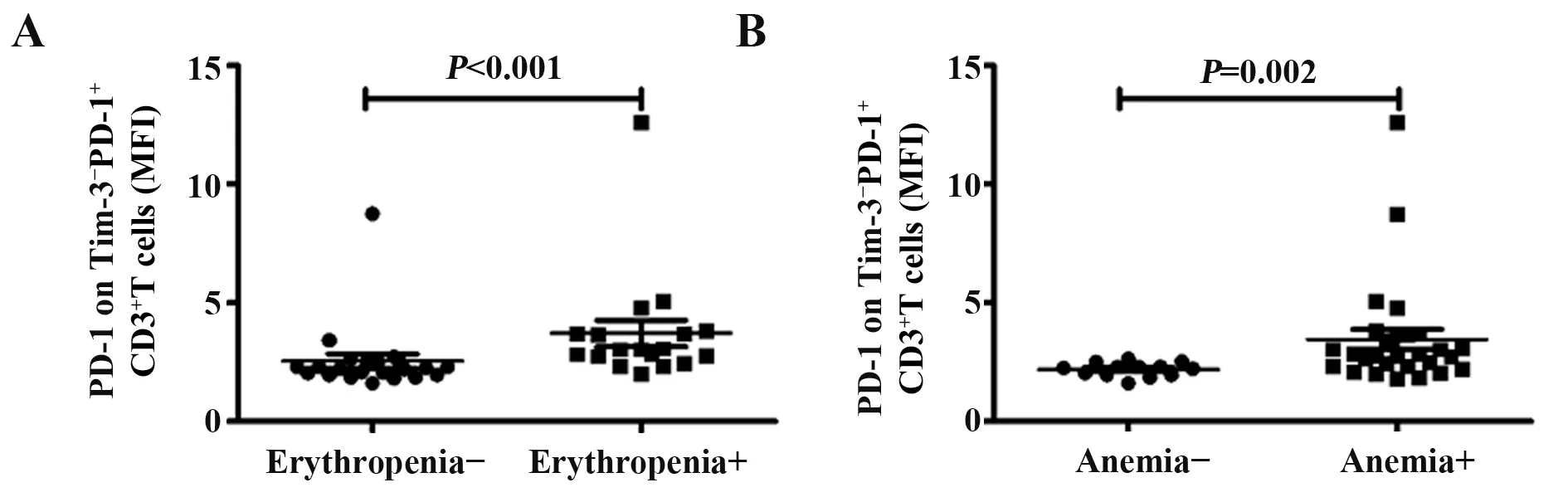
图5 PD-1+Tim-3-T淋巴细胞PD-1表达MFI与SLE患者临床表现的关系Fig.5 Correlation of MFI of PD-1 on PD-1+Tim-3-T lymphocyte in SLE patients with clinical features
2.5 SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI与临床表现的关系分析SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI与临床表现的关系发现,如图5所示,低红细胞血症组SLE患者PD-1+Tim-3-T淋巴细胞PD-1表达MFI明显高于阴性者(U=61.0,P<0.001);贫血组SLE患者PD-1+Tim-3-T淋巴细胞PD-1表达MFI明显高于阴性者(U=68.0,P=0.002)。并未发现PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比与临床表现相关。
2.6 SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达MFI与治疗的关系6例SLE患者根据正规治疗至少1周后,比较治疗前后SLE患者组PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比及其PD-1、Tim-3表达MFI水平,如图6所示,治疗后SLE患者PD-1+Tim-3-T淋巴细胞PD-1表达MFI明显低于治疗前,差异具有统计学差异(U=68.0,P=0.031),而未见其他指标与治疗存在关系。
3 讨论
SLE是一种病因与发病机制不明的自身免疫性疾病。PD-1和Tim-3是近年来受广大研究者关注的两种新型负性共刺激分子,已有研究表明PD-1、Tim-3均在SLE发生发展中发挥重要作用,但对于PD-1和Tim-3共表达在SLE中的作用却鲜有报道。本研究同时对SLE患者和健康对照者外周血T淋巴细胞表面PD-1和Tim-3表达进行检测,结果发现纳入分析的两组研究对象外周血T淋巴细胞表面总PD-1和Tim-3的表达水平均不相同,SLE组患者T淋巴细胞PD-1(百分比和MFI)和Tim-3(百分比)表达水平显著高于健康对照组;SLE组患者PD-1+Tim-3-、PD-1+Tim-3+、PD-1-Tim-3+T淋巴细胞百分比以及PD-1+Tim-3-T淋巴细胞PD-1表达的MFI显著高于健康对照组,且SLE组患者PD-1+Tim-3-T淋巴细胞PD-1表达的MFI水平与抗体含量呈正相关,提示PD-1+Tim-3-T淋巴细胞PD-1表达的MFI水平越高,患者体内的自身抗体越多,SLE病情越活跃。进一步研究发现,SLE患者外周血PD-1+Tim-3-T淋巴细胞PD-1表达的MFI水平与WBC、RBC、HGB、HCT、L、N、C3、C4呈负相关,与PLR、RDW呈正相关,且与SLE患者的临床表现和治疗相关。
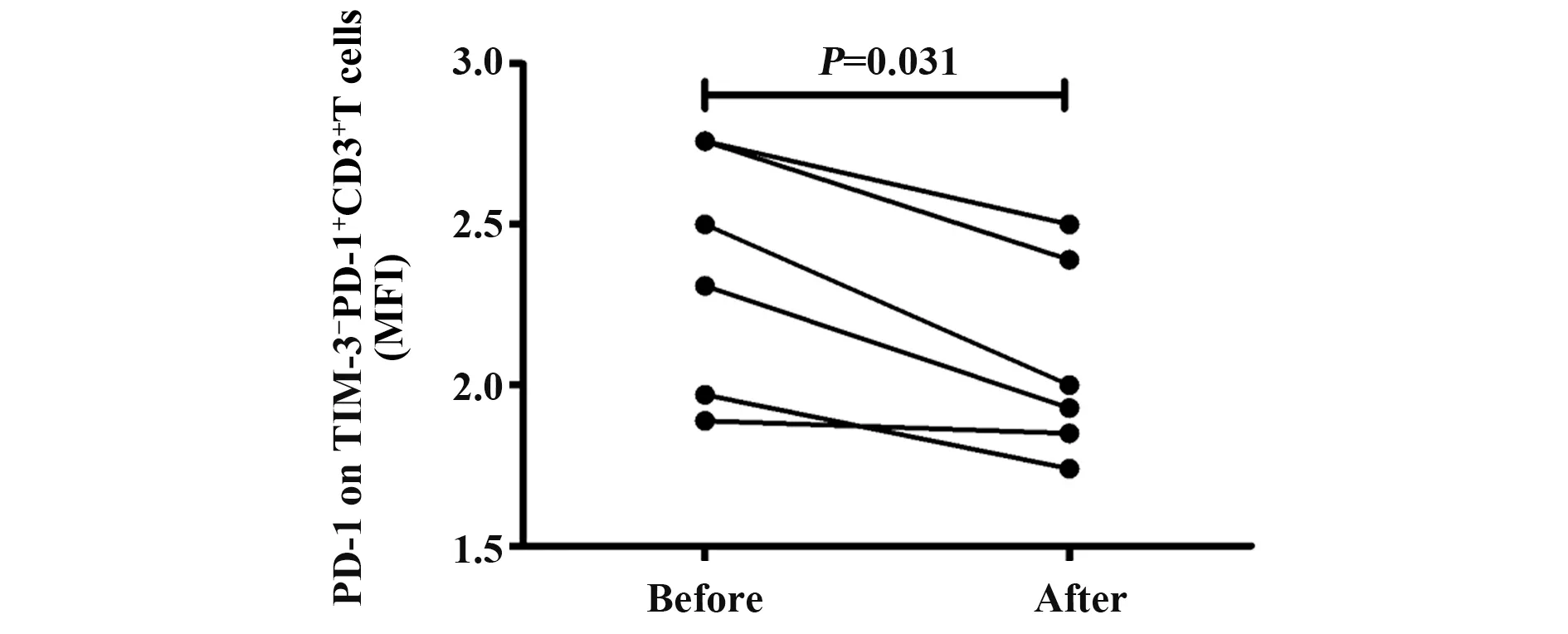
图6 PD-1+Tim-3-T淋巴 细胞PD-1表达MFI与SLE患者治疗的关系Fig.6 Correlation of MFI of PD-1 on PD-1+Tim-3-T lymphocyte in SLE patients with treatment
Tim-3是细胞免疫应答的关键细胞因子,表达于多种免疫细胞表面。已有研究表明SLE患者外周血淋巴细胞Tim-3表达明显升高,且与疾病严重程度及INF-γ表达相关[11-12]。亦有研究表明SLE患者血清和单个核细胞Tim-3表达明显降低,且与疾病严重程度呈负相关[13-14]。以上研究表明,虽然Tim-3参与SLE致病,但其功能涉及的机制并不一致。而本研究表明SLE患者外周血淋巴细胞总Tim-3+、PD-1-Tim-3+、PD-1+Tim-3+T淋巴细胞百分比明显升高,但Tim-3表达的MFI在疾病组与健康对照组间并未存在差异。已有研究证实Tim-3阳性的CD4/CD8/CD14等免疫细胞百分比在SLE中存在差异,但并未显示Tim-3表达的MFI情况,有可能是Tim-3表达的MFI差异无统计学意义,与本文研究结论一致[8-9,11];但也有可能是研究者并未分析CD4/CD8/CD14等免疫细胞MFI是否存在差异,而本文仅研究总CD3+T细胞上的Tim-3表达情况,因此有必要进一步探讨各T细胞亚群中Tim-3表达MFI。此外,本研究并未发现总Tim-3+、PD-1-Tim-3+、PD-1+Tim-3+T淋巴细胞百分比与SLE患者的疾病严重程度存在明显相关性。因此,Tim-3在SLE中的具体机制还需进一步研究。
PD-1作为一种负性共刺激分子,可向免疫细胞传导负性信号,抑制T细胞增殖和细胞因子分泌参与SLE致病[15];也可作为辅助性T细胞上的功能分子促进B细胞、浆细胞活化增殖以及致病性自身抗体的产生,从而参与SLE致病[16]。本研究综合分析SLE患者外周血T淋巴细胞PD-1和Tim-3共表达情况发现总PD-1+、PD-1+Tim-3-、PD-1+Tim-3+T淋巴细胞百分比及PD-1+Tim-3-T淋巴细胞PD-1表达的MFI明显升高,且升高的PD-1+Tim-3-T淋巴细胞PD-1表达MFI与自身抗体、疾病严重程度、临床表现以及治疗呈正相关,表明T细胞上高表达的PD-1并非以负性共刺激分子发挥抑制作用,而是以其他方式参与SLE发病。
近期,有研究表明共表达共刺激分子PD-1和Tim-3的肿瘤浸润T淋巴细胞与肿瘤发生发展及预后相关[10,17-18]。本研究首次探讨SLE患者外周血T淋巴细胞PD-1和Tim-3的共表达情况,结果发现PD-1+Tim-3+T淋巴细胞百分比明显高于健康对照组,且升高PD-1+Tim-3+T淋巴细胞百分比与L呈负相关,表明PD-1和Tim-3的共表达可能与淋巴细胞的耗竭有关,但具体作用机制还需进一步探索。
