Notch/Hes1-PI3K/AKT/mTORC1信号轴调控银屑病样皮炎小鼠白细胞介素17A表达的研究①
2022-10-07李新新王燕芹邢潇匀滨州医学院附属医院皮肤科滨州256603
李新新 王燕芹 邢潇匀 马 蕾(滨州医学院附属医院皮肤科,滨州 256603)
IL-17A导致的免疫紊乱和炎症效应是银屑病的重要致病因素,辅助性T细胞17(Th17)是其主要来源细胞[1-2]。Notch信号通路在T淋巴细胞分化中起关键作用,在小鼠和人促Th17分化的细胞因子环境中均有Notch信号通路的活化[3]。课题组前期研究亦表明,Notch/发状分裂相关增强子1(hairy and enhancer of split 1,Hes1)信号通路能够调控银屑病患者及银屑病样皮炎小鼠Th17的分化和功能[4-5]。磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(also known as PKB,protein kinase B,AKT)/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路在银屑病发展过程中发挥重要作用,且该信号通路能够正向调控Th17的分化[6-8]。第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphate and tension homology deleted on chromosome ten,PTEN)是PI3K/AKT/mTOR信号通路上游的负向调控因子,急性T淋巴细胞白血病研究显示,Notch信号通路靶基因Hes1能够负向调控PTEN[9-10]。本研究以银屑病样皮炎小鼠为研究对象,利用γ分泌酶抑制剂DAPT阻断Notch信号通路,以探讨Notch/Hes1-PI3K/AKT/mTOR复合物1(mechanistic target of rapamycin complex 1,mTORC1)信号轴对IL-17A表达和分泌的影响。
1 材料与方法
1.1 材料
1.1.1 小鼠来源及饲养24只雄性健康无特定病原(SPF)级BALB/c小鼠(济南朋悦实验动物繁育有限公司,动物合格证号:1107261911003852),6周龄,体质量(18±2)g,饲养于滨州医学院附属医院SPF动物房,动物实验许可证号:SYXK(鲁)20180022,室温(23±1)℃,照度15~20 Lux,光照时间为每天7:00~19:00,昼夜明暗交替时间12 h/12 h,标准灭菌饲料和高压蒸汽灭菌水饲养,自由取食,实验过程遵循减少、替代、优化的3R原则。
1.1.2 主要试剂与仪器5%咪喹莫特乳膏(英国3M Health Care Limited公司);DAPT(纯度99%,美国Selleck公司);Trizol RNA提取试剂、引物的设计及合成[生工生物工程(上海)股份有限公司];PrimeScriptTMRT试剂盒、TB Green®PreMix Ex TaqTMⅡ试剂盒(日本TaKaRa公司);CFX96 TouchTMReal-Time PCR检测系统(美国Bio-Rad公司);RIPA组织/细胞裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶制备试剂盒(北京索莱宝科技有限公司);兔抗鼠多克隆抗体Hes1、PTEN、磷酸化(p)-AKT丝氨酸473位 点(Ser473)、p-mTOR丝 氨 酸2448位 点(Ser2448)、IL-17A和GAPDH(美国Affinity Biosciences公司);辣根过氧化物酶标记山羊抗兔IgG二抗(美国Jackson ImmunoResearch公司);增强型ECL化学发光试剂盒(上海诺伦生物医药技术有限公司);酶标检测仪(美国Thermo公司)。
1.2 方法
1.2.1 实验分组及处理将24只小鼠按随机数字法分为对照组、模型组和干预组,每组8只。按参考文献[11-12]采用5%咪喹莫特乳膏(62.5 mg/d)外涂小鼠背部制备银屑病样皮炎动物模型,对照组小鼠涂抹等剂量白凡士林;在外涂咪喹莫特乳膏后立即给干预组小鼠腹腔注射DAPT工作液[10 mg/(kg·d),将10 mg DAPT溶解于1 ml二甲基亚砜(DMSO),配制成储存液(10 mg/ml),置于-20℃冰箱储存,用时以玉米油溶解DAPT储存液,配制成工作液(0.2 mg/ml)],对照组及模型组小鼠腹腔注射等剂量玉米油与DMSO混合液[11]。以上处理每天固定时间进行1次,连续6次,末次处理24 h后麻醉并处死小鼠,取皮损组织行实时荧光定量PCR(RT-PCR)和Western blot检测。本研究经滨州医学院附属医院实验动物伦理委员会讨论批准(编号:20190104-15)。
1.2.2 皮肤组织病理学检查剪取背部0.5 cm×0.5 cm的皮肤组织,4%多聚甲醛固定,经石蜡包埋、切片、HE染色后于显微镜下观察。Image-Pro Plus 6.0软件测量表皮厚度。
1.2.3 RT-PCR检测小鼠皮肤组织中Hes1、PTEN、AKT、mTORC1及IL-17A mRNA的 表 达采 用Trizol RNA提取试剂抽提小鼠皮肤组织中总RNA,1.5%琼脂糖凝胶电泳检测RNA完整性,紫外分光光度仪测定其纯度,吸光度比值(A260/A280)在1.8~2.0为合格样本。采用PrimeScriptTMRT试剂盒将RNA逆转录为cDNA。以GAPDH为内参照,采用TB Green®PreMix Ex TaqTMⅡ试 剂 盒 在CFX96 TouchTMReal-Time PCR检测系统上行RT-PCR检测。PCR反应体系共25µl:cDNA模板2µl(<100 ng),0.4µmol/L正、反向引物各1µl,TB Green®Premix Ex TaqTMⅡ(2×)12.5µl,灭菌水8.5µl。引物序列见表1。反应条件:95℃预变性30 min,95℃变性5 s、55℃退火30 s、72℃延伸30 s,40个循环。每个样本设3个复孔。根据2-ΔΔCt公式计算Hes1、PTEN、AKT、mTORC1、IL-17A mRNA的相对表达量,其中ΔCt=目的基因Ct值-内参基因Ct值,ΔΔCt=实验样本ΔCt值-校准样本ΔCt值。
1.2.4 Western blot检测小鼠皮肤组织中Hes1、PTEN、p-AKT、p-mTOR和IL-17A蛋白表达量从液氮中取出冻存的小鼠皮肤标本,用眼科剪将组织剪成细小的碎片并用组织匀浆器匀浆,采用RIPA裂解液于冰上提取皮肤组织蛋白,蛋白浓度均在50~2 000µg/ml范围内。取50µg总蛋白变性后,根据SDS-PAGE凝胶试剂盒恒压电泳,将电泳产物转移至聚偏二氟乙烯膜,于含5%脱脂奶粉的TBST缓冲液中封闭2 h,TBST溶液洗膜3次后滴加一抗,分别为兔抗鼠多克隆抗体Hes1、PTEN、p-AKT、p-mTOR、IL-17A和GAPDH,稀释比例均为1∶500,4℃过夜;TBST缓冲液洗膜4次,每次10 min,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶1 000),室温孵育1 h;TBST洗膜4次,每次10 min。按增强型ECL化学发光试剂盒说明书显色,在自动电泳凝胶成像分析系统下自动成像。实验重复3次。应用Image J软件分析目的蛋白条带的灰度值,以GAPDH为内参,目的蛋白的相对表达量=目的蛋白灰度值/GAPDH灰度值。
1.3 统计学处理采用SPSS19.0软件进行数据分析。应用Shapiro-Wilk检验法进行正态性检验。若Levene检验显示方差齐,数据以±s表示,多组间比较采用单因素方差分析,两两多重比较采用LSD-t法;若方差不齐,数据以中位数M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,两两多重比较采用Dunn-bonferroni检验。P<0.05认为差异有统计学意义。
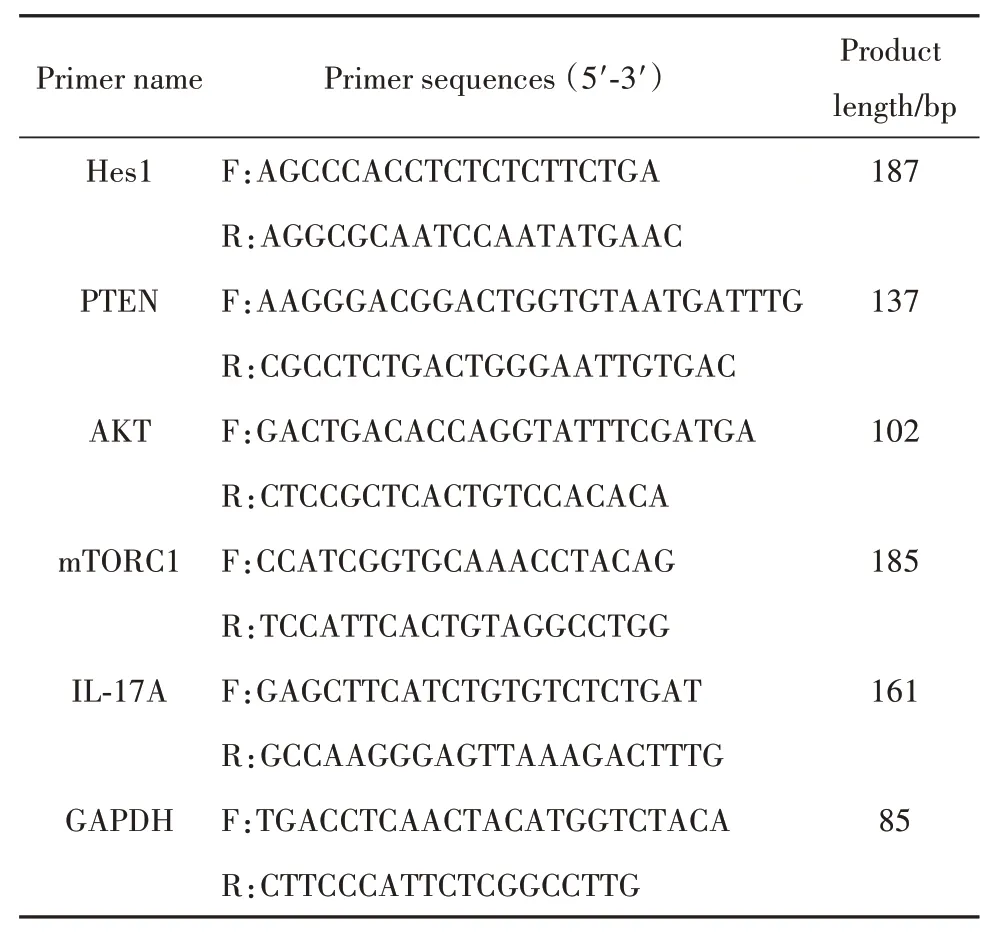
表1 引物序列Tab.1 Primer sequences
2 结果
2.1 皮损形态改变对照组小鼠皮肤始终无红斑、鳞屑及浸润增厚改变;模型组小鼠皮肤出现明显红斑、鳞屑及浸润增厚;干预组小鼠皮肤红斑、鳞屑及浸润增厚现象较模型组明显减轻,见图1。皮损严重程度评分比较见图2,对照组评分始终为0;模型组评分第2天开始持续提高,至第6天达到最高值;干预组前4天评分与模型组变化趋势一致,第5天与第4天评分基本持平,第6天评分有下降趋势,且与模型组相比差异具有统计学意义(P<0.05)。

图l三组实验小鼠背部皮肤表现Fig.1 Skin changes on back of three groups of experimental mice
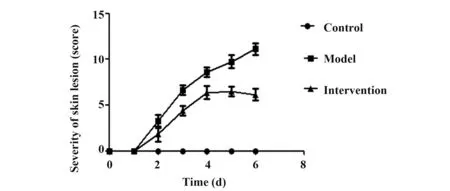
图2 三组实验小鼠背部皮损严重程度评分Fig.2 Severity scores of back lesions in three groups of experimental mice
2.2 组织病理改变对照组小鼠皮肤菲薄,表皮层仅由1~2层细胞构成;模型组小鼠表皮层明显增厚,可见角化过度及角化不全,角化不全中有中性粒细胞聚集,形成Munro微脓肿,表皮突向下延伸,真皮炎症细胞大量浸润,真皮浅层可见血管扩张;干预组小鼠表皮增厚及真皮炎症细胞浸润程度较模型组均明显减轻,见图3。
比较三组实验鼠表皮层厚度,对照组、模型组和干预组分别为(14.37±0.54)µm、(105.72±7.46)µm和(40.57±6.23)µm,差异具有统计学意义(F=560.543,P<0.01);进一步三组间两两比较(模型组比对照组、模型组比干预组、干预组比对照组)差异均有统计学意义(t值分别为32.51、23.19、9.32,P均<0.01)。
2.3 三组小鼠皮肤组织中Hes1、PTEN、mTORC1、AKT及IL-17A mRNA的表达如表2所示,三组小鼠皮肤组织中Hes1、PTEN、AKT、mTORC1及IL-17A mRNA表达差异均有统计学意义(均P<0.01)。模型组PTEN mRNA表达水平显著低于对照组(t=6.67,P<0.001),而Hes1、AKT、mTORC1及IL-17A mRNA表达水平显著高于对照组,t/Z值分别为15.25、5.57、3.39、14.63,P值 分 别 为<0.001、<0.001、0.003、<0.001。经DAPT干预处理后,干预组PTEN mRNA表达水平显著高于模型组,t=6.51,P<0.001,而Hes1、AKT、mTORC1及IL-17A mRNA表达水平均显著低于模型组,t/Z值分别为8.75、4.13、2.65、9.38,P值分别为<0.001、<0.001、0.015、0.024。干预组Hes1、PTEN、AKT、mTORC1及IL-17A mRNA的表达与对照组相比差异均无统计学意义,t/Z值分别为6.50、1.60、1.44、0.75、5.25,P值分别为0.198、0.875、0.165、0.464、0.413。
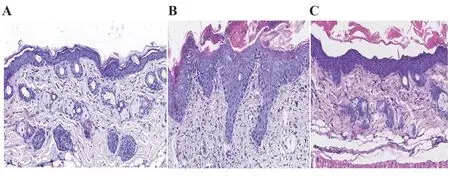
图3 三组实验小鼠皮肤组织病理组织学变化(HE,×200)Fig.3 Histopathological changes of skin tissue in three groups of experimental mice(HE,×200)
2.4 三组小鼠皮肤组织中Hes1、PTEN、p-AKT、p-mTOR及IL-17A蛋白表达如图4、表3所示,三组小鼠皮肤组织中Hes1、PTEN、p-AKT、p-mTOR及IL-17A蛋白表达差异均有统计学意义(均P<0.01)。模型组PTEN蛋白表达显著低于对照组,t=4.45,P=0.031,而Hes1、p-AKT、p-mTOR及IL-17A蛋白表达显著高于对照组,t/Z值分别为10.63、14.25、3.83、3.86,P值 分 别 为0.008、<0.001、0.001、<0.001。经DAPT干预处理后,干预组PTEN蛋白表达显著高于模型组,t=2.31,P<0.001,而Hes1、p-AKT、p-mTOR及IL-17A蛋白表达显著低于模型组,t/Z值分别为10.38、9.75、2.64、3.50,P值分别为0.010、0.017、0.015、<0.001。干预组Hes1、p-AKT、p-mTOR及IL-17A蛋白表达与对照组相比差异无统计学意义,t/Z分别为0.25、4.50、1.19、0.36,P值分别为1.000、0.609、0.248、0.290,但干预组PTEN蛋白表达显著低于对照组,t=2.14,P=0.031。
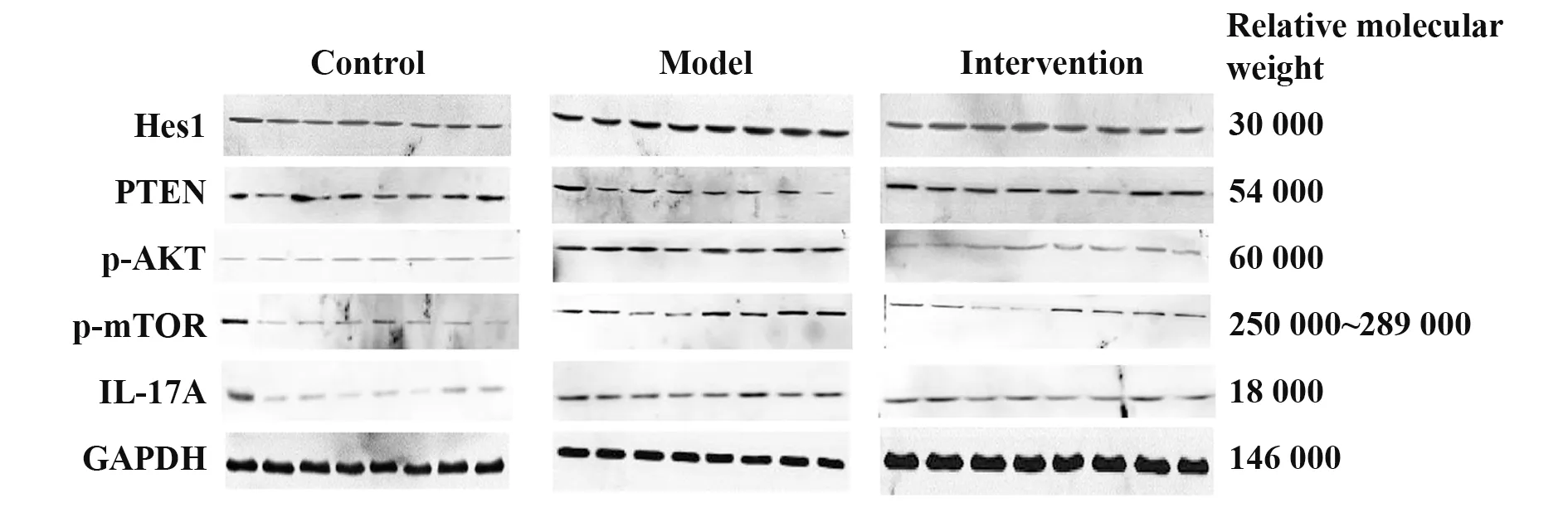
图4 三组小鼠皮肤组织中Hes1、PTEN、p-AKT、p-mTOR及IL-17A蛋白印迹图Fig.4 Western blot of Hes1,PTEN,p-AKT,p-mTOR and IL-17A in skin tissue in three groups of experimental mice
表2 三组小鼠皮肤组织中Hes1、PTEN、AKT、mTORC1及IL-17A mRNA表达水平[中位数M(P25,P75)或±s,n=8]Tab.2 Expression levels of Hes1,PTEN,AKT,mTORC1 and IL-17A mRNA in skin tissue in three groups of experimental mice[Median M(P25,P75)or xˉ±s,n=8]

表2 三组小鼠皮肤组织中Hes1、PTEN、AKT、mTORC1及IL-17A mRNA表达水平[中位数M(P25,P75)或±s,n=8]Tab.2 Expression levels of Hes1,PTEN,AKT,mTORC1 and IL-17A mRNA in skin tissue in three groups of experimental mice[Median M(P25,P75)or xˉ±s,n=8]
Note:1)Kruskal-Wallis H testχ2 value;2)One-Way ANOVA F test value.
Groups Control Model Intervention F/χ2 P Hes1 1.44(0.27,2.99)11.09(9.55,18.16)5.16(3.98,5.35)18.741)<0.001 PTEN 1.04±0.32 0.25±0.14 1.02±0.21 28.962)<0.001 AKT 1.59±1.01 5.72±2.02 2.66±1.23 16.742)<0.001 mTORC1 1.16±0.49 3.11±1.81 1.59±0.67 6.362)0.007 IL-17A 1.20(0.57,3.43)37.24(23.02,92.63)8.59(3.55,11.23)17.561)0.000 1
表3 三组小鼠皮肤组织中Hes1、PTEN、p-AKT、p-mTOR及IL-17A蛋白表达水平[中位数M(P25,P75)或±s,n=8]Tab.3 Expression levels of Hes1,PTEN,p-AKT,p-mTOR and IL-17A protein in skin tissue in three groups of experimental mice[Median M(P25,P75)or xˉ±s,n=8]

表3 三组小鼠皮肤组织中Hes1、PTEN、p-AKT、p-mTOR及IL-17A蛋白表达水平[中位数M(P25,P75)或±s,n=8]Tab.3 Expression levels of Hes1,PTEN,p-AKT,p-mTOR and IL-17A protein in skin tissue in three groups of experimental mice[Median M(P25,P75)or xˉ±s,n=8]
Note:1)Kruskal-Wallis H testχ2 value;2)One-Way ANOVA F value.
Groups Control Model Intervention F/χ2 P Hes1 0.19(0.18,0.21)0.34(0.27,0.42)0.18(0.15,0.22)11.771)0.003 PTEN 0.91±0.28 0.39±0.21 0.66±0.20 9.922)0.001 p-AKT(Ser473)0.23(0.13,0.26)0.82(0.66,0.88)0.29(0.25,0.35)16.981)<0.001 p-TOR(Ser2448)0.31±0.21 0.72±0.24 0.43±0.20 7.692)0.003 IL-17A 0.20±0.05 0.72±0.18 0.29±0.13 34.262)<0.001
3 讨论
银屑病是一种由T细胞介导的自身免疫性疾病,Th17及其产生的效应性细胞因子IL-17在银屑病的发生发展中发挥重要作用[2]。IL-17A是IL-17家族最具代表性的细胞因子。在皮肤组织中,IL-17A可诱导角质形成细胞产生TNF-α、血管内皮生长因子、IL-8、粒细胞巨噬细胞集落刺激因子和趋化因子CXCL10等细胞因子,促进角质形成细胞增殖,抑制角质形成细胞分化,破坏皮肤屏障,诱导多种前炎症细胞因子和趋化因子的表达分泌,启动并加重皮肤炎症反应[13-14]。本研究结果显示,银屑病样皮炎小鼠皮损中IL-17A的mRNA和蛋白表达均明显增高,进一步证实了IL-17A在银屑病发生发展中的重要作用。
Notch/Hes1信号通路参与细胞分化、增殖、凋亡和上皮细胞间质转化等多种生命活动过程[3]。在哺乳动物中,Notch信号转导由4类异二聚体形式的Notch受体、5类Ⅰ型跨膜蛋白的Notch配体和DNA结合蛋白CSL等组成。Notch配体与受体相互作用,在Notch受体分子的S2和S3两个位点发生连续切割,S3被包含早老素的γ分泌酶复合物切割后,释放出具有核定位信号的Notch胞内结构域(notch intracellular domain,NICD),并移位至细胞核,与C启动子结合因子1(CBF-1)、核转录激活蛋白家族MAML结合形成CBF-NICD-MAML三元复合物,启动下游靶基因的转录,如Hes1[15]。γ分泌酶抑制剂通过作用于早老素分子而阻断γ分泌酶的作用,减少NICD产生,由于NICD启动作用的缺失或减弱,下游信号分子处于静止或下调状态。本研究结果显示,γ分泌酶抑制剂DAPT阻断Notch信号后,银屑病样皮炎小鼠皮损严重程度明显改善,PASI评分降低,表皮厚度及真皮炎症细胞浸润程度较模型组均明显减轻,证实Notch信号通路参与银屑病的发生发展[4,11]。在银屑病样皮炎小鼠皮损组织中,Notch信号通路靶基因Hes1及IL-17A的mRNA和蛋白表达均明显增加,DAPT阻断Notch信号通路后,Hes1表达明显下降,同时IL-17A mRNA和蛋白表达亦显著降低,进一步表明Notch/Hes1信号通路对IL-17A表达和分泌具有调控作用[5]。
PI3K/AKT/mTOR信号通路是调节细胞生长、增殖、分化、运动和生存的经典信号途径。在银屑病相关研究中,抑制或减弱PI3K/AKT/mTOR信号通路能够抑制TNF-α诱导的银屑病细胞模型增殖,改善银屑病样皮炎小鼠皮损的严重程度及银屑病人类皮肤模型的银屑病样表现[16-17]。PI3K/AKT/mTORC1信号途径在Th17分化过程中发挥重要作用[6-8]。mTORC1能同时促进下游核糖体S6蛋白激酶1/2(S6K1/2)表达,并通过S6K1/2两条信号途径正向调控Th17的分化;敲除mTORC1上游的调控蛋白Raptor可阻止mTORC1的生物学效应,使初始CD4+T细胞无法分化成Th17[7]。PTEN是PI3K上游的重要负向调控因子,PTEN通过将细胞膜上的磷脂酰肌醇-3,4,5-三磷酸(PIP3)去磷酸化生成磷脂酰肌醇-4,5-二磷酸(PIP2),阻止PIP3将AKT招募到细胞膜上,进而拮抗PI3K介导的信号转导。关于急性T淋巴细胞白血病的研究显示,Notch信号通路靶基因Hes1结合于PTEN启动子,能够负向调控PTEN,进而促进PI3K/AKT信号通路的活化,而抑制Notch/Hes1可上调正常和病变T细胞中PTEN表达,降低AKT的磷酸化水平[9-10]。课题组前期研究结果表明,银屑病患者外周血单个核细胞及银屑病样皮炎小鼠脾脏CD4+T淋巴细胞中高表达Notch/Hes1信号分子,γ分泌酶抑制剂DAPT阻断Notch/Hes1信号通路可剂量依赖性地降低银屑病患者外周血单个核细胞及银屑病样皮炎小鼠脾脏CD4+T淋巴细胞Th17的比例及IL-17A的表达[4-5]。银屑病皮损中,p-mTOR已被证实主要与mTORC1的活性相关[18]。本研究结果显示,模型组小鼠银屑病样皮损组织中PTEN表达显著低于对照组,p-mTOR表达显著增加;DAPT阻断Notch信号后,干预组小鼠PTEN表达明显高于模型组,p-mTOR表达则显著降低。推测在银屑病的疾病环境下,Notch/Hes1信号通路可能通过负向调控PTEN,经PI3K/AKT/mTORC1信号途径调控Th17的分化和功能,促进IL-17A的表达和分泌,增强IL-17A的致炎作用。
此外,亦有研究指出,活化的AKT能抑制Notch1受体酪氨酸残基的磷酸化,减少Notch1经溶酶体途径的单泛素化和降解,以PI3K抑制剂LY294002或负显性型AKT瞬时转染人急性淋巴母细胞白血病细胞MOLT-4可明显抑制Notch1蛋白的表达及活性,降低其靶基因Hes1的转录[19]。在动脉内皮细胞、CD4+T淋巴细胞和神经元细胞中,AKT能够上调Notch1和Notch配体DLL4基因表达或提高Notch2转录活性,从而调控Notch1信号通路活性[20-22]。因此,课题组推测Notch/Hes1信号通路负向调控PTEN,促进PI3K/AKT/mTORC1信号途径活化的同时,活化的AKT亦可正向调控Notch1活性,形成正反馈调节,从而促进IL-17A的致炎效应。
