B细胞转录激活因子对实验性自身免疫性脑脊髓膜炎的调控机制研究①
2022-10-07傅增辉林再红于绘丽张广萍
傅增辉 林再红 金 艳 姜 岩 刘 晶 于绘丽 张广萍
(齐齐哈尔医学院附属第三医院神经内科,齐齐哈尔 161002)
多发性硬化(multiple sclerosis,MS)是中枢神经 系统的慢性炎症性脱髓鞘性自身免疫病。MS的临床症状不仅包括运动障碍,还包括认知缺陷[1-2]。实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是已建立的MS模型,其特征在于中枢神经系统中的炎症和神经退行性变,并表现出与人类MS在临床和组织病理学上的相似性[3-5]。课题组前期研究发现,急性发作期的复发-缓解型MS患者维甲酸相关核孤儿受体γt(retinoicr acid-related orphanreceptorγt,RORγt)、B细胞转录激 活 因 子(B cell activating transcription factor,BATF)可能通过共同调控辅助性T细胞17(helper T cell 17,Th17)的分化,从而促进Th17及其细胞因子IL-17高表达,促使MS的发生与进展[6]。研究发现,RORγt在MS和EAE的发生发展中扮演重要角色,BATF与RORγt在多种自身免疫病中具有关联性[7-8]。本研究将通过髓鞘少突细胞糖蛋白多肽35-55(myelin oligodendrocyte glycoprotein35-55,MOG35-55)、完全弗氏佐剂(complete Freund"s adjuvant,CFA)和百日咳毒素(pertussis toxin,PTX)诱导EAE模型,检测小鼠Th17水平,观察脊髓组织BATF、RORγt、IL-17的表达及病理表现,旨在探讨BATF与EAE发病关键转录因子RORγt的关系,为进一步研究及临床治疗提供可能。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF级雌性C57BL/6小鼠30只,8~10周龄,体质量18~20g,由齐齐哈尔医学院实验动物中心提供,许可证号:SCXK(黑)2016-001。本实验遵循实验室的实验动物使用管理规定,并通过齐齐哈尔医学院学校伦理委员会批准。建模前将实验动物在SPF级环境中饲养1周。将小鼠随机分为正常对照组、EAE组、EAE+甲泼尼龙(methylprednisolone,MP)组,每组10只。
1.1.2 主要试剂MOG35-55(批号:20190415020)购自英国Biorbyt公司;CFA(批号:201907143)购自美国Invivogen公司;将10 mg MOG35-55溶于2 ml生理盐水,并与含2.5 mg/ml结核杆菌的CFA等体积混合,使用玻璃注射器反复抽打至完全融合,制成油包水样乳剂。PTX(批号:19024392)购自英国Abnova公司;IL-17 ELISA试剂盒(批号:EF19014060)购自美国LSM公司;苏木精-伊红(HE)染色试剂盒(批号:1902250101)购自上海生工生物工程有限公司;勒克斯固蓝(Luxol Fast Blue,LFB,批号:19066032)购自上海歌凡生物科技有限公司;淋巴细胞分离液(批号:1906460143)购自美国Sigma公司;FITC标记的大鼠抗小鼠CD4抗体(批号:6110899)、Alexa Fluor 647标记的大鼠抗小鼠IL-17抗体(批号:201907140214)均购自美国BD Pharmingen公司;台盼蓝染色液(批号:19036326)购自上海碧云天生物技术公司;BATF、RORγt和β-actin引物由上海生工生物工程有限公司合成;Trizol试剂(批号:19013621)购自Ambion公司;反转录试剂盒(批号:RP1105)购自美国Solarbio公司;荧光定量PCR试剂盒(批号:190500310)购自美国Amresco公司。
1.2 方法
1.2.1 EAE小鼠模型建立和干预措施[9]以2%(质量浓度)戊巴比妥麻醉小鼠,按3 ml/kg给予小鼠背部沿脊柱中线两侧分四点皮下注射抗原乳剂0.2 ml,分别于0 h、48 h腹腔注射给予小鼠PTX 200 ng建立EAE模型。正常对照组小鼠以同法背部皮下注射不含MOG35-55和结核杆菌的乳剂。EAE+MP组在EAE组的基础上,造模后第12天,小鼠发病达高峰时开始给予MP(100 mg/kg),每日以生理盐水稀释后自尾静脉缓慢注入,1次/d,连续3 d后均减半药量再给药2 d,共给药5次。自免疫当天起,隔天观察并记录小鼠行为特征,采用五分法对小鼠进行Kono"s评分[10]。0分:活动正常,无明显临床症状;1分:尾部无力;2分:后肢无力,翻转后可自行恢复;3分:尾部及双后肢瘫痪,翻转后不能自行恢复;4分:四肢瘫痪;5分:濒临死亡或死亡。神经功能评分≥1分即认为发病。共观察26 d。
1.2.2 血清IL-17水平检测免疫后第26天,取小鼠眼眶血至EP管,室温静置2 h,4℃、3 000 r/min离心20 min,离心半径8 cm,收集上清,-80℃冰箱保存备用。检测时取适量血清,按照ELISA试剂盒说明书操作。
1.2.3 组织标本采集免疫后第26天,以2%(质量浓度)戊巴比妥麻醉小鼠,预冷生理盐水进行心脏灌注,打开腹腔暴露脾脏,用镊子轻轻取出脾脏,采集脊髓组织,部分以4%(质量浓度)多聚甲醛固定后制成石蜡切片,剩余组织置于-80℃冷冻保存备用。
1.2.4 脾脏淋巴细胞中Th17表达将脾脏置于200目无菌筛网,剪碎后碾磨,PBS(pH=7.4)冲洗,收集细胞悬液添加至淋巴细胞分离液。密度梯度离心,比重1.088±0.001,450 g、10 min,台盼蓝染色确保细胞存活率>95%。调整细胞浓度至1×107个/ml,接种于24孔细胞培养板,加入2µl PMA/离子霉素混合物或BFA/莫能霉素混合物,于37℃、5%CO2培养箱中培养5 h。Th17染色:加入4µl FITC标记的淋巴细胞,4℃避光孵育30 min,洗涤,加入100µl破膜剂A液,室温避光孵育5 min,鞘液洗涤1次后,加入50µl破膜剂B液,再加入2µl Alexa Fluor 647标记的IL-17抗体,室温避光孵育30 min。鞘液洗涤2次后,流式细胞仪检测,并应用CytExpert2.0.0.153软件分析。实验过程严格按照试剂盒说明书操作。
1.2.5 病理染色染色前,将切片在二甲苯中脱蜡,并在梯度乙醇中水化(100% 5 min,85% 5 min,70%5 min),PBS冲洗。按照说明书要求,对脊髓切片进行HE和LFB染色[11-12]。分别评估炎症细胞浸润和脱髓鞘。HE染色在光学显微镜下(×400)分析每只小鼠5个不同的切片。LFB染色观察每个切片的脊髓白质内至少10个(×40)随机分布的视野。使用Image-Pro Plus软件对被LFB蓝色覆盖的面积进行定量,并表示为所检查白质总面积的百分比(LFB蓝色占比)。计算每只小鼠LFB蓝色占比的平均值。
1.2.6 RT-PCR检测脊髓组织BATF、RORγt mRNA表达将冻存组织在液氮中研磨,加Trizol提取总RNA,行逆转录反应,逆转录反应程序:37℃孵育60 min,85℃温育5 min,逆转录后5倍稀释cDNA,取2µl cDNA进行PCR扩增。β-actin正向引物:3"-CTGGAACGGTGAAGGTGACA-5",反向引物:3"-AGGGACTTCCTGTAACAATGCA-5";BATF mRNA正向引 物:3"-AGCGAAGAACCTGGAGAAACA-5",反 向引 物:3"-TTCAGCACCGACGTGAAGTA-5";RORγt mRNA正 向 引 物:3"-GGCTCCCTGGATGAATAGAATG-5",反向引物:3"-AGGCAGAGGCAGAAAATGTAAAG-5"。扩增条件:95℃预变性2 min,1个循环;95℃变性30 s,56℃退火30 s,72℃延伸2 min,共35个循环;72℃总延伸6 min。按照2-ΔΔCt相对定量计算公式计算各样品的目的基因相对定量结果,分析目的基因mRNA转录水平差异。
1.3 统计学处理采用SPSS19.0软件进行统计分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以±s表示,多组均数间比较采用单因素方差分析,两两比较采用LSD-t检验,相关性分析采用Pearson分析。以P<0.05为差异有统计学意义。
2 结果
2.1 EAE小鼠临床症状评分自免疫后第10天开始,EAE小鼠陆续出现临床症状,EAE模型组小鼠神经功能评分于第24天达高峰,随后有所缓解;EAE+MP组小鼠于治疗第6天(免疫后第18天)开始,其神经功能评分明显低于EAE组(均P<0.05),见图1。
2.2 EAE小鼠血清IL-17蛋白表达水平与对照组相比,EAE组小鼠血清IL-17蛋白表达水平升高,差异有统计学意义(P<0.05);给予MP治疗的EAE+MP组较EAE组显著降低(P<0.05),见图2。
2.3 各组小鼠脾脏组织Th17/CD4+水平与对照相比,EAE组Th17/CD4+升高,差异有统计学意义(P<0.05);给予MP治疗的EAE+MP组较EAE组显著降低(P<0.05),见图3。
2.4 各组小鼠脊髓组织BATF、RORγt mRNA表达水平与对照相比,EAE组小鼠脊髓组织BATF、RORγt mRNA表达水平升高,差异均有统计学意义(均P<0.05);给予MP治疗的EAE+MP组较EAE组均显著降低(均P<0.05),见图4。
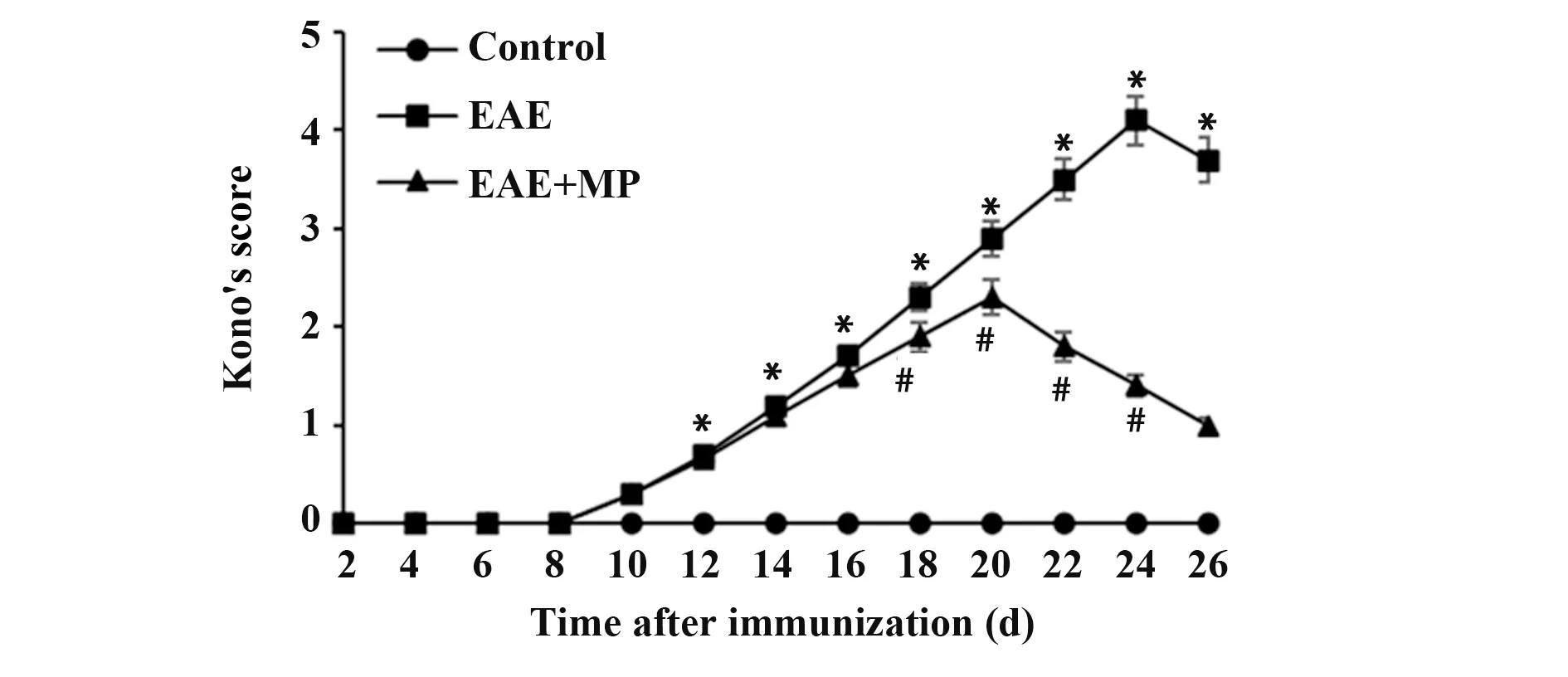
图1 各组小鼠临床症状评分比较Fig.1 Comparison of clinical symptom scores of mice in each group
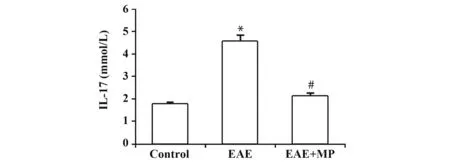
图2 各组小鼠血清IL-17蛋白表达水平比较Fig.2 Comparison of serum IL-17 protein expression level of mice in each group
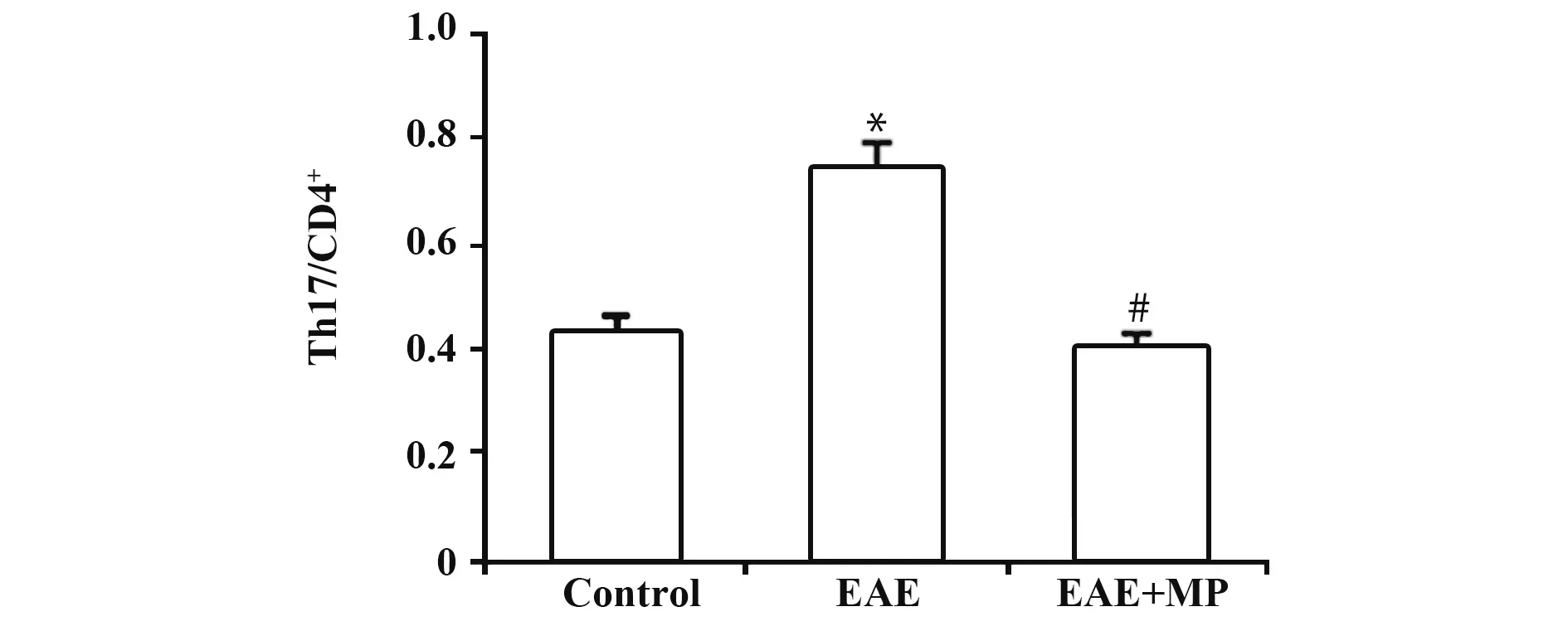
图3 各组小鼠脾脏组织Th17/CD4+比较Fig.3 Comparison of Th17/CD4+in spleen of mice in each group
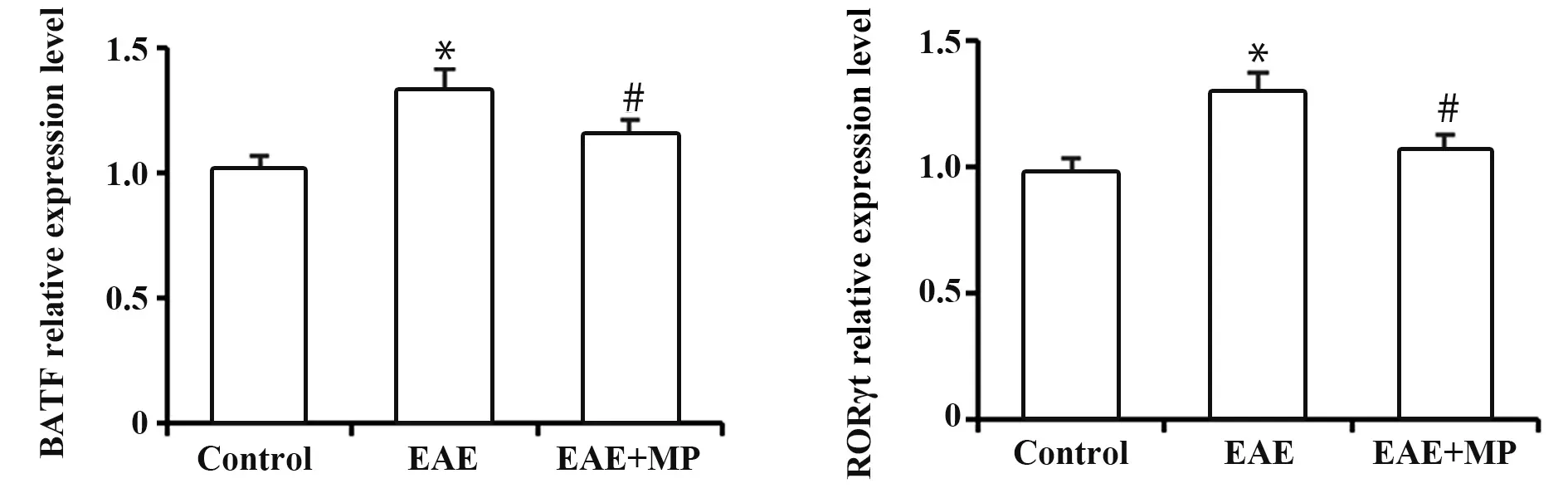
图4 各组小鼠脊髓组织BATF、RORγt mRNA表达水平比较Fig.4 Comparison of expression levels of BATF and RORγt mRNA in spinal cord of mice in each group
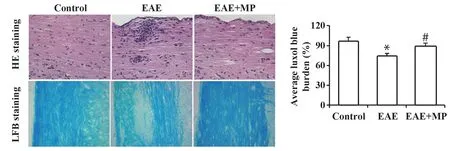
图5 各组小鼠HE和LFB病理染色结果Fig.5 Pathological staining results of HE and LFB in mice of each group
2.5 各组小鼠HE和LFB病理染色结果 如图5所示,HE染色检查每只小鼠的脊髓切片中单核细胞的浸润情况,EAE小鼠的脊髓切片中有许多血管周围的单核浸润细胞簇,而对照组小鼠的脊髓中没有这些炎症细胞浸润。给予MP治疗的EAE+MP组较EAE组小鼠脊髓中观察到较少的细胞浸润。EAE组LFB蓝色占比较对照组明显减少,差异有统计学意义(P<0.05),表明EAE小鼠有明显的神经髓鞘脱失;而MP治疗的EAE+MP组LFB蓝色占比较EAE组小鼠明显增多,代表MP治疗可减轻神经髓鞘的脱失。
2.6 相关性分析采用Pearson相关性分析,EAE组(n=10)小鼠脊髓BATF mRNA与血清IL-17表达、脾脏组织Th17/CD4+水平、脊髓RORγt mRNA表达呈正相关(r=0.833、r=0.716、r=0.514,均P<0.05);EAE组小鼠脊髓BATF mRNA与LFB染色蓝色占比呈负相关(r=-0.801,P<0.05)。
3 讨论
糖皮质激素是目前临床用于控制MS急性加重期最重要的药物之一。糖皮质激素可通过诱导T细胞凋亡及细胞因子等机制达到治疗EAE的作用[13]。构建EAE小鼠模型,并予MP治疗,其神经损害表现得到明显改善,Kono"s评分降低;而模型组病情无改善,Kono"s评分升高。说明MP可使EAE的症状缓解、缩短病程。Th17作为CD4+T细胞的一种亚群,其不同于Th1、Th2和Treg,已被证实在神经免疫疾病中扮演重要角色。IL-17是一类由Th17分泌的具有多重功效的细胞因子,在Th17中高表达,可通过诱导各种促炎因子和趋化因子等参与局部组织的炎症反应,在炎症和自身免疫病,特别MS中发挥重要作用。EAE小鼠将产生IL-17的CD4+T细胞转继给健康小鼠可诱导产生严重的EAE,并且发现IL-17的受体受阻或IL-17缺陷的小鼠抵抗EAE[14-15]。本实验结果表明,EAE小鼠IL-17表达较对照组明显增多,而给予MP可降低IL-17水平。
BATF为AP-1超家族成员,激活蛋白酶1(AP-1)可通过调节细胞因子表达调节系统性红斑狼疮、类风湿关节炎等自身免疫病的发生发展,AP-1与细胞核内转录因子进入细胞核诱导特定基因的转录引起的细胞增殖、分化有关[16]。SCHRAML等[17]发现,体外培养的BATF-/-的CD4+和CD8+T细胞IL-17水平下降,上调BATF后IL-17水平上升;同时发现,BATF-/-的小鼠T细胞不能诱导Th17相关细胞因子如RORγt等的表达分化。RORγt是控制Th17分化的特异因子,CD4+T细胞在某些细胞因子的协同刺激中,激活Stat3途径诱导RORγt表达,进而促进未致敏的CD4+T细胞向Th17分化。RORγt在Th17高表达,可诱导IL-17基因表达,参与多种炎症反应和自身免疫病的病理变化,阻断RORγt基因,则Th17分化受到抑制,IL-17表达下调[18-19]。
本研究利用MOG35-55、CFA和PTX建立EAE小鼠模型,结果显示,BATF与RORγt的表达显著高于对照组,病理切片脊髓中血管周围有大量单核细胞浸润,IL-17及炎症细胞的表达同样显著升高,表明BATF和RORγt在EAE的炎症中发挥重要作用,与既往结论相一致,而将MP给予EAE小鼠后则与之相反。同时,本研究还发现,EAE小鼠脊髓BATF、RORγt的表达与IL-17蛋白表达及脊髓神经髓鞘脱失程度呈正相关。提示BATF和RORγt可能通过调控Th17的分化发育,进而影响其关键炎症细胞和因子,从而调控中枢神经的炎症。SCHRAML等[17]在敲除BATF基因时,IL-17表达下降,此时即使用慢病毒转染上调RORγt,也并不能增加IL-17的表达。在RORγt缺乏时,过表达BATF可引起IL-17水平上调。由于RORγt是调控Th17分化发育的特异性转录因子,课题组推测,缺乏RORγt可能会引起Th17分化过程受阻,从而一定程度上减少EAE等自免疾病的发病,这与SCHRAML等[17]的结论相反,提示在BATF缺乏的条件下,RORγt不能通过诱导BATF的产生而促进Th17分化,但BATF可以诱导RORγt的产生。由于BATF和RORγt在IL-17的表达中均扮演必要角色,因此,BATF和RORγt在Th17的分化发育及表达中可能有协同作用。且本实验中EAE小鼠模型脊髓组织中BATF与RORγt的表达及其与EAE小鼠脊髓髓鞘脱失、细胞因子的表达具有相关性,BATF在EAE炎症中的重要作用可能是通过调控RORγt表达实现的,与研究组前期的临床研究结果相符,但BATF与RORγt间的具体作用机制尚需进一步深入研究。
