应用PD-1抑制剂后高血糖症1例
2022-09-29陈灿有孟翠萍
陈灿有 孟翠萍
广东药科大学附属第一医院儿科,广州 510080
临床资料
1、一般资料
患儿,男,11岁。2021年11月5日确诊“鼻咽癌,伴右侧淋巴结转移(4a)”,随后开始规律化学治疗3个疗程[顺铂+多西他赛+5氟尿嘧啶+程序性细胞死亡蛋白1(PD-1)抗体],其中PD-1抗体100 mg,21 d治疗1次,诱导化疗3疗程后,疗效部分缓解。随后开始局部放疗。治疗期间无不适,复查肿瘤稳定。2022年1月初起出现口干,多饮,起初未予重视,2022年1月26日行第4周期化学治疗,期间出现呕吐、头晕,伴有四肢乏力,当时检测末梢血糖28 mmol/L,诊断血糖升高、酮症酸中毒,立即予扩容、补碱及胰岛素(总用量28 U/24 h)治疗。动态检测血糖降至正常后,于2022年1月27日转至广东药科大学附属第一医院儿科继续治疗。患儿近期体质量无明显变化,既往无糖尿病病史,个人史无特殊,家族中无糖尿病患者。入院查体:体温36.8℃,呼吸24次/min,脉搏107次/min,体质量31 kg,身高143 cm,心肺腹无特殊,四肢无水肿,病理征阴性。入院后相关辅助检查:糖化血红蛋白5.8%。Fc-p(空腹c-肽):C肽<0.003 3 nmol/L,Pc-p(餐后120 Mc-肽):C肽(120')(CMIA)<0.003 3 nmol/L。空腹血糖:葡萄糖27.90 mmol/L;尿常规:葡萄糖(定性)阳性(4+);酮体阳性(4+)。血气分析:酸碱度7.279;二氧化碳分压20.4 mmHg(1 mmHg=0.133 kPa);氧分压139.2 mmHg;血浆碳酸氢盐浓度9.3 mmol/L;剩余碱-15.7 mmol/L。血清酮体定量:β-羟丁酸6.39 mmol/L。肾功:二氧化碳结合力13.4 mmol/L。血常规、C反应蛋白、电解质、肝功能、血淀粉酶、血脂肪酶、心肌酶、甲状腺功能未见明显异常。胰岛自身抗体检测均阴性。见表1。
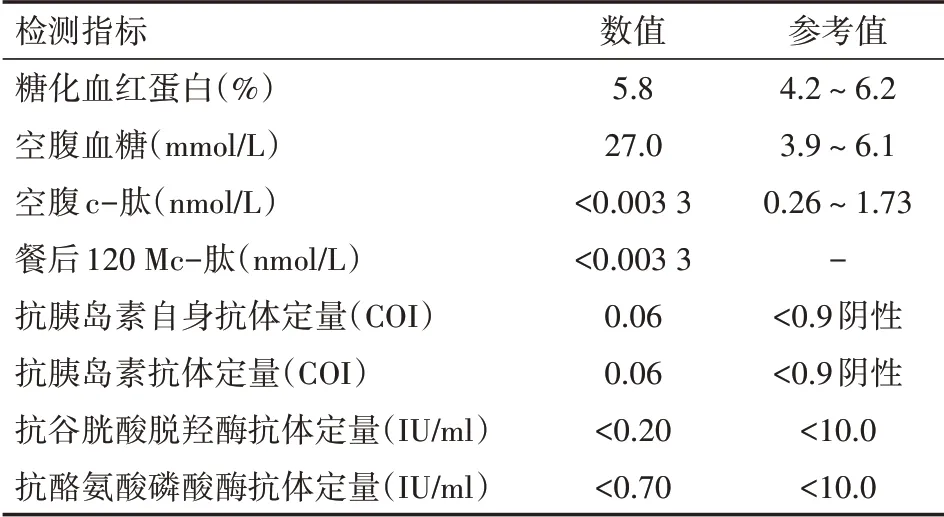
表1 1例应用PD-1抗体后出现高血糖症患儿入院后血糖相关指标
2、诊疗情况
患儿入院诊断考虑:1型糖尿病、糖尿病酮症、鼻咽癌综合治疗后。入院后于小剂量胰岛0.1 U/(kg·h)静滴,补液等治疗,动态检测血糖下降逐渐稳定,复查血气分析正常,持续静滴胰岛素4 h后,改皮下注射胰岛素降糖(三餐前:门冬胰岛素,睡前:甘精胰岛素)治疗,住院第4天血糖逐步平稳后出院。嘱出院后动态检测血糖,规律复查糖化血红蛋白、胰岛自身抗体。随访情况:现患儿安装胰岛素泵持续胰岛素治疗下(20~25 U/d),血糖控制在10 mmol/L以下,现已停用PD-1抗体,继续规律化学治疗、放疗。
讨 论
免疫检查点是维持免疫稳态和预防自身免疫性疾病的重要免疫调节因子。在正常情况下,免疫检查点使免疫系统对感染、恶性肿瘤作出反应。但是肿瘤细胞表达某些免疫检查点蛋白会抑制淋巴细胞的抗肿瘤免疫力,从而促进恶性细胞的生长和增殖。因此使用免疫检查点抑制剂(ICIs)阻断免疫检查点途径是恶性肿瘤治疗中的手段之一[1]。
PD-1抗体,已在中国获批用于治疗霍奇金淋巴瘤、转移性黑色素瘤、晚期非小细胞肺癌、霍奇金淋巴瘤、转移性肾细胞癌和不可切除肝细胞癌,可改善多种恶性肿瘤的生存,且有良好的耐受性。尽管免疫疗法有效,但免疫相关不良事件(irAEs)对患者远期生活质量造成影响,通常涉及内分泌组织、呼吸系统、消化系统,引起肺炎、垂体炎、甲状腺炎、结肠炎、胰腺炎和自身免疫性糖尿病[2]。
ICIs相关胰腺不良事件(胰腺炎、高血糖、淀粉酶/脂肪酶升高和胰腺外分泌功能不全)的发生率相对较低[3]。接受ICIs治疗的癌症患者出现的症状,包括腹痛、呕吐、消化不良、大便不规则和每日血糖波动较大,应考虑排查ICIs相关的胰腺不良事件[4-5]。
ICIs相关胰腺不良事件的机制:抗PD-1/PD-L1和抗细胞毒T淋巴细胞相关抗原4(CTLA-4)单克隆抗体结合并阻断抑制信号,从而通过阻断T细胞的抑制信号和增强免疫系统能力来引起T淋巴细胞的广泛活化和扩增,以此来对抗癌细胞。CD3+T淋巴细胞密集浸润胰岛,从而增加肿瘤周围区域CD8+/CD4+T淋巴细胞比例。增加的CD8+T细胞可能对胰腺细胞,包括胰岛β细胞和腺泡造成损害,从而破坏胰腺外分泌和内分泌组织,导致胰腺内分泌和外分泌功能下降[3]。
与糖尿病相关的ICIs(ICIs-DM)在免疫治疗开始后3~81周之间发病,给药显著使患者的血糖水平升高[3]。期间糖化血红蛋白(HbA1c)可能接近正常或略有升高,C肽水平低或检测不到,严重病例与糖尿病酮症酸中毒(DKA)相关[6]。
根据ICIs诱导糖尿病的不同临床和生物学特征及其潜在的病理生理学,将ICIs-DM分为4种类型。这些类型包括:急性自身免疫性胰岛素依赖型糖尿病、2型糖尿病样表型、由自身免疫性胰腺炎引起的糖尿病和自身免疫性脂肪萎缩后的糖尿病[7-8]。急性自身免疫性胰岛素依赖型糖尿病是一种极为罕见的irAEs,与高病死率相关。ICIs诱导的糖尿病有几个特征:(1)快速发作的严重高血糖症;(2)糖尿病酮症酸中毒(DKA)或C肽水平极低或缺失;(3)糖尿病发病后持续存在胰岛素依赖[9]。
本例患儿应用PD-1抑制剂治疗前无糖尿病,既往无糖尿病病史,于第4周期PD-1单抗治疗过程中出现呕吐、头晕,伴有四肢乏力,随机血糖28 mmol/L,初步诊断“糖尿病”。空腹及餐后C肽水平均为<0.003 3 nmol/L,且出现酮症酸中毒,故诊断考虑“1型糖尿病,酮症酸中毒”。本例患儿有明确PD-1抑制剂应用史,考虑“急性自身免疫性胰岛素依赖型糖尿病”可能性大。暴发性1型糖尿病是1型糖尿病的一种亚型,胰岛自身抗体一般阴性。诊断标准为:高血糖症状出现后1周内出现酮症或酮症酸中毒;初诊首次血糖≥16.0 mmol/L和HbA1c<8.5%;且空腹C肽<0.3µg/L、餐后C肽<0.5µg/L。本例患者满足诊断条件,但出现症状约1个月,且胰岛自身抗体阴性,故可明确诊断“暴发性1型糖尿病”。
PD-1抑制剂后所致胰岛功能损伤一般较严重、迅速,且持久,可能需终生胰岛素替代治疗。长期外源性胰岛素注射应成为PD-1抑制剂诱导糖尿病的基本治疗方法。患儿的高血糖得到良好控制后不久,可继续接受PD-1单抗[10]。一些报道显示,在用PD-1抑制剂治疗的晚期癌症中,具有irAEs的患者显示出比没有irAEs的患者明显更好的疗效,包括更高的总体缓解率,延长的无进展生存期和更长的总体生存期[6]。
本例报道了国内应用PD-1单抗后引起的“1型糖尿病合并酮症”,但前期相关临床资料收集还不够全面,仍需继续随访并记录患儿后续血糖变化。
综上所述,由于irAEs的不可预测性,建议在免疫治疗前检测糖尿病相关自身抗体和C肽,免疫治疗期间动态进行血糖监测,及早发现ICIs-DM并进行干预。
