ATP在大鼠胰岛分离中的保护作用研究
2009-05-06温寿青邱立汪春福邹桂华
温寿青 邱 立 汪春福 邹桂华
【摘要】 目的 探讨三磷酸腺苷(ATP)在大鼠胰岛分离过程中抑制胰酶对胰岛细胞的消化作用。方法 将20只SD大鼠平均分为两组,处理组在胰岛分离全过程中加用ATP进行干预,对照组则不加ATP处理,采用Ficoll非连续密度离心纯化后对两组胰岛细胞的凋亡、胰岛产量及活力方面进行比较性研究。结果 加用ATP的处理组的胰岛细胞凋亡率显著低于对照组(P<0.01),处理组胰岛产量和胰岛素释放水平均显著高于对照组(P<0.01)。结论 胰岛分离过程中加用一定浓度ATP对胰岛具有抑制凋亡和保护胰岛活力的作用。
【关键词】
胰岛分离;ATP;流式细胞仪;凋亡
Protective effect of ATP in rat islets isolation
WEN Shou-qing,QIU Li,WANG Chun-fu,et al.Baoan Peoples Hospital,Shenzhen 518101,China
【Abstract】 Objective To observe the anti-apoptosis effect of ATP in rat islets isolation.Methods The rats were devided into 2 groups according whether with the treatment of ATP during the islets isolation.The purified islets by Ficoll were compared between the groups.Results The outcome and anmouts of insulin release under the glucose stimulating of isolated and purified islets in ATP group were superior to those in the control group(P<0.01).The number of apoptosis islet cells in ATP group were fewer than those in control group(P<0.01).Conclusion With the treatment of ATP during the islets isolation may protect the islets from trypsin digestion and prevent apoptosis of islet cells.
【Key words】 Islet isolation; ATP; Flow cytometer; Apoptosis
胰岛移植通过β细胞替代疗法治疗1型糖尿病,近年来成为研究的热点[1]。但与其他移植治疗一样,供体来源的短缺仍是人同种异体胰岛移植在临床广泛开展所面临的重大困难,而目前大多数的临床胰岛移植需要2~3个供体胰腺分离所获的胰岛量来达到完全脱离胰岛素依赖的效果[2]。一个主要原因是在胰岛分离纯化过程中缺氧引起胰岛细胞的凋亡和死亡[3],,影响了移植胰岛的质量。本实验直接针对缺氧这个重要的损伤因素,在整个移植前处理过程中加用三磷酸腺苷(ATP)对胰岛进行保护,观察其对胰岛损伤,特别是在细胞凋亡过程中所产生的影响和效果。
1 材料和方法
1.1 主要实验试剂 胶原酶V,由SIGMA公司提供;分散酶Dispase Ⅱ由美国罗氏公司提供;TUNEL凋亡检测试剂盒由南京凯基生物科技发展有限公司提供;Annexin-FITC/PI凋亡检测试剂盒有Biovision公司提供;大鼠胰岛素ELISA试剂盒由Mercodia公司提供。
1.2 动物来源、分组和处理SD大鼠,雌雄不限,体质量250~300 g,由广东中医药大学实验动物中心(动物合格证号:NO.0010321)提供。20只大鼠随机分成两组,ATP处理组10只,在胰导管逆行注射胶原酶时加用ATP注射液2 ml,20 mg。对照组10只,处理过程中不加ATP,等量生理盐水代替。
1.3 胰岛的分离和纯化 实验大鼠10%水合氯醛腹腔注射麻醉后,仰卧位固定,无菌术下正中线开腹,结扎胰胆管近肝端,皮试注射器胰管逆行注射1.5 mg/ml胶原酶溶液10 ml,使胰腺充分膨胀,取下整个胰腺后剪碎,37℃水浴消化10 min后,加入含20%小牛血清的Hanks液终止消化,不锈钢滤网过滤,Hanks液洗涤离心2次。ATP处理组在整个分离过程中的Hanks液中均加用ATP(5000 U/ml)处理。
胰岛纯化采用Ficoll400不连续梯度离心法。将分离后的沉淀物加入25%的Ficoll400溶液4 ml,充分混匀后,在液层上依次加入23%,20%,10%的Ficoll400溶液,2000转/min低温离心15 min后,吸取23%,20%两层之间以及20%,10%两层之间的胰岛,Hanks液洗离心2次。用含20%小牛血清的RPMI-1640培养液收集胰岛。
1.4 胰岛产量计数 纯化后的胰岛用双硫腙(DTZ)染色。用定量加样器在胰岛悬液中取样3次,每次50 μl镜检DTZ染色阳性细胞团,按以下公式[4]计算胰岛量:胰岛数=3次细胞团总数÷3×20×样本总体积(ml)。
1.5 原位末端核苷酸标记法(TUNEL)观察胰岛细胞凋亡 将纯化后的胰岛细胞或细胞团接种于多聚赖氨酸处理过的载玻片上,按上述实验分组处理,自然干燥后,加2%多聚甲醛固定1 h,PBS漂洗5 min,浸入3%双氧水/甲醇溶液中室温封闭10 min,阻断内源性过氧化物酶。然后浸入0.1%TritonX-100室温处理 10 min,PBS洗3次。加TdT酶反应液37℃避光反应60 min,PBS漂洗后滴加Streotavidin-HRP工作液,避光反应30 min后,滴加DAB显色,室温避光反应15 min,PBS漂洗后直接光学显微镜下观察拍照。
1.6 Annexin-V/PI定量分析胰岛细胞凋亡率 纯化后的胰岛悬液中加入2 ml分散酶Dispase Ⅱ,37℃水浴摇床消化15 min,18G针筒抽吸数次,获得胰岛单细胞悬液获得含20%小牛血清的RPMI-1640培养液8 ml中止消化。用无血清的RPMI-1640培养液洗2次,收集细胞记数,调整细胞浓度为106/ml,对照管和检测管每管各加100 μl细胞悬液,每管分别加5 μl PI和Annexin V-FITC抗体,避光室温孵育10 min后,美国Coulter公司ATRLA型流式细胞仪检测分析。
1.7 流式细胞仪对Bcl-2/Fas-L表达水平的检测 制备胰岛单细胞悬液,调整细胞浓度为106/ml,加入Fixation剂100 μl,固定15 min,加入PBS1 ml清洗1次,离心后再用PBS清洗1次,将上面细胞分成两管,一管加入同性对照,一管加入Bcl-2及Fas-L一抗试剂1 μg,在避光孵育15 min。用PBS清洗1次,加入二抗FITC 10 μl试剂,避光孵育15 min,用PBS清洗1次,将样本放置在流式细胞计数仪上检测,采用SystemⅡ软件系统进行分析。
1.8 葡萄糖刺激胰岛素释放实验检测胰岛功能 纯化后的胰岛经Hanks液洗涤3次,分别转移至无糖,低糖(2.7 mmol/L)和高糖(16.7 mmol/L)无血清RPML-1640培养基中,每孔100个胰岛,于37℃,5%CO2培养箱内培养2 h,收集培养液,用大鼠胰岛素ELISA试剂盒进行检测,测定培养液中的胰岛素水平。
1.9 统计学方法 计量资料均以均数±标准差(x±s)表示。使用SPSS 11.5软件,采用两个样本t检验及两组样本率比较的秩和检验,P<0.01为差异有统计学意义。
2 结果
2.1 ATP处理对胰岛产量的影响 分离纯化后的胰岛数量,ATP处理组的胰岛产量(312.3±6.2)个较对照组(306.5±5.6)个之间差别无统计学意义(P>0.05)。
2.2 原位末端核苷酸标记法检测胰岛细胞凋亡 胞核呈深棕色的阳性细胞为凋亡细胞。光镜下观察结果显示,处理组的阳性细胞数量明显少于对照组。见图1:

2.3 Annexin V/PI双染色检测胰岛凋亡结果 通过流式细胞仪定量检测胰岛细胞凋亡,结显示ATP处理组的平均细胞凋亡率为(8.6±2.9)%,而对照组为(22.7±3.1)%,处理组的胰岛细胞凋亡率明显低于对照组(P<0.01)。见图2。
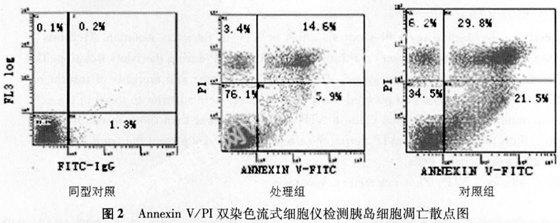
M1表示细胞碎片和部分死亡细胞比例,M2表示死亡细胞比例,M3表示活细胞比例,M4表示凋亡细胞比例。说明:三个散点图横轴的4个坐标从左到右分别为:100,101,102,103三个散点图纵轴的4个坐标从下到上分别为:100,101,102,103
2.4 Bcl-2/Fas-L表达水平的检测结果 ATP处理组Bcl-2的阳性率(20.8±1.1)%较对照组阳性率(9.7±1.7)%显著升高(P<0.01),同时处理组Fas-L的阳性率(6.2±0.9)%与对照组阳性率(15.6±2.1)%比较显著性降低(P<0.01)。
2.5 葡萄糖刺激胰岛素释放实验检测结果 ATP处理组在低浓度葡萄糖和高浓度葡萄糖刺激下释放胰岛素水平均显著高于对照组(P<0.01),在无葡萄糖刺激下两组释放胰岛素水平无显著性差异(P>0.05),见表1。

3 讨论
胰岛从生物学特性上看是相当脆弱的细胞团,外界微环境的变化对它形态结构的完整和功能的保持都有着显著的影响。如何提高供体胰岛的数量与质量是近年来研究的一个重要方面。目前的临床胰岛移植,在供体胰岛的分离纯化过程中,存在很多对胰岛损伤的因素,比如机械力的损伤,缺氧,渗透压的改变,纯化介质对胰岛的毒性作用,外分泌部腺泡释放出的胰酶,组织因子[5]等,都会对分离出的胰岛造成损害,或使胰岛团内的细胞死亡,或是激活凋亡程序。有研究用早期凋亡检测法证明,在移植前的胰岛处理过程中,一部分胰岛细胞的凋亡程序已经被启动,事实上胰岛进入受体后的命运,是否能抵抗不良因素而成功存活,在移植前就已经决定。而解决这个问题的重要途径,就是在移植前的整个处理过程中如何对胰岛进行保护[6-7]。
近年相关研究显示,胰岛自供体胰腺血流阻断起即进入缺氧状态,且在整个分离和培养过程中,直至移植后胰岛细胞团内微循环重新建立前的一段时间,都无有效的氧供,缺氧可导致胰岛细胞线粒体受损,ATP生成障碍,细胞正常生理活动受损,离子通道功能障碍,从而无法维持正常膜电位,胞质Ca2+浓度升高,细胞膜损伤和溶酶体损伤,由此引起细胞的死亡或凋亡。
根据以上情况,本实验直接针对缺氧这个重要损伤因素,在整个移植前处理过程中对胰岛进行保护。ATP是维持细胞生命重要的能量物质,细胞微环境内ATP大量缺失将导致细胞死亡。本实验设计的保护因素ATP-MgCl2是临床常用的能量剂和辅酶类药物,可透过细胞膜进入细胞,直接为细胞提供能量,维持细胞正常形态,膜电位,以及维持正常生命活动必需的蛋白质合成功能,且ATP可促进胰岛素的合成,有利于维持和提高待移植胰岛的功能。
实验结果显示ATP处理组的胰岛产量较对照组并无显著差别,但胰岛素释放实验显示实验组的胰岛对葡萄糖刺激的反应能力优于对照组,提示ATP对胰岛的功能具有保护作用。
有研究表明胰岛细胞的凋亡是引起胰岛功能损伤的一个重要因素[10]。为进一步研究ATP对分离胰岛的保护作用机制,本实验特别通过TUNEL以及流式细胞仪对胰岛细胞凋亡的进行检测。结果表明,ATP处理组胰岛细胞的凋亡得到有效控制,细胞凋亡率下降,提示ATP在分离胰岛过程中具有抑制胰岛细胞凋亡的作用,对胰岛功能的损害起到了抑制效果,从而对胰岛的活力具有保护作用。而通过对凋亡相关基因表达的检测,进一步提示了ATP对胰岛凋亡的抑制作用可能是通过促进凋亡抑制基因Bcl-2的表达和抑制凋亡基因Fas-L的表达而实现的。但是对ATP细胞毒性研究显示,ATP同时还具有诱导细胞凋亡的作用[11],其机制主要与多个嘌呤受体激活有关,包括:P2X1、P2X2、P2X7等。不过近年来的研究显示,虽然ATP对细胞凋亡具有双重作用,但其对产生细胞保护作用的浓度要低于诱导凋亡的浓度很多倍,所以对ATP的浓度控制很重要。另一方面相关研究证明,在胰岛β脉内留置时间长且不易穿破血管壁等优势在临床上得到广泛应用,为了观察BD密闭式静脉留置针在血浆置换术中应用的临床效果,笔者对2005-2008年间,共236例内科系统疾病需行血浆置换的患者, 随机分为BD密闭式静脉留置针组和细胞中ATP对胰岛素的分泌起着重要的调节作用[12],故选择ATP5000 U/ml浓度,在细胞静息状态下,ATP通过动员胞内钙库的Ca+释放使胞浆钙离子浓度显著增加,触发β细胞强烈分泌胰岛素。这就能进一步解释ATP处理组胰岛对葡萄糖刺激释放胰岛素量高于对照组的实验结果。
综上所述,本实验提示在胰岛分离过程中使用一定浓度的ATP可以起到保护胰岛,抑制胰岛细胞凋亡,提高胰岛质量的作用。因此有希望成为一种提高临床胰岛移植中供体胰岛分离纯化效果的有效途径。目前需进一步采用大动物实验及更进一步胰岛细胞凋亡观察。
参 考 文 献
[1] Jason L.G,AM..Shapiro,Gordon CW.Islet transplantation:progress and challenge.Achieves of medicalresearch,2005,36:274.
[2] OlleKorsgren,B.Nilsson,C.Berne,et al.Current status of clinical islet transplantation.Transplantation,2005,79:1289.
[3] Gray DWR.Avoiding damage transplanted human islets during implantation is important.Transplantation,2005,79:1294.
[4] 董维平,张洪德,王煜非,等.胰岛移植物质量鉴定方法的研究.中华器官移植杂志,1998,19:205.
