产脂肪酶菌株筛选及其抗氧化性的研究
2022-09-28胡静荣于智慧朱迎春
王 吉, 张 鑫, 胡静荣, 于智慧, 朱迎春
(山西农业大学食品科学与工程学院,晋中 030800)
发酵肉制品是指将禽畜肉或水产品等原料按照一定的肥瘦比例进行绞碎,与盐、糖、亚硝酸钠、发酵剂和香辛料等混合均匀后,在特定条件下利用微生物发酵制成的一种具有特殊发酵风味、营养丰富、易于保存的肉制品[1]。
脂质是发酵肉制品的重要成分之一,肉制品在发酵成熟过程中,脂质降解产生游离脂肪酸,尤其是多不饱和脂肪酸,极大提高了发酵香肠的营养价值[2]。脂肪降解产生的游离脂肪酸经过氧化作用生成羰基化合物,从而产生了醇类、酮类、醛类等风味物质[3]。有研究表明[4, 5],脂肪酶通过催化肉制品中脂质的分解,提高了游离脂肪酸的含量,从而促进风味前体物质的产生。在发酵过程中,微生物对脂质的水解起着重要的作用。李想等[6]发现腐生葡萄球菌可以促进发酵肉中脂质的水解。刘英丽等[7]报道了乳酸菌在萨米拉发酵香肠中的作用,指出乳酸菌可以促进香肠中脂质的降解。Xiao等[8]报道接种植物乳杆菌和木糖葡萄球菌可以促进游离脂肪酸的释放。脂质适度的氧化,有助于发酵肉制品风味的形成[9]。然而,脂质的过度氧化会导致产品酸败、质地和颜色的改变、微生物的生长、食用品质的降低和保质期的缩短[10]。有研究人员通过在制作发酵肉制品中添加一些抗氧化剂来抑制脂质的过度氧化[11]。也有研究人员采用具有抗氧化性的菌株作为发酵剂来抑制脂质的过度氧化,如韩飞云等[12]报道,在发酵羊肉香肠中接种复配发酵剂(木糖葡萄球菌和植物乳杆菌)可以显著降低TBARS值。
本实验从实验室保藏的12株发酵菌株中筛选具有产脂肪酶的菌株,对菌株表达脂肪酶的基因进行定性和定量分析,研究培养基初始pH、培养温度、时间、接菌量对油脂降解率的影响,并对菌株进行抗氧化分析,旨在筛选出同时具备脂解能力和抗氧化活性的菌株,为提高发酵香肠的营养价值和改善发酵香肠的风味提供技术支持,为开发具有我国自主知识产权的新型发酵剂提供参考。
1 材料与方法
1.1 实验材料与仪器
1.1.1 材料与试剂
山西农业大学食品科学与工程学院畜产品实验室保藏的12株菌株,前期经过分离、纯化和16S rDNA鉴定,种属关系明确,分别为:2株戊糖片球菌(Pediococcuspentosaceus)MGC2、MSZ1, 3株巨球菌(Macrococcuscaseolyticus)YZC2、YZC3、YXN2,2株木糖葡萄球菌(Staphylococcusxylosus)YSZ11、YCC3,1株植物乳杆菌(Lactobacillusplantarum)MSZ2,1株表皮葡萄球菌(Staphylococcusepidermidis)MYJC2,2株腐生葡萄球菌(Staphylococcussaprophyticus)YCC2、YRC1,1株屎肠球菌(Enterococcusfaecium)MRC2。
无水乙醇、硫酸亚铁、铁氰化钾、三氯化铁、磷酸氢二钠、磷酸二氢钠,1,1-二苯基-2-三硝基苯肼自由基、没食子酸、水杨酸均为分析纯;RNA试剂盒、TB GreenTM Premix Ex TaqTMⅡ定量试剂盒、反转录试剂盒。
1.1.2 培养基
中性红油脂培养基(g/L):NaCl 5 g,蛋白胨10 g,大豆油10 g,牛肉膏5 g,1.6%中性红1 mL;MRS培养基、三丁酸甘油酯培养基、营养肉汤培养基、牛肉膏、蛋白胨、琼脂粉。
1.1.3 设备与仪器
5804R高速冷冻离心机,HPP-9272电热恒温培养箱,ST2100 pH计,UV-1100分光光度计,SW-CJ-2FD双人单面超净化工作台,LDZX-50KBS立式高压蒸汽灭菌器,LC96实时定量 PCR 仪,NanoDrop2000核酸蛋白分析仪。
1.2 方法
1.2.1 菌株产脂肪酶能力筛选
参照Griebeler等[13]的方法,利用中性红油脂平板法和三丁酸甘油酯平板法筛选具有产脂肪酶能力的菌株。
1.2.2 菌株脂肪酶基因相关基因表达量的检测
用细菌RNA提取试剂盒提取菌株RNA,并用核酸蛋白分析仪对RNA浓度和纯度进行检测。将所提取的RNA反转录成cDNA,保存于-20 ℃备用。经过NCBI查询,葡萄球菌和巨球菌编码脂肪酶的相关基因为FJ979867.1、FJ979868.1、AY551101.1。进行设计并合成相应的引物,实时定量PCR引物见表1。3个基因为实验基因,18S为内参基因,cDNA作为模板进行定量PCR扩增,反应体系为: 25 μL TB GreenTMPremix Ex TaqTMⅡ,2 μL上游引物,2 μL下游引物,2 μL cDNA,R Nase Free dH2O 19 μL[14];PCR反应条件见表2。采用2-ΔΔCt计算基因的相对表达量。

表1 实时定量PCR引物
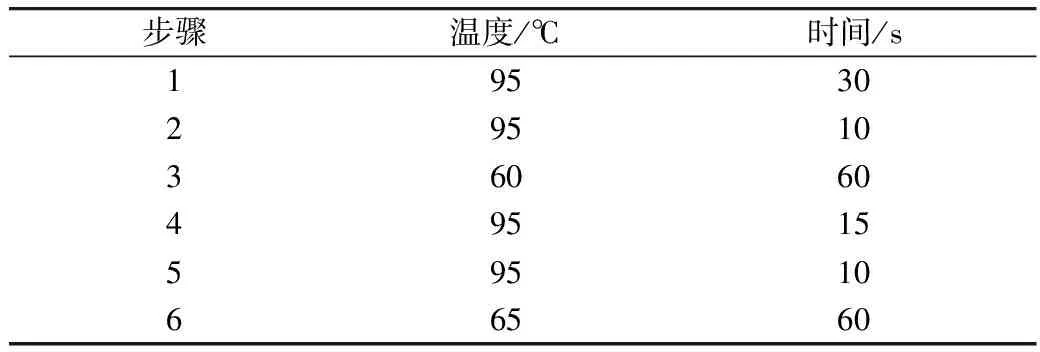
表2 PCR反应条件
1.2.3 初始pH对菌株产脂肪酶的影响
筛选出的菌株在营养肉汤中培养48 h,将菌株稀释到8 log10CFU/mL后接种到pH分别为5、6、7的三丁酸甘油酯平板中,在37 ℃下培养48 h。测量透明圈的大小来判定pH对菌株产脂肪酶能力的影响。
1.2.4 菌株培养温度对油脂降解率的影响
筛选出的菌株在营养肉汤中培养48 h,稀释到8 log10CFU/mL后按体积分数为0.2%分别接种到含有质量分数为2%油脂的营养肉汤中,在不同温度(27、32、37、42 ℃)下培养48 h,然后用25 mL石油醚对油脂萃取3次,收集有机相并且用无水硫酸钠吸取残留的水分,用旋转蒸发仪去除有机溶剂,然后置于(60±2)℃的烘箱中烘干,称量剩余油脂的质量。计算公式为:

1.2.5 菌株培养时间对油脂降解率的影响
筛选出的菌株在营养肉汤中培养48 h,将其稀释到8 log10CFU/mL后按体积分数为0.2%分别接种到含有质量分数为2%油脂的营养肉汤中,在37 ℃下培养,分别在24、36、48、60 h测定油脂的降解率。
1.2.6 接菌量对油脂降解率的影响
筛选出的菌株在营养肉汤中培养48 h,稀释到8 log10CFU/mL后分别按照按体积分数为0.10%、0.15%、0.20%、0.25%的接种量接种到含有质量分数为2%油脂的液体培养基中,在37 ℃下培养48 h测定油脂的降解率。
1.2.7 菌株发酵液抗氧化性分析
参照李权威等[15]的方法进行测定。在营养肉汤中接种体积分数为2%筛选出的菌株,37 ℃培养48 h后离心(10 000 g,15 min)得到上清液,进行抗氧化指标测定。DPPH自由基清除率参照冯美琴等[16]的方法测定。羟自由基清除率参照王静等[17]的方法测定。超氧阴离子自由基清除率参照Fonagy等[18]的方法测定。总还原力测定参照冯艳钰等[19]的方法测定。
1.2.8 数据处理与分析
所有实验均做3个平行,结果以平均数值±标准差表示。通过Statistix 8.1 进行显著性差异分析(显著水平为P<0.05);通过Origin 9.0软件绘制图片。
2 结果与分析
2.1 产脂肪酶菌株的初筛结果
通过油脂中性红平板颜色的变化可定性分析菌株是否具有产脂肪酶的能力[20]。如果平板颜色未发生变化,说明菌株产酶能力弱或者不具备产酶能力;如果平板颜色发生变化,说明该菌可以分泌脂肪酶,油脂在脂肪酶的作用下分解成脂肪酸,使平板颜色变为红色。产脂肪酶定性实验结果见表3。菌株YZC2、YSZ11、YCC3、YZC3、YCC2可以使中性红平板变为红色,说明这5株菌株具有分泌脂肪酶的能力;菌株MGC2、MRC2、YXN2、MSZ1、MSZ2、YRC1、YMJC2未使中性红平板变色,说明这7株菌分泌脂肪酶的能力弱或不具备分泌能力。

表3 产脂肪酶定性实验结果
2.2 产脂肪酶菌株的复筛结果
菌株产脂肪酶能力实验见表4,5株菌株均能够分解三丁酸甘油酯产生透明圈,5株菌株的透明圈直径与菌落直径比值(D/d)为1.78~2.29,其中菌株YCC3、YZC2、YCC2D/d值>2,说明脂肪酶活力较强,特别是菌株YCC3的D/d值最高,达到2.29。故选取YCC3、YZC2、YSZ11、YZC3、YCC2这5株菌株进行后续实验。
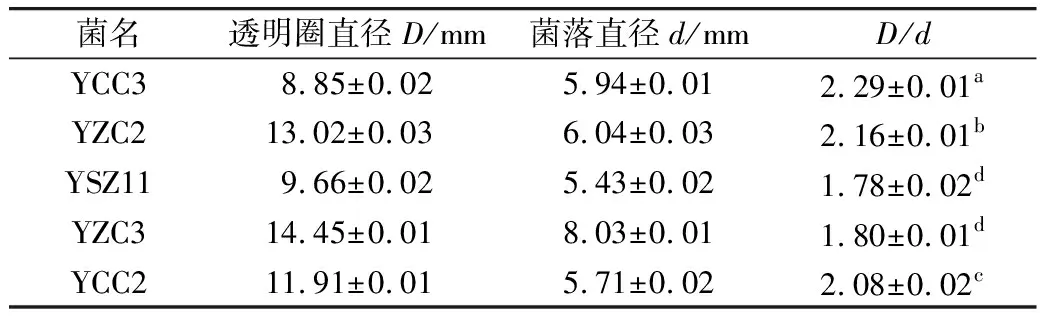
表4 菌株产脂肪酶能力实验
2.3 菌株编码脂肪酶基因表达量分析
从NCBI上查阅到葡萄球菌和巨球菌编码脂肪酶的基因并对菌株DNA进行了扩增,只对FJ979867.1、 AY551101.1、FJ979868.1这3种基因扩增成功。由表5可见,含有编码脂肪酶基因FJ979867.1的菌株有YCC2、YCC3;含有编码脂肪酶基因 AY551101.1的菌株有YSZ11、YCC2、YCC3、YZC3;含有编码脂肪酶基因FJ979868.1的菌株有YSZ11、YCC2、YCC3、YZC2、YZC3。
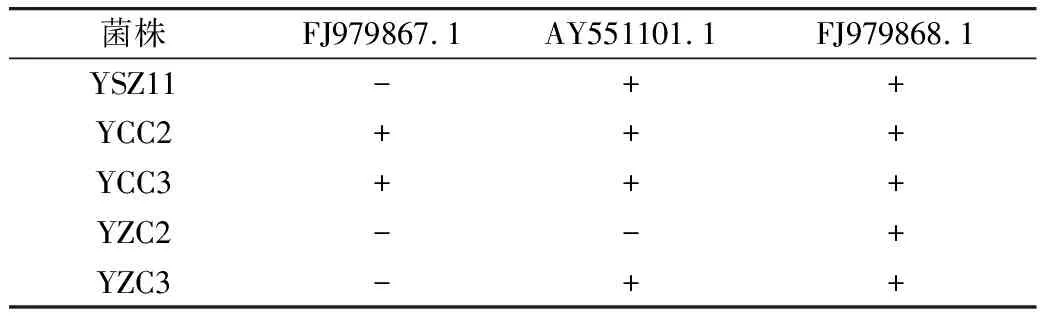
表5 5株菌株编码脂肪酶相关基因的定性结果
菌株脂肪酶基因的相对表达量如图1所示,FJ979867.1的相对表达量在菌株YCC2中最高,显著高于菌株YCC3(P<0.05),但是在其他3株菌株中均无表达。FJ979868.1在菌株YCC2、YCC3、YSZ11、YZC3中相对表达量在0.309~0.570之间,在菌株YZC2中无表达。AX551101.1在5株菌株中均有所表达,且YCC2和YSZ11的表达量显著高于其他3株菌株(P<0.05)。5株菌株比较,菌株YCC2的3种脂肪酶基因均有所表达,尤其是FJ979867.1和AX551101.1的相对表达量显著高于其他菌株(P<0.05)。
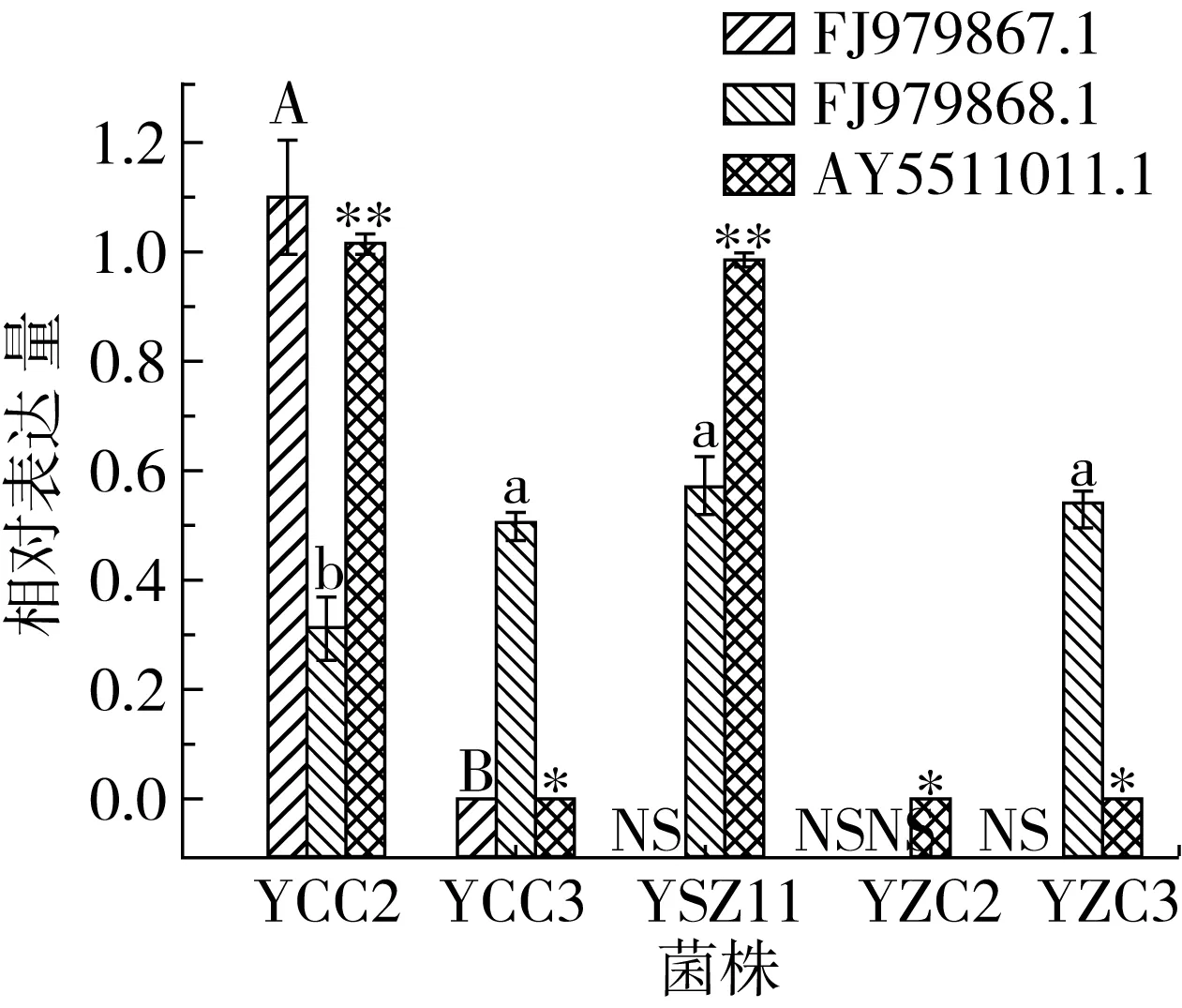
注:不同大写字母表示不同菌株对FJ979867.1 的表达量差异显著(P<0.05);不同小写字母不同菌株对FJ979868.1的表达量差异显著(P<0.05);*、**分别表示不同菌株对AX551101.1 的表达量差异显著(P<0.05)和极显著(P<0.01);NS表示没有检出该基因。图1 菌株脂肪酶基因的相对表达量
2.4 pH对菌株产脂肪酶能力的影响
不同pH对菌株产脂肪酶能力的影响如图2所示,5株菌株脂肪酶活力随着pH的下降而降低。pH为7时,菌株YZC3、YCC3、YCC2、YSZ11、YZC2D/d值分别1.88、2.18、2.18、1.51、1.55,说明5株菌株在pH为7时具有较高的脂肪酶活性;pH为6时,5株菌株D/d值降低为1.34(YZC3)、1.53(YCC3)、1.81(YCC2)、1.35(YSZ11)、1.36(YZC2),显著低于(P<0.05)pH为7时的D/d,说明在此条件下,菌株分泌脂肪酶的能力降低且酶活性降低;当pH为5时,仅有菌株YCC2出现透明圈,D/d值为1.57,而菌株YZC3、YZC2、YCC3、YSZ11均未出现透明圈,说明YCC2耐酸性较强,在pH为5时仍旧能够分泌脂肪酶且表现出较高的活力;而其余4株菌株在pH为6~7时,生长代谢较为活跃,产酶量较高,并且所产脂肪酶有较高活性,但是当pH降低为5时,菌株生长代谢能力减弱,产酶量降低或消失。
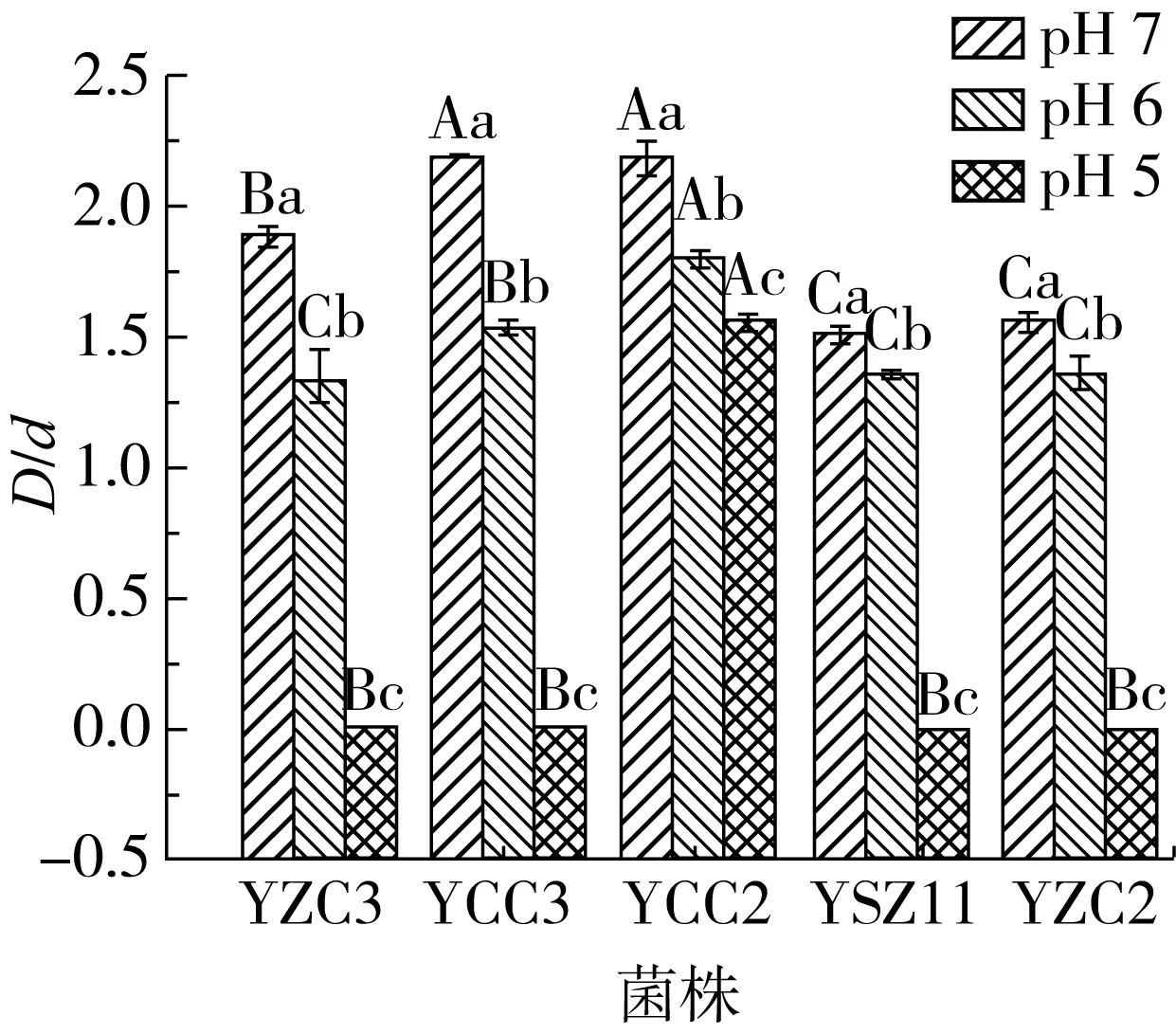
注:不同大写字母表示相同pH不同菌株之间D/d差异显著(P<0.05);不同小写字母表示菌株在不同pH D/d差异显著(P<0.05)。图2 不同pH对菌株产脂肪酶能力的影响
2.5 培养温度对油脂降解率的影响
培养温度对油脂降解率的影响如图3所示。5株菌株随着培养温度的升高油脂降解率均呈现先上升后下降的趋势。温度对菌株YCC2、YCC3的油脂降解率影响显著(P<0.05),并且在37 ℃时油脂降解率达到最高,分别为57.34%(YCC2)和49.71%(YCC3)。培养温度为32~37 ℃时,YZC3、YSZ11油脂降解率维持在较高水平,而菌株YZC2在32 ℃下培养油脂降解率最高,达到16.12%。
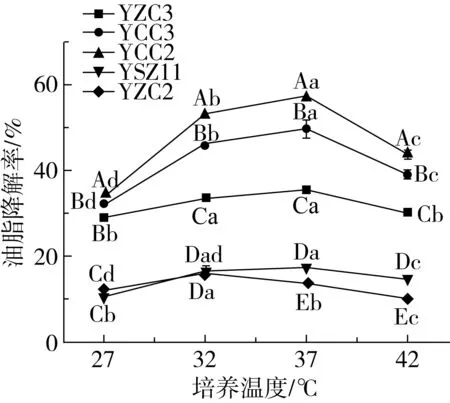
注:不同大写字母表示相同培养条件不同菌株之间油脂降解率差异显著(P<0.05);不同小写字母表示菌株在不同培养条件油脂降解率差异显著(P<0.05),下同。图3 培养温度对油脂降解率的影响
2.6 培养时间对油脂降解率的影响
培养时间对油脂降解率的影响如图4所示,随着培养时间的延长,油脂的降解率呈现先显著上升后趋于平缓的趋势。除菌株YZC2外,其余4株菌株油脂降解率培养48 h与60 h时无显著性差异(P<0.05),说明此时酶活力较弱,油脂降解能力低。5株菌株在培养60 h时,油脂降解率排序为:YCC2>YCC3>YZC3>YSZ11>YZC2。

图4 培养时间对油脂降解率的影响
2.7 接菌量对油脂降解率的影响
如图5所示,随着接菌量的增加,油脂降解率不断提高,当接菌量为0.20%时,5株菌株对油脂的降解率均达到最高,YZC3、YCC3、YCC2、YSZ11、YZC2降解率范围为14.57%~56.57%。当继续加大接种量时,油脂的降解率开始下降。
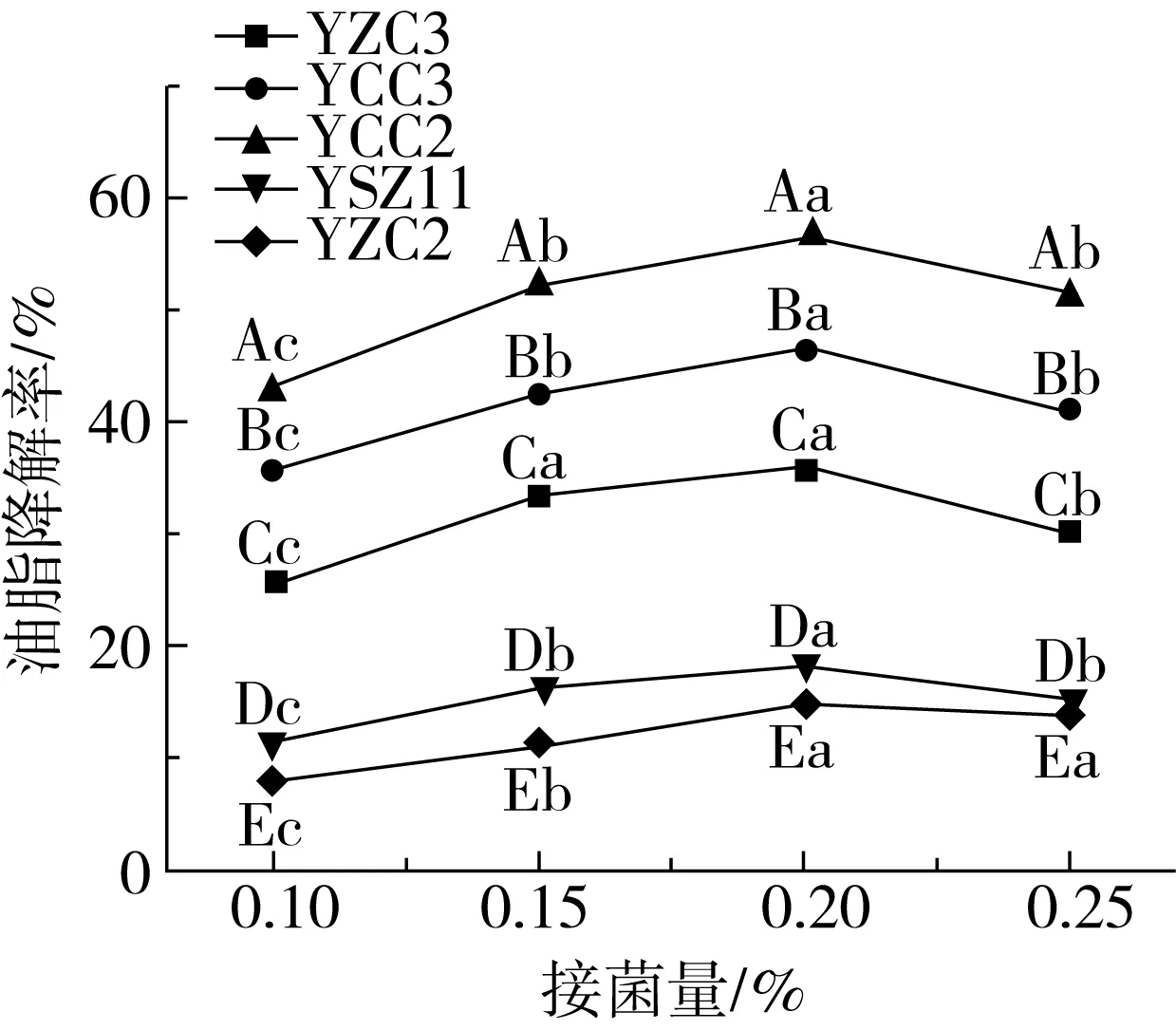
图5 接菌量对油脂降解率的影响
2.8 菌株抗氧化性分析
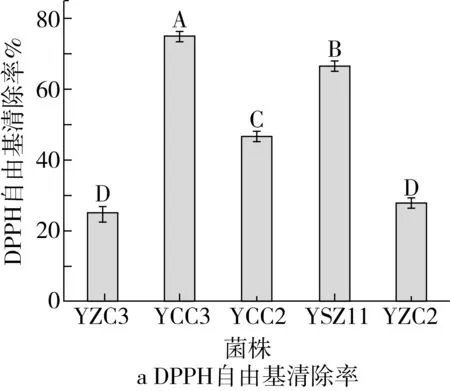
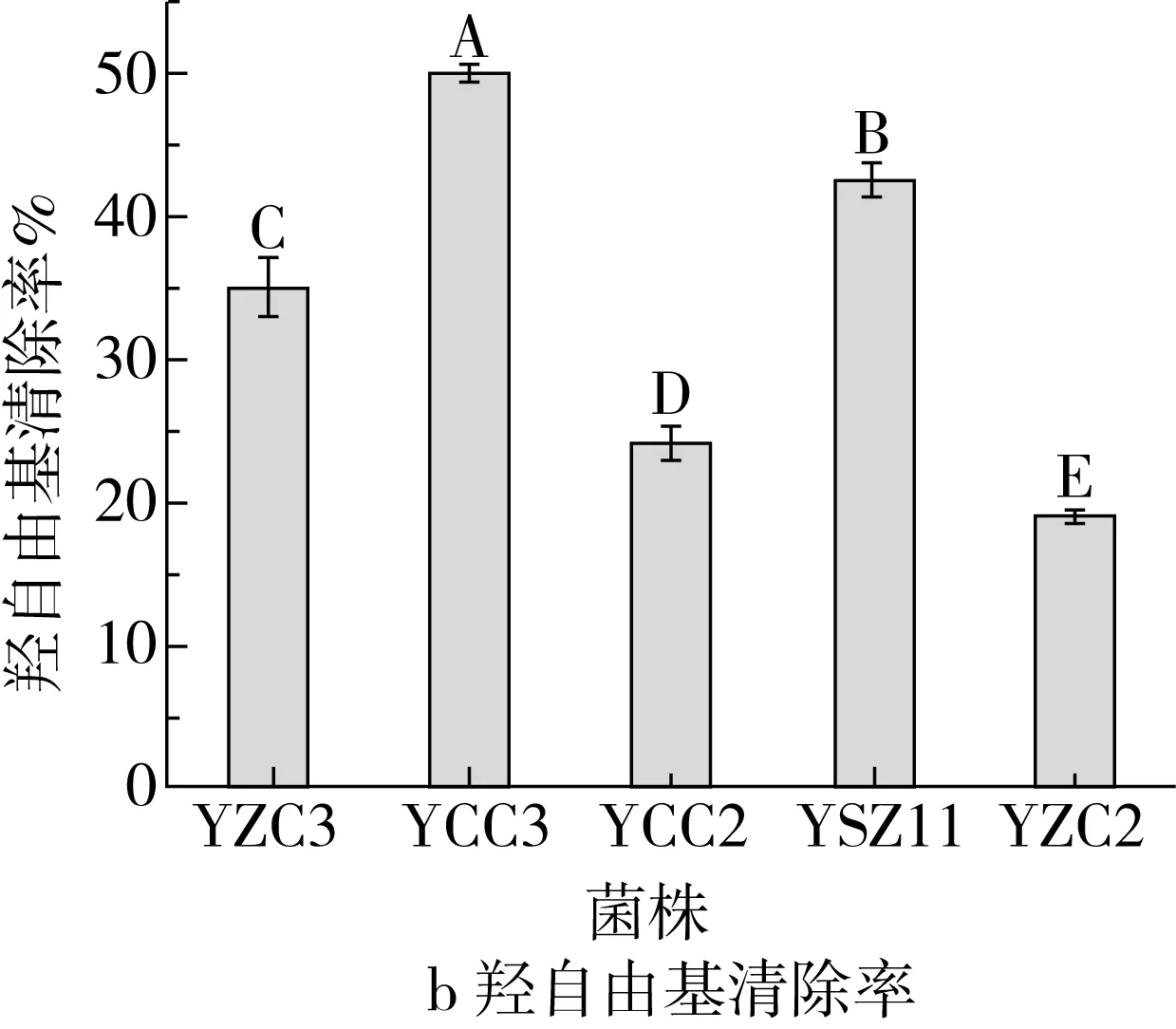
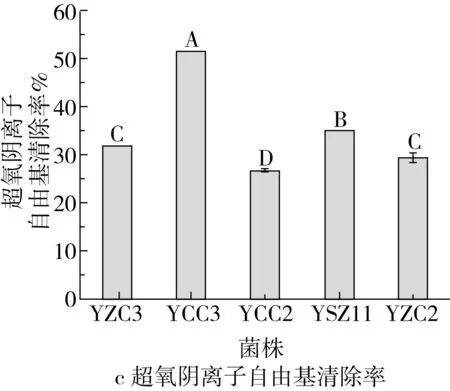
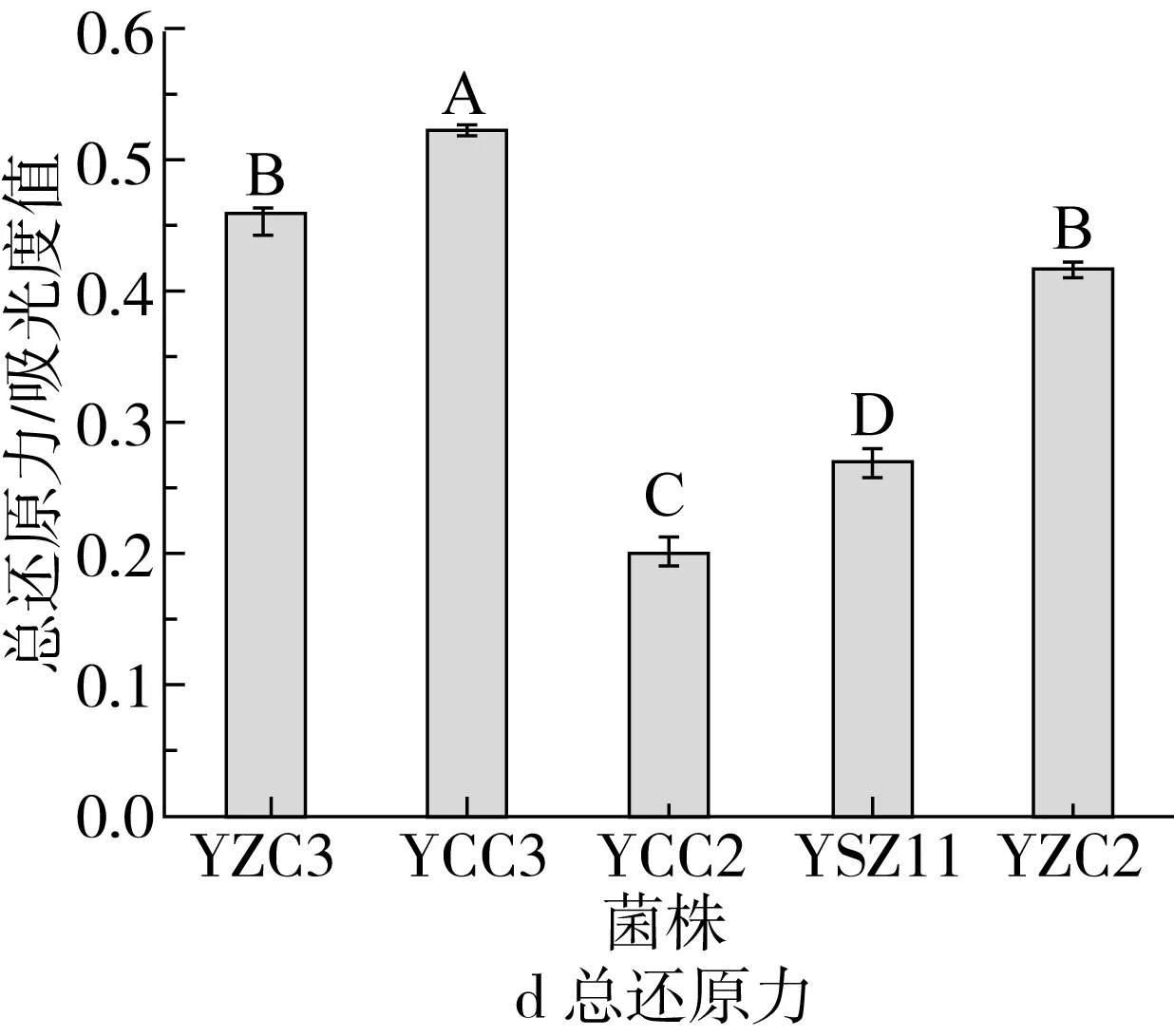
注:不同大写字母(A~E)表示差异显著(P<0.05)。图6 5株菌株的抗氧化能力
5株菌株的抗氧化能力如图6所示。如图6a可见,5株菌株对DPPH自由基均具有清除能力,不同菌株对DPPH自由基清除能力存在差异,菌株YCC3对DPPH自由基清除率最高,为74.96%,其次为菌株YSZ11,DPPH自由基清除率达到66.84%,YZC3的清除率最低为25.04%,仅达到菌株YCC3清除率的33.40%。由图6b可知,5株菌株对羟自由基均具有清除能力,清除率在19.06%~50.17%之间。其中YCC3对羟自由基清除能力最强,为50.17%,显著高于其他菌株(P<0.05),YZC2对羟自由基清除能力最弱,为19.06%。由图6c可知,5株菌株均对超氧阴离子均具有清除能力,且不同菌株之间清除率存在显著性差异(P<0.05)。YCC3对超氧阴离子自由基清除率最高,为51.79%,显著高于其他菌株(P<0.05)。图6d为5株菌株的总还原力测定。可以看出5株菌株均具有还原性,不同菌株总还原力有显著性差异。总还原力大小依次是YCC3>YZC3>YZC2>YSZ11>YCC2。综合发现5株菌株均具有抗氧化性,且不同菌株抗氧化能力有所差异。总体而言,菌株YCC3的抗氧化能力最强,菌株YSZ11和YCC2的抗氧化能力次之。
3 讨论
脂肪酶对于发酵肉制品的营养价值和风味的形成具有十分重要的作用,在发酵过程中不仅对游离脂肪酸的释放起主导作用,而且可以在短时间内积累大量的风味前体物质,加速发酵肉制品的成熟。发酵肉制品中脂肪酶的来源有两个途径:肉组织中的内源性脂肪酶和在发酵过程中微生物分泌的脂肪酶。国内外许多研究人员研究了不同源菌株对发酵肉制品脂质分解的影响,发现葡萄球菌、乳酸菌、微球菌均具有较强的脂质降解能力。Kenneally等[21]报道木糖葡萄球可以促进发酵香肠中游离脂肪酸的释放,提供更加丰富的风味前体物质。Lorenzo等[22]采用商业发酵剂制作发酵香肠,发现添加发酵剂(清酒乳杆菌和木糖葡萄球菌)香肠中脂肪酸含量显著高于对照组(P<0.05)。
菌株是否具有脂解能力与其是否含有编码脂肪酶的基因紧密相关。根据NCBI官网查询,葡萄球菌和巨球菌编码脂肪酶的相关基因为FJ979867.1、FJ979868.1、AY551101.1,本实验5株菌株中均发现了这3种基因,这也是菌株具有脂解能力的原因所在。编码基因不同,则生成的脂肪酶作用机制不同。如华根霉中基因pro27RCL编码的脂肪酶对C6-C8中链脂肪酸具有分解作用,而基因mRCL编码的脂肪酶则分解短链脂肪酸[23]。此外,有的菌株虽含有相同的编码基因,但表达量也存在差异。张开屏等[20]对6株具有产脂肪酶性能的乳酸菌进行研究,发现6株菌株中均具有编码脂肪酶的基因Lip0069、Lip0893,但不同菌株表达量存在显著差异(P<0.05),这也是降脂能力存在差异的原因所在。
不仅编码脂肪酶的基因表达量决定菌株的脂质降解能力,培养条件(pH、温度、时间、接菌量)也对菌株的降脂能力有重要影响。肉制品在发酵过程中利用微生物分解碳水化合物,产生大量乳酸[24],导致肉中pH降低,因此,菌株和所产脂肪酶的耐酸性需引起重视。本实验的5株菌株在pH为7时酶活性均较高,但随着pH的下降,酶活性也随之下降,只有菌株YCC2表现出较强的耐酸性。Kamarudin等[25]研究报道,表皮葡萄球菌分泌的脂肪酶在中性条件时表现出较高的酶活,随着pH的降低,其酶活也显著降低。刘元利等[26]的研究也表明pH为7时沙雷氏菌脂肪酶活性最高。培养温度也对发酵菌株的降脂能力有重要影响。本实验中的5株菌株均在32~37 ℃时油脂降解处于一个较高水平,李晓楠等[27]报道35 ℃是脂肪酶活力较高的温度,赵兴秀等[28]则研究发现所分离纯化的菌株在30 ℃培养时具有最高的酶活力。培养时间和接菌量也显著影响脂肪酶活性,本实验中油脂降解率在48 h与60 h无显著变化,原因可能是培养48 h时,脂肪酶活性已达到最高水平,再增加培养时间反而会使酶活力降低。邓永平等[29]研究报道显示酶活力在在72 h时最高,延长至96 h呈下降趋势。接菌量过高油脂降解率也呈下降趋势,其原因可能是过高的接种量,使培养基营养物质提前耗尽,并且培养基中的氧气含量不足,菌株提前进入衰亡期,不利于菌株的产酶[30];也可能是接种量过高时,菌株产酸速度加快,较低的pH抑制了脂肪酶的活力。
肉制品发酵过程中伴随着脂质的水解也会发生脂质的氧化反应。适度的脂质氧化,有助于发酵肉制品风味的形成。然而,脂质的过度氧化会降低产品品质。因此,具有抗氧化性也是筛选发酵菌株的一个重要指标。菌株的抗氧化能力来自于两个方面:其一为菌株本身的抗氧化性,其二为菌株的代谢产物具有抗氧化性。目前对乳酸菌的抗氧化性进行了较多研究,Chen等[31]和Ren等[32]的研究表明乳酸菌上清发酵液具有抗氧化性,推断乳酸菌的抗氧化性主要由代谢产物产生。Monica等[33]也报道乳酸菌株在发酵过程中可以产生过氧化氢酶、超氧化物歧化酶等抗氧化酶,这些抗氧化酶可将过氧化氢物分解为水,从而体现其抗氧化性[34]。此外,有研究表明利用葡萄球菌、微球菌作为发酵剂生产发酵肉制品时,脂质氧化程度显著低于不接种的空白组[35,36]。但是对葡萄球菌、微球菌等发酵菌株抗氧化性机制的研究较少。本实验通过体外抗氧化性指标测定,发现菌株的抗氧化性来源于具有较强的DPPH自由基、羟自由基、超氧阴离子自由基清除能力和具有较高的总还原力,从机制上解释了菌株抗氧化性高的原因。
4 结论
利用中性红油脂平板和三丁酸甘油酯平板从12株菌株中筛选出5株具有产脂肪酶的能力,分别为2株木糖葡萄球菌(Staphylococcusxylosus)YSZ11和YCC3、1株腐生葡萄球菌(Staphylococcussaprophyticus)YCC2、和2株巨球菌(Macrococcuscaseolyticus)YZC2、YZC3。对菌株编码脂肪酶的基因进行了检测,发现不同菌株编码脂肪酶的基因不同,且表达量也存在显著差异。5株菌株均在培养温度为32~37 ℃,接种量为0.2%,培养48~60 h时具有较高的脂质降解率。通过对发酵上清液DPPH自由基、羟自由基、超氧阴离子自由基的清除率和总还原力的测定表明5株菌株均具有抗氧化性。综合考察,5株菌株中腐生葡萄球菌YCC2和木糖葡萄球菌YCC3油脂降解能力和抗氧化性较为突出,可作为备选菌株应用于发酵香肠生产中,以促进发酵香肠中脂质分解并抑制脂质的过度氧化。
