植物乳杆菌ST-Ⅲ发酵苦荞面团中蛋白质降解变化的研究
2022-09-28李云龙欧阳博雅周一鸣吕欣东佘宣明周小理
李云龙, 欧阳博雅, 周一鸣, 吕欣东, 向 茜, 佘宣明, 周小理,3
(山西农业大学;山西功能食品研究院1,太原 030031) (上海应用技术大学香料香精技术与工程学院2,上海 201418) (上海应用技术大学;美丽中国与生态文明研究院;上海高校智库3,上海 201418)
酸面团是一种由谷物、水和乳酸菌、酵母菌等具有活性的微生物,经自然发酵或人工接菌制得的面团[1]。其发酵过程包括碳水化合物代谢、蛋白质代谢、胞外多糖的生成和挥发性代谢产物的生成等代谢反应[2,3]。尤其是乳酸菌通过发酵降解蛋白质所生成的小分子肽链、游离氨基酸等化合物,对改善面团的加工品质和产品的结构,尤其是焙烤类面制品,具有内部结构疏松细腻、风味丰富且令人愉悦,营养价值高并且在产品货架期内不易产生杂菌等优点[4-6]。
苦荞是一种富含多种营养成分和生物活性物质的杂粮,尤其是蛋白质质量分数较高,为8.5%~19%,高于玉米、水稻等作物,其中,苦荞蛋白主要由清蛋白、球蛋白、谷蛋白和醇溶蛋白组成,清蛋白和球蛋白作为主要储存蛋白,具有更高的营养价值和生物活性,而谷蛋白和醇溶蛋白主要与面制品的加工特性息息相关[7]。同时,相比于小麦来说,苦荞氨基酸含量较高且配比更合理[8],其中不仅包含了人体所需的8种必需氨基酸,也富含有人体限制性氨基酸—赖氨酸,是大米、小麦的2倍以上,其生物价相当于脱脂奶粉生物价的92.3%、鸡蛋全粉生物价的81.5%[9],因此,近年来苦荞作为功能性营养食品的一种极好资源开始受到食品与营养界的极大关注[10,11]。然而,苦荞不含麸质且纤维含量较高,其制备的饼干、面包等产品具有色泽暗淡、内部结构粗糙等缺点,将苦荞粉应用于面制产品的制备中存在巨大挑战[12,13]。发酵作为一种较好的谷物产品品质改良技术,目前在苦荞发酵制品的基础研究较少,已有研究表明,植物乳杆菌ST-Ⅲ是在酸面团发酵过程中分离出的一株具有代表性的乳酸菌,相比于其他乳酸菌来说,具有良好的耐酸和耐寒性,有利于加快发酵速度,适度的降解谷物中的蛋白质,提高发酵制品的品质及营养特性[14]。因此,本研究旨在利用植物乳杆菌ST-Ⅲ分别发酵小麦、苦荞粉,通过研究植物乳杆菌ST-Ⅲ发酵面团比较小麦及苦荞蛋白的降解和游离氨基酸的变化情况,为苦荞酸面团发酵制品提供参考。
1 材料与方法
1.1 实验材料
苦荞粉(黑丰1号);高筋小麦粉;植物乳杆菌ST-Ⅲ(CGMCC NO.0847),乳业生物技术国家重点实验室提供。
1.2 实验试剂
盐酸、氢氧化钠、硫酸、硫酸铜、氯化钠、甲基红、酚酞、乙醇、葡萄糖、甲醇、乙腈、乙酸、溴酚蓝、硼酸、考马斯亮蓝等试剂均为分析纯。蛋白分子量标准(10~150 ku);SDS-PAGE凝胶电泳试剂。
1.3 主要仪器与设备
TECAN Infinite M200PRO 多功能酶标仪,LC-10 AVP PLUS 高效液相色谱,FD-2 冷冻干燥机,Chem Studio 化学发光凝胶成像系统,S-3400N 扫描电子显微镜,K280R 冷冻离心机,FE20 pH计,LDZF-50KB-Ⅲ型高压式蒸汽灭菌锅,SPX-100B-Z 醒发箱,HH-4 数显恒温水浴锅,DYCZ-24DN 电泳仪。
1.4 方法
1.4.1 植物乳杆菌ST-Ⅲ的活化及生长曲线的测定
无菌条件下取植物乳杆菌ST-Ⅲ于MRS肉汤培养基,37 ℃下培养20 h后以5%的接种量转接到75 mL的MRS肉汤培养基中,继续于37 ℃下培养8 h。培养完成后用无菌生理盐水以4 500 r/min离心洗涤2次备用。参考杨森[1]的方法,对植物乳杆菌ST-III的生长曲线进行测定。
1.4.2 植物乳杆菌ST-Ⅲ发酵面团的制备
参考杨森[1]制备乳酸菌发酵酸面团的方法,按原料粉∶菌液质量比=2∶1的比例分别称取小麦粉、苦荞粉、混合粉(小麦粉∶苦荞粉质量比=1∶1)和洗涤后的植物乳杆菌菌液(含量为8.0 logCFU/g),混匀后放入已灭菌的发酵罐中,于30 ℃醒发箱中进行发酵后,得到小麦发酵面团(WS)、苦荞发酵面团(BS)、和混合发酵面团(WBS)。
1.4.3 面团发酵过程中中菌落密度的变化
参考杨森[1]的方法,于植物乳杆菌ST-Ⅲ发酵20 h内每隔2 h取样3种酸面团,进行植物乳杆菌ST-Ⅲ菌落密度的生长计数测定。
1.4.4 面团发酵过程中酸化能力的研究
参照Bartkiene等[15]的方法,于植物乳杆菌ST-Ⅲ发酵20 h内每隔2 h取样进行pH值和总酸的测定;参照高世阳[16]和张思佳等[17]的方法,于植物乳杆菌ST-Ⅲ发酵24 h内每隔6 h取样,测定其中乳酸与乙酸的含量。
1.4.5 面团发酵过程中蛋白质各组分含量的测定
参考杨森[1]的方法,于植物乳杆菌ST-Ⅲ发酵24 h内每隔2 h取WS、BS和WBS各1 g,依次于不同温度下溶于5 mL 1mol/L NaCl与50 mmol/L Tris-HCl(pH=8)缓冲液、5 mL 70%乙醇和5 mL 0.05 mol/L冰乙酸中,分级提取得到清蛋白、醇溶蛋白和谷蛋白,采用Bradford法[18]测定3种蛋白质含量。
1.4.6 面团发酵过程中蛋白各组分SDS-PAGE
参考杨森[1]的方法,利用SDS-PAGE凝胶电泳试剂盒对植物乳杆菌ST-Ⅲ发酵0、6、12、18、24 h时,WS、BS和WBS中的全蛋白、清蛋白和醇溶蛋白的分子量分布进行测定,凝胶染色及脱色后,拍照保存,图像利用Quantity One软件进行分析。
1.4.7 面团发酵过程中游离氨基酸含量的测定
根据SDS-PAGE实验,选取WS、BS和WBS样品各10 g,并采用张思佳等[17]的方法对样品中的游离氨基酸含量进行测定。
1.5 数据处理
采用SPSS 20.0处理数据,每组数据重复3次,取其平均值,并进行显著性分析,P<0.05表示差异显著。同时,采用Origin 2019绘图。
2 结果与分析
2.1 植物乳杆菌生长曲线及乳酸菌发酵面团菌落密度的变化
植物乳杆菌ST-Ⅲ在MRS肉汤培养基中的生长曲线如图1所示,经过6 h的延滞期后在6~14 h进入对数期,快速生长,14 h后进入稳定期。微生物生长曲线的测定可以为发酵面团制备过程中植物乳杆菌的接种和乳酸菌在面团发酵过程中的生长分析提供依据[19]。3种发酵面团中植物乳杆菌ST-Ⅲ的接种量均为8.0 logCFU/g发酵面团。植物乳杆菌ST-Ⅲ经历了2 h的延滞期后进入对数生长期;在稳定期,WS、BS和WBS中的植物乳杆菌ST-Ⅲ菌体密度分别达到11.751、12.410 、12.079 logCFU/g发酵面团;进入对数生长期后,相较于WS而言,植物乳杆菌ST-Ⅲ在BS和WBS中的生长更加旺盛,这可能是由于对数生长期时BS和WBS的酸性环境更加适宜植物乳杆菌ST-Ⅲ的生长,因而促进了植物乳杆菌ST-Ⅲ的繁殖代谢;发酵后期,植物乳杆菌ST-Ⅲ因3种酸面团中的营养物质缺乏而生长缓慢[20]。
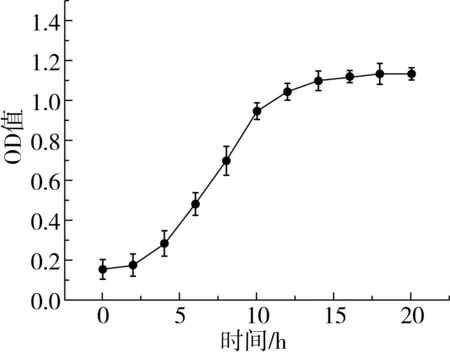
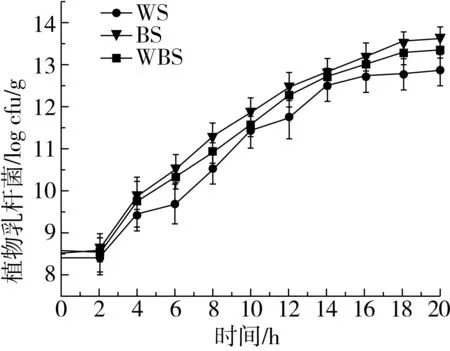
图1 植物乳杆菌ST-Ⅲ生长曲线和酸面团中乳酸菌菌落密度变化
2.2 面团发酵过程酸化能力的变化
乳酸菌发酵面团中乳酸菌的生长可以使面团pH降低,总酸度升高[21]。综合图1和图2可以看出,BS为弱酸性面团,经植物乳杆菌ST-Ⅲ发酵后,3种酸面团pH均随着发酵时间的增加逐渐下降,TTA则相反。其中,在发酵初期3种酸面团酸化速率均较慢。但随着植物乳杆菌ST-Ⅲ的不断扩增,产酸速率加快,当发酵6~12 h时,BS的pH急剧下降,总酸度急剧上升,且下降变化显著快于WS、WBS,这可能是由于处于对数生长期的植物乳杆菌ST-Ⅲ对苦荞基质具有更强的适应性,因此代谢更为旺盛。当发酵进行18 h后,随着底物不断消耗,乳酸菌的生长和代谢受到抑制,3组酸面团pH均趋于稳定,但其TTA仍呈现缓慢上升趋势,直至发酵20 h,WS、BS和WBS的TTA分别为16.28、24.39、22.26 mL,可能是由于苦荞发酵基质灰分含量较高,对酸具有较强的缓冲能力,因此BS的TTA显著高于WS、WBS。
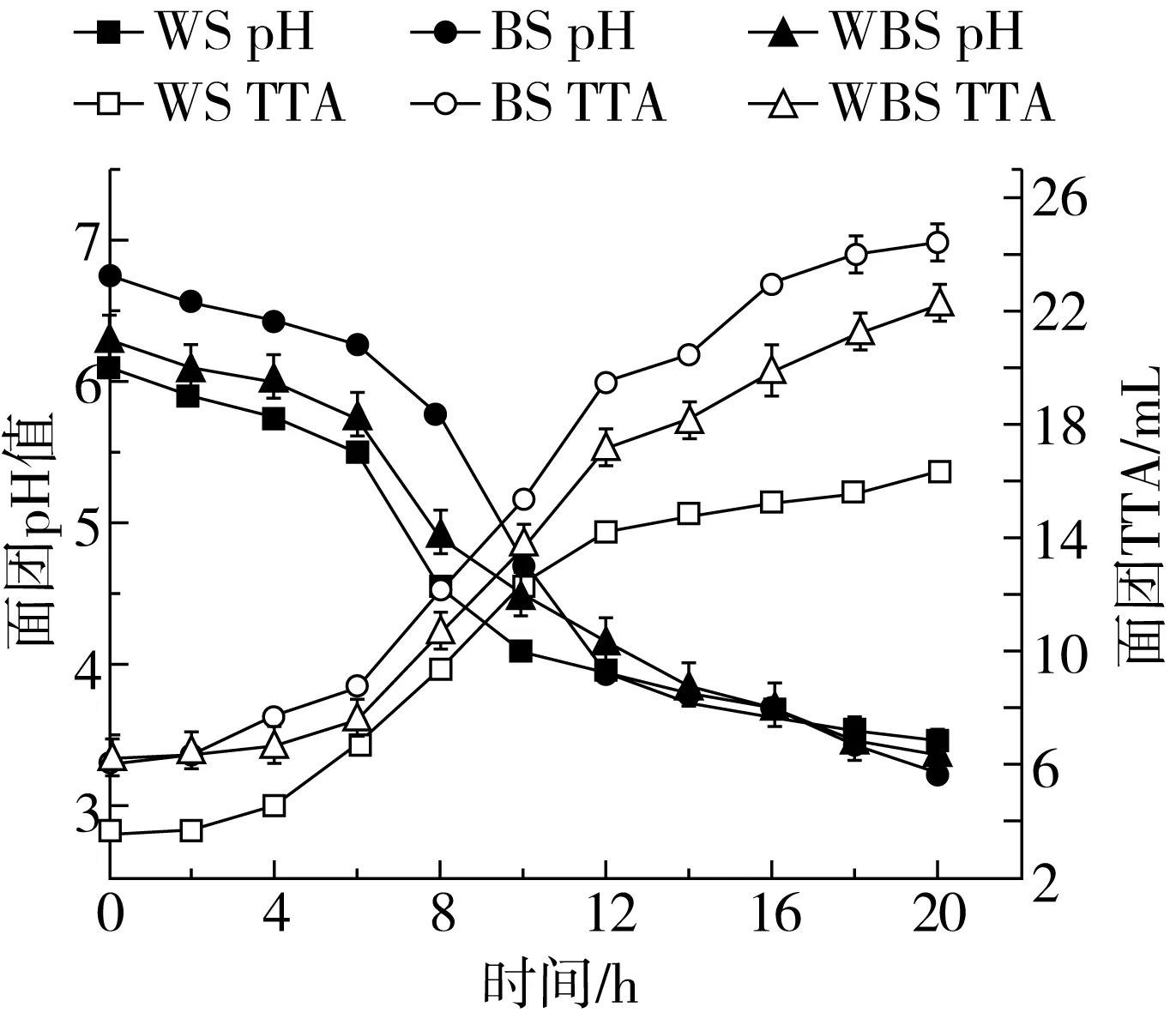
图2 植物乳杆菌ST-Ⅲ发酵酸面团pH值与TTA的变化
2.3 面团发酵过程中有机酸含量的变化
植物乳杆菌ST-Ⅲ为兼性发酵乳杆菌,优先进行糖酵解途径,即在发酵过程中利用葡萄糖产生乳酸,而后利用戊糖进行戊糖磷酸途径产生乙酸[22]。图3表明,BS中的乙酸含量在发酵12 h后分别为WS和WBS中乙酸含量的1.89、1.28倍;而BS中乳酸含量在发酵12 h分别为WS和WBS中乳酸含量的2.62、1.24倍,此现象与植物乳杆菌ST-Ⅲ的生长曲线及其在3种发酵面团的过程中其菌落密度变化趋势有一定的联系。植物乳杆菌ST-Ⅲ在发酵WS的过程中所产生的乳酸和乙酸含量均低于BS和WBS,其中,发酵24 h后BS中的乙酸含量分别为WS与WBS中乙酸含量的1.61、1.06倍;而BS中乳酸的含量分别为WS与WBS中乳酸含量的1.75、1.15倍。由植物乳杆菌ST-Ⅲ在发酵3种发酵面团过程中有机酸含量的变化,可推测BS中的蛋白质在发酵过程中能够被更加广泛地被水解,可能引起BS中游离氨基酸含量相对增幅较大。
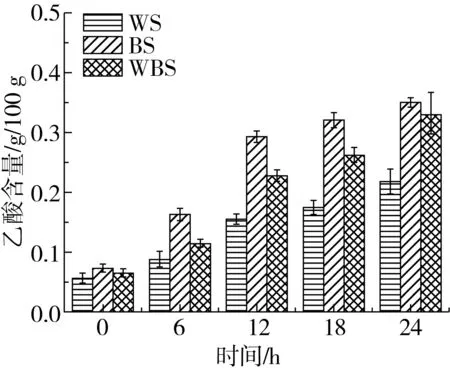
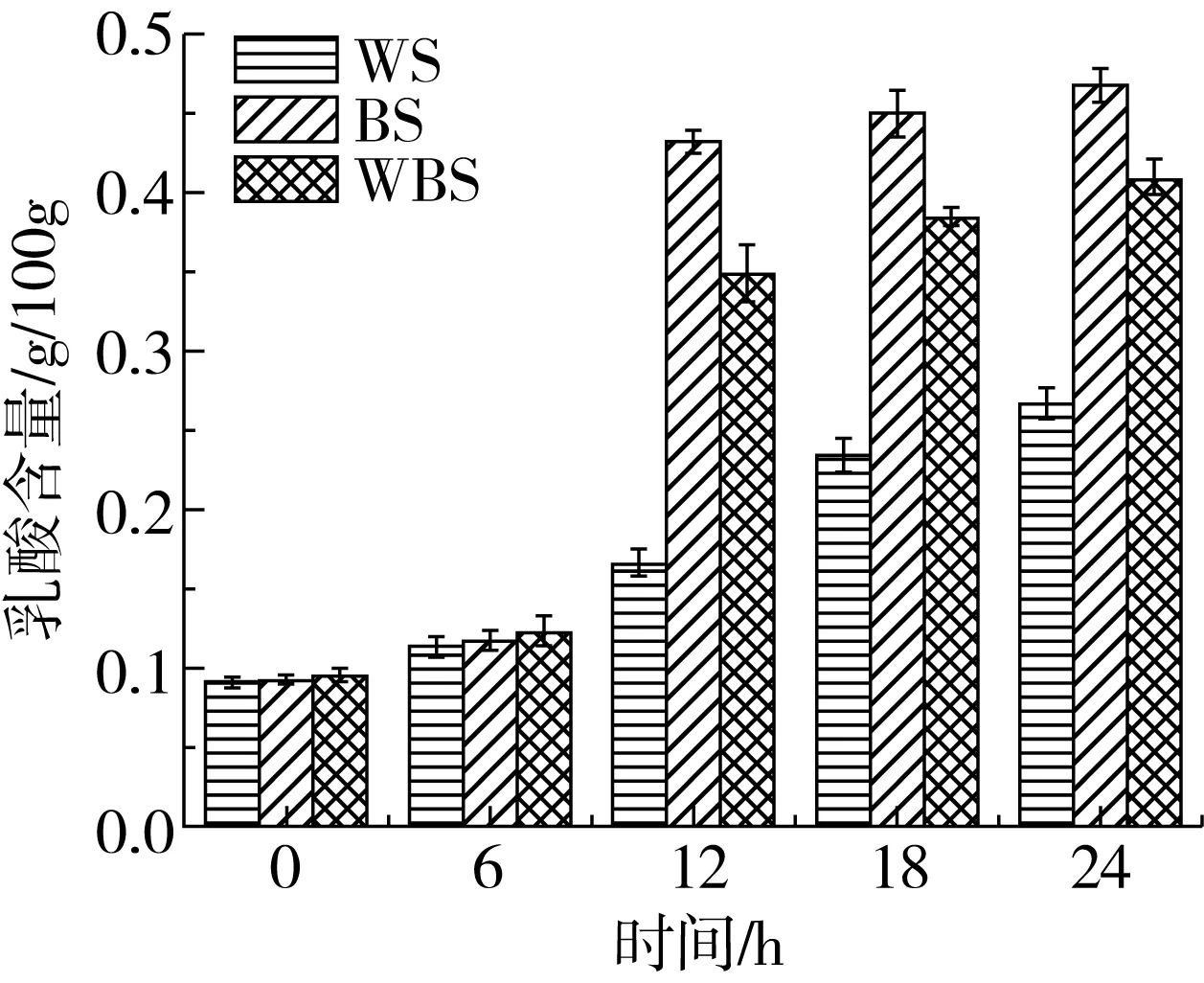
图3 植物乳杆菌ST-Ⅲ发酵酸面团中乙酸与乳酸含量的变化
2.4 蛋白质各组分含量变化
酸面团对面团中蛋白质降解程度不同,这可能是乳酸菌发酵不同谷物基质过程中,代谢产生有机酸的种类和含量差异造成的[23]。由表1可知,WS、BS、WBS中清蛋白,醇溶蛋白,谷蛋白含量随着发酵的进行具有显著差异。在发酵过程中,各组面团中的清蛋白含量均呈现下降的趋势。经过24 h的发酵,BS、WBS的清蛋白分别有30%、15.8%被降解,而WS的清蛋白则有90%被降解。植物乳杆菌ST-Ⅲ在发酵过程中对小麦面团中可溶性蛋白具有极强的降解作用,且对酸面团中清蛋白的降解主要集中在4~16 h。而含有苦荞的酸面团中清蛋白随着发酵时间的延长,降解速率较慢。
与清蛋白相比,WS、BS和WBS中的醇溶蛋白含量随着3种酸面团的发酵均呈现出先增加后减少的趋势。3种酸面团中醇溶蛋白的含量随着植物乳杆菌ST-Ⅲ发酵的进行均有不同程度的增长,这一增长趋势分别持续至WS发酵至16 h时,而当BS和WBS发酵至18 h时,醇溶蛋白含量才呈现下降的趋势。在发酵24 h后,WS、BS和WBS中醇溶蛋白较发酵初期上升,这可能是由于植物乳杆菌ST-Ⅲ的繁殖和代谢产酸促进了酸面团中诸如清蛋白等可溶性蛋白的溶解从而导致醇溶蛋白含量的增加[24]。由于醇溶蛋白的变化可能对面团的延伸性具有较大的影响,因此从醇溶蛋白的变化趋势可推测,利用植物乳杆菌ST-Ⅲ发酵苦荞酸面团能够改善苦荞面制品的加工品质。
面团发酵过程中乳酸菌的代谢产物对面团中谷蛋白具有较强的降解作用,对面团的劲度、韧性有较大的影响[24]。植物乳杆菌ST-Ⅲ发酵对3种发酵面团中的谷蛋白均有着明显地降解作用,且随发酵时间的进行具有显著差异(P<0.05);经过24 h的发酵后,WS中4.38%的谷蛋白被降解,而BS和WBS中的谷蛋白则分别被降解了4.77%、4.45%。
2.5 面团发酵过程中全蛋白SDS-PAGE图谱变化
利用Quantity One对图4的SDS-PAGE谱图进行分析得到蛋白质的质量分数(表2)。植物乳杆菌ST-Ⅲ发酵过程中,3种发酵面团中全蛋白含量均呈现下降趋势,这表明植物乳杆菌ST-Ⅲ发酵苦荞酸面团有助于将大分子苦荞蛋白降解为小分子,从而提高苦荞蛋白的利用率。结合图1可知,植物乳杆菌ST-Ⅲ在WS和WBS发酵至第6 h时开始剧烈繁殖代谢,而其在BS发酵第8 h后开始代谢产酸。BS中的苦荞蛋白,尤其是36.5 ku左右的苦荞蛋白在植物乳杆菌ST-Ⅲ发酵苦荞酸面团的过程中被降解地较为彻底,而WS与WBS中的蛋白质被降解的幅度则相对较小,这验证了BS的弱酸性环境更加适宜植物乳杆菌ST-Ⅲ的生长繁殖代谢,进一步使其产有机酸量增加,从而增进了对蛋白质的降解。
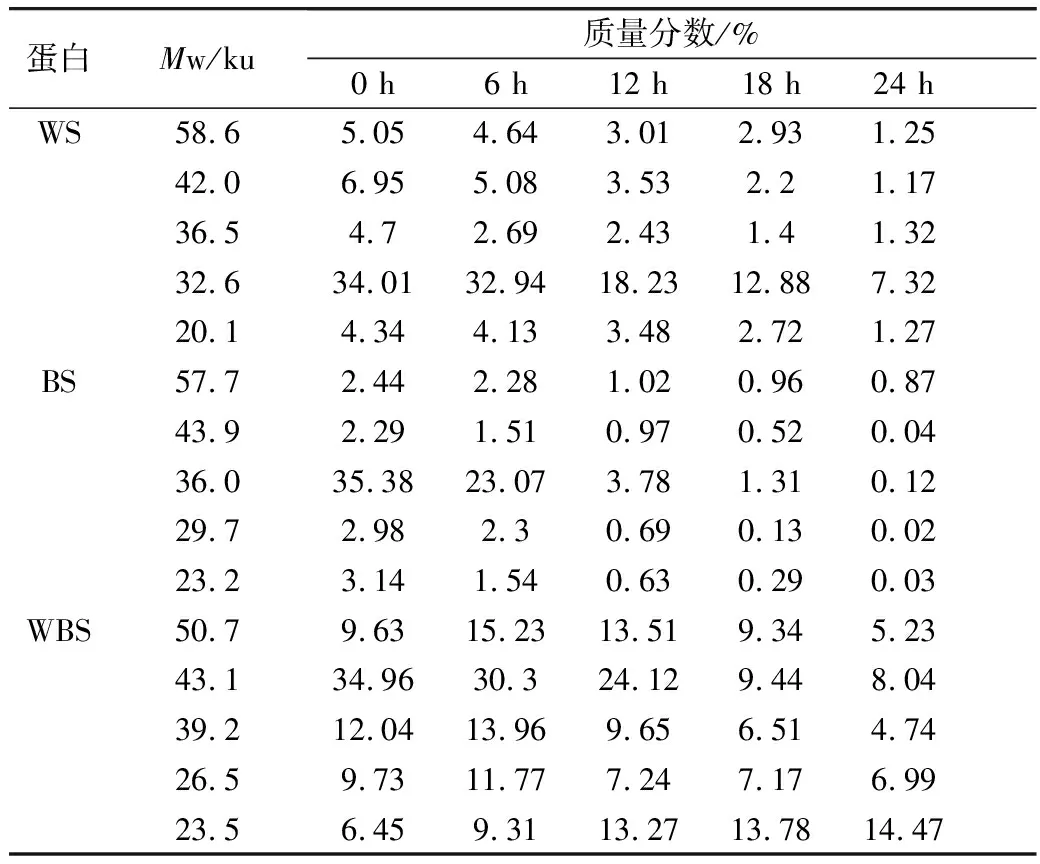
表2 植物乳杆菌ST-Ⅲ发酵3种发酵面团中全蛋白质量分数变化
2.6 植物乳杆菌发酵酸面团过程中清蛋白和醇溶蛋白SDS-PAGE图谱变化
对图5的SDS-PAGE谱图进行分析得到蛋白质质量分数(表3)。经乳酸菌发酵后,苦荞清蛋白分子量集中在23~56.7 ku之间,即1条组成2S蛋白的单链多肽链[25]。在植物乳杆菌ST-Ⅲ发酵3种酸面团的过程中,面团中的各主要分子段的清蛋白均被降解,同时结合表1来看,发酵12 h时清蛋白降解速度变缓。其中,BS中的清蛋白,尤其是36.2 ku段的蛋白质在发酵24 h后从35.38%降低至3.86%,而29.7 ku段的蛋白质则从19.01%被降解至0.07%。23.0 ku段的分子则出现积聚;由此可见,在植物乳杆菌ST-Ⅲ发酵苦荞面团有助于将面团中的部分大分子蛋白降解为小分子蛋白,从而促进人体对苦荞蛋白的吸收。
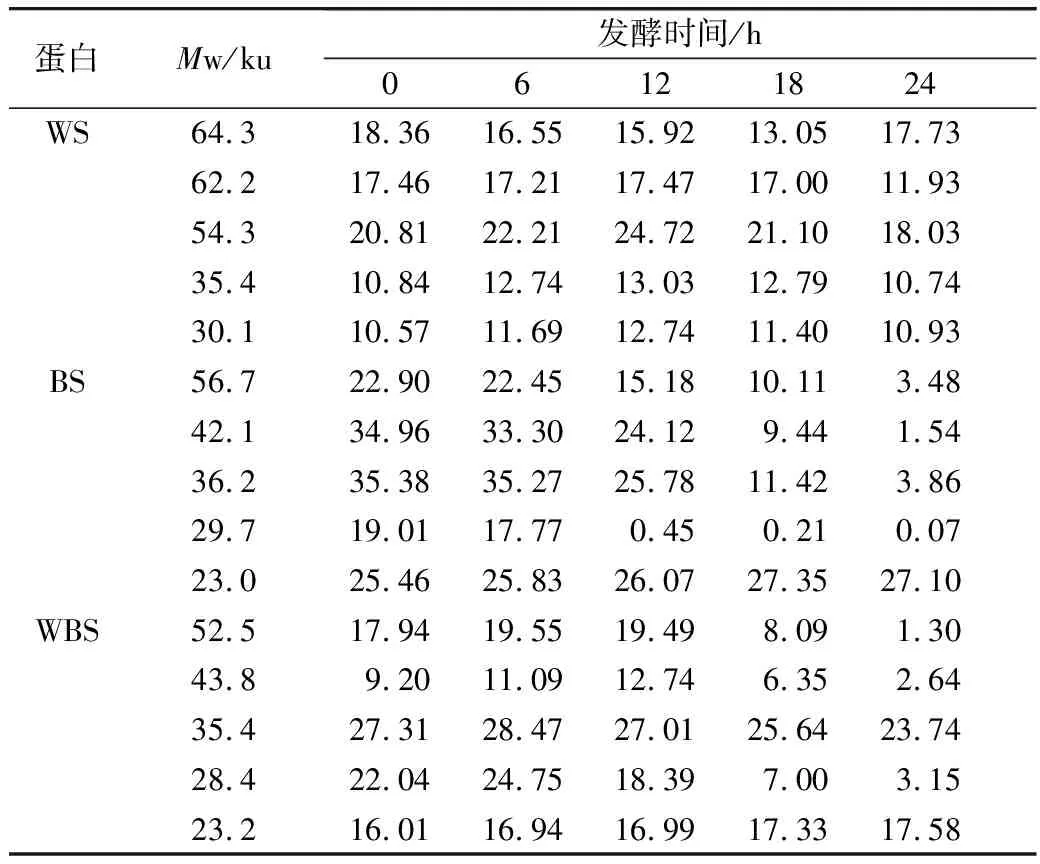
表3 植物乳杆菌ST-Ⅲ发酵WS过程中清蛋白质量分数变化/%
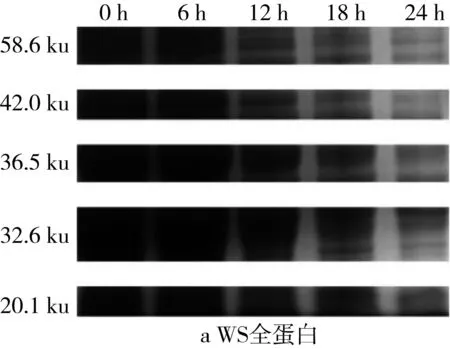
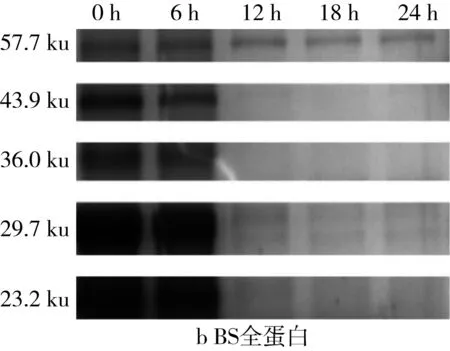

图4 植物乳杆菌ST-Ⅲ发酵酸面团过程中全蛋白SDS-PAGE
由于苦荞中醇溶蛋白含量极少,因此本研究旨在探讨乳酸菌发酵对于小麦、苦荞中醇溶蛋白含量变化的影响。由于醇溶蛋白通过Quantity One对图6的SDS-PAGE谱图进行分析从而得到蛋白质的质量分数(表3)。发酵BS过程中,37.2 ku段的蛋白质在发酵12 h时出现积聚,而78.8、62.4、48.3k、33.2 ku段的蛋白质在出现短暂积聚后继续被降解。对于WS而言,32.9 ku段的蛋白质在发酵6 h时出现积聚,而其他大分子段蛋白均被缓慢降解。但相较于全蛋白和清蛋白而言,WS、BS、WBS的醇溶蛋白质量分数随着发酵时间的延长变化较为微小。
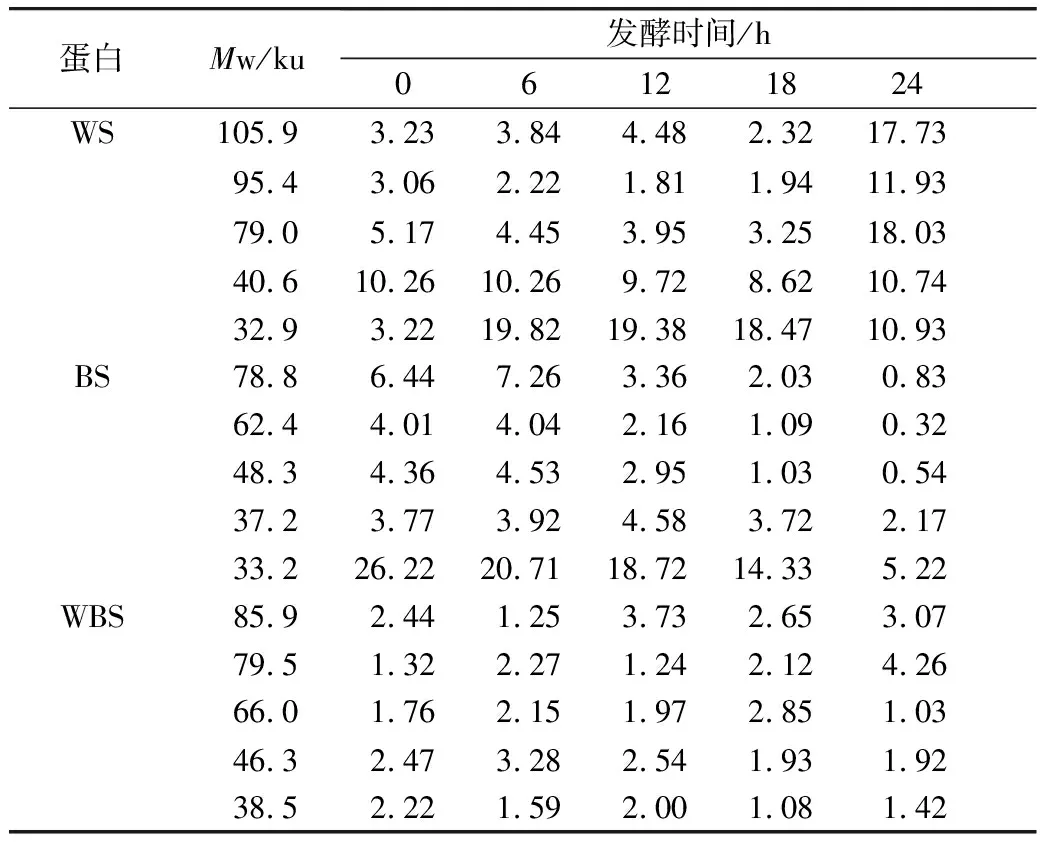
表4 植物乳杆菌ST-Ⅲ发酵WS过程中醇溶蛋白质量分数变化/%
2.7 发酵面团中游离氨基酸的变化
乳酸菌在发酵酸面团过程中能够通过其自身的生长代谢和产有机酸等方式对面团中蛋白质进行降解,将大分子蛋白降解为小分子游离氨基酸,提高酸面团中蛋白质利用率和最终产品中游离氨基酸的含量,均衡产品营养价值[26]。植物乳杆菌ST-Ⅲ发酵酸面团过程中游离氨基酸含量变化见表5。不同发酵底物作用效果差别明显。BS中的游离氨基酸含量随着发酵的进行始终呈上升趋势,发酵至18 h时,BS中的必需氨基酸含量较8 h时上升了22.22%,而非必需氨基酸含量则上升了16.92%;植物乳杆菌ST-Ⅲ发酵BS的前12 h游离氨基酸含量上升幅度较小,这可能是因为BS中的蛋白质首先被降解为小肽链,这些小肽链在12 h后被进一步地降解至游离氨基酸,同时苦荞粉中的内源性蛋白酶和淀粉酶被激活,也利于促进游离氨基酸的代谢。而WS和WBS中的游离氨基酸含量均成先上升后下降的趋势,且在植物乳杆菌ST-Ⅲ发酵18 h后酸面团中的总游离氨基酸含量均低于发酵初期,进一步说明植物乳杆菌ST-Ⅲ发酵苦荞相对于小麦而言,更有利于蛋白质水解成氨基酸。
苦荞蛋白富含一般谷物蛋白缺乏赖氨酸和精氨酸,其赖氨酸含量是大米、小麦的2倍以上[27]。随着发酵时间的延长,BS中赖氨酸、精氨酸含量升高,此现象与预期相符,也印证了发酵可以将部分蛋白质进一步降解成具有营养价值的氨基酸。赖氨酸能够增强人体的免疫力、并且能够缓解紧张等的负面情绪,同时其能够协同并促进营养素的吸收,使得这些营养素能够更好的在人体内发挥其有益功效[28]。由此可以看出,植物乳杆菌ST-Ⅲ发酵对BS中的某些必需氨基酸和非必需氨基酸的增加有着明显的促进作用,将由植物乳杆菌发酵的BS添加入烘焙类产品的制作当中,能够有效地提升产品的营养价值。

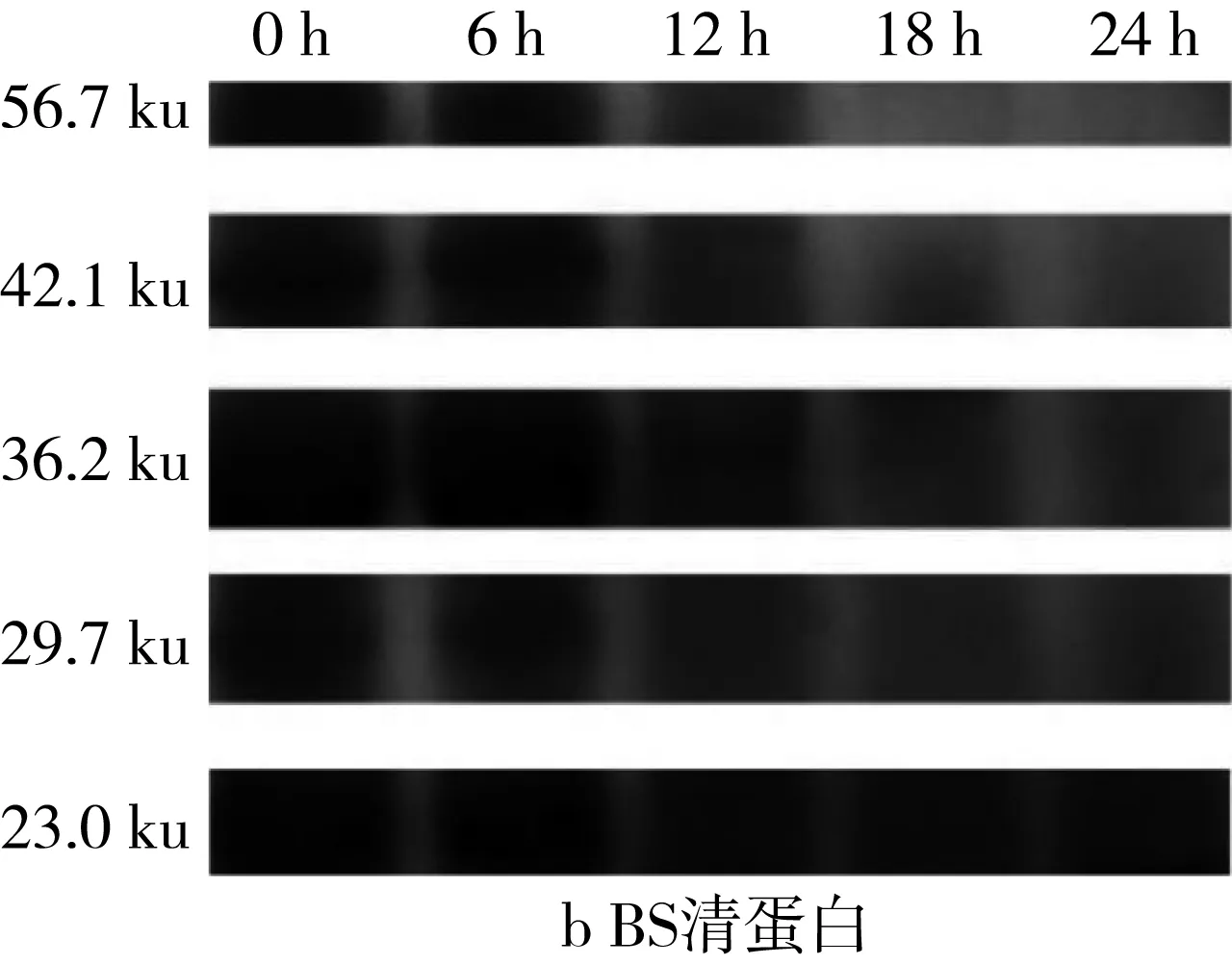
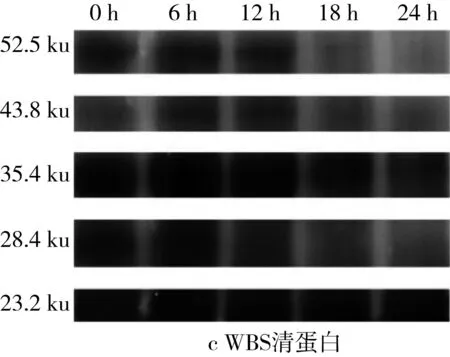
图5 植物乳杆菌ST-Ⅲ发酵酸面团过程中清蛋白SDS-PAGE

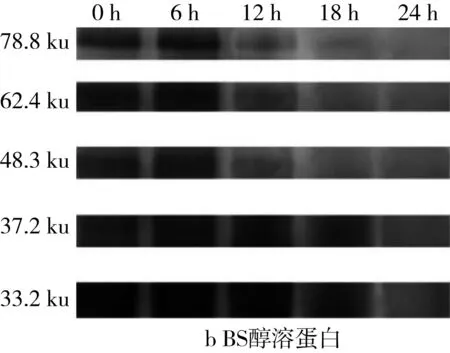
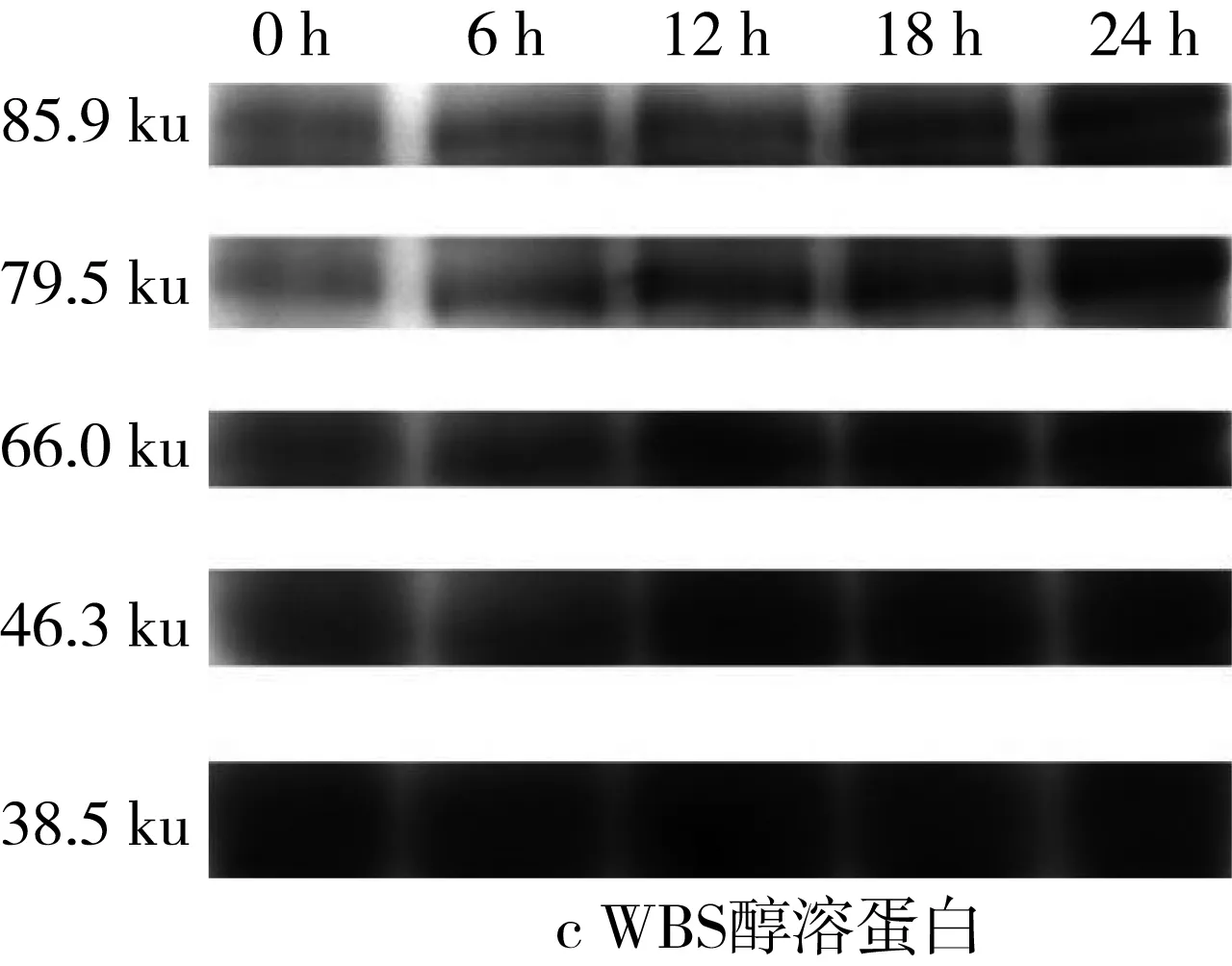
图6 植物乳杆菌ST-III发酵3种酸面团过程中醇溶蛋白SDS-PAGE变化
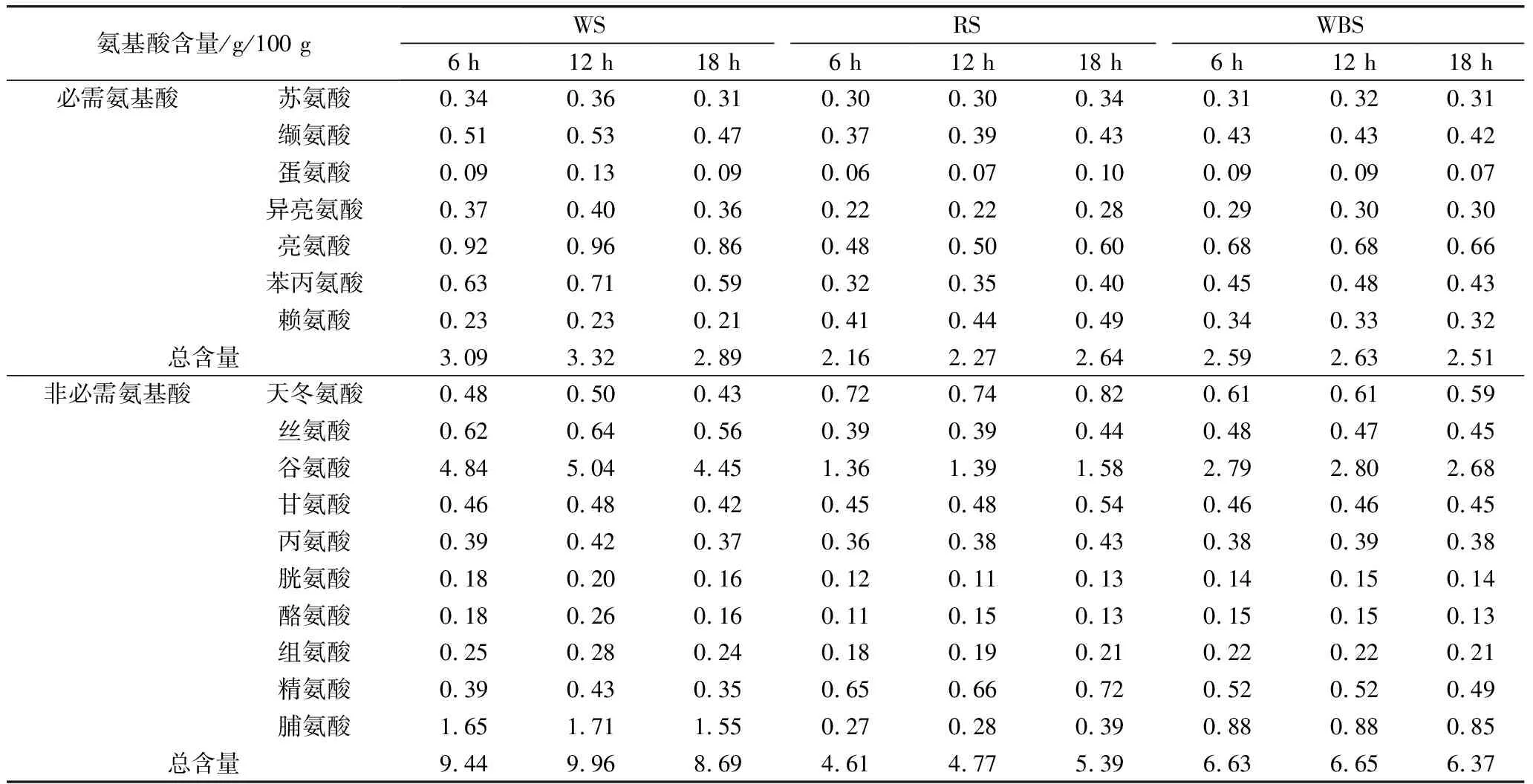
表5 植物乳杆菌ST-III发酵面团过程中游离氨基酸组成及含量变化
3 结论
将植物乳杆菌ST-Ⅲ添加到小麦、苦荞及小麦-苦荞混合粉中进行酸面团的制备,研究酸面团发酵过程中蛋白质的降解变化。结果表明,在发酵过程中,植物乳杆菌ST-Ⅲ在含有苦荞基质的酸面团中生长较为旺盛,代谢产生大量乙酸和乳酸,特别是在发酵6~12 h时,BS的pH急剧下降,总酸度上升,且下降变化显著快于WS、WBS,酸化能力较强。发酵12~18 h时,植物乳杆菌ST-III发酵对BS中苦荞蛋白适度的降解效果最为明显,且游离氨基酸含量也随着发酵的进行呈上升趋势。植物乳杆菌ST-Ⅲ在以苦荞为基质的面团中生长良好,产酸及耐酸能力较强,利于促进蛋白质的降解。并且,利用植物乳杆菌ST-Ⅲ适度发酵苦荞面团,能够促进大分子量蛋白降解为小分子蛋白和多肽,且对BS中的某些必需氨基酸和非必需氨基酸的增加有着明显的促进作用。因此,利用植物乳杆菌ST-Ⅲ发酵技术提高苦荞面制品中的蛋白质利用率。
