TNF-α对大鼠海马神经元ERK/CREB蛋白表达的影响*
2022-09-28邬薇薇王纯辉
邬薇薇 程 高 王纯辉
安徽医科大学第四附属医院麻醉科,安徽省合肥市 230000
急慢性疼痛对认知功能特别是对学习记忆的影响日益受到重视,并成为疼痛及认知领域研究中的重要内容。海马在学习记忆中起着关键作用,1957年Scoville和MiMer在切除癫痫患者双侧海马时导致了患者顺行性遗忘,患者表现为很难形成新的记忆。此后海马在学习记忆中的作用得到了大量的研究,目前认为短期记忆的发生与长期记忆的发生与存储可能都与海马有关。如果学习时海马的蛋白质合成受到抑制,尽管动物仍能正常学习,但数天后再测试却表现为记忆的缺失。目前多项研究证实肿瘤坏死因子(TNF-α)在慢性神经疼痛的发生发展中发挥着重要的作用。 Hogg等报道TNF-α可使海马神经元之间的突触传递效率持续性减弱,从而影响学习记忆[1]。但TNF-α影响学习记忆的具体机制不详。细胞外调节蛋白激酶 (Extracellular regulated protein kinase,ERK)和环磷腺苷效应元件结合蛋白 (cAMP-response element binding protein,CREB)参与的信号系统在学习、记忆和神经可塑性以及调节细胞生长、凋亡、分化和细胞对应激反应中发挥重要作用[2-3]。本研究观察TNF-α对大鼠海马神经元ERK/CREB蛋白表达的影响,探讨TNF-α在疼痛和学习记忆中的可能作用机制。
1 材料与方法
1.1 大鼠原代海马神经元培养 取出生24h的SD胎鼠海马组织,用小剪刀剪碎,加入 5倍体积的37℃、0.125%的胰酶消化后,反复吹打,中止胰酶,用 2 000细胞筛过滤,形成单细胞悬液。取5ml单细胞悬液,1 000r/min离心15min后培养液重悬,选择细胞密度为1.0×106ml/L,于24孔细胞培养板进行培养,培养液为Neurobasal+2%B27,3d换液1次,首次半量换液。
1.2 免疫荧光鉴定 取培养1周的海马神经元进行免疫荧光检测,用预冷的40g/L多聚甲醛常温固定15min,PBS洗涤(3min×3次),再用含0.3% Triton-x-100和5%山羊血清的PBS湿盒内室温封闭通透1h,加入一抗神经元标志物β-tubulinⅢ(1∶200),4℃湿盒孵育过夜。次日用PBS洗涤(3min×3次),加入荧光二抗(Alexa-Fluor 488,1∶500)避光孵育1h。PBS洗涤(3min×3次),共聚焦显微镜下观察。
1.3 实验分组 神经元细胞分为两组培养:正常培养组和TNF-α组。TNF-α组神经元培养液中加入50μg/L TNF-α,正常组加入相同体积的培养液。培养48h后行免疫荧光检测神经元形态;使用RT-PCR和WB检测ERK/CREB mRNA和蛋白表达情况。
1.4 RNA提取和RT-PCR检测 按照RT-PCR的方法进行实验,用Trizol 溶解细胞,收集胞内的总 RNA。使用SYBR Green Premix Ex Tap试剂盒进行qPCR实验,并在ABI7500qPCR仪进行检测。使用GAPDH作为内参,ERK的正向引物为5’-CCAGGAAAGCATTACCTTGACC-3’,反向引物5’-CCAGAGCCTGTTCAACTTCAATC-3’;CREB的正向引5’-TGGCTAACAATGGTACGGATGG-3’,反向引物5’-GTGCTGTGCGGATCTGGTATGT-3’,GAPDH的正向引物5’-CCTCGTCCCGTAGACAAAATG-3’,反向引物5’-TGAGbenGTCAATGAAGAAGGGGTCGT-3’,参考GAPDH的表达结果标准化ERK和CREB的表达结果。用DA相对拷贝数和相对表达量(2-ΔΔCt)表示ERK和CREB基因的相对表达量。
1.5 Western blot检测 Western blot检测两组细胞中ERK/CREB蛋白表达情况。两组神经元培养48h后,用PBS洗涤,lysis buffer裂解细胞。收集细胞裂解液,在4℃,10 000r/min离心20min,收集上清液,并用BCA试剂盒检测蛋白水平。10%的SDS-PAGE溶解40mg蛋白后转移到PVDF膜上,再用TBTS配制的5%的脱脂牛奶封闭PVDF膜1h,一抗兔抗ERK多克隆抗体(1∶2 000)和兔抗CREB多克隆抗体(1∶1 000)4℃孵育过夜,TBTS液洗涤3次后,二抗(1∶500)室温孵育1h,使用ECL法显影。
2 结果
2.1 大鼠海马神经元形态学观察和免疫鉴定 培养48h后大鼠海马神经元贴壁,胞体透亮,饱满,透光性强,部分细胞发出突起,长短不等,随着培养时间的延长,突起长度逐渐增加,部分形成神经网络(见图1)。取培养5d的海马神经元细胞进行免疫荧光检测,可见神经元细胞表达特异性标志物 β-tubulinⅢ(见图2)。
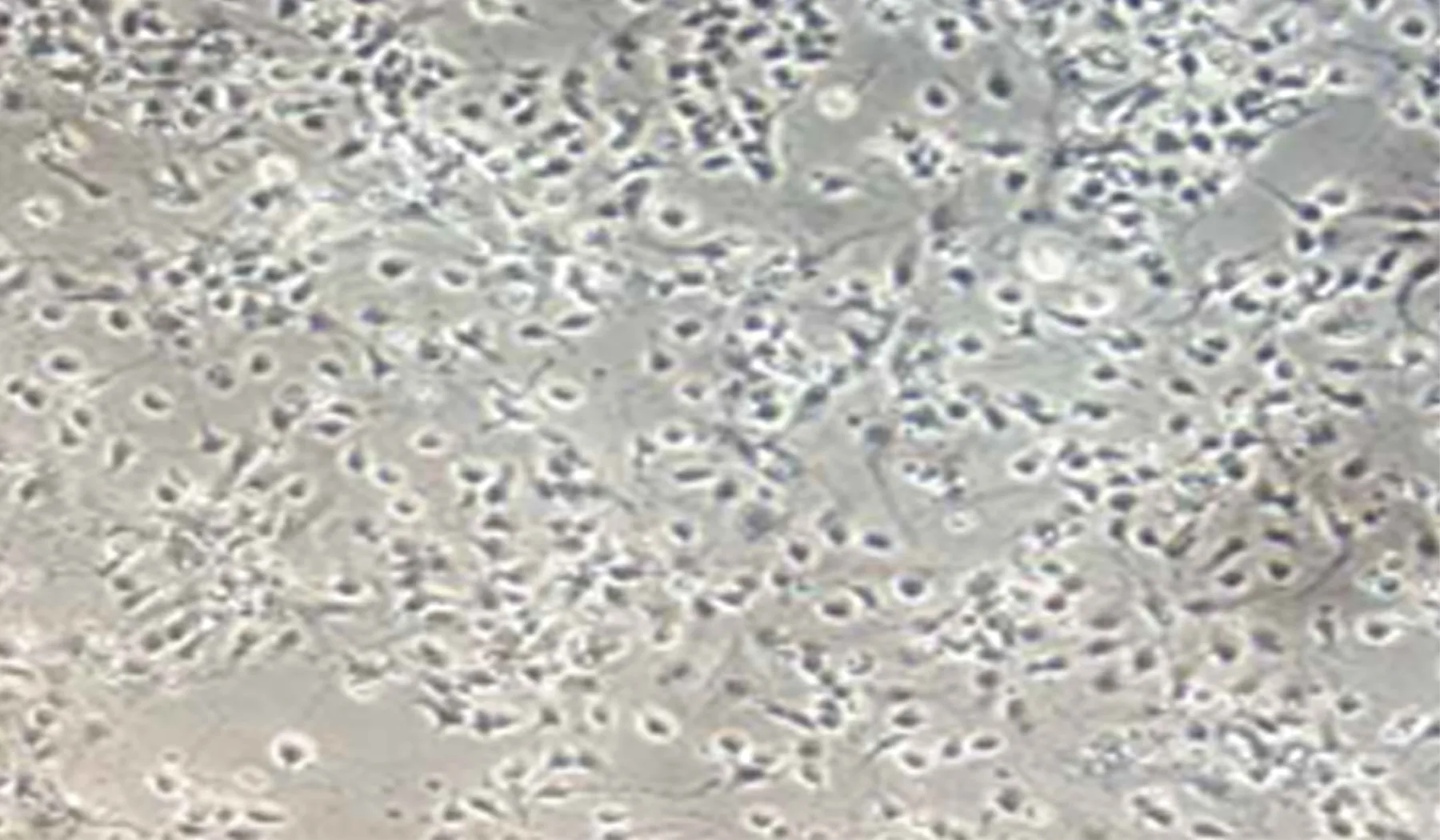
图1 海马神经元培养48h后光镜图(×200)
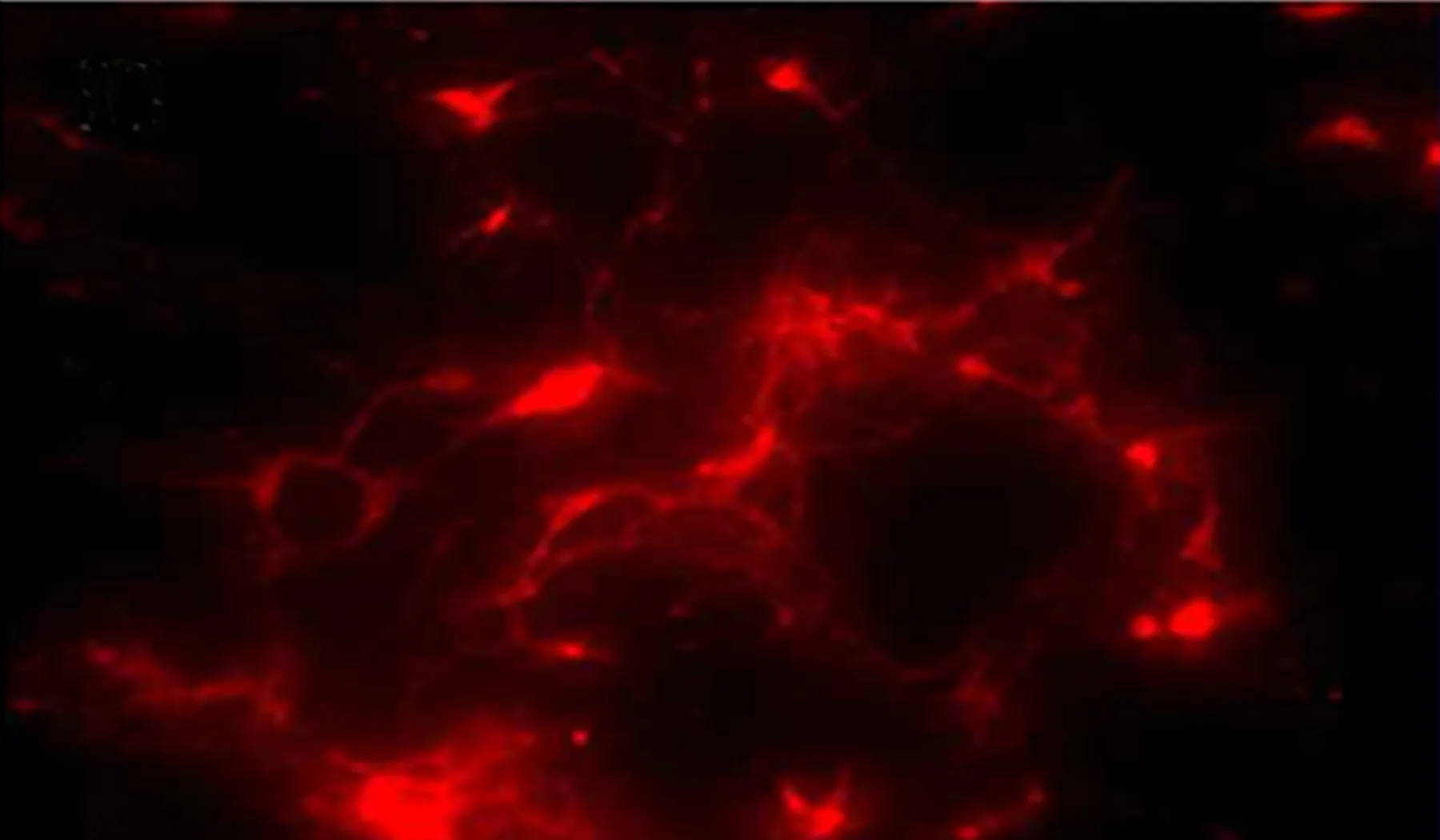
图2 海马神经元表达特异性标志物β-tubulinⅢ(×200)
2.2 不同实验组神经干细胞培养情况 神经元分为TNF-α组和正常组,培养48h后行免疫荧光检测,显示TNF-α组神经元神经突起长度(57.2±6.4)μm明显短于正常生长组(86.6±7.2)μm,差异有统计学意义(P<0.01)。见图3。
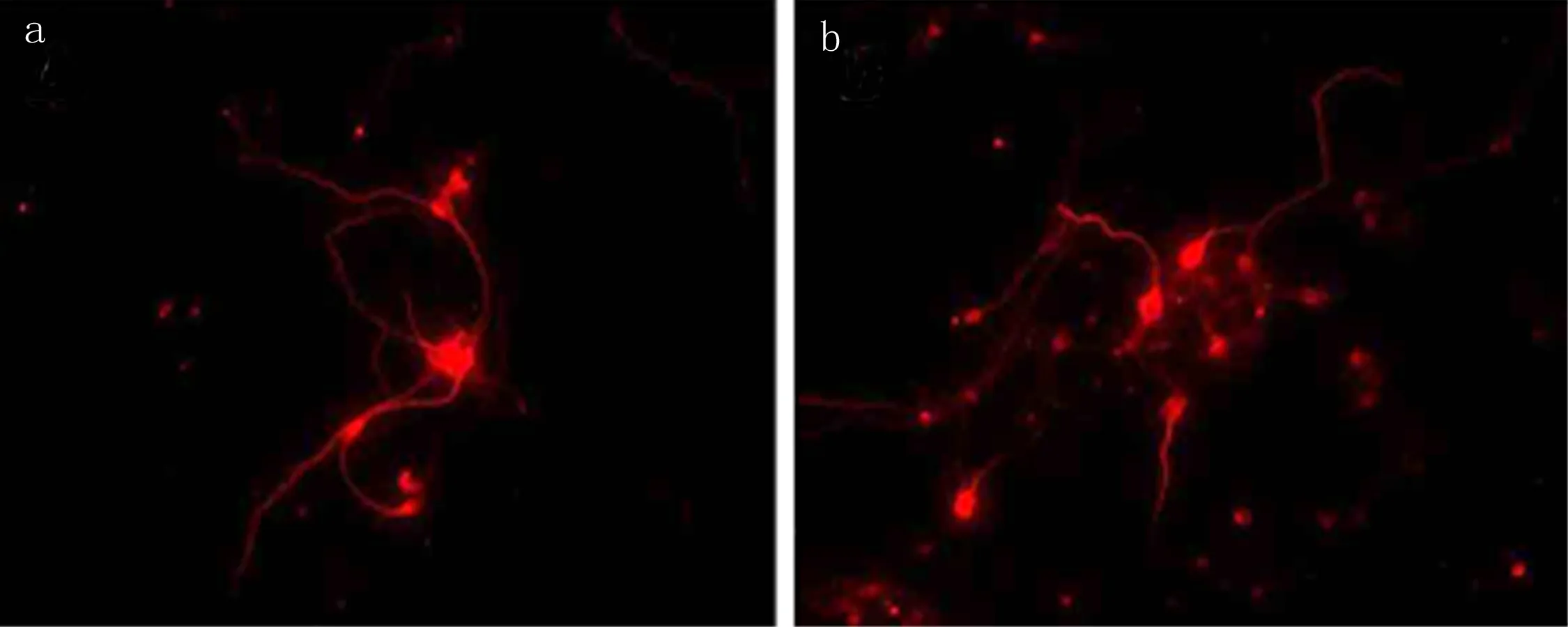
图3 海马神经元培养48h后免疫荧光
2.3 各组ERK和CREB mRNA水平 与正常培养组神经元相比,TNF-α组神经元细胞中ERK 和CREB mRNA水平明显降低,差异有统计学意义(P<0.01)。见图4。

图4 正常组和TNF-α组神经元ERK mRNA、CREB mRNA表达水平比较
2.4 各组ERK和CREB 蛋白表达情况 与正常组相比,TNF-α组ERK和CREB 蛋白表达水平明显下降,差异有统计学意义(P<0.01)。见图5。
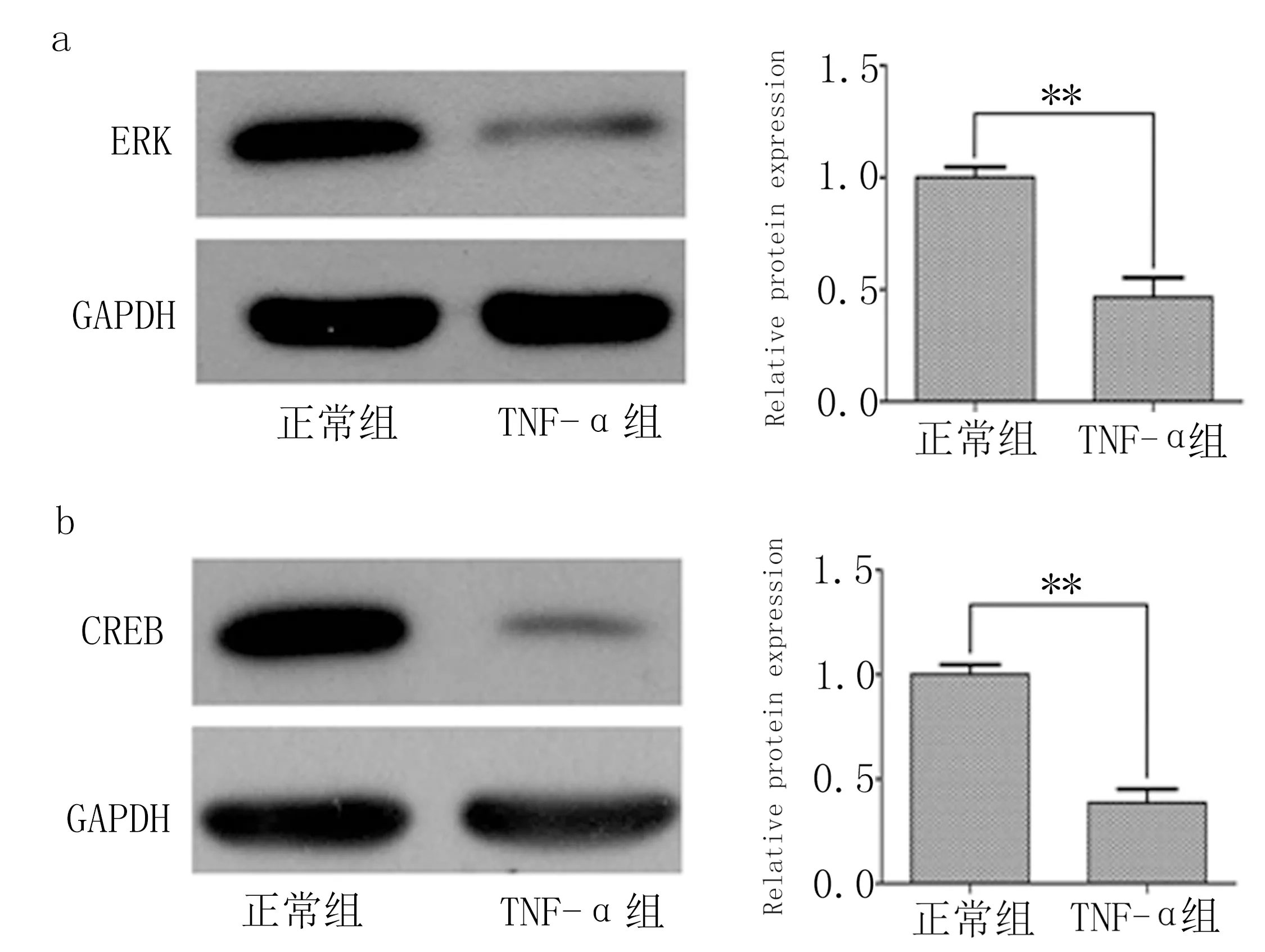
图5 正常组和TNF-α组ERK、CREB蛋白表达水平比较
3 讨论
疼痛是一种注意力依赖性的感觉刺激,在个体学习或回忆时疼痛的出现可能对学习与记忆提取时的注意力起到分散作用;而学习记忆不仅需要大脑运行信息整合,也需要认知时注意力的参与。目前临床研究发现疼痛可以导致学习记忆能力下降,炎性痛与神经病理性疼痛能够产生明显的遗忘效应。动物实验表明急慢疼痛时通常伴随认知功能障碍。疼痛的发生发展机制十分复杂,涉及众多的分子和信号通路[4-5]。
目前认为感染和阿尔茨海默病等多种炎症疾病导致的遗忘效应在分子水平的作用靶点主要是皮层与海马的TNF-α[6],2014年Liu等就研究发现慢性神经病理性疼痛时,脊髓背角与海马的TNF-α升高,并且疼痛时升高的TNF-α对脊髓和海马神经元的长时程增强作用(LTP)相反,外周神经损伤后的TNF-α表达升高并减弱海马神经元的LTP,降低突触可塑性[7]。ERK 通过激活胞质中底物而对细胞生长、发育、凋亡起调控作用,或转移至细胞核内,促进基因的转录。CREB作为ERK的下游靶标,对神经可塑性和神经元结构、功能的恢复有重要作用,尽管ERK/CREB信号转导通路在学习记忆过程中具有重要作用[8-9],但ERK、CREB作为关键信号分子,其蛋白的表达与活性调节是否参与TNF-α受体调控的疼痛遗忘效应仍研究较少。当学习事件发生时,海马与皮层的兴奋性突触末端的树突棘会表现与学习事件相关的突触可塑性的结构改变,当突触可塑性改变时,会发生CREB所介导的突触活性依赖性变化。CREB作为一个“记忆蛋白”,在新记忆的发生与巩固过程中都具有这种重要作用。CREB有磷酸化和非磷酸化两种状态,静息状态的CREB保持非磷酸化状态,活性低。在接受外界学习过程中,外界学习信号刺激使ERK信号通路激活,磷酸化ERK使CREB磷酸化增加,磷酸化的CREB活性增加后会使得胞浆内大量具有转录活性的CREB转移进入核内从而调节记忆相关的基因表达,启动基因转录及蛋白质合成,参与海马神经元突触可塑性调节,增强记忆的编码与形成[10]。
本研究中取大鼠海马神经元进行原代培养并鉴定,结果证实培养的神经元形态良好,表达神经元特异性标志物。给予TNF-α刺激后,神经元突起长度明显短于正常组,同时ERK和CREB mRNA和蛋白表达较正常组下降。这也与部分研究结果相吻合,Sun等报道TNF-α和TNF-α受体结合可后通过调节海马的ERK活性与LTP介导剧烈运动后的认知功能障碍[11]。因此笔者推测TNF-α可以通过抑制轴突生成和通过调控ERK/CREB信号通路参与这一过程。
综上所述,TNF-α可以下调大鼠海马神经元中ERK/CREB蛋白表达,并可能通过这一信号通路参与疼痛导致的学习记忆下降。
