过表达miR-217调控EZH2促进骨质疏松模型小鼠BM-MSCs成骨分化
2022-09-28李贺伟龚艳琳刘佳丽
阮 锋,李贺伟*,龚艳琳,刘佳丽,刘 平
(1.华中科技大学同济医学院附属梨园医院 骨科,湖北 武汉 430077;2.武汉市第一医院 内分泌科,湖北 武汉 430030)
骨质疏松症(osteoporosis, OP)是一种骨代谢紊乱的疾病,在绝经女性中高发,其可增加骨折风险,对绝经女性健康构成不利影响[1]。另外,骨髓间充质干细胞(bone marrow derived mesenchymal stem cells, BM-MSCs)是成骨细胞的前体细胞,其成骨分化能力可影响骨形成,在OP发生发展中具有重要作用[2-3]。因此,寻找影响BM-MSCs成骨分化的有关机制,对治疗OP有积极意义。微小RNA-217(microRNA-217,miR-217)是微小RNA(microRNA, miRNA)的一员,其与血管生成、肾脏疾病、肿瘤、OP发生发展等相关[4]。研究发现,miR-217在股骨头坏死患者的BM-MSCs中表达下调,BM-MSCs成骨分化能力降低,过表达miR-217可通过靶向调节 Dickkopf相关蛋白1表达进而促进BM-MSCs向成骨分化[5];且miR-217可通过靶向调节蛋白激酶B γ表达进而影响成骨分化[5]。以上研究表明,miR-217可能通过靶向调控有关基因表达,进而影响成骨分化,为治疗OP提供思路。此外,抑制果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2, EZH2)表达可促进祖细胞成骨分化[6],其可能为改善骨量提供新策略。且有关报道显示,miR-217可通过靶向调控EZH2表达进而影响胃癌发展[7]。因此,推测miR-217可通过调控EZH2表达进而影响OP小鼠BM-MSCs成骨分化。因此,本文通过构建OP小鼠模型,分离培养BM-MSCs,观察miR-217、EZH2在OP小鼠BM-MSCs中的表达情况,初步探究二者对BM-MSCs的作用机制,以期为临床诊治OP提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级24只C57BL/6雌性小鼠,9周龄,体质量(20±2)g]广东至远生物医药科技有限公司,许可证号:SCXK(粤)2021-0057。实验经本院动物伦理委员会批准,并遵循《实验动物的护理和使用指南》。
1.1.2 试剂:α-MEM培养基(BC-M-042-500mL)(南京森贝伽生物科技有限公司);胎牛血清(fetal bovine serum,FBS)、β-甘油磷酸钠、地塞米松和抗坏血酸(北京索莱宝科技有限公司);Lipofectamine 2000转染试剂(Invitrogen公司);Revert Aid First Strand cDNA Synthesis Kit(K1622)(上海康朗生物科技有限公司);碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒(南京建成生物工程研究所);RIPA裂解液(上海联迈生物工程有限公司);茜素红S(alizarin red S,ARS)染色试剂盒(北京百奥莱博科技有限公司);SYBR Green Real-time PCR Master Mix(QPK-201)(TOYOBO公司);一抗兔源Runt相关基因2(Runt-related transcription gene 2, Runx2)抗体、骨钙素(osteocalcin,OCN)抗体、Ⅰ型胶原(collagen typeⅠ, collagenⅠ)抗体、GAPDH抗体、EZH2抗体及辣根过氧化物酶缀合的二抗(Abcam公司);miR-217模拟物阴性对照(miR-NC)、miR-217模拟物(miR-217 mimics)、空载体(pcDNA3.1)、EZH2过表达载体(pcDNA3.1-EZH2)及miR-217、U6、OCN、Runx2、collagenⅠ、EZH2、GAPDH引物、野生型EZH2(wild-type EZH2, WT-EZH2)载体、突变型EZH2(mutant EZH2, MUT-EZH2)载体(上海生工生物工程有限公司合成)。
1.2 方法
1.2.1 小鼠的分组及处理:将小鼠适应性喂养1周后,参考文献[8]方法构建OP模型。经腹腔注射给予小鼠戊巴比妥钠(80 mg/kg,1.5%)麻醉,无菌环境下俯卧固定,备皮,行双侧卵巢切除术,设置为OP组,其余小鼠仅切除双侧卵巢位置处的脂肪组织并设置为sham组,每组均为12只小鼠,术后所有小鼠均继续饲养8周。sham组、OP组小鼠在处死前,均进行micro-CT股骨扫描以确定OP造模成功。麻醉后处死各组6只小鼠,分离双侧股骨,剔除多余组织后,研碎,用于miR-217及EZH2 mRNA检测。
1.2.2 BM-MSCs的分离及培养:按参考文献[9]提取小鼠BM-MSCs,接种于α-MEM培养液(含10%FBS)中,每3 d更换1次培养液,并在显微镜下观察细胞形态。至细胞增殖至80%左右,胰蛋白酶消化传至3~4代,用于miR-217及EZH2 mRNA检测及成骨诱导分化。
1.2.3 BM-MSCs的成骨诱导分化及细胞的分组及处理:将从OP小鼠分离且培养3~4代的BM-MSCs(2×106细胞)接种于6孔板,待BM-MSCs汇合至80%左右,将细胞分为对照组、miR-NC组、miR-217 mimics组、miR-217 mimics+pcDNA 3.1组和miR-217 mimics+pcDNA 3.1-EZH2组。用Lipofectamine 2000转染试剂盒分别对各组细胞进行转染12 h,其中miR-NC 和miR-217 mimics均为20 pmol/L,pcDNA 3.1、pcDNA 3.1-EZH2质粒4 μg。之后加成骨诱导分化培养液(含0.2%抗坏血酸、0.01%地塞米松、1% β-甘油磷酸钠、1%青霉素-链霉素及10% FBS的α-MEM培养基),每3 d换1次成骨诱导分化培养液,培养14 d,显微镜观察BM-MSCs细胞形态变化。
1.2.4 RT-qPCR检测骨组织/BM-MSCs中miR-217、EZH2、OCN、Runx2、collagenⅠ mRNA表达水平:以Trizol Reagent提取OP组、sham组小鼠骨组织/BM-MSCs(仅用于检测miR-217、EZH2 mRNA表达)及转染后各组BM-MSCs总RNA,利用RevertAid First Strand cDNA Synthesis Kit将总RNA反转录,收集cDNA,使用SYBR Green Real-time PCR Master Mix、RT-qPCR仪进行扩增,收集检测指标循环阈值(CT值)。扩增参数:97.6 ℃ 8 min;95.2 ℃ 20 s,64.6 ℃ 20 s,62.5 ℃ 20 s,40个循环。miR-217以U6为内参,EZH2、OCN、Runx2、collagen Ⅰ以Gapdh为内参,引物序列见表1。miR-217、Ezh2、Ocn、Runx2、collagen Ⅰ 相对表达量以2-△△Ct法计算。

表1 引物序列Table 1 Primer sequences
1.2.5 ALP活性的检测:细胞按ALP检测试剂盒说明书进行操作,用酶标仪测定各组BM-MSCs在波长520 nm处的吸光度值,计算各组细胞ALP活性。
1.2.6 ARS染色检测:将细胞用PBS清洗后,4%多聚甲醛固定10 min,清洗后,加入茜素红染色液染色20 min,再次清洗后,显微镜下观察各组细胞染色情况。
1.2.7 Western blot检测成骨分化相关基因及EZH2蛋白表达:低温条件下用RIPA裂解液裂解各组诱导分化后细胞,BCA法对蛋白进行定量。取50 μg样品,经10% SDS-聚丙烯酰胺凝胶电泳分离、转膜、 封闭后,加入一抗Runx2、OCN、collagenⅠ、EZH2及GAPDH,4 ℃孵育过夜,清洗后,加二抗,室温孵育2 h后,清洗3次。使用凝胶成像系统和Image Pro Plus软件对条带进行分析。
1.2.8 双荧光素酶报告基因验证靶向关系:收集从OP小鼠分离的BM-MSCs,接种于24孔板(密度:2×104个/孔),置于培养箱培养24 h,然后将构建的野生型(WT-EZH2)和突变型(MUT-EZH2)载体与miR-NC或miR-217 mimics共转染上述BM-MSCs 48 h,分为WT-EZH2+miR-NC组、(WT-EZH2+miR-217 mimics)组、(MUT-EZH2+miR-217 mimics)组和(MUT-EZH2+miR-NC)组。分别收集各组细胞并裂解20 min,离心后检测各组上清液中荧光素酶活性,并以海肾荧光素酶活性为参照,计算荧光素酶相对活性。
1.3 统计学分析
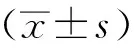
2 结果
2.1 各组小鼠骨组织和BM-MSCs中miR-217及EZH2 mRNA表达水平
与sham组相比,OP组小鼠骨组织及BM-MSCs中miR-217表达水平降低(P<0.05),EZH2 mRNA表达水平升高(P<0.05)(图1)。

*P<0.05 compared with sham group图1 各组小鼠骨组织及BM-MSCs中miR-217、EZH2 mRNA表达水平比较
2.2 转染后各组BM-MSCs中miR-217及EZH2表达情况
与对照组和miR-NC组相比,miR-217 mimics组BM-MSCs中miR-217表达水平升高(P<0.05),EZH2 mRNA及蛋白表达水平降低(P<0.05);与miR-217 mimics组、miR-217 mimics+pcDNA 3.1组相比,miR-217 mimics+pcDNA 3.1-EZH2组BM-MSCs中EZH2 mRNA及蛋白表达水平升高(P<0.05)(图2~3)。

图2 各组BM-MSCs中EZH2蛋白表达Fig 2 EZH2 protein expression in BM-MSCs of each group

*P<0.05 compared with control group; #P<0.05 compared with miR-NC group; △P<0.05 compared with miR-217 mimics group; ▲P<0.05 compared with miR-217 mimics+pcDNA 3.1 group图3 转染后各组BM-MSCs中miR-217及EZH2表达情况Fig 3 Expression of miR-217 and EZH2 in BM-MSCs of each group after n=6)
2.3 各组BM-MSCs ALP活性比较
与对照组和miR-NC组相比,miR-217 mimics组BM-MSCs ALP活性升高(P<0.05);与miR-217 mimics组、miR-217 mimics+pcDNA 3.1组相比,miR-217 mimics+pcDNA 3.1-EZH2组BM-MSCs ALP活性降低(P<0.05)(表2)。

表2 各组BM-MSCs ALP活性比较
2.4 各组BM-MSCs ARS染色情况
ARS染色结果显示,与对照组和miR-NC组相比,miR-217 mimics组、miR-217 mimics+pcDNA 3.1组、miR-217 mimics+pcDNA 3.1-EZH2组BM-MSCs细胞染色程度较深;与miR-217 mimics组、miR-217 mimics+pcDNA 3.1组相比,miR-217 mimics+pcDNA 3.1-EZH2组BM-MSCs细胞染色程度较浅;对照组和miR-NC组、miR-217 mimics组和miR-217 mimics+pcDNA 3.1组BM-MSCs细胞染色程度无明显差异(图4)。

图4 各组BM-MSCs的茜素红S(ARS)染色结果Fig 4 Alizarin reds(ARS) staining results of BM-MSCs in each group (×100)
2.5 各组BM-MSCs中成骨分化相关基因OCN、Runx2、collagenⅠ mRNA表达水平比较
与对照组和miR-NC组相比,miR-217 mimics组BM-MSCs中OCN、Runx2、collagenⅠ mRNA表达水平升高(P<0.05);与miR-217 mimics组、miR-217 mimics+pcDNA 3.1组相比,miR-217 mimics+pcDNA 3.1-EZH2组BM-MSCs中OCN、Runx2、collagenⅠ mRNA表达水平降低(P<0.05)(图5)。

*P<0.05 compared with control group; #P<0.05 compared with miR-NC group; △P<0.05 compared with miR-217 mimics group; ▲P<0.05 compared with miR-217 mimics+pcDNA 3.1 group图5 各组BM-MSCs中OCN、Runx2、collagenⅠ mRNA表达水平比较Fig 5 Comparison of OCN, Runx2 and collagenⅠ mRNA expression levels in BM-MSCs of each
2.6 各组BM-MSCs中成骨分化相关蛋白OCN、Runx2、collagenⅠ表达水平比较
与对照组和miR-NC组相比,miR-217 mimics组BM-MSCs中OCN、Runx2、collagenⅠ蛋白表达水平升高(P<0.05);与miR-217 mimics组、miR-217 mimics+pcDNA 3.1组相比,miR-217 mimics+pcDNA 3.1-EZH2组BM-MSCs中OCN、Runx2、collagenⅠ蛋白表达水平降低(P<0.05)(图6~7)。

图6 各组BM-MSCs中OCN、Runx2、collagenⅠ 蛋白表达Fig 6 Expression of OCN, Runx2 and collagenⅠ proteins in BM-MSCs of each group

*P<0.05 compared with control group; #P<0.05 compared with miR-NC group; △P<0.05 compared with miR-217 mimics group; ▲P<0.05 compared with miR-217 mimics+pcDNA 3.1 group图7 各组BM-MSCs中OCN、Runx2、collagenⅠ蛋白 表达水平比较Fig 7 Comparison of OCN, Runx2 and collagenⅠ protein expression levels in BM-MSCs of each
2.7 双荧光素酶报告基因检测系统验证miR-217与EZH2靶向关系
经starbase数据库预测显示,miR-217与EZH2 mRNA 3′UTR区有结合位点,见图8。双荧光素酶报告基因检测结果显示,与WT-EZH2+miR-NC组比较,WT-EZH2+miR-217 mimics组荧光素酶相对活性降低(P<0.05);MUT-EZH2+miR-NC组与MUT-EZH2+miR-217 mimics组荧光素酶相对活性差异无统计学意义(表3)。

图8 miR-217与EZH2 mRNA 3′UTR区结合位点 预测结果Fig 8 Prediction results of binding sites between miR-217 and EZH2 mRNA 3′UTR region
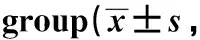
表3 各组双荧光素酶报告基因检测结果
3 讨论
微小RNA是一类存在于骨组织、细胞中的非编码RNA分子,其可调控BM-MSCs向成骨细胞分化[10]。miR-217在人脂肪源间充质干细胞(adipose-derived stem cells, hADSCs)向成骨细胞分化过程中表达水平升高,其可能在hADSCs成骨分化中起重要调控作用[11];另外,miR-217可通过促进成骨相关基因表达, 进而在hADSCs向成骨细胞分化过程中起促进作用[12]。提示miR-217可能参与OP发生发展,过表达miR-217可能改善OP。另外,本研究通过体外实验检测了过表达miR-217对OP小鼠BM-MSCs向成骨细胞分化的作用,发现过表达miR-217后,BM-MSCs中miR-217表达水平升高,ARS染色加深,ALP活性升高,表明过表达miR-217可促进OP小鼠BM-MSCs成骨分化。OCN、Runx2、collagen Ⅰ与成骨分化关系密切,其可作为评估成骨分化能力的标志物[13]。提示过表达miR-217通过促进成骨分化相关基因表达进而促进BM-MSCs成骨分化。
EZH2可参与细胞增殖,影响氧化应激,调节机体发育,促进破骨细胞分化,影响骨代谢平衡,与骨代谢疾病关系密切[14]。在炎性反应条件下,人牙周膜干细胞(periodontal ligament stem cells, PDLSCs)中EZH2表达上调,且EZH2过表达可抑制OCN等成骨标志物的表达,进而抑制PDLSCs成骨分化,可能是治疗牙周炎的潜在靶点[15]。提示EZH2可能是OP的治疗靶点。进一步研究发现,过表达miR-217后,BM-MSCs中EZH2 mRNA及蛋白表达水平降低,且过表达EZH2可使BM-MSCs中miR-217表达水平略有降低,OCN、Runx2、collagenⅠ mRNA及蛋白表达水平显著降低,ARS染色程度、ALP活性降低,提示miR-217可能通过调节EZH2表达进而影响OCN、Runx2、collagenⅠ等成骨分化相关基因表达,从而在BM-MSCs向成骨细胞分化过程中发挥调控作用。
本研究利用starbase数据库预测发现,Ezh2的3’UTR序列中包含了miR-217的靶序列,表明miR-217可能与Ezh2存在调控关系。此外,双荧光素酶报告基因检测显示,miR-217可明显抑制野生型EZH2荧光素酶活性,而对突变型EZH2荧光素酶活性无明显影响,表明Ezh2是miR-217的直接靶点,且ALP、ARS染色实验、RT-qPCR、Western blot实验也表明了过表达EZH2可部分逆转过表达miR-217对OP小鼠BM-MSCs成骨分化的促进作用,进一步证实了在OP小鼠BM-MSCs中miR-217可负靶向调控EZH2表达。
综上,过表达miR-217可通过靶向抑制EZH2表达,从而促进OP小鼠BM-MSCs成骨分化。miR-217、EZH2有望成为诊治OP的分子靶点,为防治OP提供新方案。但miR-217、EZH2对OP小鼠BM-MSCs成骨分化的影响机制尚不够深入,后期可考虑结合临床实验加以探究。
