上调miR-140增强人CML细胞株KBM5R对伊马提尼的敏感性
2022-09-28高秋英张维华
郑 研,李 岚,高秋英,牛 奔,张维华
(陕西省人民医院 血液内科,陕西 西安 710068)
慢性髓系白血病(简称慢粒)(chronic myeloid leuke-mia,CML)是一种以费城染色体和断裂点簇集区-艾贝尔逊白血病病毒(breakpoint cluster region-abelson leukemia virus,BCR-ABL)融合基因为特征的骨髓增生性疾病。BCR-ABL具有高酪氨酸激酶活性,可激活如丝裂原活化蛋白激酶、Janus激酶/信号传导与转录激活子和磷脂酰肌醇3-激酶等多种通路的信号活性。这些通路的激活可增加B细胞淋巴瘤/白血病-2(B-cell lymphoma/lewkmia-2,Bcl-2)蛋白的表达,最终促进CML细胞恶性增殖[1-2]。虽然伊马替尼(imatinib,IM)、尼罗替尼和达沙替尼等酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)能明显改善CML患者的预后并延长预期寿命,但依然约有20%的患者TKIs耐药[3]。因此,逆转TKIs耐药性对CML的治疗具有重要意义。
近年来,微小RNAs(microRNAs,miRNAs)被广泛认为是调节包括CML在内的多种癌进展以及化学耐药的关键参与者[4]。但miRNA种类繁多,其在CML的分子机制仍未得到很好的阐明。业已发现,miR-140是胃癌、骨肉瘤和结肠癌中的抑癌基因[5-7]。尽管miR-140在多种类型的癌中具有强烈的抗肿瘤作用,但其在CML中调节化学耐药的潜在机制仍未完全明确。因此,本研究以IM敏感CML细胞KBM5和IM耐药CML细胞KBM5R为材料,旨在研究miR-140对KBM5R的IM敏感性的影响以及机制。
1 材料与方法
1.1 材料
1.1.1 细胞:人CML细胞系KBM5(上海传秋生物科技有限公司)。
1.1.2 试剂和试剂盒:胎牛血清、DMEM培养基和Lipofectamine 2000(Invitrogen公司);TaqMan miRNA分离试剂盒、TaqMan microRNA测定试剂盒和TaqMan Universal PCR Master Mix(Applied Biosystems公司);miR-140 mimic和阴性对照(miR-NC)(由上海吉玛公司合成);快速点突变试剂盒(Agilent公司);Annexin V-FITC/PI细胞凋亡检测试剂及蛋白质提取和定量试剂盒(陕西脉元生物科技有限公司);抗cleaved caspase-3和Bcl-2抗体(CST公司);CCK-8法细胞计数试剂盒和JC-1染色试剂盒(上海碧云天生物技术有限公司);抗 β-actin抗体和辣根过氧化酶标记的IgG二抗(北京百奥莱博科技有限公司);伊马替尼(IM,纯度≥99%)(上海阿拉丁生化科技股份有限公司)。
1.2 方法
1.2.1 细胞的培养与IM耐药细胞株KBM5R构建:将KBM5细胞接种在含有10%胎牛血清、1%青霉素和1%链霉素的DMEM培养基中,置于在37 ℃、5% CO2的细胞培养箱中培养。按照文献[3]方法,将KBM5细胞通过暴露在浓度递增的IM中,获得IM耐药的KBM5R细胞株。
1.2.2 细胞的转染:在转染细胞前,先将KBM5R细胞接种在无血清、青霉素和链霉素的DMEM培养基中12 h,然后根据转染试剂的说明书步骤,用Lipofectamine 2000试剂分别将60 nmol/L的miR-140 mimic或miR-NC转入细胞。转染后48 h,收集细胞,用RT-qPCR检测miR-140 mimic的转染效率后,用于后续实验。
1.2.3 RT-qPCR检测miR-140相对表达量:用TaqMan miRNA分离试剂盒从KBM5和KBM5R细胞以及已转染miR-140 mimic或miR-NC的KBM5R细胞中提取miRNAs。用TaqMan microRNA测定试剂盒进行miRNA定量的测定。用TaqMan Universal PCR Master Mix反应试剂盒和各引物在ABI 7500实时定量PCR(qPCR)系统进行分析。反应条件为95 ℃ 10 min,然后进行40个循环(95 ℃ 15 s,60 ℃ 1 min)。用2-△△Ct法计算miR-140相对于内部对照U6的表达量。引物的序列如下:miR-140 (正向):5′-GAGTGTCAGTGGTTTTACCCT-3′,miR-140 (反向):5′-GCAGGGTCCGAGGTATTC-3′;U6(正向):5′-CTCGCTTCGGCAGCACATATACT-3′,U6(反向):5′-ACGCTTCACGAATTTGCGTGTC-3′。
1.2.4 CCK-8法检测细胞活力:将已转染miR-140 mimic或miR-NC的KBM5R细胞以3×106个细胞/mL接种到6孔培养板中,分别用0、25、50、75和100 nmol/L的IM处理24 h。每孔加入10 μL CCK-8试剂,并在37 ℃温育4 h后,用酶标仪在波长450 nm处检测吸光度(A)值。
1.2.5 Annexin V-FITC/PI染色流式细胞测量术检测细胞凋亡:用100 nmol/L的IM将已转染miR-140 mimic或miR-NC的KBM5R细胞处理24 h后,PBS洗涤细胞2次,用无EDTA的胰蛋白酶消化,收集细胞。 按照试剂盒说明书步骤,在室温避光下进行annexin V-FITC和 PI染色。用流式细胞仪分析细胞凋亡。
1.2.6 JC-1染色评估线粒体膜电位:用100 nmol/L的IM将已转染miR-140 mimic或miR-NC的KBM5R细胞处理24 h后,在37 ℃避光下进行JC-1染色。用荧光显微镜拍照,并用Image J软件分析红色荧光和绿色荧光的荧光强度。
1.2.7 荧光素酶活性分析验证miR-140与Bcl-2的靶向关系: miRanda在线软件(http://www.microrna. org/microrna/home.do)预测Bcl-2的3′UTR中存在miR-140结合位点。用点突变试剂盒将预测Bcl-2基因3′UTR与miR-140结合的位点的基因序列进行点突变,并用PCR将Bcl-2基因的3′UTR以及已点突变的3′UTR的基因序列扩增并分别插入荧光载体中,构建野生型(WT)Bcl-2 3′UTR和突变型(MUT)Bcl-2 3′UTR荧光载体质粒。用Lipofectamine 2000将miR-140 mimic或miR-NC以及WT-Bcl-2 3′UTR或MUT-Bcl-2 3′UTR质粒共转染到细胞中。转染48 h后,通过双荧光素酶报告分析系统分析荧光素酶活性。
1.2.8 Western blot检测Bcl-2和cleaved caspase-3的表达:分别取KBM5和KBM5R细胞、已转染miR-140 mimic或miR-NC的KBM5R细胞以及100 nmol/L IM处理24 h的已转染miR-140 mimic或miR-NC的KBM5R细胞,提取细胞的蛋白质,并定量蛋白的浓度。按照常规程序,用Western blot检测Bcl-2、cleaved caspase-3相对与内参β-actin的相对表达水平。
1.3 统计学分析
2 结果
2.1 miR-140在KBM5和KBM5R细胞中的表达
KBM5R细胞中miR-140的表达水平为0.25±0.13明显低于KBM5细胞的0.99±0.04(P<0.01)。
2.2 过表达miR-140对KBM5R细胞伊马替尼敏感性的影响
与miR-NC组比较,miR-140 mimic转染组中miR-140的表达水平明显增加(P<0.01);在25~100 nmol/L的IM存在的条件下,与miR-NC组比较,miR-140 mimic转染组的细胞活力明显降低(P<0.01或P<0.001);在100 nmol/L的IM条件下,与miR-NC组比较,miR-140 mimic转染组的细胞凋亡明显增加(P<0.001)(图1)。
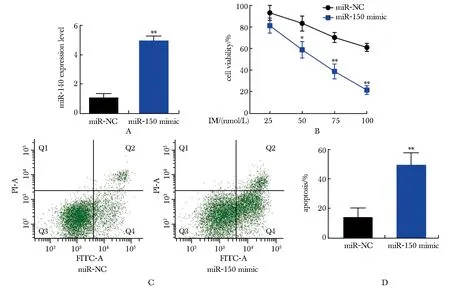
A.after transfected into KBM5R cells with miR-NC or miR-140 mimic, the expression level of miR-140 was detected by RT-qPCR; B.KBM5R cells transfected with miR-NC or miR-140 mimic were treated with 25-100 nmol/L IM for 24 hours; Cell viability was detected by CCK-8 assay; C-D.KBM5R cells transfected with miR-NC or miR-140 mimic were treated with 100 nmol/L IM for 24 hours; Cell apoptosis was detected by flow cytometry; *P<0.01, **P<0.001 compared with miR-NC group
2.3 过表达miR-140对KBM5R细胞的线粒体膜电位和cleaved caspase-3表达的影响
在100 nmol/L的IM条件下,与miR-NC组比较,miR-140 mimic转染组线粒体膜电位明显降低[表现为绿色荧光强度/红色荧光强度明显增加(P<0.001)],cleaved caspase-3表达水平明显增加(P<0.001)(图2)。
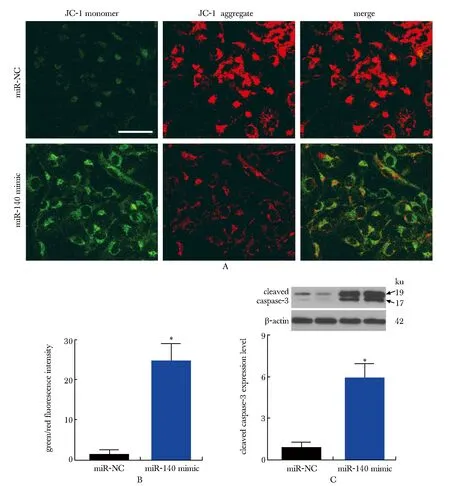
A,B.KBM5R cells transfected with miR-NC or miR-140 mimic were treated with 100 nmol/L IM for 24 hours; Mitochondrial membrane potential was detected by JC-1 staining (scale bar=10 μm); C.cleaved caspase-3 expression was detected by Western blot; *P<0.001 compared with miR-NC group
2.4 Bcl-2是miR-140的靶标
与KBM5细胞相比,KBM5R细胞中Bcl-2表达水平明显增加(P<0.001)(图3A);与miR-NC组比较,miR-140 mimic转染组Bcl-2表达水平明显降低(P<0.001)(图3B);Bcl-2是miR-140的靶基因(图3C)。
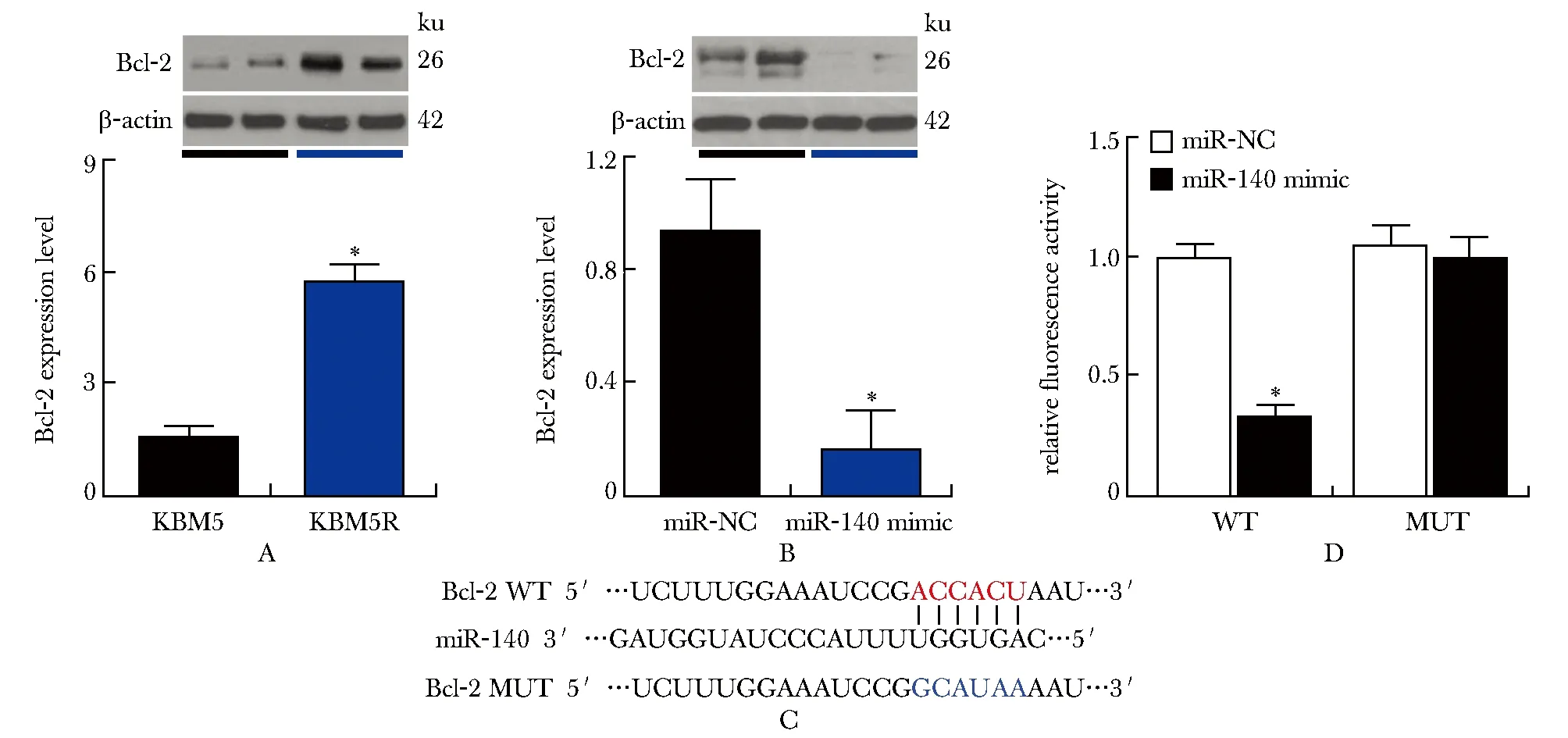
A.expression of Bcl-2 in KBM5 and KBM5R cells was detected by Western blot; B.expression of Bcl-2 in KBM5R cells transfected with miR-NC or miR-140 mimic was detected by Western blot; C.Bcl-2 and miR-140 targeted binding sites predicted by miRanda software; D.targeting relationship between Bcl-2 and miR-140 was verified by fluorescence activity analysis; *P<0.001 compared with miR-NC group
3 讨论
尽管已经进行了许多研究试图克服对抗癌药的耐药性,但化疗耐药仍然是目前治疗CML患者的主要障碍。CML最常见的耐药机制是ABL激酶结构域(kinase domain,KD)点突变,其在耐药CML患者中约占50%,尤其是获得性耐药患者[8]。TKIs的主要治疗靶点即为ABL KD,而其突变严重阻碍TKIs与ABL激酶的结合,并最终影响CML的疗效[9]。因此,必须发现除ABL KD之外的其他目标,以优化患者对TKIs的反应。
关于miRNA参与调控肿瘤化疗敏感性的作用的研究逐渐受到研究人员的关注。此前的研究已经证实miR-140在多种肿瘤中发挥抑制肿瘤的作用[5-7]。最近研究[10]表明,miR-140可促进非小细胞肺癌细胞对顺铂的敏感性。本研究使用IM耐药CML细胞系KBM5R和正常CML细胞系KBM5探索了miR-140与IM耐药之间的关系,并通过将miR-140 mimic转染到KBM5R细胞中来研究过表达miR-140对IM敏感性的影响。结果显示,miR-140在KBM5R中表达显着下调,过表达miR-140能抑制KBM5R的增殖活性并促进了细胞凋亡,降低线粒体膜电位和增加cleaved caspase-3表达。这些发现表明,miR-140表达降低可能是CML的IM耐药的机制之一,而上调miR-140能增强KBM5R细胞对IM的敏感性。
MicroRNA(miRNA)是通过与靶mRNA的3′非翻译区(3′-UTR)的碱基以互补配对结合方式负调控基因表达来发挥生物学效应。因此,鉴定miR-140靶基因对于理解其在CML的IM耐药中的作用非常重要。本研究发现,miR-140 在KBM5R中能够直接靶向Bcl-2的3′-UTR并负调节Bcl-2蛋白表达。Bcl-2具有促进细胞存活的作用,同样抑制Bcl-2表达能抑制细胞活性和促进细胞凋亡。最近的研究强调了Bcl-2在维持骨髓白血病干细胞干性和存活中的重要作用[11]。也有报道证明,Bcl-2抑制剂ABT-737和ABT-263可明显增强TKIs诱导的原发性CML细胞死亡[12-13]。因此,这些结果证实miR-140通过靶向Bcl-2增强KBM5R的敏感性。
总之,本研究表明miR-140表达下调可能是导致CML的IM耐药的关键因素,上调miR-140能通过Bcl-2增强KBM5R对药物的敏感性。
