HMGB1减弱丹参酮ⅡA对大鼠心肌缺血/再灌注损伤的缓解作用
2022-09-28钟金鹏王辉波陈红健李金伟文明洪吕云波
钟金鹏,杨 莉,王辉波,陈红健,李金伟,文明洪,吕云波*
(三峡大学人民医院 宜昌市第一人民医院 1.心内科; 2.神经内科, 湖北 宜昌 443000)
丹参酮IIA(tanshinone IIA,TSA)是中药丹参的重要成分之一,其在心肌缺血再灌注(ischemia-reperfusion,I/R)损伤中能减小心肌梗死面积、改善心功能[1-2]。这可能与其抗氧化、抗炎及抗凋亡等有关,但具体机制仍不十分清楚。有报道高迁移率族蛋白B1 (high-mobility group box 1,HMGB1)作为一种重要的核蛋白,参与了心肌I/R损伤过程[3]。TSA对心肌I/R损伤的影响可能与HMGB1的下调表达有关[2]。也有报道外源性HMGB1对心肌I/R损伤的影响,但结论不一致[4-5]。本研究通过构建心肌I/R损伤的动物模型,应用TSA和HMGB1进行干预,探讨其对心肌I/R损伤的影响。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级SD大鼠40只,雄性,体质量220~260 g,6~8周龄,12 h光照与黑暗交替、湿度60%、温度25 ℃,独笼常规喂养(三峡大学实验动物中心,合格证号42010200005760)。
1.1.2 试剂:丹参酮IIA(滁州仕诺达生物科技有限公司);重组HMGB1(上海经科化学科技有限公司);2%戊巴比妥钠(武汉卡布达公司);肌酸激酶同工酶(CK-MB)检测试剂盒(上海将来实业股份有限公司);2,3,5—氯化三苯基四氮唑染液(上海吉至生化科技有限公司);RT-qPCR试剂盒(北京索莱宝科技有限公司);HGMB1、NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、胱冬肽酶-1(caspase-1)和核因子-κB(NF-κB)兔抗鼠一抗及二抗(艾美捷科技有限公司)。
1.2 方法
1.2.1 大鼠的分组与处理:将大鼠随机分假手术(sham)组、I/R组、TSA组(I/R+静脉注射TSA 10 mg/kg)、TSA+HMGB1组(I/R+静脉注射TSA 10 mg/kg+腹腔注射重组HMGB1 100 μg/kg)。按参考文献[1]建模。假手术组仅开胸后缝合。TSA组和TSA+HMGB1组均于再灌注前3 min内的给药。
1.2.2 ELISA测定CK-MB:再灌注24 h采血,按试剂盒说明书检测血清CK-MB活性水平。
1.2.3 HE染色观察心肌细胞结构:取相同部位心肌,固定于4%多聚甲醛,经脱水、包埋、切片、HE染色后在显微镜下观察心肌细胞结构变化。
1.2.4 TCC法测定心肌梗死面积:按文献[1]方法应用TCC法对心脏标本进行染色,梗死心肌呈苍白色,正常心肌染成红色,Image-Pro Plus软件分析图像,计算心肌梗死面积百分比。
1.2.5 RT-qPCR测定心肌中白介素-6(IL-6)、白介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的转录水平:使用Trizol液从心肌样品中分离提取总RNA,按试剂盒说明书合成cDNA,然后在Applied Biosystems 7500 real-time PCR系统平台上按照制造商流程进行分析。Il-6的引物为:正链5′-GATGCTACC AAACTGGATATAATC-3′,负链 5′-GGTCCTTAGCCA CTCCTTCTGTG-3′;Il-1β的引物为:正链5′-CCTTG TCGAGAATGGGCAGT-3′,负链5′-CAGGGAGGGA AACACACGTT-3′;Tnfα的引物为:正链5′-CCATT CCTGAGTTCTGCAAAG-3′,负链5′-GCAAATATAAA TAGAGGGGGGC-3′。表达倍数改变通过2-ΔΔCt方法进行定量,以sham组为参考。
1.2.6 Western blot检测心肌HGMB1、NLRP3、ASC、caspase-1和NF-κB的蛋白表达:选取相同梗死部位等量心肌,捣碎裂解,抽提蛋白质;加热变性蛋白,冷却后,加到SDS-PAGE胶加样孔内,通电电泳。选用PVDF膜进行转膜,然后染色、漂洗、封闭。经过相应一抗及二抗孵育后,予以定影及显影。使用凝胶图象处理系统对目标条带予以定量分析。
1.3 统计学分析
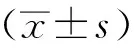
2 结果
2.1 CK-MB的变化
I/R组血清中CK-MB水平明显高于sham组(P<0.01);TSA组较I/R组显著下降(P<0.01);而TSA+HMGB1组的CK-MB较TSA组显著上升(P<0.01)(图1)。
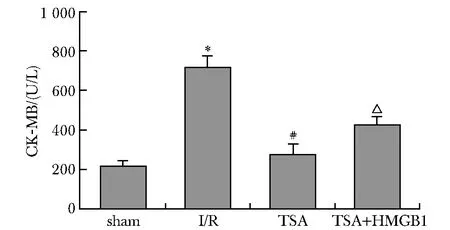
*P<0.01 compared with sham group; #P<0.01 compared with I/R group; △P<0.01 compared with TSA group图1 心肌I/R损伤对血清中CK-MB水平的影响Fig 1 Level of CK-MB in serum after myocardial I/R
2.2 心肌细胞结构的变化
光镜下见sham组心肌细胞排列整齐,细胞结构完成;I/R组心肌细胞结构紊乱,肌浆均质红染,胞核破碎,间质可见炎性细胞浸润;TSA组心肌细胞结构较I/R组有明显改善,可见部分完整心肌细胞结构;TSA+HMGB1组见细胞肿胀,间质存在水肿(图2)。

图2 HMGB1减弱TSA改善I/R诱导的心肌结构改变Fig 2 HMGB1 attenuated remissions to I/R-induced myocardial structural alterations by TSA(×400, bar= 50 μm)
2.3 各组大鼠心梗面积比较
假手术(sham)组未发现明显心肌梗死;I/R组的心肌梗死面积最大;与I/R组相比,TSA组的心肌梗死面积明显减少(P<0.01);TSA+HMGB1组心肌梗死面积较TSA组明显增加(P<0.01)(图3,表1)。

图3 TSA减少I/R导致的心肌梗死面积而HMGB1增加心梗面积Fig 3 TSA decreased the myocardial infarct area due to I/R while HMGB1 reversed
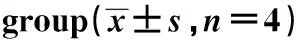
表1 各组大鼠心肌梗死面积比较Table 1 Comparison of myocardial infarct area of rats in each
2.4 比较心肌I/R损伤后炎性反应指标转录及蛋白表达水平
I/R组心肌中IL-6、IL-1β和TNF-α的mRNA转录水平明显高于sham组(均P<0.01);TSA组的IL-6、IL-1β和TNF-α的转录水平较I/R组显著下降(P<0.01,P<0.01,P<0.05);TSA+HMGB1组IL-6、IL-1β及TNF-α的转录水平较TSA组又显著上升(均P<0.01)(图4A~C)。

*P<0.01 compared with sham group; #P<0.05, ##P<0.01 compared with I/R group; △P<0.01 compared with TSA group
I/R组心肌HMGB1、NLRP3和caspase-1的表达水平明显高于sham组(P<0.05,P<0.01,P<0.05);TSA组的HMGB1、NLRP3、caspase-1和NF-κB的表达水平较I/R组显著降低(均P<0.01);而TSA+HMGB1组HMGB1、NLRP3、caspase-1和NF-κB的表达较TSA组显著增加(P<0.05,P<0.01,P<0.01,P<0.01)(图5)。

*P<0.05, **P<0.01 compared with sham group; #P<0.01 compared with I/R group; △P<0.05, △△P<0.01 compared with TSA group
3 讨论
本结果提示TSA可以缓解心肌I/R损伤,而外源性HMGB1能逆转这种作用,该过程可能与其影响炎性因子的表达有关。
TSA对抗I/R损伤广泛存在于多个器官,其潜在机制可能都与HMGB1密切相关。在大脑中动脉闭塞的动物模型实验中,予以TSA治疗,其HMGB1水平低,脑细胞凋亡程度轻,脑梗面积小[6]。在肝移植中,予以TSA预处理可以下调肝枯否细胞中HMGB1-TLR-4/NF-κB通路的表达,减轻肝I/R损伤[7]。而在心肌中,TSA通过减少HMGB1表达和抑制炎性反应来减轻心肌I/R损伤,且这种效应与TSA之间存在剂量依赖性[2],心肌I/R的2 h内予以TSA治疗是减轻心肌I/R损伤的最佳时间窗[1]。
HMGB1在心肌I/R损伤中具有重要地位。在I/R动物模型的心肌[8]及心肌梗死患者的血[9]中均观察到HMGB1的上调表达。缺血损伤后的心脏组织释放HMGB1通过脾晚期糖基化终产物(receptors of advanced glycation end products,RAGE)途径激活白细胞,并促使白细胞迁移到损伤的心肌组织,导致再灌注时梗死的加重[10]。依赖于HMGB1/NF-κB通路的NLRP3炎性小体的激活,可以促进IL-1β、IL-18等炎性因子的释放,并加重了组织细胞的损伤[11]。下调HMGB1-TLR4(Toll like receptor 4)/NF-κB信号途径可以减轻心肌I/R损伤[12]。氧化应激和亚硝化应激在I/R中控制HMGB1的表达和释放,四磺基苯基铁卟啉[5,10,15,20-tetrakis-(4-sulfonatophenyl)phosphyrinato-iron(Ⅲ),FeTPPS]是一种选择性过氧化物清除剂,能显著降低I/R诱导的心肌HMGB1表达和减轻损伤[13]。槲皮素、雷公藤红素等草药,在I/R中也具有抑制HMGB1上调表达和保护心肌的作用[3]。上述研究说明抑制HMGB1表达及相关通路的激活有助于缓解I/R损伤。
至于外源性HMGB1对心肌I/R损伤的影响如何,既往的研究结论不一致。用重组HMGB1(10 μg/只,腹腔注射)预处理,加重了心肌损伤,增加了心梗面积[8],HMGB1的作用依赖于RAGE/MAPKs/NF-κB和TLR2的激活,因为Rage-/-和Tlr2-/-小鼠即便使用HMGB1也能免受I/R损伤[3]。而另有学者同样用重组HMGB1进行干预处理,则发现外源性HMGB1可以抑制炎性反应,减轻氧化应激,减轻心肌的I/R损伤[14]。以上结果的不一致可能与给药的时机、途径和剂量相关,但最终与HMGB1的氧化还原状态有关[3]。基于HMGB1结构中半胱氨酸的氧化还原状态,HMGB1有3种形式:完全还原型HMGB1(fully reduced HMGB1,fr-HMGB1)、二硫化HMGB1(disulfide HMGB1,ds-HMGB1)和氧化型HMGB1(oxidized HMGB1,ox-HMGB1)。fr-HMGB1和ds-HMGB1具有对立的作用,fr-HMGB1发挥趋化作用,能使巨噬细胞向再生表型形成,ds-HMGB1能刺激免疫细胞产生促炎细胞因子/趋化因子,而ox-HMGB1在炎性反应晚期出现,可能与再生修复相关,可影响中性粒细胞的激活状态[3]。心脏损伤产生活性氧(reactive oxygen species,ROS)的浓度水平调控fr-HMGB1向ds-HMGB1和ox-HMGB1转化程度,不同状态的心肌,三者的比例不一样,产生的作用也不一样,这能解释各种心肌损伤实验模型中使用外源性HMGB1却观察到了不同的结果[3]。
总之,HMGB1在TSA对心肌I/R损伤的影响中具有重要作用,可能成为针对I/R损伤治疗的潜在靶点[15],但仍需要更多的临床和基础研究来进一步阐明其复杂机制。
