可移植人髓母细胞瘤PUMC-MBT1瘤株的建立与鉴定
2022-09-28王世尊冯海凉刘玉琴
王世尊,张 丹,葛 明,冯海凉,刘玉琴*
(中国医学科学院基础医学研究所 北京协和医学院基础学院 1.病理学系; 2.细胞中心,北京 100005; 3.首都医科大学附属北京儿童医院 国家儿童医学中心 神经外科, 北京 100045)
髓母细胞瘤(medulloblastoma)是一种常见的后颅窝恶性胚胎性肿瘤,好发于儿童[1]。由于中国小儿神经外科起步较晚,全国范围内能开展小儿神经外科的医院较少[2],因此儿童神经肿瘤组织标本十分珍贵。另外目前对髓母细胞瘤生物学行为的认识和治疗方法的探索仍存在较大的困难,其主要原因在于髓母细胞瘤发生、发展等内在机制研究尚不充分,且髓母细胞瘤可用的实验模型较少,因此建立更多的髓母细胞瘤细胞和动物模型显得尤为重要[3]。目前用于研究髓母细胞瘤的实验模型主要为细胞模型和动物模型,其中细胞模型主要包括连续传代细胞系[4]和类器官培养[5],动物模型主要包括细胞系来源的异种种植肿瘤(cell-line-derived xenograft, CDX)[6]、患者来源的异种种植肿瘤(patient-derived xenograft, PDX)[7]以及基因编辑模型小鼠(genetically enginee-red mouse models, GEMMs)[8]等。其中连续传代细胞系、CDX模型和PDX模型应用较为广泛。PDX模型虽较CDX模型更接近患者情境,如肿瘤细胞的多样性等,但构建过程相对CDX模型更加繁琐,成功率较低并且较难获得稳定的株系[3]。本研究通过接种人髓母细胞瘤细胞系PUMC-MB1,构建了一个可在小鼠体内连续稳定传代的可移植瘤模型——PUMC-MBT1瘤株,旨在为髓母细胞瘤研究提供易于构建、特征稳定的体内研究工具。
1 材料与方法
1.1 实验动物及细胞系
SPF级SCID雄性和雌性小鼠,4~5周龄,体质量16~18 g(北京华阜康生物科技有限公司[SCXK(京)2019-0008])。本研究体内实验遵循中国医学科学院基础医学研究所动物伦理要求及福利饲养,环境采用12 h/ 12 h光照/黑暗条件,小鼠自由饮水、采食,并遵循“3R”原则[减量化(reducing)],再利用(resusing)和再循环(recycling)三种原则进行实验。人髓母细胞瘤细胞系PUMC-MB1为本课题组自建髓母细胞瘤细胞系,经鉴定为经典型髓母细胞瘤。本研究使用的为自液氮复苏的第40代细胞[PUMC-MB1(P40)]。肿瘤CDX模型构建和传代均在生物安全柜中进行。
1.2 试剂与仪器
一抗:anti-NeuN(货号:#ABN78)(Millipore公司);anti-Syn(货号:#36406)、anti-H2K27M(货号:#74829)、anti-MUC1(货号:#4538)(CST公司);anti-Ki-67(货号:ab16667)、anti-GFAP(货号:ab7260)、anti-CK(AE1/AE3) (货号:ab80826)、anti-S100(货号:ab52642)(Abcam公司);二抗:通用二步法检测试剂盒(货号:PV-9000)、抗体稀释液、DAB显色试剂盒及苏木精-伊红(HE)染料(北京中杉金桥生物技术有限公司)。
1.3 髓母细胞瘤移植瘤瘤株建立
复苏培养PUMC-MB1(P40)细胞,于体外培养至对数生长期后,收集细胞,离心并用PBS重悬为5×107个/mL的单细胞悬液,于SCID小鼠右侧腋窝皮下接种细胞悬液0.1 mL,雄性小鼠5只和雌性小鼠5只,待皮下肿瘤(P0)长径增长至1.5 cm时,麻醉后处死小鼠,取出肿瘤并置于PBS中,剪除外周纤维组织、血管及中心坏死组织,将剩余鱼肉样肿瘤组织剪碎并充分研磨后用PBS重悬,细胞浓度为5×107个/mL,细胞悬液0.1 mL接种于每只小鼠的右侧腋窝皮下,体内移植瘤命名为PUMC-MBT1,并记作P1。重复上述步骤连续于体内传代10次,每次雄性小鼠2只和雌性小鼠2只,分别记作P1、P2、P3、P4、P5、P6、P7、P8、P9,第10代为10只(5只雄性、5只雌性)小鼠。记录第10代移植瘤模型肿瘤生长情况、荷瘤小鼠体质量以及生存情况,留取肿瘤组织用于后续病理学检查。
1.4 髓母细胞瘤移植瘤体内生长的观察
PUMC-MBT1移植后每3 d触摸小鼠皮下有无瘤性结节,记录小鼠体质量。如触及肿瘤,用游标卡尺测量肿瘤长径(L)和短径(S),并按照公式V(mm3)=L(mm)×S(mm)2/2计算肿瘤体积。
1.5 髓母细胞瘤移植瘤特性鉴定
PUMC-MBT1(P10) 肿瘤组织经4%多聚甲醛固定,石蜡包埋切片,行HE染色,并进行Ki-67、Syn、NeuN、GFAP、S-100、H3K27M、MUC1、CK(AE1/AE3)免疫组化染色。
1.6 统计学分析
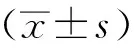
2 结果
2.1 髓母细胞瘤PUMC-MBT1移植瘤模型建立情况
PUMC-MB1细胞系接种25 d左右可在皮下触及结节,40 d后肿瘤长径达到1.5 cm左右。PUMC-MBT1细胞株从P1传至P9,各代雄性小鼠和雌性小鼠成瘤率均为100%,25~35 d传代1次。第10代雄性小鼠(n=5)和雌性小鼠(n=5)皮下成瘤率见图1。P10在接种后第14天可在皮下触及结节,29 d后肿瘤长径达到1.5 cm左右。肿瘤生长曲线可见肿瘤生长的4个阶段:0~14 d为潜伏期、15~29 d为快速生长期、30~41 d为死亡前期、42~58 d为死亡期(图2)。同一时间点,雄性小鼠和雌性小鼠之间肿瘤体积差异无统计学意义(图2A)。荷瘤小鼠体质量稳定增长,同一时间点,雄性小鼠和雌性小鼠体质量差异无统计学意义(图 2B)。荷瘤雄性小鼠生存时间为(46.0±2.8)d (n=5),荷瘤雌性小鼠生存时间为(54.8±3.1)d (n=5),雄雌小鼠荷瘤生存时间差异无统计学意义(图 2C)。
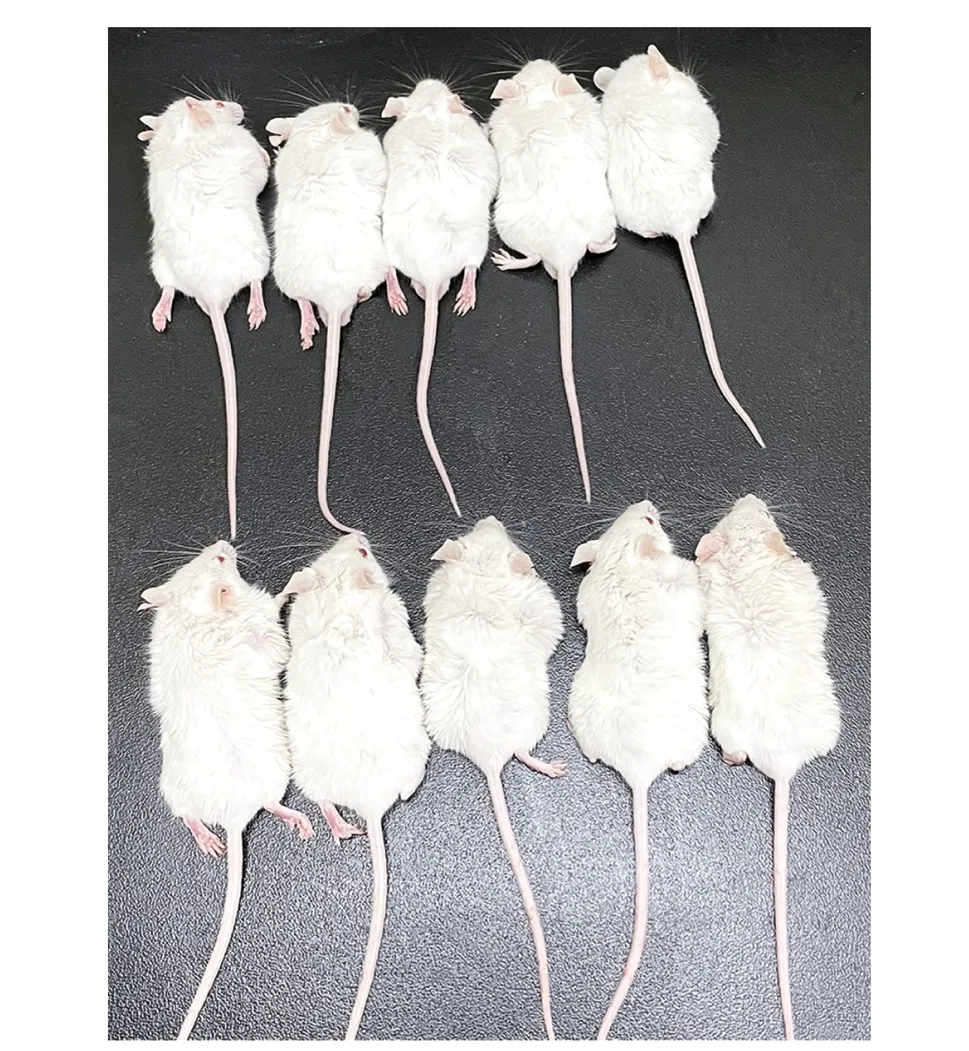
The first line: male tumor-bearing mice; the second line: female tumor-bearing mice图1 PUMC-MBT1细胞的成瘤性验证Fig 1 Tumorigenicity of PUMC-MBT1 cells(n=5)
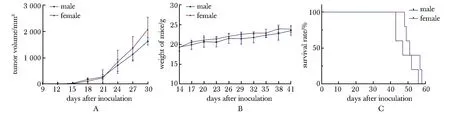
A.growth curve of transplanted tumors of male/female mice at passage 10; B.body weight of tumor-bearing male/female mice at passage 10; C.survival curve of tumor-bearing male/female mice at passage 10
2.2 髓母细胞瘤PUMC-MBT1移植瘤病理形态学观察
PUMC-MBT1移植瘤肉眼观形态相对规则,呈圆形或椭圆形,肿瘤表面有包膜,与周围组织边界清晰,周围有供血血管(图3A),肿瘤实质为鱼肉样,质韧(图3B)。解剖小鼠脑、肝脏、脾、肺脏、胰腺和肾,肉眼未见转移灶。HE切片观察可见肿瘤由高度密集的小细胞构成,细胞胞质少,核大且深染,呈圆形或卵圆形,高倍镜下可见多个核仁以及多核分裂象(图 3C),与患者原发灶组织病理学一致(图3D)。

A.general view of transplanted tumor; B.section view of transplanted tumor; C.HE image of transplanted tumor; D.HE image of original tumor (scale bar=100 μm)
2.3 髓母细胞瘤PUMC-MBT1移植瘤特异性分子表达情况
肿瘤免疫组化染色可见Ki-67阳性(80%~90%),Syn阳性(40%~50%),NeuN阳性(20%~30%),GFAP、S-100、H3K27M、MUC1、CK(AE1/AE3)阴性(图4)。
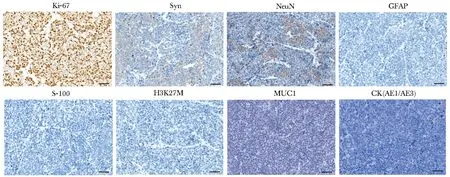
图4 PUMC-MBT1免疫组化染色Fig 4 Immunohistochemical images of PUMC-MBT1(scale bar=50 μm)
3 讨论
随着神经外科和放化疗技术的进步,接受多学科综合治疗的髓母细胞瘤患者中60%~80%可达到长期生存[9],但是高危组患者预后仍较差[1]。因此为了更好地支持髓母细胞瘤的研究,本研究通过接种人髓母细胞瘤细胞系PUMC-MB1构建了一个可在小鼠体内连续稳定传代的可移植髓母细胞瘤模型PUMC-MBT1。
PUMC-MBT1移植瘤与人髓母细胞瘤的病理特征特性一致,是人髓母细胞瘤体内研究的理想模型。PUMC-MBT1来源于本课题组自建人髓母细胞瘤细胞系PUMC-MB1的CDX模型,经过小鼠体内连续传代,很好地适应了小鼠体内环境,生长(潜伏期、生长速度、荷瘤寿命)特性等已稳定,与CDX模型相比,成瘤潜伏期明显缩短,由25 d缩短至14 d,快速生长期时间相近,成瘤率100%。生长速度适中,荷瘤小鼠存活时间50 d左右,一批体内研究可在30 d左右得到结果。移植瘤组织病理学特征与患者原发灶组织病理学结果保持一致,均为经典型髓母细胞瘤,免疫组化染色显示髓母细胞瘤特异表达分子Syn和NeuN为阳性,GFAP、S-100、H3K27M、MUC1、CK(AE1/AE3)均为阴性,与星型胶质细胞瘤和室管膜瘤等可鉴别。表明PUMC-MBT1细胞可作为髓母细胞瘤体内研究工具。
可移植瘤瘤株建立体内肿瘤研究模型比CDX/PDX具有突出的优势。肿瘤研究中,体外培养连续细胞系的优势在于可以进行基因操作,验证信号通路等分子机制,可以观察药物等影响因素对肿瘤细胞直接的作用。与体内环境相比,体外培养环境简单、条件易控。但是,体外培养很难体现真实发生在体内的肿瘤的方方面面。所以在药物研究过程中,利用动物体内实验模型进行的药效学验证是无法逾越的阶段。CDX在多组体内研究时,比如需要50~60只动物接种时,需要培养大量的细胞,细胞培养操作复杂、耗时长且昂贵。根据肿瘤类型和使用小鼠种类的不同,PDX模型成功率不同,对于中枢神经系统肿瘤,据报道使用SICD小鼠构建PDX模型平均成功率仅50%左右[10]。人的肿瘤组织第一次移植到小鼠体内,潜伏很长、且不确定[11]。第一代移植的肿瘤,首先在数量上往往也不能满足多组研究的需要,需要多次在动物体内传代,才能获得足量肿瘤;其次,在这个过程中肿瘤细胞多样性在传代后能否保留,也是未知数,缺乏研究[12]。而使用瘤株的移植瘤模型,在动物体内传代后,克服了上述种种缺点,保留了肿瘤最主要的特性,获得了稳定的预期。瘤株可在液氮中长期储存,使用时复苏建模,是理想的肿瘤实验研究模型。
综上所述,PUMC-MBT1细胞具有稳定传代的特性,是髓母细胞瘤良好的体内研究工具。
