Ku70高表达促进人卵巢癌细胞系的增值并与卵巢癌患者不良预后相关
2022-09-28张晓燕朱爱华于宏波范新丹汤春辉姚秀芳
王 娟,张晓燕,朱爱华,于宏波,范新丹,汤春辉,姚秀芳
(1.南通大学附属妇幼保健院 妇产科,江苏 南通 226001; 南通大学附属如东医院 2.妇产科; 4.病理科,江苏 南通 226400;3.南通大学附属医院 妇产科,江苏 南通 226001)
上皮性卵巢癌(epithelial ovarian cancer,EOC)被认为是女性生殖系统常见的三大恶性肿瘤之一,其病死率居首位。尽管临床上常采用手术联合化学药物治疗、放射治疗等多种治疗手段,但患者总的5年生存率仍较低[1]。因此,需要寻找一种潜在的、特殊的分子,以便为未来开发一种更有效的检测及治疗方法显得尤为重要。
DNA损伤可引起细胞异常增殖、分化和凋亡,最终导致癌变。DNA双链断裂(DNA double-strand breaks, DSB)是最严重的一种DNA损伤类型,它可以被DNA DSB修复系统修复,非同源端连接(non-homologous end-joining, NHEJ)是人类主要的DNA DSB修复系统[2],而Ku70/XRCC6是此途径所必需的[3]。Ku70参与了多个核过程,包括DNA修复、端粒维护和细胞凋亡[4]。有报道Ku70也位于细胞质中,调控抗凋亡Bcl-2家族成员。近年来,有研究表明Ku70与肿瘤进展有关,如宫颈癌[5]、乳腺癌[6]、肺癌[4]、肝癌[7]等。
本研究通过检测Ku70在人卵巢癌组织及细胞中的表达,观察卵巢癌细胞的增殖、凋亡及迁移,探讨Ku70在卵巢癌发生发展中的意义。旨在为卵巢癌寻找新的标志物和分子治疗靶点提供科学依据。
1 材料与方法
1.1 材料
1.1.1 组织样本:对2004—2009年在南通大学附属医院治疗的119例EOC手术标本(包括61例浆液腺癌、5例黏液癌、10例子宫内膜样腺癌、10例透明细胞癌和33例其他类型癌)进行免疫组化。从南通大学附属医院病理科档案中收集119例标本资料,并追踪其5年生存率的结果。12个新鲜标本在手术取出后立即用液氮冷冻,-80℃保存,用于Western blot分析,其中包括3例正常新鲜组织和9例EOC组织。所有标本的收取均经南通大学附属如东医院伦理委员会审查批准(NO.20190062)。
1.1.2 细胞系:人卵巢癌细胞系A2780、SKOV3、OVCAR3、HO8910(上海细胞生物学研究所)。
1.1.3 试剂:小鼠抗人Ku70单克隆抗体、小鼠抗人Ki-67单克隆抗体、小鼠抗人cyclin D1单克隆抗体、小鼠抗人PCNA单克隆抗体、小鼠抗人Bcl-2单克隆抗体、小鼠抗人Bax单克隆抗体和兔抗人GAPDH多克隆抗体(Santa Cruz Biotechnology公司);HRP 标记抗兔 IgG(Sigma-Aldrich公司);CCK-8试剂(Dojindo, Kumamoto公司); Ku70-siRNA及其阴性对照control-siRNA(GenePharma公司)。所有siRNA序列如下:Ku70-siRNA#1(5′-GUGAUG UCCAAUUCAAGAUTT-3′);Ku70-siRNA#2(5′-GC AUCUUCCUUGACUUGAUTT-3′);Ku70-siRNA#3(5′-CUGUGGGCAUUUAUAAUCUTT-3′);Control-siRNA(5′-UUCUCCGAACGUGUCACGUTT-3′)。
1.2 方法
1.2.1 细胞的培养及处理:所有细胞在1640培养基中增殖,培养基中添加10%热灭活胎牛血清,37 ℃,5% CO2培养箱中培养。细胞转染:HO8910细胞在培养皿中培养,汇合度达到80%时,根据脂质体转染试剂盒提供的说明书,通过脂质体转染将Ku70-siRNA和control-siRNA导入HO8910细胞系。在无血清的培养基中培养 6 h,然后换成 10%的完全培养基培养 48 h,收集细胞进行Western blot、CCK-8、集落形成、划痕实验、Transwell迁移和凋亡染色的流式细胞仪检测。
1.2.2 Western blot检测蛋白:样本组织加入蛋白裂解液,提取组织蛋白,按比例配制待测样品,进行 SDS-PAGE,将蛋白转至 PVDF(polyvinylidene fluoride,聚偏二氟乙烯膜)膜上,在含5%脱脂奶粉的 TBST(tris buffered saline tween,含吐温的三羟甲基氨基甲烷缓冲溶液)中室温封闭 2 h,加一抗(兔抗人Ku70多克隆抗体,1∶400)室温孵育 2 h或4 ℃孵育过夜,用TBST洗膜3次,每次5 min,加入二抗室温孵育 2 h,然后用TBST冲洗3次,每次15 min。这些条带由增强化学发光检测系统(Pierce, Rockford, IL)显示。使用ImageJ分析系统测量条带强度。
1.2.3 免疫组织化学(immunohistochemistry, IHC)检测蛋白表达:手术切除的组织用10%甲醛固定,石蜡包埋,在玻片上制备4 μm厚的标本切片。切片在二甲苯中常规脱蜡,通过分级乙醇系列再水化,然后在10 mmol/L柠檬酸钠缓冲液(pH=6.0)中用高压灭菌器加热到121 ℃ 3 min进行抗原回收。H2O2(0.3%)冷却20 min后,内源性过氧化物酶活性被阻断。PBS(pH=7.2)冲洗后,用小鼠抗人Ku70抗体(1∶400稀释)和小鼠抗人Ki-67抗体(1∶500稀释)室温孵育3 h。所有玻片均采用过氧化物酶-抗过氧化物酶法处理。PBS洗涤后,用显色剂二氨基联苯胺(diaminobenzidine, DAB)(0.1%磷酸盐缓冲液,0.02 %二氨基联苯胺四盐酸盐和3% H2O2)孵育切片,观察过氧化物酶反应。切片用水冲洗后,用苏木精进行反染色。然后用分级酒精脱水。结果由两位研究员采用双盲法使用徕卡荧光显微镜独立阅片。
1.2.4 CCK-8法检测细胞增殖:将转染细胞以2×104cells/well(体积为100 μL)接种到96孔细胞培养板(Corning Inc, Corning NY, USA)中,孵育24 h。然后每孔加10 μL CCK-8试剂,37 ℃的暗室中孵育1.5 h。根据厂家的技术说明,在测试波长为450 nm和参考波长为630 nm的情况下,使用微孔板阅读器(Bio-Rad)测量吸光度值。
1.2.5 集落形成实验检测细胞增殖:将转染了Ku70-siRNA#1和control-siRNA 的HO8910细胞的单细胞悬液(约50个细胞)接种于培养皿中,14 d后集落用0.5%结晶紫染色30 min。对样本进行拍照,并统计可见集落的数量。
1.2.6 流式细胞测量术分析细胞凋亡:转染Ku70-siRNA#1和对照control-siRNA的HO8910细胞培养48 h后收集。在每根试管中加入60 μL的悬浮细胞,然后在每根试管中加入60 μL的检测试剂。在室温下黑暗孵育20 min后,根据试剂盒提供的说明书,使用MuseTM细胞分析仪进行凋亡检测。
1.2.7 免疫共沉淀实验检测蛋白间相互作用:收集HO8910细胞并在缓冲液(50 mmol/L, Tris-HCl, pH 7.5, 150 mmol/L NaCl, 5 mmol/lL EDTA, 1% NP-40, 0.5%去氧胆酸,0.1% SDS)中裂解。收集上清30 μL作为Input。剩下的液体用30 μL protein A/G agarose在4 ℃中预处理 2 h。之后,预处理的上清液分离成两部分,分别加入6 μL鼠单克隆抗体Ku70和0.3 μL老鼠免疫球蛋白IgG在4 ℃中低速孵化过夜。然后加入30 μL protein A/G在4 ℃中低速孵育2 h,去除上清液,收集沉积物,然后使用针对Ku70和Bax的特异性抗体对免疫复合物进行免疫印迹分析。
1.2.8 免疫荧光检测基因表达:将转染了Ku70-siRNA和control-siRNA的HO8910细胞接种到培养皿中,加入含有10%灭活胎牛血清的1640培养基,放置在37 ℃,5% CO2培养箱中孵育过夜。然后用PBS洗涤,在室温下用4%多聚甲醛固定细胞30 min,用PBS洗涤3次,然后用0.2% Tritonx-3%牛血清白蛋白-PBS渗透10 min。用0.1% BSA缓冲液在室温下封闭2 h,然后在室温下用Ku70抗体孵育2 h,PBS洗涤后,用二抗孵育细胞,用hochest进行反染色,并用荧光显微镜(Leica CTR 5000)观察。
1.2.9 划痕实验检测细胞迁移能力:细胞在6孔板的单层细胞中几乎完全汇合。转染48 h后,血清饥饿细胞12 h。然后用10 μL的移液管尖端在满细胞的6孔培养板中间做划痕,用PBS洗涤脱落的细胞,加入含有1%胎牛血清的1640培养基,放入37 ℃,含有5% CO2培养箱中培养,用20×物镜的相差显微镜拍摄0 h和24 h时的细胞状态。
1.2.10 Transwell小室法检测细胞侵袭:经Ku70-siRNA#1和control-siRNA预处理的细胞经胰蛋白酶处理后重悬于不含血清白蛋白的1640培养基中。将细胞(约1×105个/孔)添加到24孔趋化板Transwell小室 (Corning,孔径8 μm)的顶部腔室中,并在底部腔室中添加含有10% FBS的1640培养基。孵育24 h后,去除顶部(未迁移)细胞,底部(迁移)细胞用4%多聚甲醛固定20 min,结晶紫染色可见细胞。在200倍显微镜下统计5个区域的迁移细胞数量,并测定每个腔室的平均值。所有实验都是重复进行的。
1.3 统计学分析
2 结果
2.1 Ku70在上皮性卵巢癌组织和细胞中过表达。
Ku70在肿瘤组织的表达水平高于正常组织(图1A~B)。Ku70在4株卵巢癌细胞系中高表达,其中在HO8910细胞中表达最显著(图1C)。与对照组相比,转染siRNA后HO8910细胞中Ku70的表达被抑制,其中Ku70-siRNA#1的下调效果最明显,可用于后续实验(图1D)。Ku70在119例上皮性卵巢癌样本中的表达情况,与预期一致,Ku70在分化差的标本中表达高于分化好的标本,这与Ki-67一致(图2)。
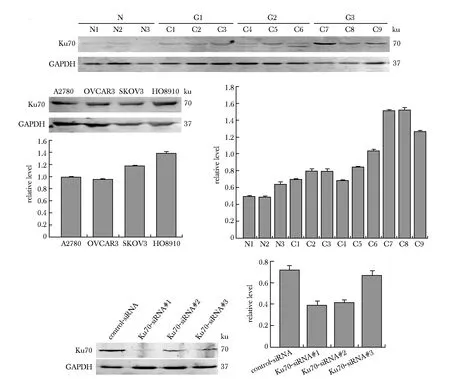
图1 Ku70在EOC组织和HO8910细胞中的表达情况Fig 1 Expression of Ku70 in EOC tissues and HO8910 n=3)
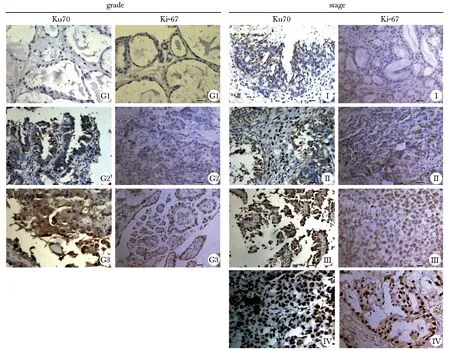
图2 免疫组化分析Ku70、Ki-67在119例EOC组织中的表达及分布
在上皮性卵巢癌患者组织样本,Ku70高表达与肿瘤分期(P<0.001),肿瘤分级(P<0.05),有无淋巴结转移(P<0.05)及有无远处转移(P<0.05)密切相关(表1)。此外,Ku70的表达与Ki-67的增殖活性也呈正相关(r=0.642,P<0.001)(图3)。
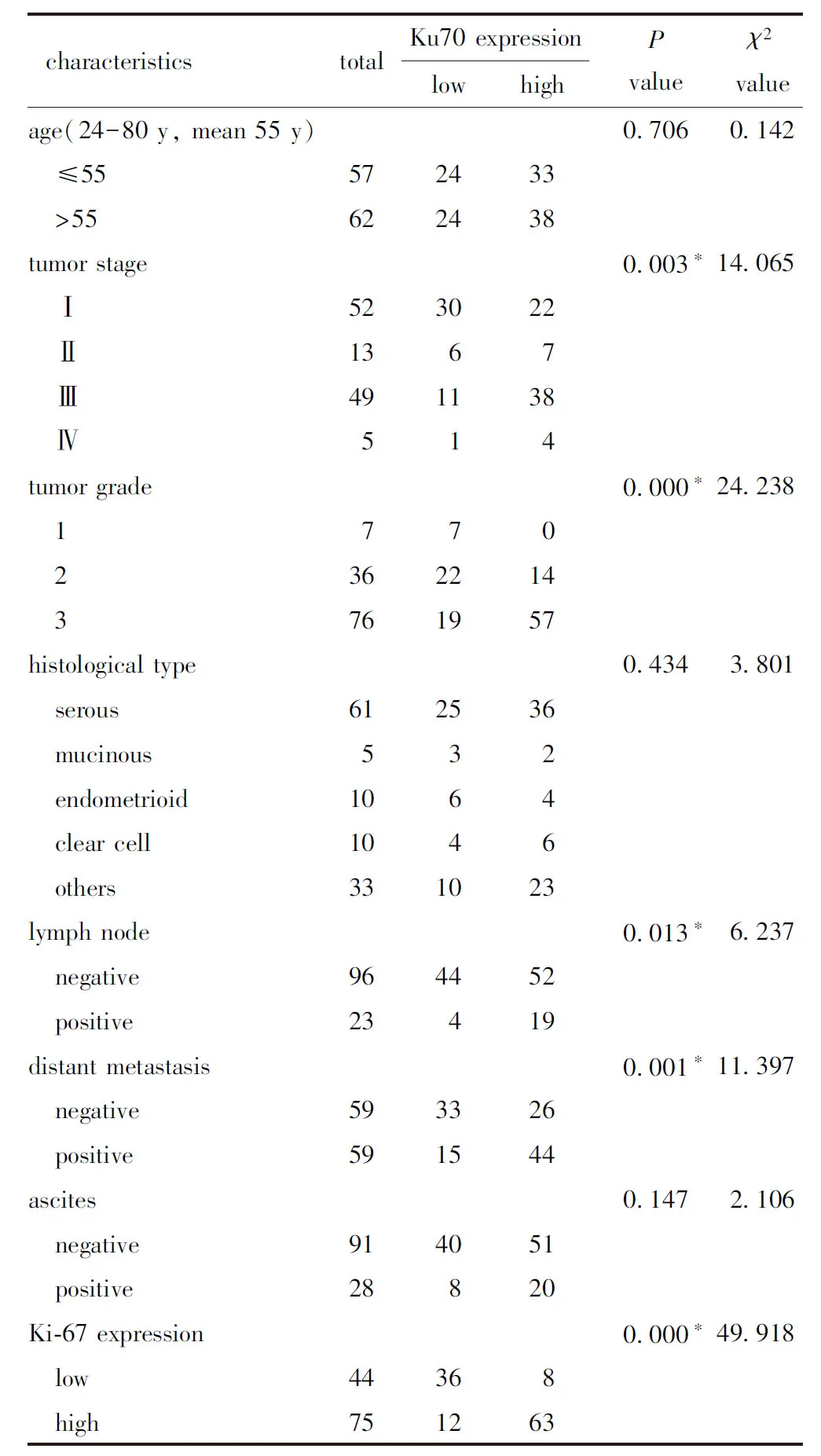
表1 Ku70和Ki-67在119例EOC样本中的表达 及临床病理特征
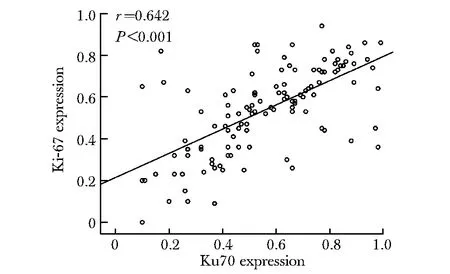
图3 Ku70与Ki-67增殖指数在EOC中表达的相关性Fig 3 Relationship between Ku70 and Ki-67 prolifera- tion index expression in EOC
2.2 Ku70表达与上皮性卵巢癌患者生存率的关系
Ku70高表达的患者其5年生存率低,年龄(P<0.05),肿瘤分级(P<0.05), 肿瘤分级(P<0.001),组织学类型(P<0.05),远处转移(P<0.001),Ku70表达(P<0.001),Ki-67表达(P<0.001)与其5年生存率密切相关。Cox比例风险模型进行多因素分析临床病理特征的独立预后价值,患者的5年生存率与患者年龄(P<0.001),肿瘤分级(P<0.05),Ki-67(P<0.05)及 Ku70 的表达 (P<0.05)密切相关,Ku70的表达可以作为评估卵巢癌患者5年生存率的一个独立因素(图4,表2)。
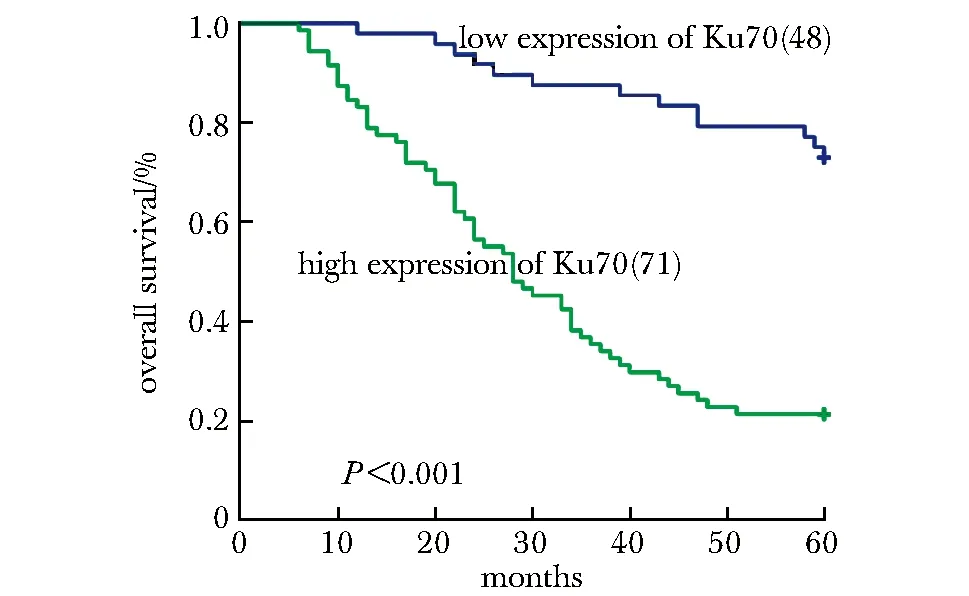
图4 根据Ku70蛋白表达情况绘制119例EOC患者 Kaplan-Meier生存曲线Fig 4 Kaplan-Meier survival curves for 119 EOC patients according to Ku70 protein expression status(long-rank test)
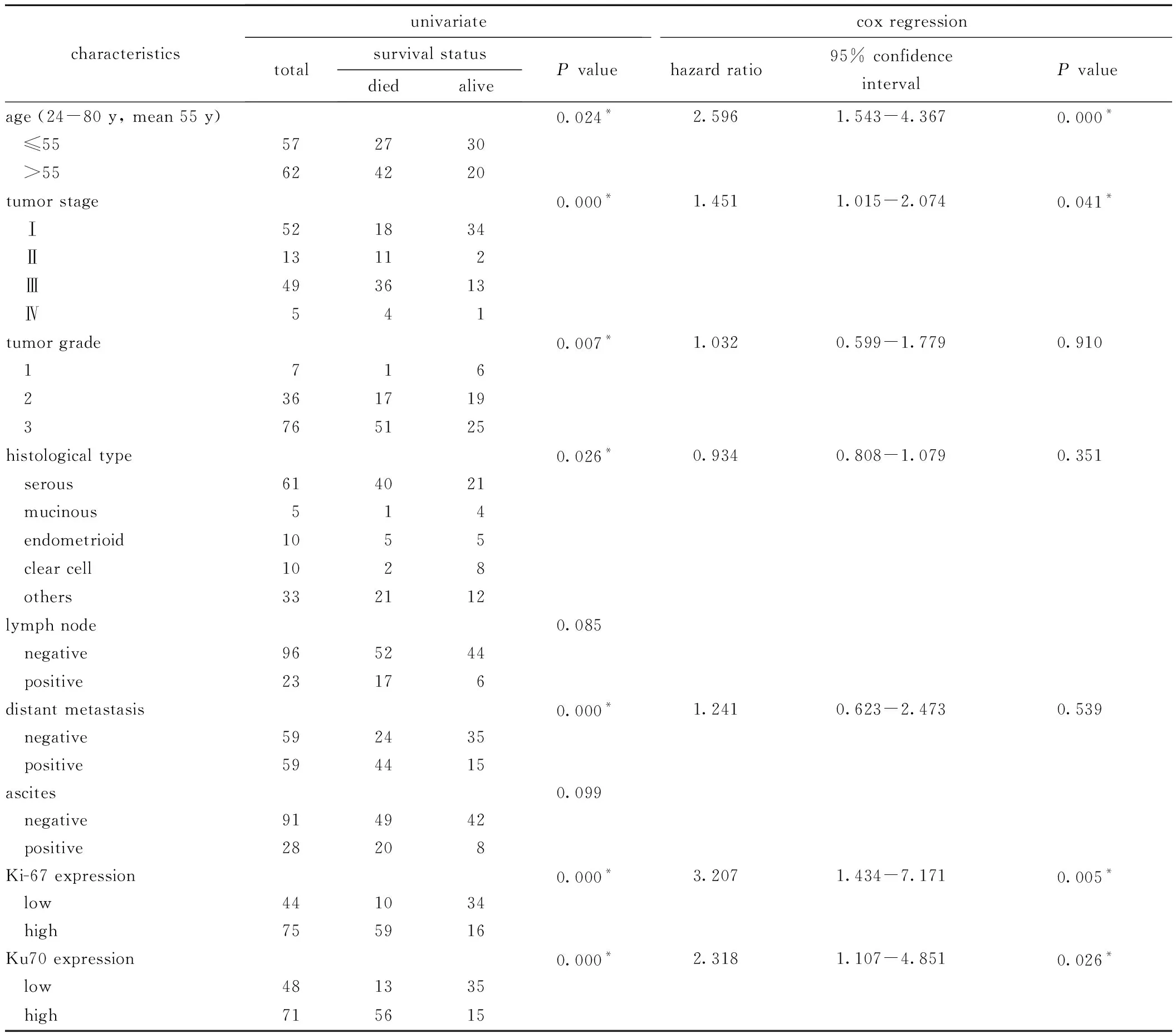
表2 单因素和Cox回归分析119 EOC样本中各种病理因素对生存率的影响
2.3 低表达Ku70可抑制上皮性卵巢癌细胞增殖
与对照组相比,转染了Ku70-siRNA#1及Ku70-siRNA#2的HO8910细胞增殖被抑制(图5A)。转染Ku70-siRNA#1及Ku70-siRNA#2后,HO8910细胞形成的集落数量和大小均显著减少(图5C,D)。此外,Ku70-siRNA #1及Ku70-siRNA#2转染的细胞中Ku70的表达显著降低,与PCNA、cyclin D1的下调一致(图5B)。
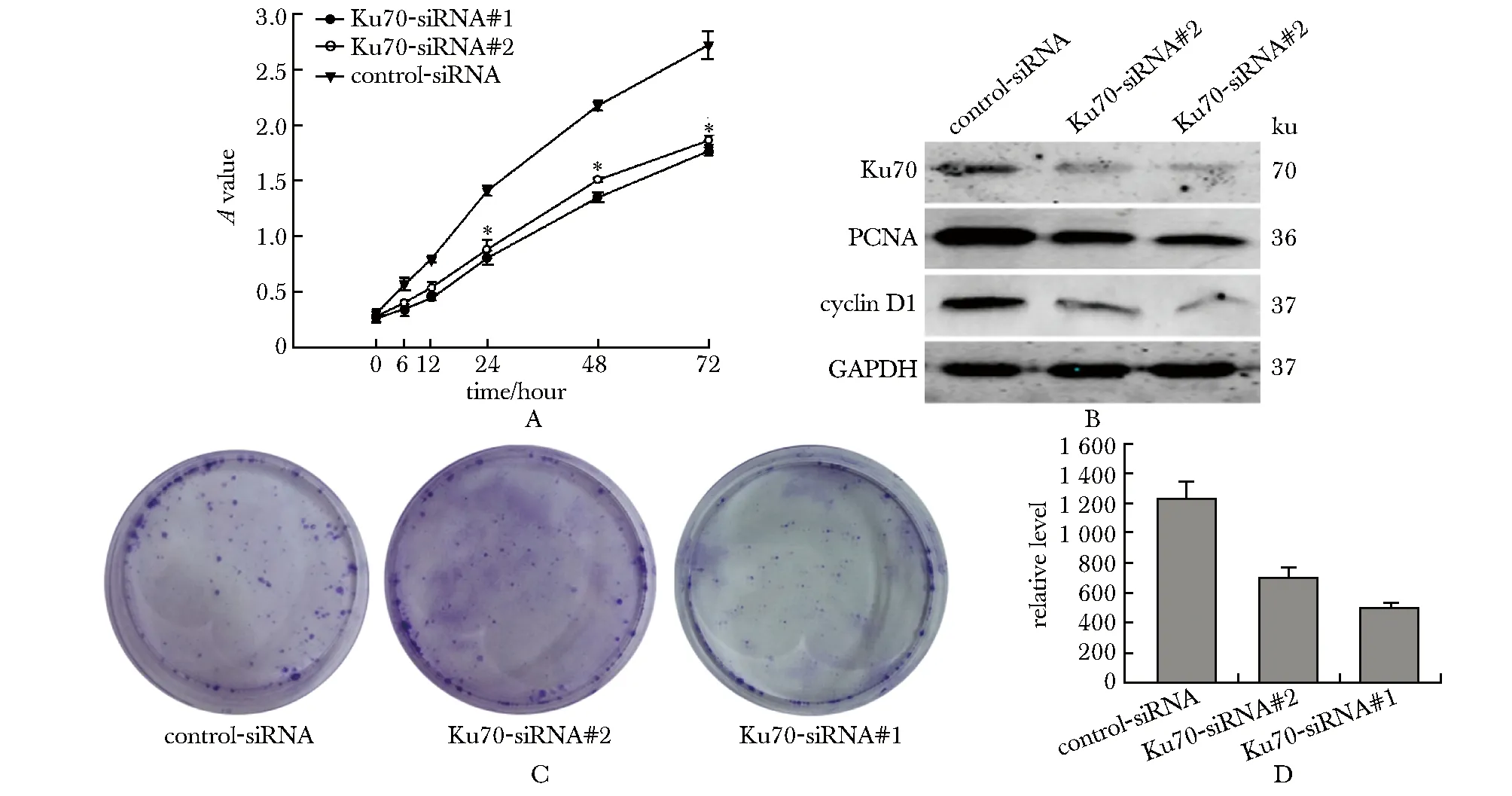
A.down-regulating Ku70 inhibited cell proliferation by CCK-8 assay; B.down-expressed Ku70 inhibited the expression of cell-cycle-related proteins like cyclin D1 and PCNA; C,D.inhibition of Ku70 expression could inhibit the proliferation of HO8910 cells by colony formation assay; *P<0.05 compared with control-siDNA
2.4 Ku70表达缺失诱导卵巢肿瘤细胞凋亡
与control-siRNA转染细胞相比,Ku70-siRNA#1转染细胞的凋亡百分率显著升高(图6A)。Ku70参与了Bax (Bcl-2家族之一)凋亡通路,这与研究结果一致(图6B,C)。免疫荧光分析证实Ku70确实位于细胞质和细胞核中(图6D)。
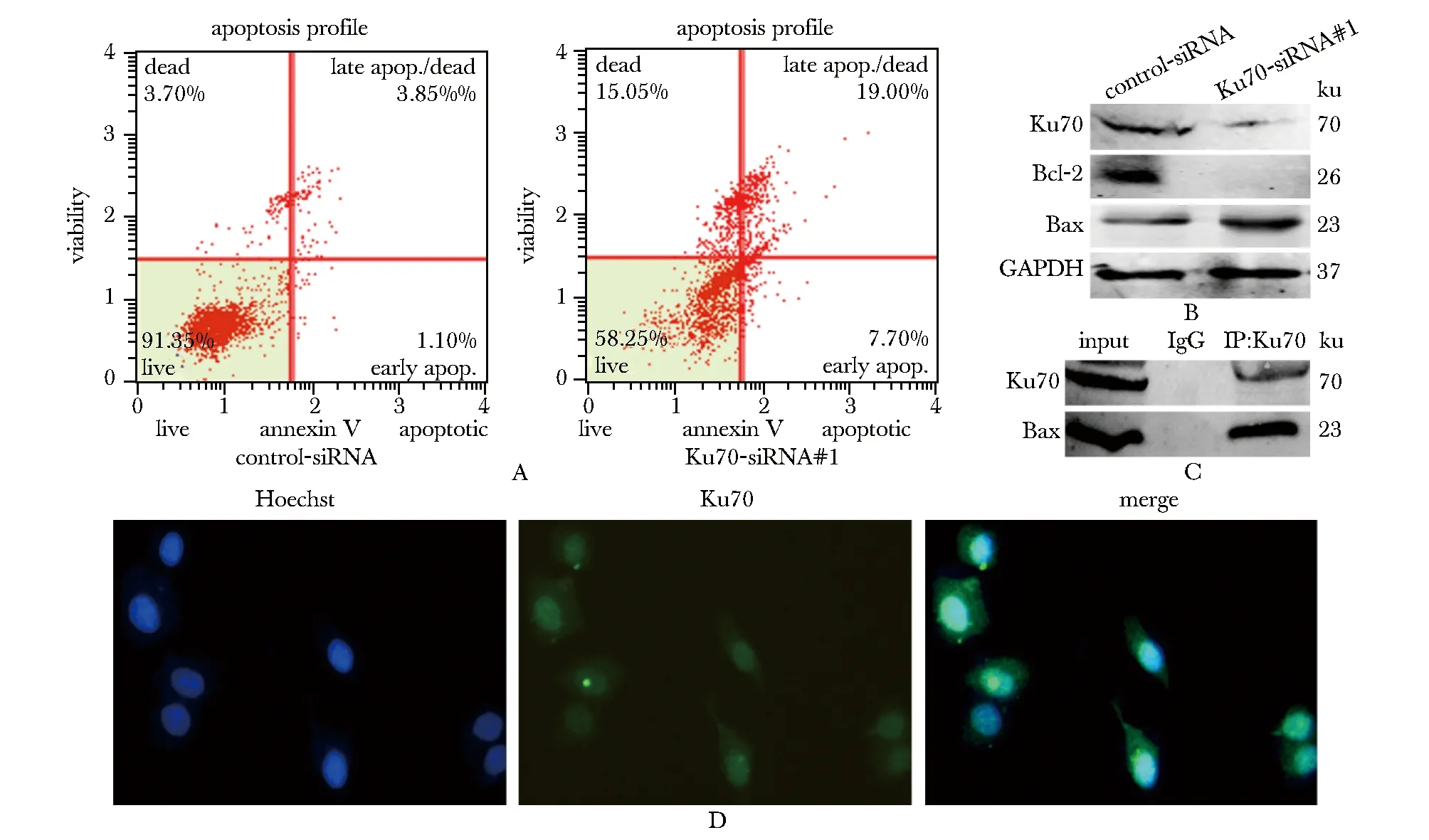
A.inhibiting Ku70 promotes apoptosis of HO8910 cells by flow cytometry; B.Western blot was used to detect the protein levels of Bcl-2 and Bax when inhibiting Ku70 compase with control; C.interaction of Ku70 and Bax was demonstrated by co-immunoprecipitation assay; D.blue nucleus, green cytomembrane located by immunofluorescence(×200)
2.5 下调Ku70表达可减缓卵巢肿瘤细胞的迁移
Ku70的下调表达可以通过使被划伤HO8910细胞的“伤口”更慢地愈合,从而减少伤口愈合过程(图7A)。同时,在Transwell 小室实验中,与对照组相比,Ku70的下调表达抑制了细胞向底腔的迁移(图7B)。
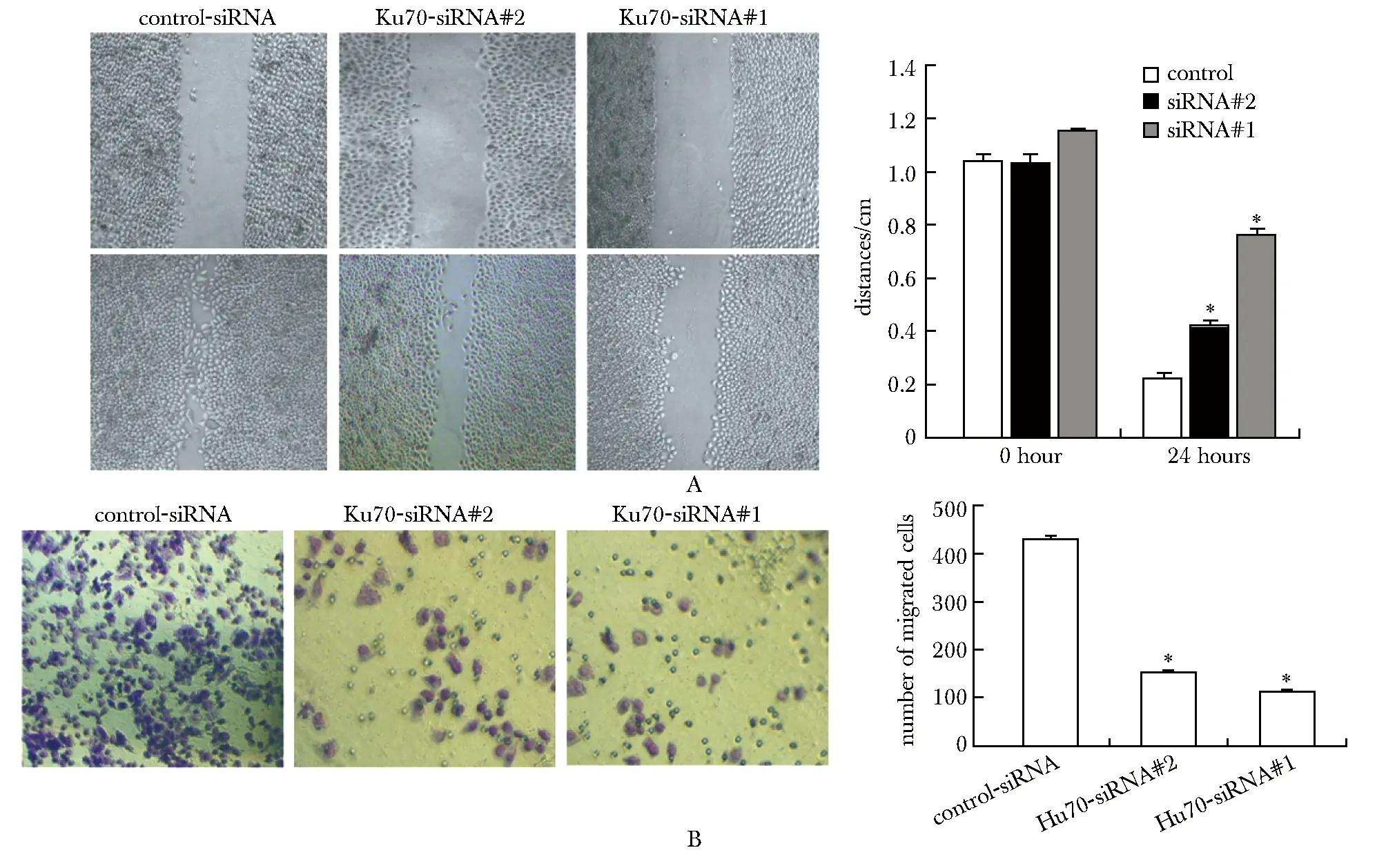
A.effect of Ku70 knockout on the migration of HO8910 cells by wound healing assays(×40); B.Transwell assays were used to detect the effect of Ku70 knockout on the migration of HO8910 cells(×200); *P<0.05 compared with control
3 讨论
上皮性卵巢癌(EOC)被认为是最致命的妇科肿瘤之一,虽然临床采用手术、化学治疗和放射治疗等综合治疗手段,但其在妇科恶性肿瘤中病死率仍最高[1]。此外,EOC具有高复发率和多药耐药性,患者5年生存率低[8]。因此,更好地了解EOC的分子机制有助于靶向化疗药物的研发。
NHEJ被认为是哺乳动物细胞中主要的DNA修复途径,而Ku70是参与NHEJ的主要因子。Ku70的失调使细胞对DNA损伤敏感,突变和染色体畸变的积累导致细胞凋亡和过度细胞增殖,增强基因组不稳定引发肿瘤[2,9]。研究表明,Ku70与细胞增殖、凋亡和迁移有关[7,10-11]。本研究通过集落形成、CCK-8、PCNA、cyclin D1检测,初步提示Ku70下调表达可能通过细胞周期过程降低EOC细胞增殖。此外,流式细胞仪分析显示, 降低Ku70的表达可能促进EOC细胞凋亡。通过划痕实验和Transwell小孔实验测定Ku70诱导细胞迁移的能力。以上结果提示,Ku70的过表达可能在卵巢癌的发生发展中起重要作用。
一些研究证实,Ku70也位于细胞质中,通过隔离癌组织线粒体中的Bax来抑制细胞凋亡,而当Ku70从Bax释放时,Bax可以转运到线粒体中,触发细胞色素C的释放,导致caspase依赖的细胞凋亡[4]。本研究中,免疫组化和免疫荧光显示Ku70位于EOC细胞的细胞核和细胞质中,这与报道[12]一致。流式细胞测量术分析显示,下调Ku70可诱导EOC细胞凋亡。Western blot显示,在Ku70-siRNA#1转染的细胞中,促凋亡的Bax表达增加,抗凋亡的Bcl-2表达减少。免疫共沉淀显示Ku70与Bax在EOC中相互作用。以上结果提示,Ku70可能是EOC中Bax凋亡通路抑制细胞凋亡的重要原因。
综上所述,抑制Ku70表达可延缓EOC细胞增殖,诱导细胞凋亡,减少细胞转移。Ku70可能通过参与NHEJ的DSB修复机制,调控细胞周期及caspase依赖的细胞途径发挥作用。Ku70可能是卵巢癌等肿瘤的重要治疗靶点。
