罗沙司他治疗肾性贫血的研究进展
2022-09-28胡宝丽
胡宝丽,胡 斌
(1.三峡大学医学院, 湖北 宜昌 443002;2.三峡大学附属仁和医院 肾内科,湖北 宜昌 443000)
慢性肾脏病(chronic kidney disease,CKD)是全球死亡率增长较快的原因之一,预计到2040年将成为5大死亡原因之一[1]。肾性贫血显著增加慢性肾脏病患者心脑血管事件发生率、病死率[2],而扭转这一趋势则需要更好的预防和治疗慢性肾脏病及其并发症。目前中国CKD患者约有1.195亿,预计患者数量还将不断增加,其中接受透析的患者中约90%以上合并肾性贫血[3]。肾间质细胞合成促红细胞生成素(erythropoietin,EPO)绝对或相对不足是导致肾性贫血的重要原因之一。1989年问世的红细胞生成刺激剂(erythropoiesis-stimulating agents,ESAs)开启了长达30几年的肾性贫血治疗新纪元,联合铁剂治疗是目前的主要治疗方式,但大剂量的使用增加心血管疾病发生的风险。所以亟需寻找一个合适的治疗方案来解决肾性贫血的问题。以拮抗低氧诱导因子脯氨酰羟化酶(hypoxia-inducible factor proly hydroxylase,HIF-PH)的新型治疗肾性贫血药物罗沙司他(roxadustat,爱瑞卓,Evrenzo)的出现,可能为广大肾性贫血患者带来新的曙光。
1 肾性贫血的治疗现状
世界卫生组织推荐成年男性血红蛋白(hemo-globin,Hb)<130 g/L,非妊娠女性Hb<120 g/L,妊娠女性<110 g/L,即可诊断为贫血。一项纳入95例诊断为慢性肾脏病5期的,且首次血压透析治疗患者的临床资料行回顾性研究分析显示,患者均有不同程度的贫血,中、重度以上贫血患者比例高达61.2%[4],足以见得,在透析初期,肾性贫血的问题就不容忽视。2019年一项研究纳入了上海28家血液透析中心的8 392例维持性HD(maintenance hemodialysis,MHD)患者,其中发现Hb<80 g/L者占比4.96%,80~100 g/L的患者占比20.14%,Hb在110~130 g/L的患者占比40.4%[5]。患者长期贫血,氧分压下降,心脏前负荷增加,心输出量增加,长期以此致使左心室肥厚,发展成全心肥大甚至心衰,病死率随之增加。
促红细胞生成素(erythropoietin,EPO)是组织在低氧的情况下产生的一种增殖的成熟的因子。人体产生的EPO约90%来自肾脏,10%来自肝脏。肾源性EPO是由位于肾外髓质和内皮层近端小管细胞附近的皮质小管周成纤维细胞产生的。在低氧和贫血的条件下,产物扩展到外皮层,而这一区域易受到低氧的影响,可见,组织低氧是增加EPO产生的重要条件。ESAs通过结合并激活骨髓中红系祖细胞表面的EPO受体(EPOR)刺激红细胞生成,极大的改善了输血依赖性贫血患者的生活质量。长期高剂量的使用ESAs,不可忽视潜在的心血管事件、血栓事件等[6]。铁是合成Hb的主要原料,CKD患者大部分存在铁缺乏,适当补充铁剂可以提高红细胞水平。患者口服铁剂伴随着较大的胃肠反应,吸收差,多数血透患者需要静脉补充铁以达到最佳治疗效果。长期的静脉补铁会导致肝脏铁负荷超载,进一步诱导血管氧化应激、内皮功能紊乱等的发生。
2 罗沙司他(roxadustat)的简介
罗沙司他是珐博进(中国)(FibroGen China)和阿斯利康(中国)(AstraZeneca China)医药技术开发有限公司自主研发的首类口服低氧诱导因子脯氨酰羟化酶抑制剂(hypoxia-inducible factor prolyl hydroxylase inhibitors,HIF-PHI),是一种具有全新作用机制的治疗肾性贫血的药物,其主要拮抗脯氨酰羟化酶(prolyl hydroxylase,PHD),激活低氧信号下的氧感机制,改善贫血。2018年12月17日,罗沙司他作为1类创新药物,被国家药品监督管理局正式批准用于治疗透析患者的慢性肾脏病贫血,成为治疗透析患者肾性贫血的首个口服小分子HIF-PHI新药,用于肾性贫血患者的治疗。
3 罗沙司他(roxadustat)治疗肾性贫血的作用机制
3.1 Roxadustat促进内源性EPO生成
HIFs蛋白家族在EPO生成的信号传导通路上起着重要作用。HIF转录因子是一种异源二聚体碱性螺旋-环-螺旋蛋白,属于转录调控因子bHLH家族。HIF转录因子由氧敏感型的α亚基和表达结构型的β亚基组成。目前已经发现3个HIF-α亚基型:HIF-1α、HIF-2α和HIF-3α。HIF-1α和HIF-2α在细胞低氧应答中的作用不容小觑,对于HIF-3α的研究目前还很少。HIF-1α和HIF-2α主要通过调控红细胞生成、血管生成、厌氧代谢、线粒体代谢等一系列生物反应以促进低氧下的氧气运输和细胞适应[7]。促红细胞生成素的合成和铁代谢主要由HIF-2α调节。
HIF-1α和氧敏感型的HIF-2α组成的复合物与HIF-1β结合产生相应通路效应。在低氧条件下,人肾脏纤维母细胞只有HIF-2α被激活。最早是在导致红细胞异常增多的突变基因中发现HIF-PHD2的。在常氧条件下,HIF-2α被脯氨酰羟化酶2(PHD2)羟化,从而被标记,与冯希佩尔-林道蛋白肿瘤抑制因子(Von Hippel-Lindau tumor suppressor,pVHL)相结合,随后泛素化,在细胞外被降解[8]。PHD2具有广泛的靶点以及细胞内功能,包括参与红细胞生成的相关基因,包括EPO相关基因、EPO受体相关基因以及促进铁吸收、铁转运和血红素合成的蛋白。而罗沙司他(HIF-PHI)就是根据这一原理,在常氧条件下阻止HIF-2α被羟化,HIF-2α富集化,与HIF-1β结合形成二聚体,移位进入细胞核内,诱导EPO基因及其受体的转录,从而促进内源性EPO生成。
3.2 Roxadustat调节铁代谢
CKD患者长期透析,在透析导管处或器械中丢失铁,以及因穿刺部位的出血、反复取样检验、体内的炎性微环境等一系列因素,不可避免导致铁的缺乏。HIF-2α通过调节十二指肠细胞色素B,也称为细胞色素还原酶1(duodenal cytochrome b reductase 1,DcytB)、二价金属转运体1(divalent metal transporter 1,DMT1)、转铁蛋白,将三价铁转化为易于吸收的二价铁,促进二价铁被消化道吸收;促进转铁蛋白运至全身;调节转铁蛋白受体,将铁转运至细胞内[9]。
研究者从人的血清和尿里分离出来的一种由25个氨基酸肽组成的调节铁的激素——铁调素,使人们进一步认识到肾性贫血的发生机制。铁调素的增加抑制了十二指肠对铁的吸收作用。铁调素与膜铁转运蛋白结合使其被内化到细胞里甚至降解,从而抑制了细胞内铁的释放。炎性因子会促进铁调素表达的增加。HIF-2α通过调节促红细胞生成素的表达间接抑制铁调素基因的表达,从而下调铁调素。即使在炎性条件下,罗沙司他也能有效的激活HIF-2α通路的表达,下调铁调素的水平[10]。罗沙司他的作用机制如图1。
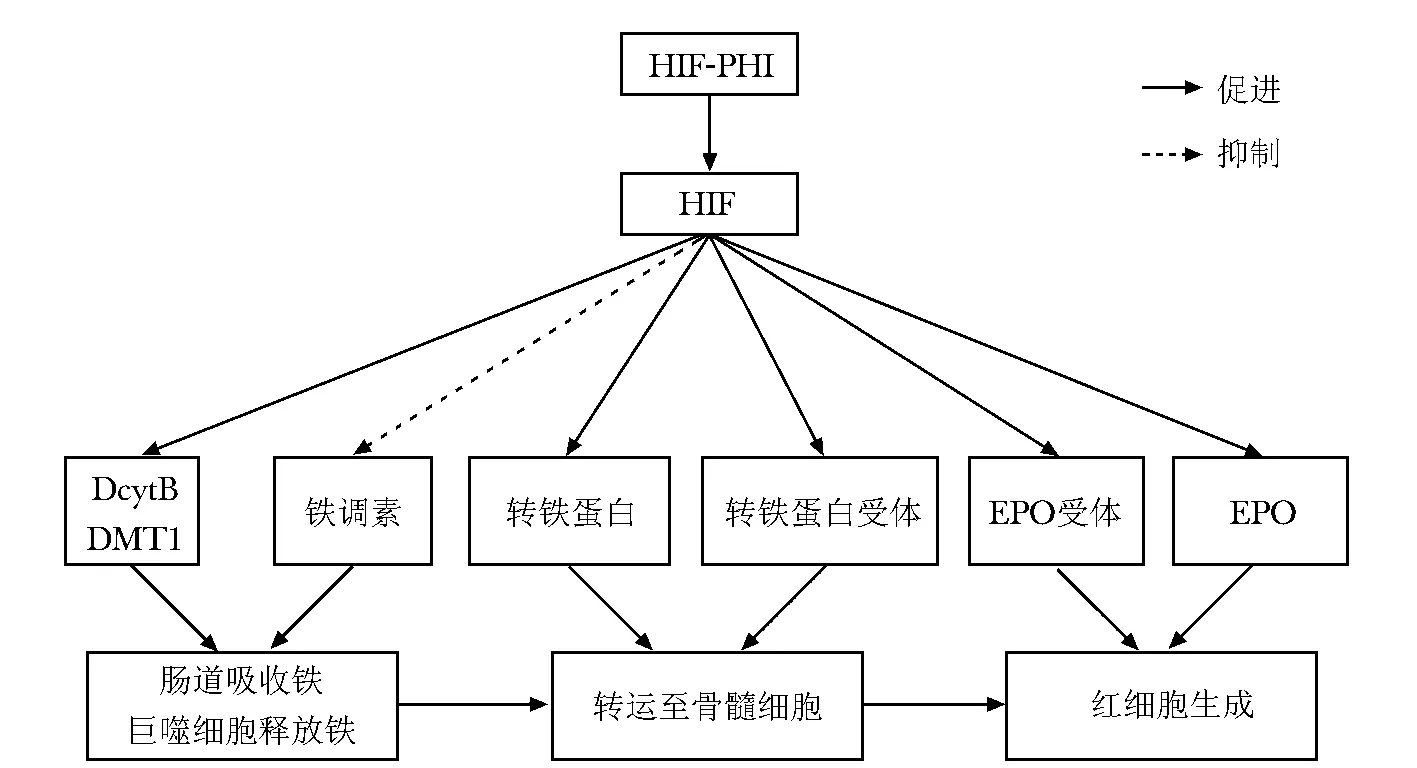
图1 HIF作用机制Fig 1 The mechanism of HIF
4 罗沙司他(roxadustat)的临床应用
美国、俄罗斯、日本、中国等国家现已分别进入Ⅲ期临床研究[10-16],共计纳入1万例研究患者,已完成了6项罗沙司他对NDD-CKD患者的有效性及安全性的临床试验,以及7项观察罗沙司他对透析依赖慢性肾脏病(DD-CKD)患者的治疗效果和安全性,均可观察到罗沙司他的治疗的有效性及其安全性。
一项在中国开展的随机、双盲、安慰剂对照组的Ⅲ期临床研究[16],其研究对象是154例非透析依赖-CKD(NDD-CKD)贫血患者,131例患者(罗沙司他组87组,对照组44例)完成了为期8周的初始双盲治疗期,进入了开放标签延长期,最终有98例患者完成了开放标签阶段的研究。结果显示在第9周时,罗沙司他组(相对于基线增加≥1.0 g/dL)较安慰组(均未产生应答)明显改善血红蛋白。罗沙司他治疗26周后,患者的Hb达标率(Hb>11 g/dL)高达84%。罗沙司他明显下调铁调素。在第9周,安慰剂组和罗沙司他组相对于基线水平分别下降。
在中国开展的另外一项中心、随机、开放性、阳性对照研究的Ⅲ期临床研究,以证明罗沙司他在既往接受过红细胞生成刺激剂(erythropoiesis-stimulating agents,ESAs)治疗,且在接受透析的CKD患者中纠正和维持血红蛋白的有效性和安全性。纳入305例CKD患者,以2∶1比例随机接受罗沙司他胶囊(204例患者)或注射阿法依泊汀(101例)治疗。罗沙司他组Hb的改善明显优于阿法依泊汀组,第23~27周,罗沙司他组患者的平均Hb水平达11.2 g/dL,在基线Hb水平相似的前提下,罗沙司他组Hb水平升高幅度从第2周开始,即显著优于ESAs组,并持续研究结束;合并炎症状态患者,罗沙司他组较ESAs组疗效明显,罗沙司他组较ESAs明显降低胆固醇。以上都表明,罗沙司他有良好的改善贫血的效果[10]。
4.1 安全性
根据目前公开的数据显示, 罗沙司他总体安全性和耐受性良好。Ⅲ期临床研究中罗沙司他不良事件中发生上呼吸道感染、高血压、高血钾较高,但与对照组相比,差异无统计学意义[10]。其中个例报道,罗沙司他的使用可能会导致横纹肌溶解[17],其发生机制还需进一步研究。
4.2 其他
当PHD活性被抑制,可引发潜在的一系列HIF-α靶基因的表达。在罗沙司他治疗小鼠骨折的模型中,罗沙司他促进了骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)增殖表达,使BM-MSCs迁徙到骨折点,促进骨折的愈合,同时,HIF的富集能有效增加血清中Ca2+水平[18]。HIF也参与了呼吸道合胞病毒感染患者中病毒的复制[19]。此外, HIF-2α可通过调节碱性神经酰胺酶2促进神经酰胺的降解,降低了胆固醇的血清水平和,防止动脉粥样硬化[20]。
5 问题与展望
肾性贫血是各种原因导致的终末期肾脏病常见的并发症,改善肾性贫血,可以显著提高患者生活质量,降低心血管疾病发生率。铁剂和ESAs使用广泛,但达标率较低,仍需新的治疗方法来改变现状。作为治疗肾性贫血的新型口服药物罗沙司他,通过上调促红胞生成素基因的表达以及调节相关铁代谢,明显的改善了贫血。且不断有新的研究表明罗沙司他在其他方面可能有意想不到的治疗效果,例如降低胆固醇、增加血清Ca2+的水平,对于在慢性肾脏病患者并发的肾性骨病中是否有辅助的升钙效应,需要更多的临床数据去验证。罗沙司他在抑制HIF降解的同时,可激活体内其他的低氧信号通道,是否会带来一些潜在的不良不应,是否影响患者生活质量,应是未来主要的研究方向。
