323例原发弥漫大B细胞淋巴瘤中CD30表达及其临床病理意义
2022-09-28刘艳梅姬文莉郭云泉李新霞
刘艳梅,姬文莉,岳 娜,郭云泉,李新霞
弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是一组来源于B细胞的具有明显异质性的恶性肿瘤,约1/3的DLBCL患者经联合治疗后仍出现耐药和疾病复发,因此迫切需要寻找新的治疗靶点和可靠的预后标志物。随着CD30靶向药物对CD30阳性间变大细胞淋巴瘤(anaplastic large cell lymphoma, ALCL)和晚期经典型霍奇金淋巴瘤(classical Hodgkin lymphoma, CHL)治疗有效,CD30靶向药物对CD30阳性DLBCL治疗的临床试验也逐步开展。Hu等[1]提出CD30阳性DLBCL可能是DLBCL的一种独立亚型,CD30靶向药物的使用或许能改善患者预后。目前CD30蛋白表达在DLBCL中的意义尚不明确。因此,本实验收集323例原发DLBCL,探讨CD30蛋白在西北地区DLBCL患者中的阳性率及CD30阳性DLBCL的临床病理学特征。
1 材料与方法
1.1 临床资料收集2010年5月~2020年5月新疆医科大学附属肿瘤医院收治的323例原发DLBCL患者。病理诊断和组织学分型参照WHO(2016)淋巴造血组织肿瘤分类标准[2],排除由其他类型淋巴瘤转化的DLBCL和特殊类型DLBCL(原发中枢神经系统DLBCL,原发皮肤DLBCL腿型,原发纵隔DLBCL,慢性炎症相关、人类疱疹病毒8型相关的DLBCL,ALK阳性DLBCL,伴有获得性免疫缺陷的DLBCL)。
323例原发DLBCL的临床资料包括患者年龄、性别、受累部位、B症状、血清乳酸脱氢酶(LDH)浓度等,根据Ann Arbor分期系统对病例进行分期,并采用东方肿瘤协作组(eastern cooperative oncology group, ECOG)体力状态评分系统和国际预后指数(international prognostic index, IPI)进行评估。病例随访至2021年9月1日或患者死亡时间,自确诊之日起计算生存时间,随访内容包括无进展生存期(progression free survival, PFS)和总生存期(overall survival, OS)。
1.2 免疫组化所有标本均经10%中性福尔马林固定,4 μm厚切片,HE染色。免疫组化染色采用EnVision法,DAB显色。一抗CD20、PAX-5、CD3、CD5、CD10、BCL-6、MUM1、BCL-2、c-myc、CD30、Ki-67,均购自北京中杉金桥公司。具体操作步骤严格按照试剂盒说明书进行,以PBS代替一抗作为空白对照。以肿瘤细胞CD30阳性率>0为阳性阈值,CD30阳性率分为<20%、20%~79%、≥80%三组。根据Hans分型将病例分为生发中心型(GCB型)和非生发中心型(non-GCB型)。
1.3 统计学分析采用SPSS 19.0软件进行统计学分析,CD30阳性组与阴性组DLBCL临床病理特征的对比分析采用χ2检验,生存分析采用Kaplan-Meier法,预后分析采用Cox比例风险回归模型,以P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征323例原发DLBCL均为初治DLBCL,原发淋巴结190例,原发结外133例(胃肠道20例,扁桃体16例,咽部13例,睾丸9例,乳腺6例,甲状腺5例,其他部位64例);男女比为1.1 ∶1;少数民族98例(维吾尔族65例、哈萨克族13例、回族15例、其他民族5例),汉族与少数民族病例比为2.3 ∶1。中位年龄61岁(21~95岁),>60岁者170例(52.6%)。284例获得临床及随访资料,初诊时有B症状者95例,LDH升高者106例,19例出现骨髓侵犯;Ann Arbor分期:Ⅰ+Ⅱ期107例,Ⅲ+Ⅳ期177;ECOG评分:0~1分234例,2~4分50例;IPI指数:0~2分148例,3~5分136例。随访时间5~196个月(中位随访时间45.5个月),129例(45.8%)患者死亡。270例获取治疗信息的患者中,163例接受R-CHOP或ECHOP方案治疗,另74例接受CHOP化疗,5例行中药治疗,2例行放疗,26例未治疗。中位OS为65个月,中位PFS为47个月。
2.2 免疫表型323例中CD30阳性79例(24.5%),BCL-2阳性129例(39.9%),Ki-67增殖指数为40%~98%(中位数为80%)。Hans分型:GCB型99例,non-GCB型224例。189例行EBER检测,12例阳性,其中伴CD30阳性者9例。44例行BCL-2、BCL-6、MYC基因易位检测,12例CD30阳性病例中5例BCL-6基因分离,32例CD30阴性病例中5例BCL-6基因分离,2例MYC基因分离。
2.3 CD30阳性与阴性DLBCL的临床病理特征79例CD30阳性DLBCL患者的中位年龄59岁(24~95岁),<60岁者42例(53.2%),男性略多(1.19 ∶1)。主要累及淋巴结(72.2%),组织学主要表现为体积中等偏大的肿瘤细胞取代淋巴结或结外累及部位的正常结构,呈弥漫性或窦性生长,55例(69.6%)以中心母细胞样细胞为主,瘤细胞体积中等到大,有中等量的嗜酸性胞质,细胞核呈椭圆形或圆形,近核膜处可见2~3个嗜碱性小核仁(图1A);7例(8.9%)以免疫母细胞样细胞为主,瘤细胞体积大,有中等量的嗜碱性胞质,细胞核大、圆形,可见一个中位嗜碱性大核仁(图1B);1例为中心母细胞和免疫母细胞混合;16例(20.3%)为间变型,瘤细胞体积大、多形,核怪异、不规则(图1C),可见霍奇金Reed-Steinberg(RS)样细胞和类似未分化癌的黏附性生长模式,其中3例瘤细胞在淋巴窦内分布。免疫表型:79例(24.5%)CD30在细胞膜和(或)高尔基区呈阳性,CD30阳性率≥80%者17例(21.5%,图1D),20%~79%者47例(59.5%,图1E),阳性率<20%者15例(19.0%,图1F)。与CD30阴性DLBCL相比,CD30阳性DLBCL更易累及淋巴结(P=0.012)、non-GCB型比例更高(P=0.013)、EBER阳性率更高(P=0.001)、更易发生骨髓累及(P=0.049)、间变型组织形态比例更高(P<0.001),易发生于较年轻的人群(年龄<60岁)、BCL-2的阳性率(44.4%)和c-myc/BCL-2共同阳性率(16.7%)均较低、BCL-6基因易位比例较高(5/12),但差异无统计学意义(P>0.05);CD30阳性DLBCL组与CD30阴性DLBCL组在性别、民族、CD10表达、BCL-6表达、MUM1表达、CD5表达、Ki-67增殖指数、B症状、临床分期等方面差异均无统计学意义(P>0.05)(表1)。以CD30表达状态为分层因素,在CD30阳性组中,汉族患者临床分期Ⅲ+Ⅳ期的比例高于少数民族(P=0.021),CD30阳性率<20%、20%~79%、≥80%三组患者出现B症状的几率差异有显著性(P=0.031),CD30阳性率≥80%患者出现B症状的几率较CD30阳性率20%~79%患者低(P=0.01);CD30阴性组中,汉族患者CD5阳性率高于少数民族(P=0.022)。汉族与少数民族其他临床病理特征差异无统计学意义。
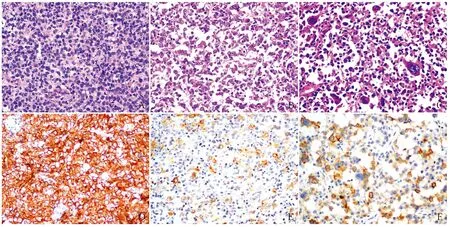
ABCDEF
2.4 Cox预后生存分析Cox单因素分析显示,患者年龄、有无B症状、LDH水平、是否发生骨髓累及、Ann Arbor分期、ECOG评分、IPI指数、治疗方式与患者OS和PFS相关(P<0.05)。CD30阳性DLBCL患者的OS和PFS均高于CD30阴性DLBCL患者,但差异无统计学意义(P>0.05,表1)。CD30阳性DLBCL组,年龄<60岁、EBER阴性(图2)、CD5阴性、无骨髓累及、LDH水平正常、ECOG评分0~1分、IPI指数0~2分、接受R/E-CHOP治疗患者(图3)的OS和PFS均高于相对应组,差异有显著性(P<0.05);Cox多因素分析显示,EBER状态和治疗方式是影响CD30阳性DLBCL患者OS的独立预后因素(EBER状态:P=0.001,HR=11.505,95%CI=2.757~48.010;治疗方式:P=0.023,HR=3.135,95%CI=1.173~8.374),影响PFS的独立预后因素只有EBER状态(P=0.002,HR=28.760,95%CI=3.315~249.517)。CD30阳性率<20%、20%~79%、≥80%三组患者OS和PFS差异均无显著性(P>0.05)。
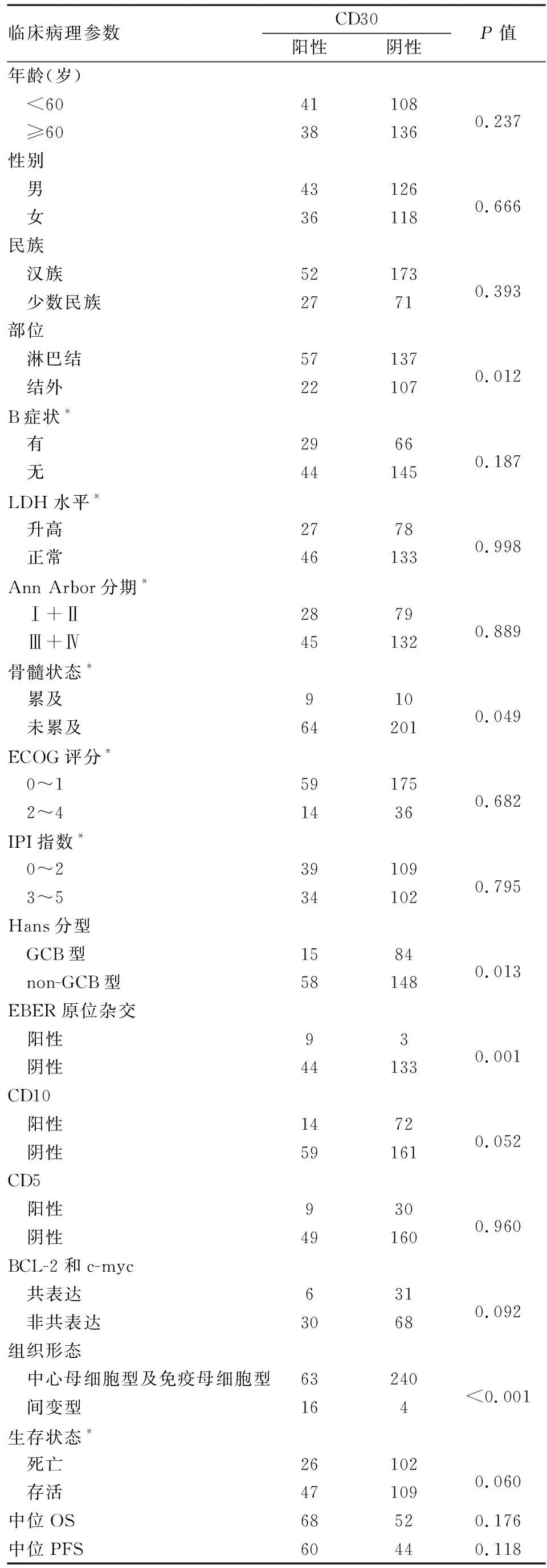
表1 CD30阳性和阴性DLBCL的临床病理特征
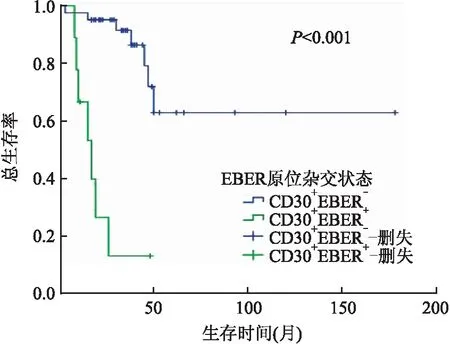
图2 CD30+EBER+与CD30+EBER-DLBCL患者的OS
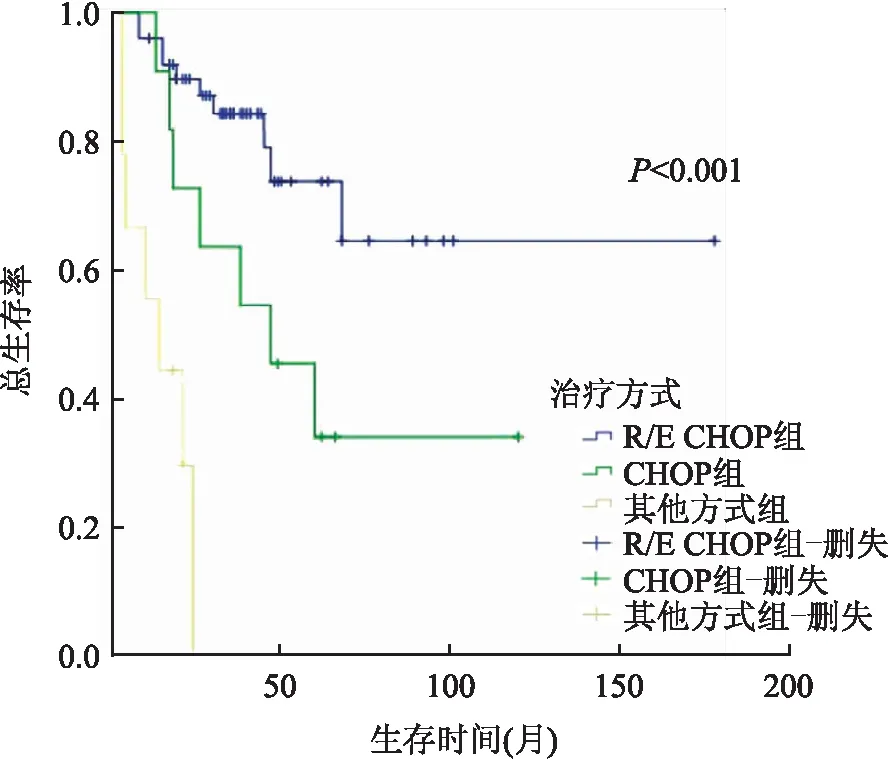
图3 不同治疗方式CD30+DLBCL患者的OS
3 讨论
CD30是一种I型跨膜糖蛋白,表达于自然杀伤细胞、树突细胞及CD4+和CD8+活化T细胞[3],可能参与导致NF-κB活化和调节Th1/Th2反应平衡的信号转导[4],是临床诊断霍奇金淋巴瘤和ALCL的重要标志物,作为CHL和ALCL的治疗靶点改善了患者的预后。CD30在非特殊型DLBCL中的阳性率文献报道不一,国际DLBCL R-CHOP联盟项目研究组[1]研究显示CD30表达于14%的原发DLBCL;以阳性率>20%为阈值,Rodrigues-Fernandes等[5]报道的CD30阳性率为2.5%~36.7%,拉丁美洲[6]DLBCL人群CD30阳性率约21%,国内广州[7]、南京[8]、杭州[9]CD30阳性率为12.0%~17.5%。本实验使用阳性率>0为阈值时,CD30阳性率为24.5%,当以20%为阈值时,阳性率为19.8%,稍高于国内文献报道,分析可能的原因有:(1)目前采用免疫组化法检测CD30阳性率,需要病理医师镜下判读,具有较大的主观性;(2)应用不同厂家、不同克隆号的试剂,不同实验室条件等客观因素的存在,导致阳性率存在差异,需要联合多中心进行研究避免这些因素的影响;(3)与本组未删除EBV阳性病例有关,有文献报道[1]EBV阳性DLBCL的CD30阳性率较EBV阴性DLBCL高,本组病例未全部检测EBV状态,同时存在EBV阳性CD30阳性病例,造成本组CD30阳性率偏高。
DLBCL依照组织学形态可分为中心母细胞型、免疫母细胞型和间变型,Li等[10]研究了DLBCL的组织形态分型与各种临床病理特征的关系,认为间变型DLBCL(anaplastic diffuse large B-cell lymphoma, A-DLBCL)是一组侵袭性亚型,提示患者预后较差,约86%的病例Hans分型为non-GCB型,51%病例CD30阳性,80%病例p53阳性,43%为BCL-2和c-myc共表达型,患者总体生存率较低。遗传学研究[10]发现,91%的A-DLBCL呈RELA、RELB或c-REL阳性,表明NF-κB信号通路被激活。A-DLBCL常呈窦性生长模式,Megahed等[11]报道的18例A-DLBCL中16例呈窦性生长,而Xu等[12]报道的17例窦性DLBCL(sinusoidal large B-cell lymphoma, SLBCL)中15例(88.2%)可见大量或散在的间变性肿瘤细胞。SLBCL和A-DLBCL的临床病理和分子特征有许多相似之处,如临床呈侵袭性过程,预后不良,高表达p53、c-myc、BCL-2和PD-L1,多为non-GCB型,伴有TP53的高频突变、MYC和BCL-2和(或)BCL-6基因重排、PD-L1/L2基因扩增和(或)多倍体,SLBCL中CD30的阳性率高于A-DLBCL,不表达CD5蛋白[10]。Hashmi等[13]报道的220例DLBCL中14例(6.4%)为间变型,仅发现A-DLBCL中的BCL-2表达缺失,未见与其他临床病理特征及预后的关系。本组323例原发DLBCL中20例(6.2%)为间变型,9例呈窦性浸润,16例(80%)CD30阳性,间变型更常见于CD30阳性病例(P<0.001),与文献报道相似,但未观察到组织形态学与其他临床病理特征及预后的关系。
Rodrigues-Fernandes等[5]总结出CD30阳性DLBCL较少累及结外部位,以Ann Arbor分期Ⅲ+Ⅳ期、ECOG评分为0~1分、non-GCB型多见,MYC和BCL-2易位比例低,但51%存在BCL-6基因易位;Hao等[7]研究显示CD30阳性DLBCL患者更易出现B症状、骨髓浸润及BCL-2高表达。本实验分析CD30表达与DLBCL临床病理特征及多项蛋白表达的关系,显示CD30阳性DLBCL更易累及淋巴结、non-GCB型比例更高、EBER阳性率更高,且更易累及骨髓,与文献报道相似。Gong等[8]研究认为CD30阳性多见于年轻患者,在BCL-2阳性和BCL-2与c-myc共阳性的DLBCL中CD30阳性率下降。本实验虽然观察到CD30阳性多见于年龄<60岁、BCL-2低表达人群,CD30阳性组c-myc/BCL-2共阳性率低、BCL-6基因易位比例高,但与CD30阴性DLBCL相比差异无统计学意义。Gong等[8]研究显示CD30阳性预示患者有更长的OS和PFS,但Hao等认为CD30阳性患者5年OS和EFS较阴性患者明显缩短,本实验未观察到CD30表达与DLBCL预后相关。
本实验以CD30表达状态为分层因素,在CD30阳性组中,汉族患者临床分期Ⅲ+Ⅳ期的比例高于少数民族;CD30阴性组中,汉族患者的CD5阳性率高于少数民族。将CD30表达程度分为<20%、20%~79%、≥80%三组,三组患者出现B症状的几率不同,CD30阳性率≥80%患者出现B症状的几率较阳性率为20%~79%患者低。影响CD30阳性DLBCL患者OS的独立预后因素是EBER状态和治疗方式,影响PFS的独立预后因素仅有EBER状态。
CD30阳性DLBCL有其独特的临床病理特征,但CD30作为DLBCL预后标志物的证据尚不充分。维布妥昔单抗虽可提高复发或难治性CD30阳性DLBCL患者的应答率和生存期[14],但抗CD30靶向药物治疗DLBCL的疗效还有待进一步验证。
