乳腺癌HER-2检测的内部质量控制:10年单中心数据分析
2022-09-28于佳秀杨丽娟曾祥菲可雪璇杨洁亮
于佳秀,杨丽娟,曾祥菲,可雪璇,杨洁亮,魏 兵
随着HER-2阳性和弱阳性乳腺癌的相关临床试验持续进展,临床对准确检测HER-2状态提出了更高要求。乳腺癌HER-2检测的数据分析是病理实验室重要的内部质控保障,主要包括HER-2阳性率监测和不同方法之间检测结果的一致性分析。美国临床肿瘤学会(ASCO)/美国病理学医师学院(CAP)以及英国乳腺病理协作委员会将HER-2阳性率监测作为乳腺癌HER-2检测质控的关键因素,同时将不同方法之间检测结果的一致率能否达到90%及以上作为检测验证试验是否合格的临界值。目前,HER-2阳性率质控数据的系列总结非常少见。本文旨在通过总结华西医院病理科2011~2020年浸润性乳腺癌HER-2免疫组织化学(IHC)各级别病例的构成比(含阳性率)、IHC与荧光原位杂交(FISH)检测的一致率,探讨上述指标在实验室HER-2检测内部质控中的适用性和监测参考值,以及HER-2检测指南变更对以上指标的影响。
1 材料与方法
1.1 材料收集2011~2020年四川大学华西医院连续性诊治的浸润性乳腺癌14 425例,其中5 688例行FISH检测。HER-2 IHC各级别病例构成比的纳入标准:(1)浸润性乳腺癌IHC染色结果明确;(2)同一患者具有多个病理标本,选取最具代表性(癌组织含量、新辅助治疗影响等)的标本进行HER-2结果统计;(3)乳腺癌转移病灶的染色结果和复发病例未纳入。HER-2 IHC与FISH检测一致率的纳入标准:(1)同时具有本科室进行的IHC和FISH检测结果;(2)FISH检测成功,数据可分析;(3)排除FISH检测结果呈异质性和特殊性的病例。
1.2 方法
1.2.1IHC和FISH检测 IHC HER-2抗体克隆号为4B5(浓缩型,Roche公司),采用自动免疫组化染色仪(BenchMark,Ventana-Roche)进行染色。FISH采用PathVysion DNA探针试剂盒。2011~2013年、2014~2018年、2019~2020年乳腺癌IHC和FISH检测结果的判读分别参考我国2009、2014及2019版HER-2检测指南[1-3]。
1.2.2数据分析和统计学方法 使用SPSS 25.0软件进行统计学分析。(1)统计2011~2020年IHC检测HER-2 0、1+、2+、3+病例整体构成比和每年度的构成比;使用χ2检验分析三版检测指南下3个时段之间IHC各级别病例的构成比是否存在差异。(2)统计10年间和每年度行FISH检测的IHC各级别病例数及其HER-2基因扩增率;使用χ2检验和Fisher精确检验分析三版检测指南下3个时段之间IHC各级别病例FISH检测结果之间是否存在差异。(3)分析每年度以及3个不同时段内IHC与FISH检测的阳性一致率和阴性一致率。阳性一致率是指HER-2 3+病例中HER-2基因扩增的比率。阴性一致率是指HER-2 0、1+病例中HER-2基因未扩增的比率。
2 结果
2.1 IHC检测HER-2各级别病例的构成比
2.1.12011~2020年IHC检测HER-2各级别病例的构成比 2011~2020年纳入分析的浸润性乳腺癌合计14 425例,每年检测的病例数为788~2 142例。其中HER-2 0、1+、2+、3+病例占比分别为22.3%(15.4%~25.9%)、29.0%(24.9%~33.2%)、26.7%(20.8%~32.4%)、22.0%(19.4%~27.9%)(表1)。
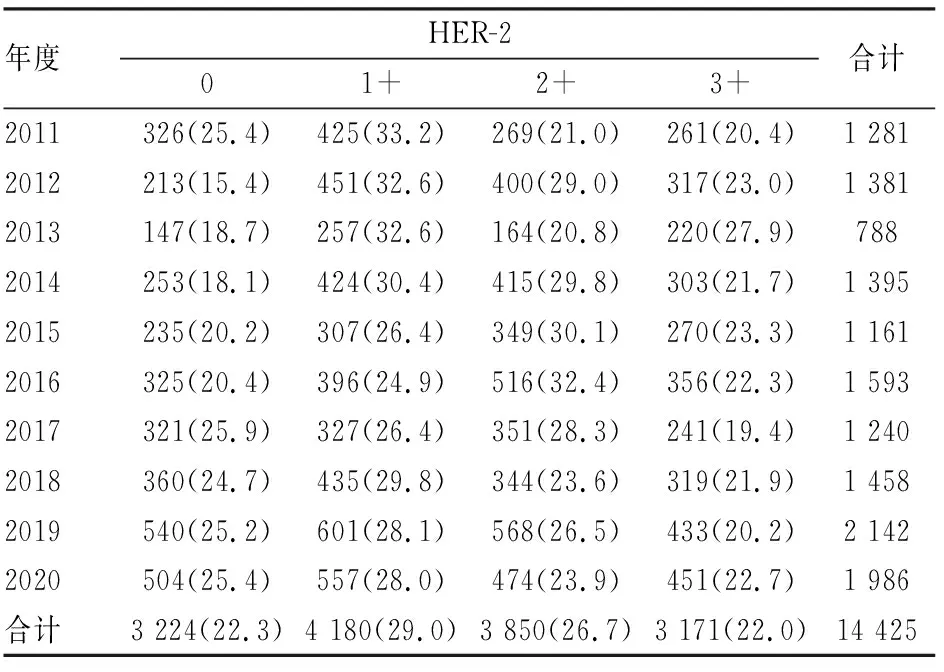
表1 2011~2020年IHC检测HER-2各级别病例数量及构成比[n(%)]
2.1.2 三版HER-2检测指南下3个时段IHC检测HER-2各级别病例的构成比2009、2014和2019版HER-2检测指南主要在2011~2013年、2014~2018年、2019~2020年3个时段被分别使用,3个时段检测的病例总数分别为3 450、6 847和4 128例(表2),IHC检测HER-2各级别病例的构成比差异有显著性(P<0.001)。2009版和2014版HER-2检测指南下的构成比差异体现在HER-2 1+、2+病例,HER-2 0、3+病例占比无差异。2009版和2019版HER-2检测指南下的构成比差异体现在HER-2 0、1+病例,HER-2 2+和3+病例占比无差异。2014版和2019版HER-2检测指南下的构成比差异体现在HER-2 0和2+病例,HER-2 1+和3+病例占比无差异。
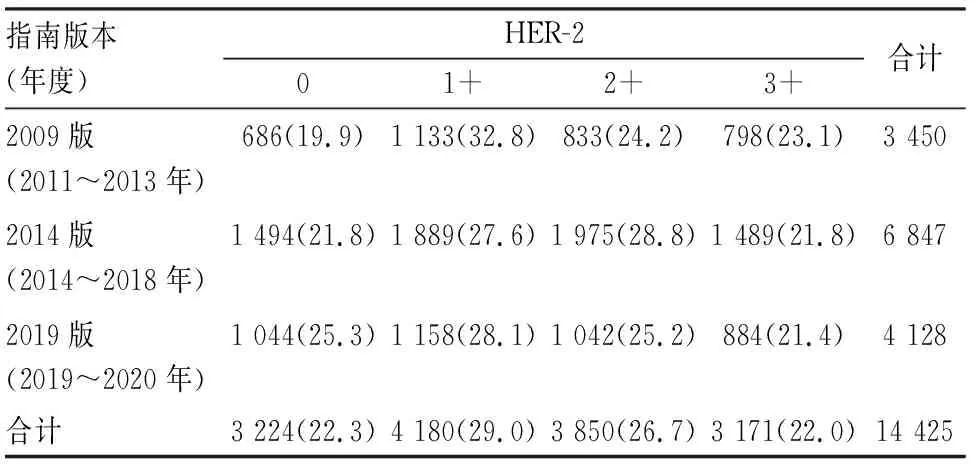
表2 三版HER-2检测指南下3个时段IHC检测HER-2各级别病例数量及构成比[n(%)]
2.2 HER-2基因FISH检测数据分析
2.2.12011~2020年行FISH检测的HER-2 IHC各级别的病例数及其HER-2基因扩增率 2011~2020年纳入FISH检测数据分析的乳腺癌合计5 688例,其中HER-2 2+病例最多(4 126例,72.5%)。HER-2 0、1+、2+、3+的病例总数和每年度检测的病例数等见表3。HER-2 0、1+、2+、3+病例HER-2基因扩增率分别为2.4%(0~15%)、3.1%(0~6.4%)、20.3%(12.6%~35.1%)、97.7%(92.5%~100.0%)。
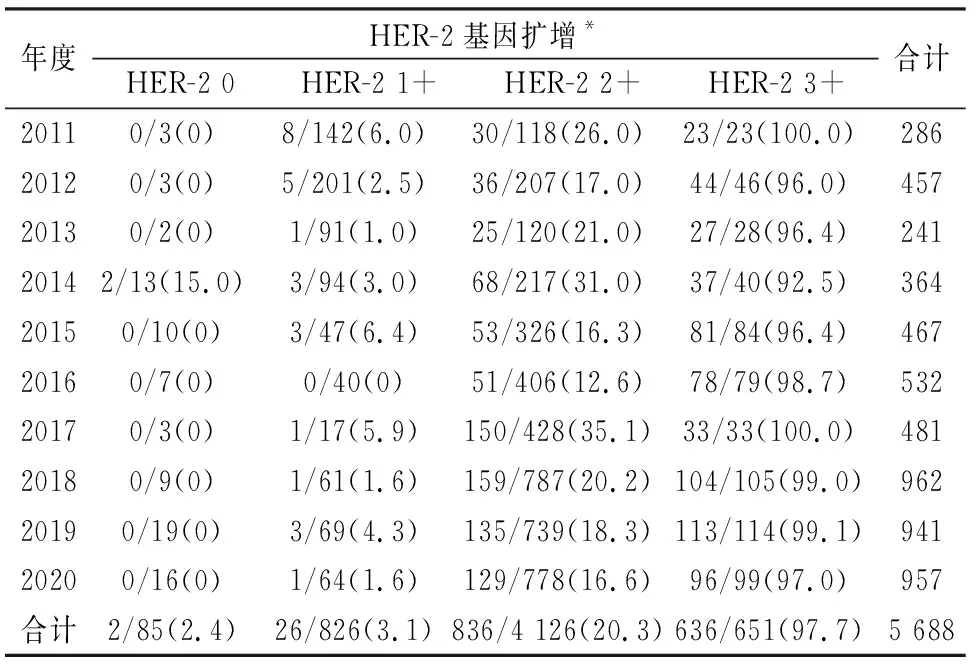
表3 2011~2020年行FISH检测的HER-2 IHC各级别病例数及其HER-2基因扩增率[n(%)]
2.2.2三版HER-2检测指南下3个时段IHC各级别病例FISH检测结果的对比分析 3个时段HER-2 0、3+病例的FISH检测结果差异无统计学意义。3个时段中,2009版和2014版指南之间HER-2 1+病例的FISH检测结果差异有显著性(P=0.006),体现在FISH检测结果不确定组;2014版和2019版指南之间HER-2 2+病例的FISH检测结果差异有显著性(P<0.001),其FISH检测结果阳性和阴性组均存在差异(表4)。
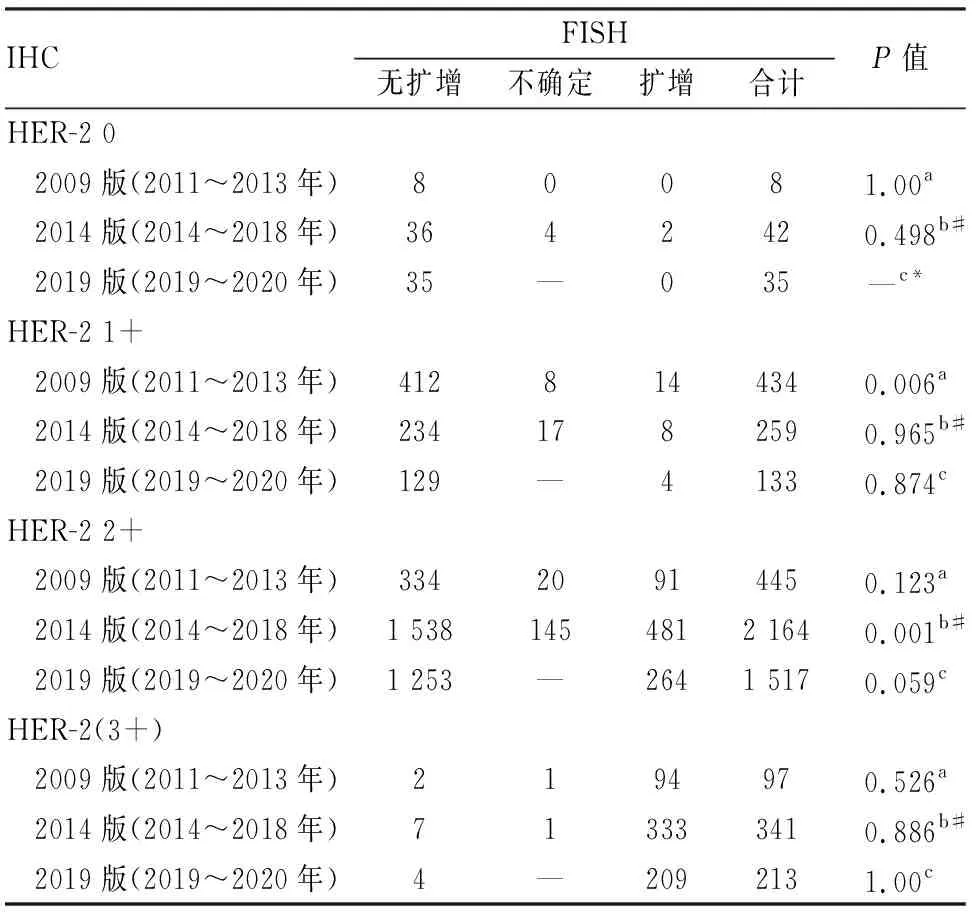
表4 三版HER-2检测指南下3个时段IHC各级别病例FISH检测结果的对比分析
由于2019版指南不存在FISH检测结果不确定类别,因此检测结果的统计分析仅能进行两两比较;a2009版vs2014版;b2014版vs2019版;c2009版vs2019版;#表示该组比较时,2014版时段数据中的FISH不确定病例需要根据2019版指南重新分类后再行统计分析;*表示该组比较不能进行统计分析
2.3 IHC与FISH检测HER-2的一致率
2.3.12011~2020年IHC与FISH检测HER-2的阳性一致率和阴性一致率 除2014年外,其余各年度的HER-2阳性一致率均>95.0%。IHC与FISH检测HER-2的阴性一致率(86.0%~98.8%)变化较大,其中6个年度HER-2阴性一致率≥95.0%。由于2011~2018年“IHC检测HER-2 0/1+而FISH检测结果不确定”的病例等同于临床HER-2阴性,如果计算“阴性一致率”时将该组病例纳入,则IHC与FISH检测HER-2的阴性一致率显著提高,各年度均≥94.5%(表5)。
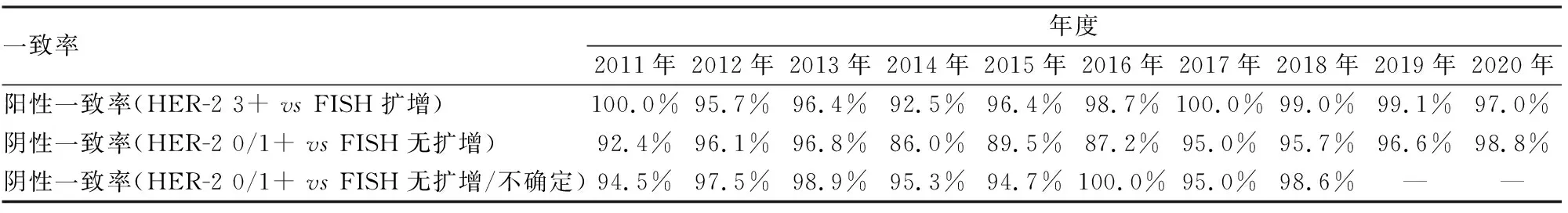
表5 2011~2020年IHC与FISH检测HER-2的一致率
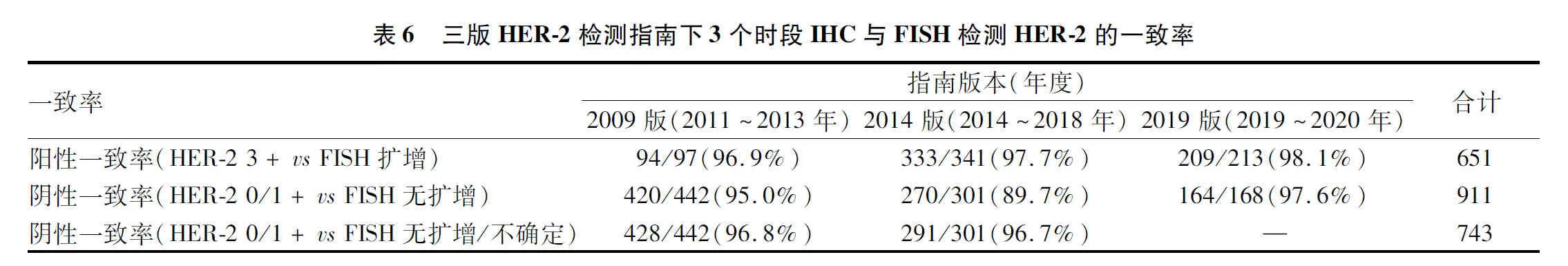
2.3.2三版HER-2检测指南下3个时段IHC与FISH检测HER-2的阳性一致率和阴性一致率 三版检测指南下的HER-2阳性一致率均>95%。2009版和2019版指南下的HER-2阴性一致率≥95%,2014版指南下的HER-2阴性一致率为89.7%。如果将IHC检测HER-2 0/1+而FISH检测结果不确定的病例纳入阴性一致率统计,2014版指南下的HER-2阴性一致率可提高至96.7%(表6)。
3 讨论
乳腺癌HER-2的准确检测依赖于实验室对影响因素进行完善的质控[4]。华西医院病理科在通过CAP实验室认证过程中,不仅需要完成CAP HER-2 IHC和FISH室间质评,同时必须在现场检查时提供HER-2内部质控数据分析结果,包括年度HER-2阳性率监测、IHC与FISH检测的一致率[5]。尽管以上指标已被欧美实验室作为室内质控的重要因素,但对相关质控数据进行系统分析的文献极少[5-6],且国内实验室多未对上述指标进行常规监测,其质控适用性和监测参考值有待进一步评估和探索。
ASCO/CAP和英国乳腺病理协作委员会均推荐定期监测HER-2阳性率[7-8],但目前缺乏公认的阳性率参考值。文献报道连续性乳腺癌病例IHC检测的HER-2阳性率为9.9%~22.8%[6,9-12]。相关研究纳入的病例数量、检测平台和试剂、医师判读的主观性等因素导致阳性率数值出现变异。CAP实验室认证手册指出,连续检测病例的HER-2 3+病例占比为20%左右[5]。如果HER-2 3+病例占比偏离20%较多,提示实验室存在检测假阳性或假阴性。本实验室9个年度IHC检测HER-2的阳性率平稳在20%左右(19.4%~23.3%),提示检测具有可靠性和稳定性,且20%是适用的阳性率参考值。2013年HER-2 3+阳性率达27.9%,更可能是因为该年度乳腺癌患者数量统计出现偏差。该年度纳入分析的病例数为788例,与前后各年度的病例数存在较大差异。本实验室10年间参加20轮次CAP HER-2 IHC室间质评均获通过,从外部质控方面印证室内质控符合要求。10年间,本实验室HER-2 0/1+、2+、3+病例的平均占比为51.3%、26.7%和22.0%。文献报道的对应占比为49.5%~72.1%、17.8%~32.5%和10.1%~22.8%[9-13],本组数据与之相符。Magee-Womens医院10年(2008~2017年)数据显示:HER-2 0/1+、2+、3+病例占比为55.3%、34.8%和9.9%,不确定病例占比偏高而阳性率偏低的主要原因在于该实验室在判定HER-2 3+时“标准更严格”[6],此结果提示IHC各级别的构成比具有质控价值。
尽管检测指南指出仅HER-2 2+病例需要行FISH检测,本实验室仍有1 562例(27.5%)HER-2 0/1+或3+病例行FISH检测。既往文献显示:HER-2 0/1+、2+、3+病例HER-2基因扩增率分别为0.52%~5%[9,14]、9.4%~24.2%[15-16]、90.3%~100%[12,14]。10年间,本组HER-2 0/1+、2+、3+病例整体的FISH扩增率为5.5%、20.3%、97.7%,与文献报道相符,提示实验室HER-2检测准确可靠。另一方面,HER-2 0/1+和3+病例各年度FISH扩增率波动较小,HER-2(2+)病例FISH扩增率出现一定程度的波动(12.6%~35.1%)。这一现象同样见于Magee-Womens医院的总结,其HER-2 2+病例FISH扩增率为5.8%~19.2%[6],可能是由于HER-2 2+病例具有更明显的异质性,检测指南判读标准的变化亦有影响。质控数据分析时应避免对此波动现象的误读。
HER-2 IHC与FISH检测的一致率能够间接反映检测准确性。CAP实验室认证将一致率分析作为现场检查的内部质控指标。ASCO/CAP指南提出HER-2阳性和阴性病例的检测一致率需达95%,对HER-2不确定病例未作要求[7]。10年间,本实验室IHC与FISH检测HER-2阳性一致率仅2014年低于95%但仍超过90%;阴性一致率中3个年度的数值低于90%,主要原因是“HER-2 0/1+而FISH检测结果不确定”的病例数偏多,其不能纳入阴性一致率计算。由于此类病例等同于临床HER-2阴性,将其纳入计算后则IHC与FISH检测的阴性一致率明显升高。2019版检测指南去除“FISH不确定”类别后,2019年和2020年的阴性一致率均高于95%。CAP 2008年的调研数据显示仅73%、81%的美国实验室能够分别达到95%的阳性一致率、阴性一致率[17]。2011年以后以上数据降低至70.4%、76.5%[18]。近期文献显示,IHC与FISH检测HER-2的阳性一致率为90.3%~100.0%,阴性一致率为89.8%~94.0%[12,14,19]。上述数据提示将IHC与FISH检测一致率设定为95%可能偏高,将其下调至90%具有更强的可行性,值得进一步研究。
本实验结果显示,三版HER-2检测指南判读标准变化对IHC检测的HER-2阳性率、IHC与FISH检测一致率缺乏实质性影响,而对HER-2 IHC各级别病例的构成比/FISH扩增率存在影响。对比三版HER-2检测指南中IHC的判读标准,2009版与其它两版存在较大差异的是HER-2 1+定义,2014版与其它两版存在较大差异的是判定HER-2 2+不需要完整膜染色。判读标准的变化提示2011~2013年HER-2 1+病例、2014~2018年HER-2 2+病例的占比会增高。本组结果证实以上两个类别的占比高于其它两个时段,说明数据的起伏变化并非检测流程出现偏差。与之类似,2014版指南下HER-2 2+病例的FISH扩增率高于2019版,与FISH扩增判读标准变化有关。
目前,国内尚未检索到系统分析乳腺癌HER-2检测室内质控数据的文献。本实验通过总结单中心10年的HER-2检测结果,验证了HER-2阳性率等指标在质控实践中的适用性,探讨了各质控指标合理的监测参考值以及HER-2检测指南变更产生的影响。鉴于上述质控指标能够反映HER-2检测的整体质量状况,其数据分析简便易行,适宜将其作为常规的内部质控措施在国内病理实验室推广开展。
