糖尿病周围神经病变患者神经电生理变化情况及其与患者病情的关系
2022-09-26刘敏代凌陈建霞王玲
刘敏 代凌 陈建霞 王玲
糖尿病是常见的慢性疾病,目前临床尚无治愈该病的方法,多利用药物控制血糖[1]。糖尿病的病程较长,随病情的进展,可对机体多个系统造成损伤,糖尿病周围神经病变(DPN)是糖尿病常见并发症,机体伴随的与周围神经功能障碍相关的症状均可归为DPN[2]。DPN早期症状隐匿,可出现肢体麻木、肢端感觉异常等,随病情进展可出现运动神经受累及肌力减退,严重时可导致肌肉萎缩[3]。关于DPN的发病机制尚未完全明确,主流观点认为机体由于血氧供应减少,进而诱发氧化应激反应对神经微循环造成损伤,抑制受损神经纤维的再生,导致DPN的发病[4]。DPN症状多样,且病情分级不同症状表现不一,治疗方法不尽相同,故及早明确DPN的病情分级具有重要意义[5]。随着神经电生理检查手段的开展,其以便捷、敏感的优点被用于DPN的早期诊断。有学者发现伴有神经病变患者肌电图检测时波幅较低,并且证实波幅改变与活检时表皮层神经纤维密度线性相关[6]。然而关于其在DPN患者病情分级方面鲜有报道,故笔者开展本研究。
1 资料与方法
1.1 一般资料
以2019年1月-2021年1月泸县人民医院收治的95例DPN患者为对象作为观察组。纳入标准:确诊为DPN。排除标准:(1)合并癫痫、阿尔茨海默病;(2)脑卒中后认知功能损伤;(3)服用影响神经功能药物。以95例健康人作为对照组。观察组年龄32~78岁,平均(62.13±5.31)岁;男53例,女42例;体重指数(23.15±2.41)kg/m2;病程(6.41±2.14)年。对照组年龄30~78岁;平均(63.41±5.26)岁;男50例,女45例;体重指数(22.38±2.36)kg/m2。两组年龄、性别、体重指数比较,差异无统计学意义(P>0.05),具有可比性。研究经本院伦理委员会批准。患者对本研究知情同意。
1.2 DPN病情分级
从神经症状、神经反射及感觉功能障碍3个方面评价。神经症状包括下肢麻木、疼痛、针刺样、乏力、步态不稳等,正常为0分,其他每个症状1分;神经反射包括膝反射、踝反射,正常为0分,减弱为1分,消失为2分;感觉功能包括痛觉、温度觉、触觉、震动觉、位置觉,正常为0分,异常为1分。总分6~8分为Ⅰ级(n=47),9~11分为Ⅱ级(n=21),12~14 分 为Ⅲ 级(n=19),15~19 分 为Ⅳ级(n=8)。
1.3 方法
检测两组神经电生理指标,分析其与DPN患者病情的关系。神经电生理检测,采用5通道肌电图诱发电位仪测定,检测正中神经的运动神经传导速度、波幅、远端潜伏期等。皮肤交感反应(SSR)用突发电刺激诱发汗腺活动,潜伏期为刺激开始至第1个负相波起始。躯体感觉诱发电位(SEP),刺激双侧正中神经,记录上肢、下肢SEP异常情况。
1.4 统计学处理
数据分析采用SPSS 21.0处理。计量资料以(±s)表示,采用t检验,多组间采用方差分析,计数资料以率(%)表示,采用χ2检验,采用Pearson或Spearman进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组神经传导结果比较
观察组运动神经传导速度、波幅低于对照组,远端潜伏期高于对照组(P<0.05),见表1。
表1 两组神经传导结果比较(±s)
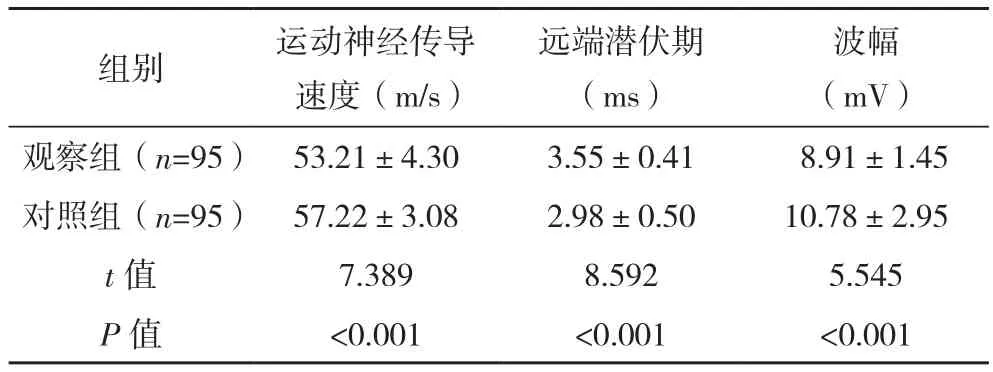
表1 两组神经传导结果比较(±s)
组别 运动神经传导速度(m/s)远端潜伏期(ms)波幅(mV)观察组(n=95) 53.21±4.30 3.55±0.41 8.91±1.45对照组(n=95) 57.22±3.08 2.98±0.50 10.78±2.95 t值 7.389 8.592 5.545 P 值 <0.001 <0.001 <0.001
2.2 两组SSR、SEP异常情况比较
观察组SSR异常、上肢SEP异常、下肢SEP异常率分别为93.69%、73.68%、76.84%,高于对照组的4.21%、7.37%、8.42%(P<0.05),见表2。
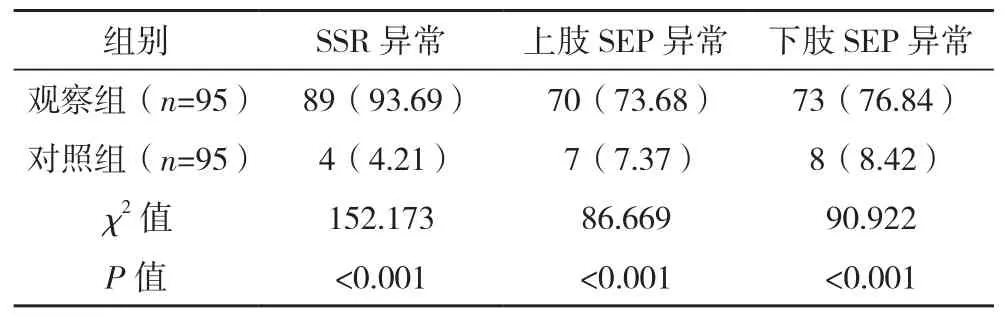
表2 两组SSR、SEP异常情况比较[例(%)]
2.3 不同DPN病情分级患者的电生理指标比较
DPN患者不同病情分期运动神经传导速度、远端潜伏期、波幅、上肢SEP异常比较,差异有统计学意义(P<0.05)。运动神经传导速度、波幅在Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级组中依次降低,远端潜伏期依次升高(P<0.05)。上肢SEP异常率在Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级组差异有统计学意义(P<0.05),见表3。
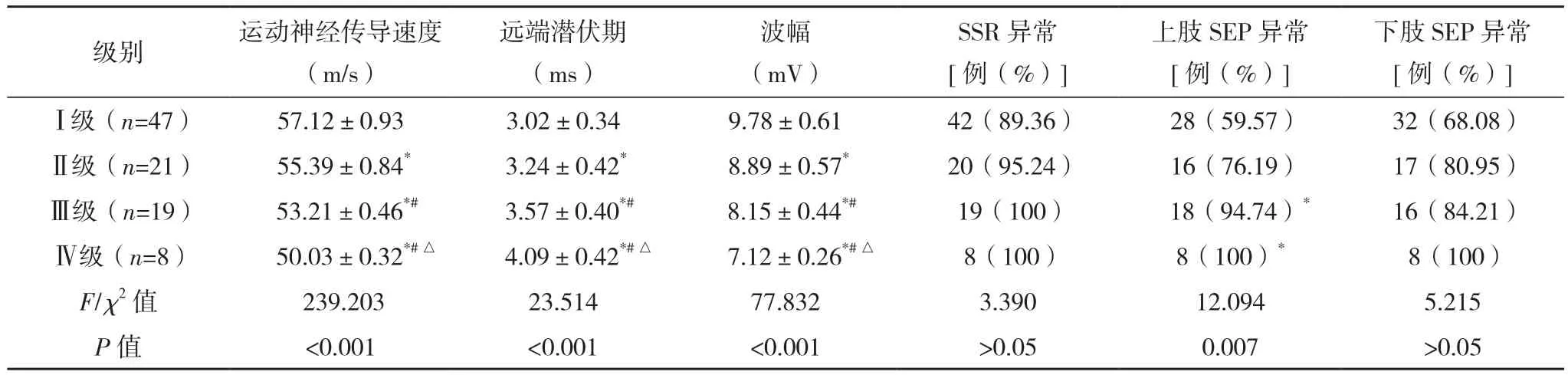
表3 不同DPN病情分级患者的电生理情况比较
2.4 DPN患者病情分级与神经电生理指标的关系
Pearson相关性分析显示DPN患者病情分级与运动神经传导速度、波幅呈负相关,与远端潜伏期呈正相关(P<0.05);Spearman相关性分析显示DPN病情分级与SSR异常、上肢SEP异常、下肢SEP异常正相关(P<0.05),见表4。
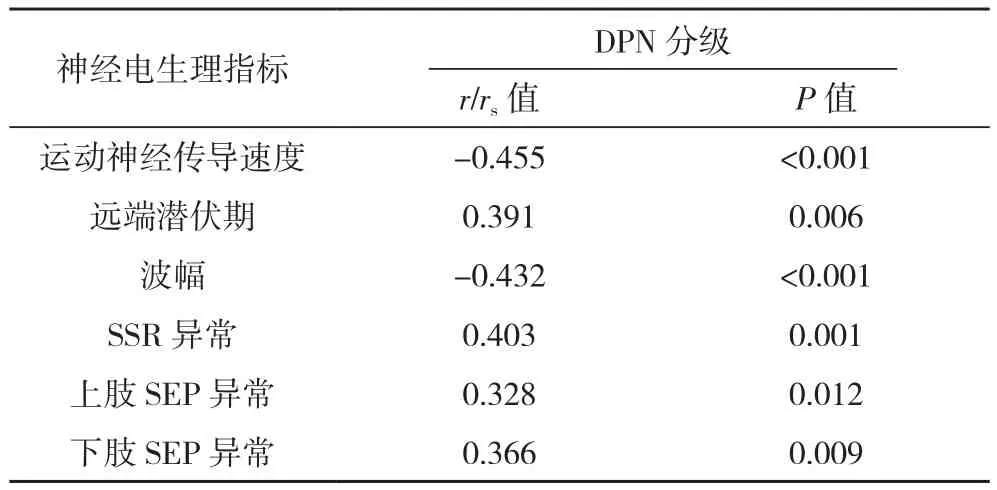
表4 DPN患者病情分级与神经电生理指标的相关性
3 讨论
糖尿病是内分泌系统常见的疾病,其发病人数逐年增加。DPN为糖尿病的常见并发症,数据显示约20%的糖尿病患者合并DPN[7]。DPN早期症状无特异性,对诊断造成较大的干扰,DPN是诱发足部溃疡、感染、截肢的重要因素[8]。DPN的发病原因尚未明确,主流观点认为其发病与下述因素有关:(1)代谢功能紊乱,糖尿病患者的糖脂代谢紊乱,可造成多元醇代谢亢进、肌醇异常代谢等诱发神经功能障碍;(2)氧化应激反应,机体的血糖异常升高,可促进非酶促糖基化作用,产生大量的氧自由基,损伤周围神经,进一步发展为神经营养障碍;(3)血管顺应性的改变,血糖波动幅度较大时,动脉管壁硬化、狭窄、闭塞可引起神经周围的组织灌注减少,进而诱发缺氧缺血坏死,导致脱髓鞘、轴索变形的发生[9-10]。DPN尚无特效治疗手段,故早期诊断、预防等意义重大。
目前主要依靠疾病史、神经损害症状及电生理的异常表现等诊断DPN,随着电生理技术的日趋完善,神经电生理检查逐渐成为诊断DPN的主要方法。SSR、SEP是常规电神经生理检测的常用指标,SSR的生物学机制为突触的交感反射,在不同刺激方式作用下传入途径不同,可由内/外源性刺激诱发,其为反映自身神经小纤维变化的指标[11]。SSR的敏感性较高,可发现DPN患者早期交感神经小纤维损害情况,其价值较感觉神经传导速度及运动神经传导速度高[12]。本文结果显示DPN患者SSR、上肢/下肢SEP异常率均较高,提示SSR、SEP可用于DPN的早期诊断。肌电图仪可反映躯体深处感觉传导通路的异常情况,可定位追踪累及体感通路的病变[13]。文献[14]指出,DPN患者的临床体征与神经传导速度减慢程度存在关系,DPN通常表现为远端神经异常。本文结果显示DPN患者运动神经传导速度、波幅低于正常人,而远端潜伏期高于正常人群,与上述研究相符。本文中DPN患者随病情的加重,运动神经传导速度、波幅降低,远端潜伏期增加,SSR、上肢/下肢SEP异常率增加,相关性分析显示DPN病情分级与神经电生理存在相关性,提示DPN患者存在明显的脱髓鞘改变,表明神经电生理指标可反映DPN患者神经病变的程度。
综上所述,神经电生理指标可用于DPN的早期诊断并且可评估患者的病情。
