蒙古栎烂皮病病原菌鉴定
2022-09-25黄麒陈洁刘忠玄刘雪峰刁桂萍
黄麒,陈洁,刘忠玄,刘雪峰,刁桂萍
(东北林业大学 林学院,哈尔滨 150040)
0 引言
蒙古栎(Quercusmongolica)又名柞树、柞木、蒙古柞和橡树等,是壳斗科栎属的落叶乔木。蒙古栎是东亚-东西伯利亚分布类型,主要分布于我国东北三省、内蒙古和河北省北部[1],以及俄罗斯的远东、西伯利亚、蒙古东部、朝鲜半岛和日本[2],既是东北温带地区的地带性森林植被阔叶红松林的重要组成树种,也是华北地区暖温带落叶阔叶林的建群种[3-5],是我国东北地区天然次生林的主要组成部分及我国主要用材林树种之一。蒙古栎适宜凉爽气候,喜中性至酸性土壤,抗旱耐瘠薄,根系发达具有强烈的萌芽力[6],在天然次生林内,能形成大面积纯萌芽林。由于蒙古栎的抗旱性和萌芽力,在干旱的生境下,亦能形成灌丛状的“蒙古栎矮林”,但在肥沃的土壤上常被其他树种所排挤。蒙古栎对气候、土壤条件的适应范围较广,耐瘠薄的土壤,不耐水湿,喜光不耐阴,除幼龄稍能耐庇荫外,一般不能忍受来自上层林冠的庇荫,与其他树种相比,蒙古栎能有效地利用强光辐射,而对弱光辐射利用效率较低。具有抗旱形态的叶、较低的水能值及浮动调节能力,在干旱期间能维持较高的光合速率[7-9]。此外,在全球变暖的背景下,蒙古栎的地理分布有扩大的趋势。蒙古栎根系发达,适应性强,抗风性强,并具有良好的抗腐蚀、护坡、防腐和保土作用;其木材材料坚硬,抗腐蚀性强,可用作运输、建筑和木材等材料,压缩木材作机械部件,此外,蒙古栎叶片可养蚕,种子可以用来酿酒,树皮可以用来治疗腹泻[10]。
壳囊孢属菌(Cytosporaceratosperma)是子囊菌亚门(Ascomycotina)粪壳菌纲(Sordariomycetes)间座壳目(Diaporthales)中的真菌,有性型为黑腐皮壳菌属(Valsaceratosperma)。C.ceratosperma有许多同物异名,其形态和DNA系统发育存在混乱。Rossman等[11]推荐使用C.ceratosperma,优于Valsaceratosperma。尽管在中国已报告过一些物种,但绝大多数是在培养过程中未被发现的,早期的鉴定只是基于形态学,基于其ITSrDNA基因数据系统发育研究进行的分类[12]。
壳囊孢属中相当多的菌可能是相对宿主特异性的,如C.australia、C.eucalyptus、C.agarwalii,该结论还需进一步地收集数据和进行致病性研究来证实[13]。此外,目前的研究表明,作为引起枯梢病和溃疡病的重要植物病原菌,在不同寄主中具有较高的发病率和不同的症状,如杏子、桉树、白蜡、女贞、芒果、梧桐、杨树、刺槐、柳和榆等[13-14]。Zhu等[15]的研究详细介绍了宿主植物的范围,包括9属20种,即栒子属、山楂属、苹果属、李属、梨属、蔷薇属、鲜卑花属、花楸属和绣线菊属。C.ceratosperma可以感染多种植物,包括紫葳科的蓝花楹(Jacarandamimosifolia)、胡桃科的胡桃(Juglansregia)[16],蔷薇科的榅桲(Cydoniaoblonga)和一些蔷薇科的经济作物(苹果,沙梨)[17]。
本文介绍的蒙古栎烂皮病,通过病害症状、病原菌的形态学、致病性测定及系统发育分析,明确该病原菌为C.ceratosperma,国内尚未有记载,为国内新病害,本研究可为该病的防治和进一步研究奠定基础。
1 材料与方法
1.1 病样采集
2019年7月在黑龙江省加格达奇地区(50°25′N,126°07′E)采集数枝明显患病的蒙古栎分枝,带回东北林业大学森林病理实验室分离纯化,并于东北林业大学校园内采集健康蒙古栎枝条做接种材料。植物标本和真菌分离株保存于东北林业大学病理实验室。
1.2 症状观察
对采集的蒙古栎烂皮病病枝标本的发病症状进行观察,借助手持放大镜以及实体解剖镜(Phenix XTL-165-MT)对发病部位进行观察,对其危害部位和危害症状及其在寄主表面的排列状况和颜色等观察。
1.3 病原菌的分离纯化
采用单孢分离法分离,获得病原真菌。枝条表面连续在75%的乙醇(福晨化学试剂有限公司)中浸泡1 min,质量浓度2% 的NaClO溶液(福晨化学试剂有限公司)中浸泡40 s,后用无菌水冲洗3次,无菌环境下用吸水纸擦拭。从患病的枝上采集分生孢子器,在显微镜下用手术刀从分生孢子器中提取分生孢子,然后放在清洁工作台的水琼脂(WA)块上。取带有单个孢子的水琼脂块,用接种针将其置于马铃薯葡萄糖琼脂(PDA)培养基上。所得培养物在25 ℃斜面培养基上,避光培养。将该菌种培养7 d后,在无菌超净工作台上进行纯化操作,挑取少量菌落边缘新生菌丝移至新的PDA斜面培养基纯化培养,将纯化菌种放在低温冰箱内保存备用。
1.4 致病性测定
在室内条件下,选择粗细大致相等的健康蒙古栎枝条,用枝剪剪成20 cm左右的短枝,用流水仔细冲洗干净后,再用酒精擦拭表面,按照柯赫氏法则,采用划伤、烧伤和无伤3种接种方法对健康的蒙古栎枝条进行接种。设置10组重复,用孢子悬浮液(1×105个/mL)浸泡的纱布,包裹刺伤、烧伤、无伤的枝条各20株,用浸泡无菌水的纱布包裹在枝条的刺伤、烧伤、无伤伤口处上,各取10株设为对照实验组,在25 ℃、30%±5%的相对湿度下培养。接种24~48 h后,去除纱布,在相同条件下继续培养。将接种后的枝条室温培养,做好标记,观察发病症状的变化情况。发病后采用孢子分离法从病斑上再分离、纯化菌株。
1.5 病原菌形态学鉴定
取采集及新接种的患病枝条,切片镜检,在光学显微镜(XSP-12CA)下观察病原菌形态,并利用电子显微镜观察、测量分生孢子器、分生孢子梗和分生孢子数据,并拍摄显微图片。将病原菌接种于培训基(PDA)上,25 ℃恒温遮光培养,观察记录其生长速度、菌落颜色和形态。
1.6 病原菌系统发育分析
在PDA上培养用于提取DNA的分离物(培养约7 d),用2 × T5 Direct PCR Plant Kit(高效的植物直扩试剂盒)从菌丝中提取基因组DNA。使用ITS1和ITS4引物扩增内部转录间隔区(ITS);核糖体大亚基(LSU)区域使用引物LR0R和LR7,TEF1-α基因使用引物TEF1-688f/TEF1-1251r扩增并测序[18]。
由青岛生物科技股份有限公司(北京,中国)提供的PCR模板为50 μL,双蒸馏水22 μL,引物1 μL, DNA模板1 μL, 2 × T5 Direct PCR Mix(Plant)25 μL。
ITS、LSU和TEF1-α的PCR反应条件为:94 ℃,5 min; 94 ℃,30 s;56.4 ℃,30 s;72 ℃,1 min,循环40次; 扩增产物经琼脂糖凝胶电泳分析,并由上海生工生物技术有限公司(上海)测序。
利用BLAST比对GenBank中保存的壳囊孢属菌(C.ceratosperma)的其他序列。这些序列包括GenBank的参考序列,然后使用MEGA v.6手动编辑比对[19]。利用最大似然法和启发式搜索来推断系统发育关系。根据1 000次重复计算树枝的Bootstrap支持值。相似度(%)使用MEGALIGN程序(DNASTAR Inc.)计算。本研究的所有序列数据均已存入GenBank。
2 结果与分析
2.1 蒙古栎烂皮病症状
蒙古栎烂皮病自然条件下多发生于幼龄或衰弱枝条上,单个枝条多处发生。病变部位最初呈淡红色至红褐色,后病斑扩大、颜色加深,呈浅褐色至深褐色凹陷病变,后期出现许多灰黑色至深黑色凸起,树皮开裂,突破树皮。每个子座上产生1个至多个分生孢子器,分生孢子器浸没至半浸没在树皮中,有的具黄色分生孢子角。随着病部扩散,整株植物都会死亡。如图1所示。

图1 蒙古栎烂皮病症状和平板培养形态
2.2 病原菌致病性测定
致病性测定的结果显示,烧伤处理的蒙古栎枝条上在30 d后出现分生孢子器。发病症状经观察与野外采集标本一致,将接种发病后的枝条病症处经切片镜检,与野外病原菌一致。此外,刺伤处理组、无伤处理组、空白对照组均不发病。各接种方法的发病情况统计见表1。
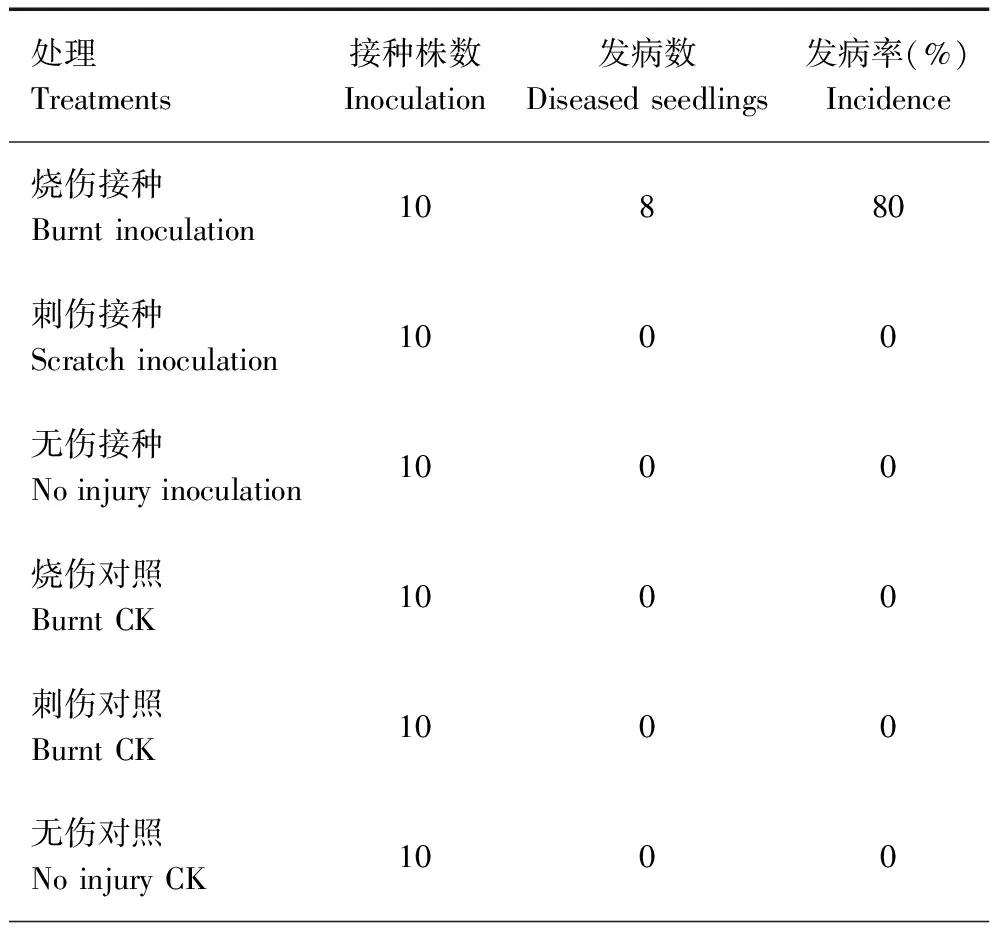
表1 病原菌在蒙古栎幼枝上3种不同接种方法的发病情况
2.3 病原菌形态特征
在25 ℃的PDA培养基中,遮光培养下的菌落最初呈白色、辐射状、规则,缺乏气生菌丝,7 d后变为橄榄绿至黄褐色,30 d后变为黄褐色,菌落背面为灰色至灰黑色。分生孢子器不规则分布于表面,单生或聚集,呈乳突、黑色,菌丝为白色至淡黄色。部分有黄色分生孢子角。在25 ℃时,遮光培养24 h后PDA上菌落直径达到9 mm,2 d为32 mm, 3 d为56 mm, 4 d为79 mm,5 d为90 mm,6 d为90 mm,如图1(a)和图1(b)所示。
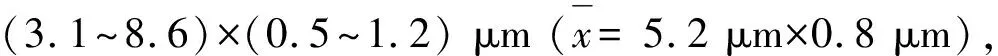
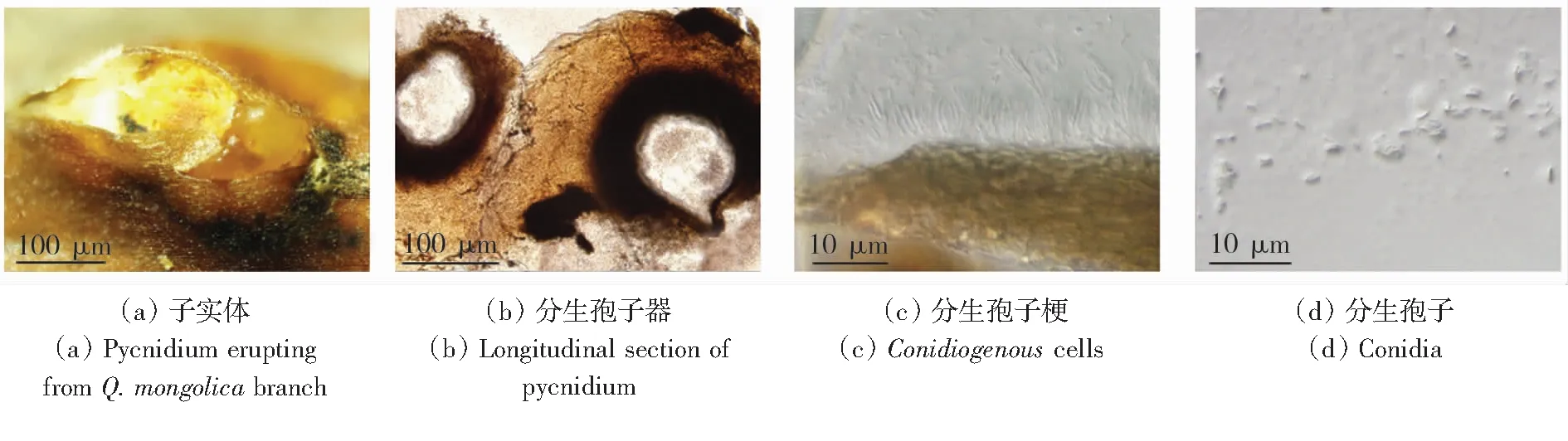
图2 病原菌无性形态特征
2.4 病原菌系统发育分析结果
引物ITS1/4 扩增测序ITS区域,引物LR0R/LR7和引物TEF1-688f/TEF1-1251r扩增并测序LSU、TEF1-α区域将所得基因登录NCBI,得到登录号(MW418308,MW418309)(MW425032,MW425033)和(MZ127836,MZ127837),与壳囊孢属菌(C.Ceratosperma)KY051985、AF408387、KP310860序列同源性分别为98%、100%、100%。然后使用MEGA v.7.0编辑序列。系统发育关系采用启发式搜索的邻接法(neighbor-joining method)进行推断。基于1 000次重复计算了树枝的Bootstrap支持值。相似度(%)用MEGALIGN程序(DNASTAR Inc.)计算,如图3—图5所示。结合形态学鉴定及相关文献,鉴定此菌为壳囊孢属菌(Cytosporaceratosperma)。
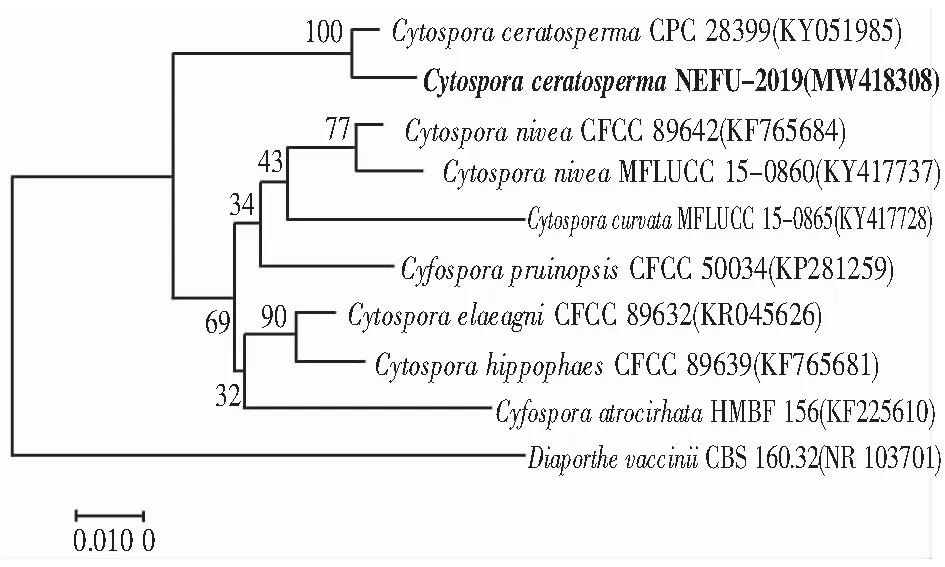
图3 NEFU2019与其他Cytospora sp.和Diaporthe vaccinii ITS序列的系统发育树
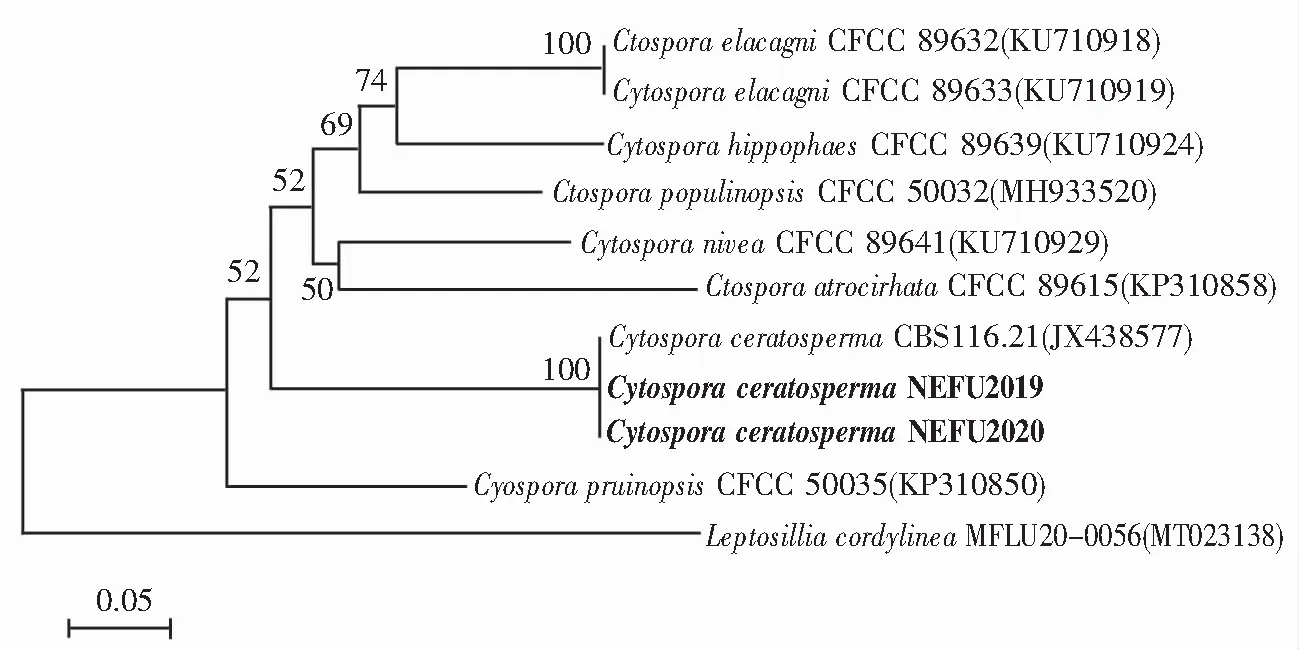
图4 NEFU2019与其他Cytospora sp.和Leptosillia cordylinea的TEF-1α系统发育树
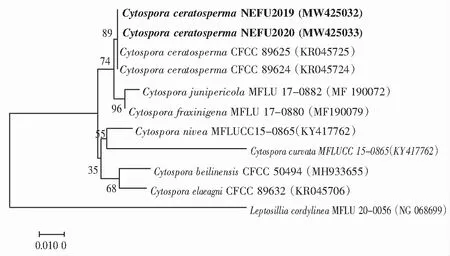
图5 NEFU2019与其他Cytospora sp.和Leptosillia cordylinea的LSU系统发育树
3 讨论与结论
本研究通过单孢分离法对蒙古栎烂皮病病原菌进行分离纯化,得到了菌株NEFU2019,根据柯赫氏法则对健康蒙古栎枝条进行接种和再分离,确认了病原菌。结合形态学鉴定和系统发育结果,鉴定该病原菌为C.ceratosperma。根据记载[20],该菌自然条件下,分生孢子器直径800~1 400 μm,分生孢子梗13~22 μm。分生孢子(4.0~6.0)μm×(1~1.5)μm。分生孢子梗、分生孢子大小与本研究中测定结果接近,分生孢子器略大于测定结果1/3。推测差异与寄主以及分布区域的差异有关。
壳囊孢属真菌分布广泛,通常被视为寄主范围广泛的植物病原菌、内生菌或腐菌。作为植物病原体,主要与烂皮病有关,但也有其他疾病的报道,如红枣根腐病和石榴环腐病。烂皮病症状包括树皮中细长、轻微凹陷和变色的区域,通常沿着溃疡边缘分裂。症状因宿主种类和疾病发展阶段而异。患病的内部树皮和感染形成层上方的树皮可能会凹陷,出现黄色、棕色、红棕色、灰色或黑色的病斑,随着组织的退化,变得潮湿且有气味。形成层以下的木材被染成棕色[21]。组织病理学上,皮层和韧皮部的快速定植是通过宽的细胞间菌丝进行的,而细胞质在形成小室后被较窄的细胞内菌丝消化。
在本研究中,所有样本均来自中国加格达奇地区。利用邻域连接法和贝叶斯推理法对单个ITS数据集进行了系统发育分析,并对部分C.ceratosperma进行了识别。利用ITS、LSU、TEF-1α区域对其进行了鉴定,并进行了验证和说明。
蒙古栎烂皮病是由C.ceratosperma引起的,这是中国范围内首次报道由C.ceratosperma引起的蒙古栎烂皮病。因此,该文提供的蒙古栎烂皮病数据是初步的,今后研究重点将放在病原体的生物学特性上,这可能在抑制疾病的发生和传播方面发挥不可或缺的作用。
