以心肌炎为突出表现的特发性炎性肌病5例分析
2022-09-23张文浩魏路华蒋捷吕鹤张巍袁云王朝霞
张文浩 魏路华 蒋捷 吕鹤 张巍 袁云 王朝霞
特发性炎性肌病(idiopathic inflammatory myopathies,IIMs)是一组具有异质性的自身免疫性疾病,常累及骨骼肌、肺、皮肤和关节等,根据临床表现、肌炎特异性抗体及骨骼肌病理可分为皮肌炎(dermatomyositis,DM)、免疫介导坏死性肌病(immune-mediated necrotizing myopathy,IMNM)、重叠性肌炎、散发性包涵体肌炎和多发性肌炎(polymyositis,PM)5类[1]。心脏受累在IIMs中并不少见。Zhang等[2]一项系统综述研究结果显示13%~72%的IIMs患者存在心脏受累证据。不同研究结果差异较大,可能与不同研究采用的心脏受累界定标准不同有关。目前多数研究纳入的患者多为同时存在亚临床及症状性的心脏受累表现,而以症状性心肌炎为主要心脏受累表现的IIMs比例很低。此外,心脏受累与自身抗体类型存在一定相关性。抗线粒体抗体(anti-mitochondrial antibodies,AMA)阳性[3]和抗信号识别颗粒(signal recognition particle,SRP)抗体相关肌病[4]患者心脏受累较常见。现就作者医院收治的5例以心肌炎为突出表现的IIMs患者的临床表现、血清学、影像学以及病理学特征进行分析,以提高临床医生对其认识。
1 对象和方法
1.1 对象回顾性收集2017年1月至2021年11月北京大学第一医院的IIMs合并心肌炎患者5例。IIMs诊断标准符合2017年欧洲风湿病联盟/美国风湿病学会标准[5]。对于未进行心内膜心肌活检(endomyocardial biopsy,EMB)的患者,心肌炎的诊断依据2013年欧洲心脏病学会的“临床疑似”心肌炎诊断标准[6];对于进行EMB的患者,心肌炎的确诊依据Dallas标准[7]。该研究经北京大学第一医院伦理委员会审批通过,患者或家属知情同意。
1.2 方法收集并分析患者一般资料、临床表现、实验室检查、影像学检查、活检结果及治疗情况。患者均进行肌炎抗体与抗核抗体(antinuclear antibodies,ANAs)谱测定。心脏受累评估包括心肌肌钙蛋白I(cardiac troponin I,cTnI)等心肌损伤标志物、心电图、超声心动图、心脏磁共振成像(cardiac magnetic resonance imaging,CMR)及EMB;骨骼肌受累评估包括肌力查体、肌酶标志物〔如肌酸激酶(CK)等〕、肌电图、大腿MRI及骨骼肌活检。
2 结果
2.1 临床特征5例患者中男3例、女2例,发病年龄47~70岁,中位数为58岁,发病至确诊时间2~49个月,中位数21个月。例1~3慢性起病,以活动性喘憋、胸闷为突出表现,伴轻度骨骼肌力弱;例4亚急性起病,以全身力弱、呼吸困难为主要表现;例5表现为急性起病的晕厥、胸闷,查体肌力正常。结果见表1。
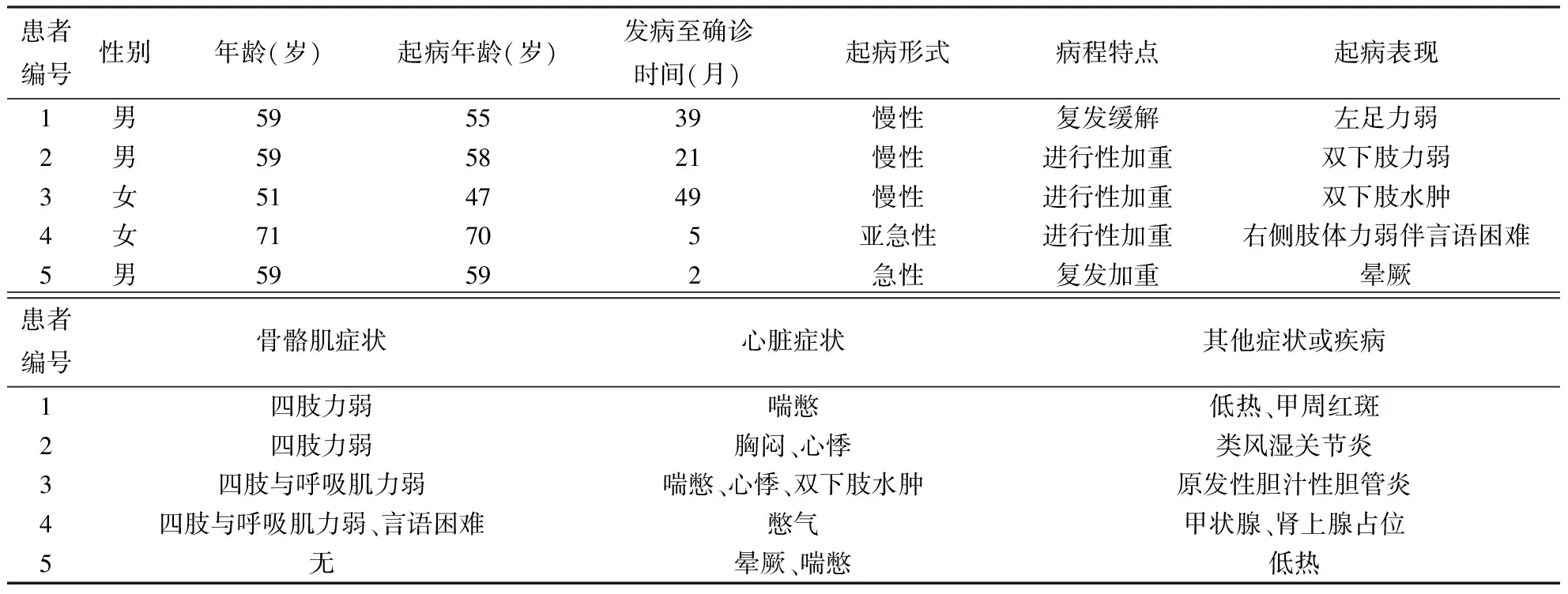
表1 5例IIMs患者临床特征
2.2 心脏相关检查具体结果见表2。5例患者血清cTnI水平为0.072~2.405 ng/mL,均升高。电生理检查显示4例患者出现室性节律;超声心动检查显示4例患者出现心腔扩大与左室射血分数明显降低,为23.1%~44.0%,中位数32.5%。例1~3行CMR检查,结果显示均出现左室基底部异常,2例出现左室中部与间隔壁病变(图1)。例5于病情活动期行EMB检查,主要结果显示偶见心肌坏死、再生、萎缩,伴炎细胞浸润。
注:CMR:心脏磁共振成像;A:心脏短轴位FST2WI像显示左室中部间隔壁及前壁片状高信号(箭头所示);B:心脏短轴位延迟强化扫描显示左室中部前壁、下壁片状延迟强化灶(箭头所示)

表2 5例IIMs患者心脏检查结果
2.3 骨骼肌相关检查结果见表3。4例患者存在四肢肌无力(其中1例无法行走),1例四肢肌力正常,其中2例为双侧肢体无力呈对称分布,2例为非对称分布。肌无力累及颈屈肌、髂腰肌4例,呼吸肌2例,咀嚼肌1例,出现吞咽障碍/构音障碍1例。1例有肌痛表现,2例有肌萎缩表现。血清CK水平为94~6344 IU/L,4例均升高;例1~3患者血清AMA阳性,例4血清抗SRP抗体弱阳性。4例患者行肌电图检查,结果显示肌源性损害。

表3 5例IIMs患者的骨骼肌受累评价
2.4 治疗与随访5例患者均给予口服糖皮质激素〔等效剂量为泼尼松1 mg/(kg·d)起始〕、免疫抑制剂与静脉丙种球蛋白,急性期治疗后症状均有好转。例1~4接受长期免疫抑制治疗,病情稳定,例5出院6个月后因恶性心律失常猝死(表4)。

注:IIMs:特发性炎性肌病;A:HE染色显示散在分布的肌纤维坏死(黑箭头所示)与肌纤维再生(白箭头所示);B:MHC-Ⅰ免疫组化染色显示许多肌纤维膜及胞浆MHC-Ⅰ阳性表达;C:补体免疫组化染色显示非坏死肌纤维膜补体沉积(箭头所示);D:CD8免疫组化染色显示个别肌内衣CD8阳性淋巴细胞浸润(箭头所示);E:HE染色显示肌纤维坏死,有束周分布倾向(箭头所示);F:MHC-Ⅰ免疫组化染色显示部分肌纤维膜及胞浆MHC-Ⅰ阳性表达,有束周分布倾向(箭头所示)

表4 5例IIMs患者治疗及预后
3 讨论
本组5例患者均存在呼吸困难等心功能不全表现或心悸等心律失常表现,影像学检查证实患者心脏存在结构及功能异常,心电图检查结果显示患者存在电生理异常,结合cTnI升高,符合2013年ESC“临床疑似”心肌炎诊断标准[6];例5行EMB检查显示心肌细胞坏死伴炎细胞浸润,符合Dallas标准中的确诊心肌炎[7]。5例患者均存在骨骼肌受累表现,骨骼肌病理所见符合炎性肌病[5]。因此本组患者均可诊断为IIMs与心肌炎。例1、2以骨骼肌力弱起病,病程中出现心脏受累,例4表现为广泛性骨骼肌受累伴心肌受累,考虑为IIMs合并心肌炎;而例3、5以心脏受累症状首发且症状尤为突出,而骨骼肌受累较轻,考虑为心肌炎合并IIMs。
既往报道[3,8]IIMs最常见的症状性心脏受累形式为心力衰竭,约占10%~15%,且IIMs合并心肌炎患者心力衰竭更突出。本组患者均存在喘憋、胸闷等心力衰竭症状,与之相符。室性节律等电生理异常在本组患者中常见,心脏成像检查显示心腔扩大、射血分数减低等,提示为扩张性心肌病,且CMR检查结果显示的异常信号灶多位于左室基底部与中部,这与文献报道的结果一致[3,8]。
与心脏受累突出不同,本组患者骨骼肌受累程度不一。值得注意的是,针对外周组织骨骼肌受累的评估对本组患者的诊断起到了重要作用。除例3外,其余4例患者CK水平显著升高;例5虽肌力正常,但肌电图检查提示肌源性损害;大腿MRI检查结果显示双侧对称性的肌肉水肿;骨骼肌病理检查示肌纤维坏死、再生,伴肌纤维膜MHC-Ⅰ阳性表达、非坏死肌纤维膜补体沉积。此外,本组患者的骨骼肌病变具有相似性,以肌纤维坏死、再生为主,炎细胞浸润不明显,可归为IMNM。国内外研究[2,9-10]结果显示,除IMNM外,DM、PM以及抗合成酶综合征也可合并心脏受累。
近年来研究发现,随着肌炎抗体检测的广泛开展,不同抗体相关的IIMs患者心脏受累比例不同。本组患者3例AMA阳性,特点为病程缓慢。国内外队列研究发现肌炎患者AMA阳性率为0.6%~19.5%[10],但IIMs合并心脏受累患者AMA阳性比例明显升高[3]。日本一项队列研究提出慢性病程、肌萎缩、心脏受累、呼吸功能受累是AMA阳性IIMs的临床特征[11]。本组3例患者与之相符。IMNM队列研究结果显示抗SRP抗体肌病较抗羟甲基戊二酸单酰辅酶A还原酶抗体肌病更易出现呼吸肌受累(12%比0)[12]。本组例4患者抗SRP抗体弱阳性,特点为亚急性病程,骨骼肌群及心肌广泛受累,且呼吸肌受累突出,其临床特点与文献[12]结论相符,但其抗SRP抗体滴度较低,其致病意义需进一步随访验证。除AMA与抗SRP抗体外,其他肌炎抗体与IIMs患者并发心脏受累的相关性并不显著。本组例5患者骨骼肌病理可见束周肌纤维坏死,后者常见于抗合成酶综合征,但该患者未检出包括抗合成酶抗体在内的自身抗体,其临床特点为以急性心肌炎起病,骨骼肌症状轻。文献报道急性心肌炎合并骨骼肌受累常见于接受免疫检查点疗法的肿瘤患者,除四肢及躯干肌群受累外,还可合并眼外肌受累[13]。
总之,当心肌病变患者出现无法解释的骨骼肌症状或相关异常检查结果时,应及时行骨骼肌活检等,以判断是否合并IIMs;当表现为肢体无力的IIMs患者检出AMA或抗SRP抗体阳性时,应关注有无胸闷、心肌酶异常升高等,必要时行心脏电生理及心脏成像检查以判断是否合并心脏受累。
