精神分裂症伴Hp感染患者肠道菌群变化及意义的初步探讨*
2022-09-20
目前,临床上关于精神分裂症的诊断主要采用ICD或DSM诊断系统,同时结合临床精神量表等进行,精神分裂症的前驱期主要是对患者的心境、认知、感知觉、行为以及生理功能改变的描述[1]。虽然上述诊断可以对首发精神分裂症患者有较好的预测效度,但在实际应用中尚有很多不足,有时存在主观因素的影响。因此从客观指标了解精神分裂症的病理机制可能成为新的研究方向。近年来,肠道菌群不仅可调控食物消化能力,维持免疫系统的运作,而且能通过脑-肠-微生物轴影响大脑的活动,已经在动物模型中得到证实,其中孤独症有较多的研究[2,3]。但关于精神分裂症与肠道菌群的相关性研究尚少。幽门螺杆菌(Hp)感染是人体最常见的慢性感染性疾病,研究发现[4],我国Hp的感染率可高达70.0%。为此本研究即探讨精神分裂症伴Hp感染患者肠道菌群变化及意义。
1 对象与方法
1.1 对象 选取2018年2月~2020年2月84例确诊为精神分裂症的患者作为病例研究对象。纳入标准:年龄≥18岁;病例精神分裂症诊断符合美国精神障碍诊断与统计手册第4版(DSM-Ⅳ)诊断标准[5],病程>2年但目前病情平稳;采用C14呼气试验检测Hp感染情况,结果dpm/mmol CO2<100为阴性,>100为阳性;患者或直系亲属签署知情同意;临床资料完整。排除标准:年龄<18岁;妊娠或哺乳期;既往存在肠道功能异常或糖尿病、甲状腺疾病等影响肠道菌群者;合并其他明确的精神障碍或认知障碍者;合并恶性肿瘤、免疫系统疾病者;近期服用治疗Hp感染的抗生素者;临床资料不完整者。根据是否合并Hp感染将所有入组患者分为Hp感染组50例和非Hp感染组34例,其中Hp感染组男30例,女20例;年龄18~62岁,平均(44.31±5.34)岁。非Hp感染组男20例,女14例;年龄18~63岁,平均(42.52±6.53)岁。同时选择50名健康人群作为对照组,其中男26名,女24名;年龄18~63岁,平均(43.55±6.76)岁。三组性别、年龄比较差异均无统计学意义(P>0.05)。
1.2 方法
1.2.1 检测方法 采用高通量测序联合16S rRNA实时巧光定量PCR法(qPCR)检测所有受试者肠道菌群差异。基于分类学信息,在门、属分类水平上进行菌群多样性的统计分析,其中Alpha多样性分析包括:Chao1指数、Ace指数、Shannon指数和Simpson指数;Beta多样性分析主要为weighted unifrac指数。采用酶联免疫吸附法(ELISA)检测肠道免疫球蛋白A(IgA)水平,采用NADH速率法检测谷氨酸合成酶活性。采用直接涂片法直接计算肠道菌群球/杆比。
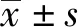
2 结果
2.1 三组肠道菌群多样性比较 三组Alpha多样性及Beta多样性比较差异均无统计学意义(P>0.05)。见表1。
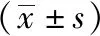
表1 三组肠道菌群多样性比较
2.2 三组在门水平上的肠道菌群相对丰度比较 三组间放线菌门丰度比较差异有统计学意义(P<0.01)。进一步两两结果显示,Hp感染组放线菌门丰度高于非Hp感染组(Z=-5.691,P=0.000)和对照组(Z=-6.012,P=0.000),非Hp感染组放线菌门丰度高于对照组(Z=-4.259,P=0.000) 。见表2。

表2 三组在门水平上的肠道菌群相对丰度比较[M(Q25,Q75)]
2.3 三组在属水平上的肠道菌群相对丰度比较 三组间拟杆菌属、粪杆菌属、放线菌属、罗氏菌属、斯卡多维亚氏菌属、奇异菌属、乳杆菌属、伊格尔兹氏菌属、莫雷拉菌属丰度比较差异均有统计学意义(P<0.01)。进一步两两比较结果显示,Hp感染组拟杆菌属、粪杆菌属丰度低于非Hp感染组和对照组(P<0.05),而放线菌属、罗氏菌属、斯卡多维亚氏菌属、奇异菌属、乳杆菌属、伊格尔兹氏菌属、莫雷拉菌属丰度高于非Hp感染组和对照组(P<0.05);非Hp感染组拟杆菌属、粪杆菌属丰度低于对照组(P<0.01),而放线菌属、罗氏菌属、斯卡多维亚氏菌属、奇异菌属、乳杆菌属、伊格尔兹氏菌属、莫雷拉菌属丰度高于对照组(P<0.01)。见表3。

表3 三组在属水平上的肠道菌群相对丰度比较[M(Q25,Q75)]
2.4 三组肠道粘膜免疫力比较及肠道菌群球/杆比 三组间IgA、谷氨酸合成酶活性及肠道菌群球/杆比比较差异均有统计学意义(P<0.01)。进一步两两比较结果显示,Hp感染组IgA、谷氨酸合成酶活性及肠道菌群球/杆比均高于非Hp感染组和对照组(P<0.01),非Hp感染组IgA、谷氨酸合成酶活性及肠道菌群球/杆比均高于对照组(P<0.01) 。见表4。

表4 三组肠道粘膜免疫力比较及肠道菌群球/杆比[M(Q25,Q75)]
2.5 肠道菌群球/杆比与肠道粘膜免疫力相关性 肠道菌群球/杆比与IgA(r=0.398,P=0.000)、谷氨酸合成酶活性(r=0.445,P=0.000)均呈正相关,IgA与谷氨酸合成酶活性呈正相关(r=0.456,P=0.000) 。
3 讨论
精神分裂症是精神科常见的疾病之一,主要表现为特殊的思维、知觉、情感、行为等多方面的障碍和精神活动与环境的不协调,一般无意识及智能的障碍[6]。精神分裂症不仅给患者带来沉重的精神压力,也会给其家庭带来沉重的经济负担。目前精神分裂症的病因尚不清晰,因此仍需从多方面对精神分裂症病因进行探索。近年来研究发现肠道菌群组成及数量的改变会直接影响机体的免疫系统和中枢神经系统,进而可以对认知和行为等方面产生不同程度的影响[7,8];此外有研究发现机体免疫系统功能紊乱可促进精神分裂症的发生、发展,因此可以认为肠道菌群与精神分裂症存在密切关系[9,10]。目前肠道菌群和精神分裂症之间的联系机制未被阐明,但有研究认为肠道菌群可以通过肠-脑轴来与大脑进行双向交流[11],而肠-脑轴主要是由激活迷走神经、影响人体免疫系统、调节神经内分泌系统及产生神经递质等通路构成的,因此肠-脑轴作为一个双向的神经体液传播系统,其功能障碍可能会产生精神行为异常等后果[12,13]。Hp感染是机体最常见的肠道感染,其感染后会引起肠道PH值及肠道其他菌群的变化[14]。本研究对精神分裂症伴Hp感染患者肠道菌群变化进行分析。
本研究发现精神分裂症及健康人群肠道优势菌群均为厚壁菌门、拟杆菌门、梭菌门、变形菌门、放线菌门;但门水平上精神分裂症患者放线菌门丰度明显升高,且合并Hp感染后升高更明显。分析认为Hp是一种微厌氧菌,虽然存在于多数人的肠道菌群中,但其仍是一种致病菌,已被证实与消化系统溃疡及肿瘤等密切相关。因此提示精神分裂症合并Hp感染可能是精神分裂症发生、发展的促进因素。本研究属水平研究发现,Hp感染组拟杆菌属、粪杆菌属丰度低于非Hp感染组和对照组,且非Hp感染组拟杆菌属、粪杆菌属丰度低于对照组。分析认为拟杆菌属、粪杆菌属是典型的益生菌,且可以参与人体短链脂肪酸的代谢[15],而短链脂肪酸是肠上皮细胞能量的主要来源[16],因此拟杆菌属、粪杆菌属丰度降低可能会导致肠上皮细胞通透性改变进而影响人体各项生理功能。
本研究发现Hp感染组IgA、谷氨酸合成酶活性及肠道菌群球/杆比均高于非Hp感染组和对照组,非Hp感染组IgA、谷氨酸合成酶活性及肠道菌群球/杆比均高于对照组;此外本研究发现肠道菌群球/杆比与IgA、谷氨酸合成酶活性均呈正相关;且IgA与谷氨酸合成酶活性亦呈正相关。分析认为IgA是肠道黏膜表面的第一道免疫防线,主要由肠黏膜中的IgA浆细胞分泌,其受神经、内分泌和免疫系统的调节,发挥抑制肠道内的细菌黏附肠道黏膜表面,中和肠道内的毒素、酶和病毒的作用[17]。当Hp感染后肠道免疫屏障功能随之降低,肠道IgA为保护肠道粘膜而分泌增加,进一步抑制致病菌而影响肠道菌群球/杆比。研究认为[18,19],谷氨酸作为神经递质,参与了神经突触可塑性形成及学习记忆过程,而与其相关的神经振荡异常参与了精神分裂症的发生过程。谷氨酸的合成需要谷氨酸合成酶在激活状态催化氨基谷氨酰胺转移到α-酮戊二酸上,因此谷氨酸合成酶活性的增加可以直接导致谷氨酸的增加[20,21],进而参与精神分裂症的发生、发展过程。而Hp感染后可进一步降低肠道免疫力进而影响肠道谷氨酸的代谢功能,推测其可能就是通过增加了谷氨酸合成酶的活性,随着谷氨酸的增加,肠道PH值改变,进而可影响肠道免疫功能及其他菌群数量的变化。
综上所述,本研究显示,精神分裂症伴Hp感染后可进一步加重肠道菌群失调,通过影响肠道免疫功能及神经递质可能增加精神分裂症风险。本研究存在一定不足:首先本研究样本量较小,且未考虑饮食习惯、 生活方式等对肠道菌群的影响;其次本研究中的患者在入组时已经服用抗精神病药物,无法分析患者用药前后肠道菌群变化情况,不能明确抗精神病药物对肠道菌群有何影响,因此需进一步扩大样本验证。
