急性短暂性精神病性障碍患者血清非酶类抗氧化物水平研究*
2022-09-20
急性短暂性精神病性障碍(Acute and Transient Psychotic Disorder,ATPD)是一组急性发作、病程短暂的精神疾病[1]。患者突然受到精神刺激,出现短时间精神异常并短时间恢复正常,通常其发病前性格与家族史并无特殊。病程较短为该病主要特点,通常持续1~2周,达不到精神分裂症的诊断标准。患者痊愈后,诊断稳定性较差,部分患者病程迁延反复,达到精神分裂症等其他精神疾病的诊断标准,可更改诊断,而部分患者病情不再发展,预后良好,仍维持原诊断。该病病理机制尚不明确,其转归可能是多因素综合作用的结果。
大脑耗氧量高,抗氧化能力弱,易受氧化应激失衡的影响。氧化应激诱导的大脑损伤对中枢神经系统功能产生影响,可导致患者出现精神异常,因此,氧化应激失衡或参与了精神疾病的急性发病过程。近年来,大量研究表明多种精神障碍患者体内存在氧化应激失衡[2],如焦虑症、抑郁症、精神分裂症[3],检测相关指标变化对精神疾病的病理生理过程给予重要提示[4]。非酶类抗氧化物是细胞外液的主要抗氧化系统,主要包括谷胱甘肽、生育酚、维生素A、维生素C、尿酸(Uric Acid,UA)、白蛋白(Albumin,ALB)、胆红素等。其中UA、ALB、总胆红素(Total Bilimbin,T-BIL)占血浆总抗氧化能力的85%以上[4],能够在一定程度上反映机体的氧化应激情况。ATPD作为临床上相对常见的精神异常,该病患者体内是否存在氧化应激失衡,抗氧化能力如何变化,氧化应激相关指标变化与该病的转归有无关联以及治疗过程中抗精神病药物的使用对患者氧化应激系统的影响等一系列问题尚不明确,本研究由此展开。
1 对象与方法
1.1 对象 对2017年~2019年期间就诊于北京回龙观医院的150例诊断为ATPD的患者临床资料进行回顾性分析,通过查阅患者住院记录、复诊记录及电话回访进行为期2年的病例追踪。ATPD a组(n=150)纳入标准:(1)年龄16~60岁;(2)符合国际疾病分类第10版(ICD-10)中ATPD的诊断标准(患者2周内急性发病,突然从完全没有精神病性症状转变为明显异常的精神病状态,病程短于3个月且精神分裂样症状持续不超过1个月);(3)入组前12周内未服用抗氧化剂类药物,6个月内未服用过抗精神病药物者;(4)患者急性期阳性与阴性症状量表(PANSS)总分≥60分。ATPD b组(n=127)纳入标准:(1)2年观察期间未接受抗氧化剂类药物治疗;(2)2年观察期间未出现肝肾功能异常;(3)患者痊愈后按要求回院复诊或电话问诊,病例追踪未中断。ATPD组(n=55)纳入标准:患者预后良好,2年观察期间内病情未发展,仍维持原诊断。非ATPD组(n=72)纳入标准:患者2年观察期间内再次发生精神状态异常并更改诊断的患者(其中精神分裂症29例,双相情感障碍18例,其他精神疾病25例)。排除标准:(1)合并脑器质性疾病或脑外伤等;(2)合并高血压、糖尿病、痛风等代谢类疾病及肝肾功能异常;(3)尿妊娠试验阳性和哺乳期女性。以上各组纳入流程见图1。另选取同期于医院科研中心参与临床研究项目的健康对照者60名作为对照组。 本研究通过相关伦理委员会批准。

图1 ATPD患者入组流程图
1.2 方法
1.2.1 临床资料收集 所有患者由精神科高年资主治级别以上医师明确诊断,收集研究对象一般人口学资料 [年龄、性别、体质量指数 (BMI)、职业、遗传史等],统计患者的用药情况。
1.2.2 血清UA、T-BIL、ALB的测定 所有患者于急性发病期首次入院时、抗精神病药物治疗2周时采集静脉血3~5 ml送至北京回龙观医院医学检验中心,室温下分离血清。采用贝克曼AU5800型全自动生化分析仪检测血清UA、ALB、T-BIL水平。
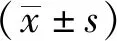
2 结果
2.1 各组一般资料比较 三组性别构成、年龄、BMI比较差异均无统计学意义(P>0.05)。非ATPD组PANSS总分及阳性症状评分均高于ATPD组(P<0.01)。见表1。

表1 一般临床资料比较
2.2 入院期间用药情况 本研究为回顾性分析,未对患者抗精神病药物使用种类和剂量加以限定,患者急性发作入院治疗期间抗精神病药使用情况见表2。ATPD组38.18%的患者采用单药治疗,61.81%的患者采用两种药物联合治疗。非ATPD组34.72%的患者采用单药治疗,65.28%的患者采用两种药物联合治疗。卡方检验分析显示两组总体用药类别情况比较差异无统计学意义(χ2= 0.471,P=0.688)。
2.3 三组治疗前后UA、T-BIL、 ALB水平比较 ATPD组及非ATPD组治疗前UA水平均高于对照组(P<0.05),但非ATPD组UA水平高于ATPD组(P<0.05);抗精神病药物治疗2周后,ATPD组及非ATPD组UA水平均较治疗前下降(P<0.01),且均低于对照组(P<0.05)。ATPD组及非ATPD组治疗前T-BIL水平均高于对照组(P<0.01);ATPD组及非ATPD组抗精神病药物治疗2周后T-BIL水平均较治疗前降低(P<0.05),但仍高于对照组(P<0.01)。ATPD组及非ATPD组治疗前ALB水平均低于对照组(P<0.05);抗精神病药物治疗2周后ATPD组与非ATPD组ALB水平均低于对照组(P<0.05)。见表3,表4。

表2 患者抗精神病药物使用情况[n(%)]
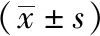
表3 治疗前后三组组间UA、T-BIL、ALB水平比较
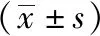
表4 治疗前后ATPD组和非ATPD组组内UA、T-BIL、ALB浓度比较
3 讨论
ATPD起病急、病程短(多在一个月之内),此外,随着时间的推移,该病患者痊愈后常再次出现精神状态异常而更改诊断,具体病因尚不明确。本研究结果显示仅43.31%的患者在2年后仍维持原诊断,56.69%的患者复发精神异常而更改诊断,这与Lopez-Diaz A等[5]研究结果相类似。进一步提示ATPD诊断稳定性较低,易复发,临床诊疗过程中应针对该特点对患者长期关注,及时干预。
机体氧化应激系统处于动态平衡状态,当该系统出现氧化-抗氧化失衡,机体多系统会受到损伤,如内分泌系统、心脑血管系统、中枢神经系统等。已有研究证明氧化应激参与多种精神疾病的病理生理过程[6],包括抑郁症、焦虑症、精神分裂症和孤独症谱系障碍等[4],而ATPD也属于相对常见的一种精神疾病,本研究旨在探究该病患者体内氧化应激相关指标如何变化。机体抗氧化防御系统的作用不仅取决于其酶活性成分,还取决于非酶活性成分。非酶类抗氧化剂主要包括UA、ALB和胆红素。UA是人体特有的水溶性抗氧化剂,是血液所有抗氧化剂中浓度最高的,占血清中总抗氧化能力的50%[7]。UA的抗氧化活性很复杂,能对过氧亚硝基阴离子、过氧化物和次氯酸起到抗氧化作用[3];胆红素是血红素分解代谢的最终产物,其作为一种抗氧化剂通过清除过氧自由基参与抗氧化机制[8];ALB是一种内源性抗氧化剂,具有清除自由基的特性,通过结合金属离子抑制脂质过氧化[7]。
本研究结果显示患者急性发作入院时,ATPD组及非ATPD组UA、T-BIL水平升高,ALB水平降低,而非ATPD组UA水平高于ATPD组。说明氧化应激参与了多种精神疾病的急性发作过程,包括ATPD。既往研究表明慢性精神分裂症患者抗氧化能力下降,非酶类抗氧化类指标水平下降[9]。而本研究以急性发作患者为研究对象,为进一步探索氧化应激与精神疾病急性发作的相关性提供依据。Lu Z等[10]研究结果显示精神分裂症患者急性发作时UA水平升高,与本研究结果相一致。有研究指出适当增加UA可以提高身体的抗氧化能力[11],患者急性期UA水平升高为机体处于急性氧化应激状态与抗氧化能力反应性增强的表现。而非ATPD组UA水平高于ATPD组,提示UA或为患者预后预测因子,UA水平较高的患者预后更差。此外,患者急性发作时T-BIL水平升高可能是氧化应激下红细胞膜脆性增加的结果。Muller N等[12]研究发现精神分裂症患者在急诊入院时经常出现胆红素浓度增加,认为胆红素是精神分裂症的潜在生物标记物。Miyaoka T[13]指出非结合高胆红素血症(Gilbert综合征,GS)与精神分裂症易感性密切相关,而GS亚型精神分裂症患者的预后可能较差,这些与本研究结果中T-BIL的变化趋势相一致。过去也有研究结果显示精神类疾病患者T-BIL水平低于健康对照组[10],但研究对象多为精神分裂症、双相情感障碍等疾病的稳定期患者。与UA及T-BIL变化趋势相反,急性发作期ATPD及非ATPD患者ALB水平均低于对照组。Solberg DK等[14]研究结果显示精神分裂症患者急性期ALB水平较正常降低,与本研究结果相一致,或因ALB在氧化应激中的作用不同,可能在发病早期ALB已经开始发挥其抗氧化作用而被逐渐消耗。此外,胆红素在外周血中是以ALB结合体转运的,ALB的消耗可能是T-BIL下降的原因之一。
抗精神病药物治疗2周后,ATPD组及非ATPD组UA、T-BIL水平均下降,UA水平低于对照组,而T-BIL水平高于对照组,ALB水平无显著变化。结果提示抗精神病药物对患者的氧化-抗氧化系统产生了影响,可能具有抗氧化应激作用。这与北京回龙观医院早期研究结果相一致[15],陈大春等[15]研究结果显示抗精神病药物利培酮可使首发精神分裂症患者非酶抗氧化物浓度下降。Lu Z等[10]研究指出抗精神病药物的使用可以降低患者T-BIL及ALB水平,T-BIL水平的变化趋势与本研究结果相一致,但ALB变化趋势存在差异。本研究结果显示ALB水平变化幅度不大且大多在正常范围内,这可能与体内蛋白代谢特点有关,肝脏合成蛋白质是源源不断的,需要将该因素考虑在内。过去有研究表明抗精神病药物会导致患者嘌呤代谢紊乱,UA水平升高[16],与本研究结果相反。究其原因,首先,研究对象不同,氧化-抗氧化系统为动态调节系统,不同的疾病及疾病不同时期均可能存在差异,本研究入组的ATPD患者均为首次发病入院且病程较短,用药后监测仅间隔2周,此时药物对嘌呤代谢的影响相对较小。本研究为病例回顾性研究,抗精神病药物的使用没有做到统一标准,仅依据单药治疗或两种药物联合治疗做了简单分类,统计学分析显示ATPD组与非ATPD组入院治疗期间治疗方式比例大致相同,用药后观察时间节点均为2周,但用药的种类存在差异,这些都是影响因素,在后续的研究中,会进一步完善试验。
本研究还存在一些局限性。首先,饮食易影响外周血UA和ALB水平,本研究患者住院期间饮食均由医院食堂提供,种类大致相同,但本研究并没有严格控制饮食量。此外,三种非酶类抗氧化剂还受多种因素的影响,如运动情况、糖代谢、脂代谢等,患者的生活习惯各不相同,难以做到统一。第二,虽然已有研究表明ALB、胆红素和UA的抗氧化能力占血浆总抗氧化能力的85%以上,但还需要检测更多的氧化应激相关指标(如总抗氧化能力、过氧化物、抗坏血酸、酶类抗氧化剂等)来进一步验证相关结论。第三,外周血中抗氧化因子水平仅仅间接反映了中枢神经系统氧化应激状态,或存在偏差。第四,本研究纳入的患者中有2/3为女性,这导致了性别选择偏倚。性别间的氧化应激状态有无差异有待研究。最后,氧化还原调节是动态的,并在疾病的不同阶段变化,更长时间的观察是必要的。
综上,本研究可能存在多方面的不足,但仍带来一些有益的启示,氧化应激可能参与了多种精神疾病的急性发作,包括ATPD,而氧化应激的程度及机体抗氧化能力或与患者预后相关,此外,提示抗精神病药物可能具有抗氧化应激的作用。
