基于生物信息学分析GLIS3在胃癌中表达与免疫浸润的临床意义
2022-09-20马腾达屈才浩李玉民
王 瑞,马腾达,屈才浩,李玉民△
(1.兰州大学第二医院普外科,兰州 730030;2.甘肃省消化系肿瘤重点实验室,兰州 730030)
胃癌是全世界最常见的恶性肿瘤之一,2020年全球最新癌症统计显示:新发病例超过100万,估计死亡病例76.9万,已经成为第五大最常见的癌症和第四大癌症死亡原因[1]。目前,全球43.9%的胃癌新发病例和48.6%的胃癌致死病例发生在中国,对我国的公共卫生领域构成了极大的挑战[2]。尽管目前以手术、放化疗、靶向治疗和免疫治疗的联合治疗改善了胃癌患者的生存和预后,但进展期胃癌患者接受手术后的5年生存率仍不理想[3-4]。因此,寻找胃癌相关的诊断及预后标志物对于改善胃癌患者的预后具有重要意义。
GLIS3基因位于染色体9p24.2上,共有11个外显子,编码930个氨基酸,它是GLI样锌指蛋白家族的成员之一,其异常表达与一些病理状态有关,如骨质疏松症、肋骨骨折、甲状腺功能减退症、胰腺功能不全和糖尿病[5]。近年来,随着基因组学、分子生物学的快速发展,发现GLIS3的异常表达与癌症有关,如上皮瘤[6]、乳腺癌[7]等,但GLIS3在胃癌中的作用仍不清楚。本研究通过生物信息学方法分析TCGA数据库数据,探讨GLIS3在胃癌中的表达及其与免疫浸润、预后的意义,并预测调控GLIS3表达的微RNA(microRNA,miRNA)和GLIS3在胃癌可能参与的生物学功能,现报道如下。
1 资料与方法
1.1 一般资料
从TCGA数据库(http://www.tcga.org)下载胃癌mRNA-seq数据、miRNA-seq数据及临床相关数据,其中包括375个肿瘤组织和32个正常组织。使用R及perl软件整理合并数据文件。排除了生存时间缺失和临床信息不完整的标本。
1.2 方法
1.2.1GLIS3在肿瘤中的表达差异分析
利用TIMER数据库(http://timer.comp-genomics.org/)分析GLIS3在不同肿瘤中的表达水平。使用R软件提取GLIS3在胃癌组织标本和癌旁组织标本的表达数据,分析GLIS3在胃癌组织及癌旁组织标本中的表达差异,并分析其在26例配对胃癌及癌旁组织标本的表达水平,使用GEPIA在线工具(http://gepia2.cancer-pku.cn/)进行表达差异验证。用受试者工作特征(ROC)曲线评价GLIS3在胃癌中的诊断性能。
1.2.2GLIS3表达水平与患者临床病理特征的相关性分析
根据下载整理的患者临床病理信息,匹配GLIS3表达水平,研究GLIS3与年龄、性别、组织学分级、TNM分期等临床相关性。
1.2.3GLIS3表达水平与胃癌患者的生存分析
以GLIS3表达水平中位数为截断值,将患者分为高表达组和低表达组,比较两组间的生存差异,并用“survival”包绘制生存曲线。同时使用GEPIA进一步验证GLIS3在胃癌患者中的生存关系。采用单因素和多因素Cox回归分析判断GLIS3在胃癌中的预后价值。
1.2.4预测胃癌中调控GLIS3异常表达的miRNA
运用miRWALK(3.0)、TargetScan v7.2数据库预测调控GLIS3的miRNA,并与TCGA数据库筛选得到的差异表达的miRNA取交集获得共同的miRNA。进一步通过线性回归分析,确定胃癌中调控GLIS3异常表达的miRNA。
1.2.5基因富集分析
采用GSEA(版本4.0.3)以分子特征数据库中c2.cp.kegg.v7.0.symbols.gmt数据集作为功能基因集,对GLIS3高表达数据集进行基因富集分析。P<0.05和错误发生率(false discovery rate,FDR)<0.25的基因集作为明显富集的基因集。
1.2.6免疫浸润分析
运用TIMER数据库分析GLIS3表达水平与胃癌免疫细胞浸润水平的相关性,包括CD4+T、CD8+T和巨噬细胞等。另外,将375例肿瘤标本以GLIS3表达水平中位数为界分为高、低表达两组。使用CIBERSORT算法(http://cibersort.stanford.edu/)评估两组中免疫细胞占比,绘制22种免疫细胞在GLIS3高低表达组占比的小提琴图。
1.3 统计学处理
计数资料以频数表示,两组间比较采用Wilcoxon秩和检验;生存分析采用Kaplan-Meier法,采用Log-rank检验生存差异;相关性分析采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 GLIS3在胃癌和癌旁组织中的表达差异
与癌旁组织比较,GLIS3在胆管癌、子宫内膜癌、胃癌等肿瘤中高表达,见图1。TCGA数据库中,GLIS3在胃癌组织中表达水平明显高于癌旁组织(P<0.05),26例配对的胃癌组织中GLIS3也高表达。同样,GEPIA数据库的验证结果显示,GLIS3在胃癌组织中的表达也高于癌旁组织(P<0.05)。另外,通过ROC曲线分析显示,GLIS3对胃癌具有明显的诊断价值,曲线下面积(AUC)=0.763(P<0.05),见图2。
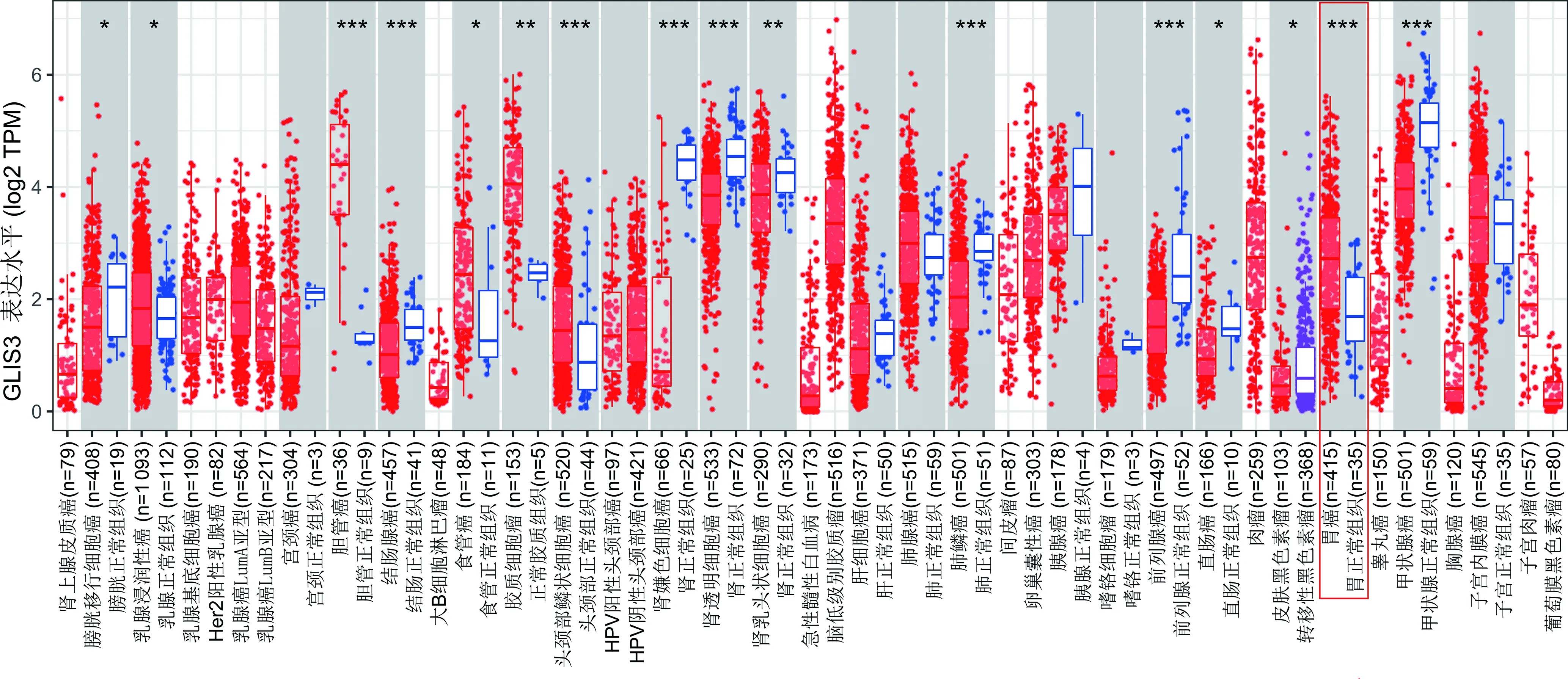
图1 TIMER数据库中GLIS3在不同肿瘤组织和癌旁组织中的表达
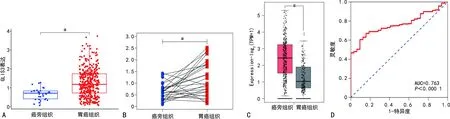
A:TCGA数据库中GLIS3胃癌及癌旁组织中的表达;B:TCGA数据库中GLIS3在配对胃癌及癌旁组织中的表达;C:GEPIA数据库中GLIS3在胃癌及癌旁组织中的表达;D:GLIS3诊断胃癌的ROC曲线;a:P<0.05。
2.2 GLIS3表达与胃癌患者临床病理特征的关系
GLIS3表达与患者肿瘤组织学分级相关(P<0.05),而与年龄、性别、TNM分期、T分期、N分期无关,见图3。
2.3 GLIS3表达水平与胃癌患者预后的关系
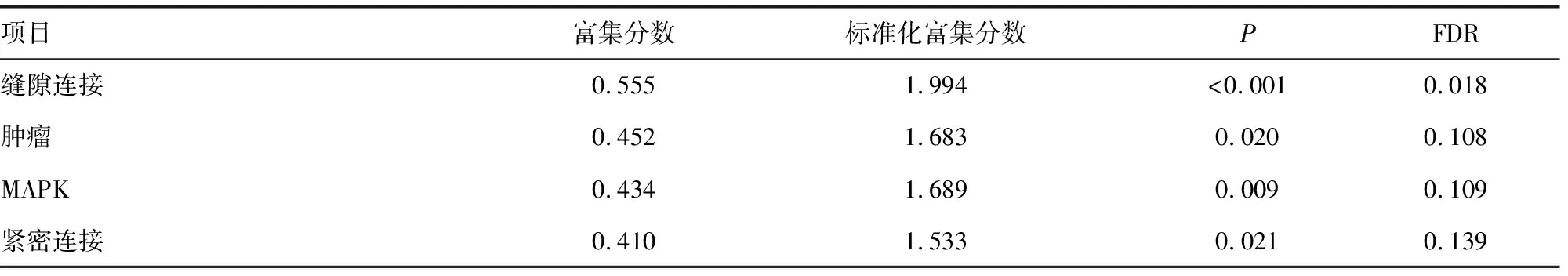
TCGA数据库得到的生存曲线表明,GLIS3的差异表达明显影响胃癌患者生存预后,与低表达组比较,GLIS3高表达组总体生存期明显降低,差异有统计学意义(P<0.05)。GEPIA在线数据库生存曲线同样表明,GLIS3高表达组生存率明显低于低表达组(P<0.05),见图4。单因素和多因素Cox回归分析显示,GLIS3表达是影响胃癌患者预后的独立危险因素,见表1。
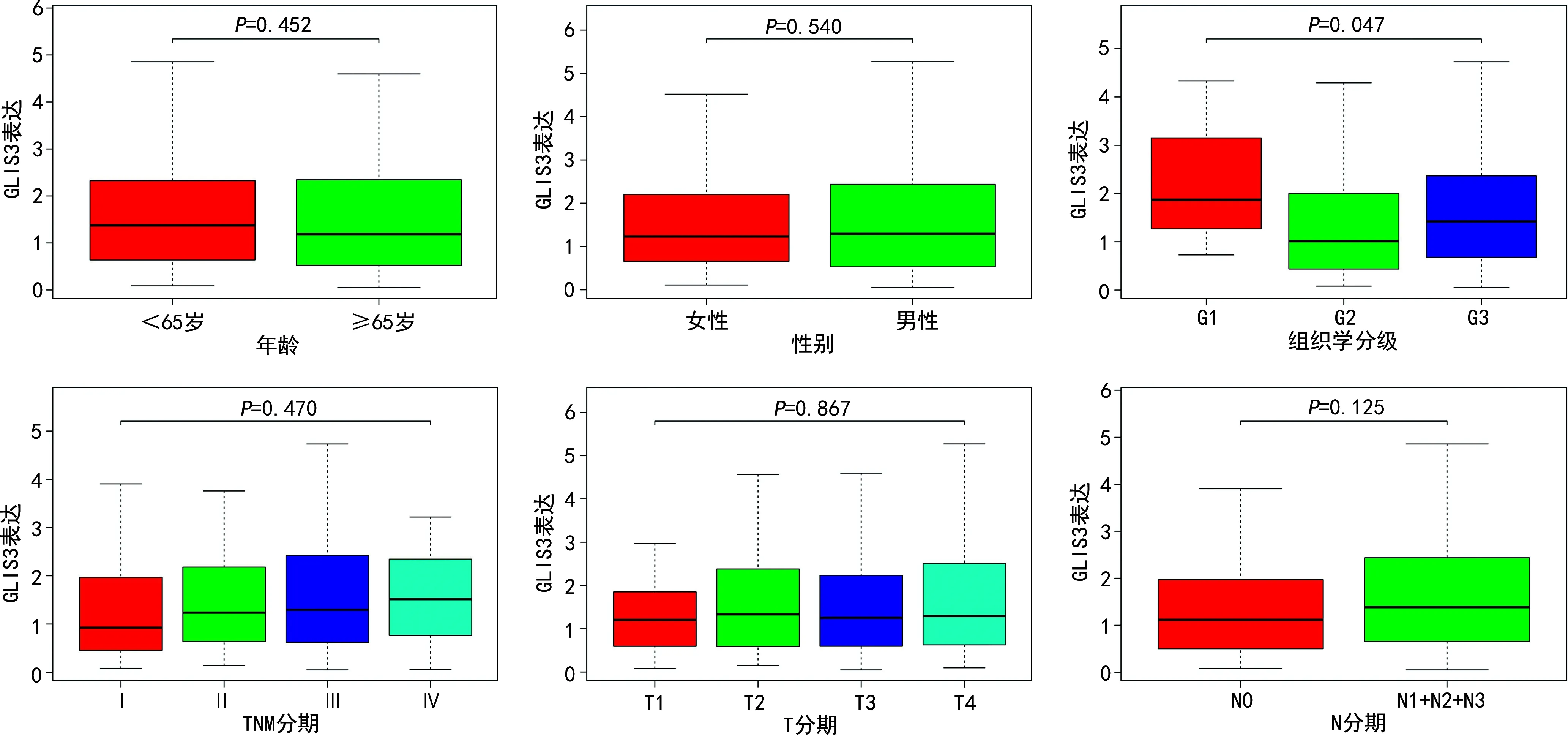
图3 GLIS3表达与胃癌患者临床病理资料的相关性
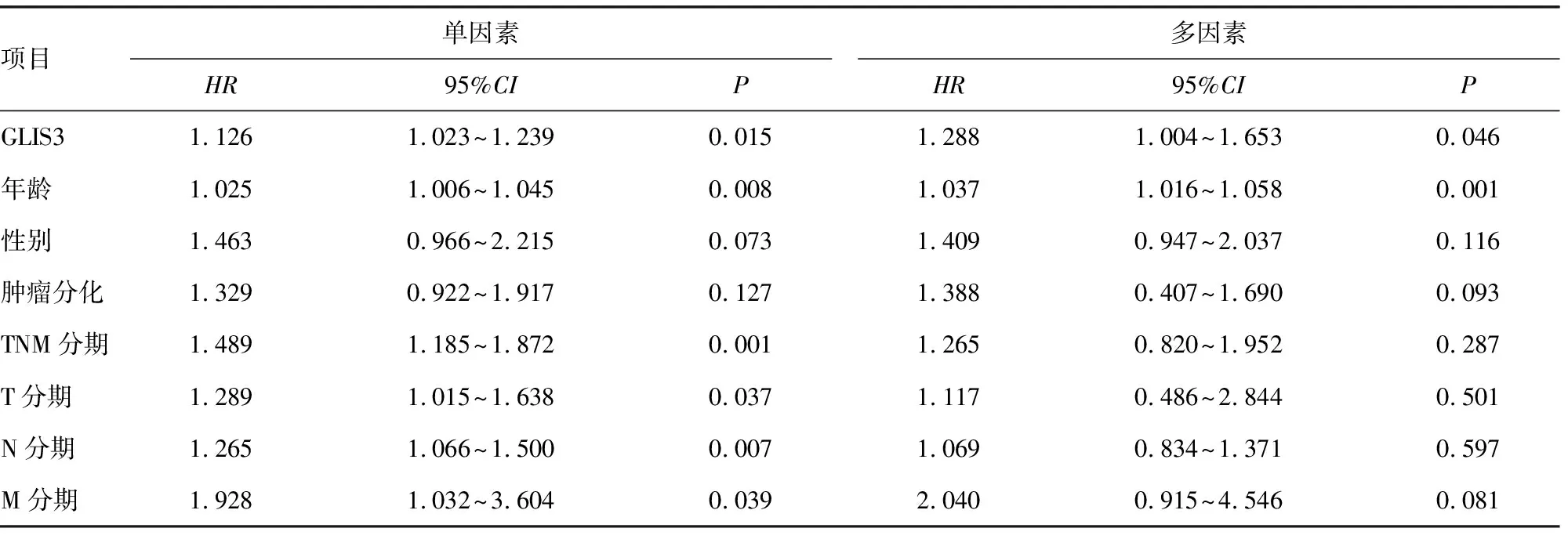
表1 影响胃癌患者预后的Cox单因素及多因素回归分析
2.4 调控GLIS3异常表达的miRNA
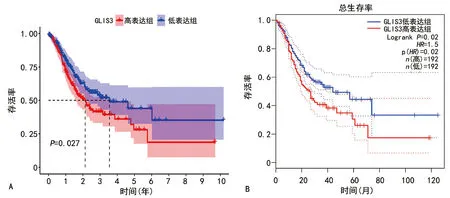
miR-204-5p是调控GLIS3表达的潜在miRNA。在TCGA数据库中,与癌旁组织比较,胃癌组织中miR-204-5p表达明显下调(P<0.001)。且在配对的胃癌组织中也明显下调,通过相关性分析显示,miR-204-5p与GLIS3 mRNA表达情况呈明显负相关(r=—0.17,P<0.001),见图5。
2.5 基因富集分析预测GLIS3的功能
GSEA富集分析共筛选出与GLIS3高表达相关的12个P<0.05且FDR<0.25的基因集,选取7个有意义的信号通路,发现GLIS3高表达主要富集在细胞外基质(ECM)受体相互作用、钙、黏着斑、缝隙连接、肿瘤、丝裂原活化蛋白激酶(MAPK)、紧密连接这些信号通路,见表2、图6。

表2 GLIS3在胃癌中的基因富集分析
续表2 GLIS3在胃癌中的基因富集分析
A:TCGA数据库中GLIS3表达与胃癌患者预后的生存曲线;B:GEPIA数据库中GLIS3与胃癌患者预后的生存曲线。
A:miR-204-5p在胃癌组织及癌旁组织中的表达水平;B:miR-204-5p在配对胃癌组织及癌旁组织中的表达水平;C:miR-204-5p表达与GLIS3表达之间的相关性;a:P<0.05。
2.6 GLIS3表达与胃癌组织中免疫细胞浸润水平的关系
使用TIMER数据库分析发现,GLIS3表达与胃癌组织中CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞均呈正相关(P<0.05),相关系数分别为0.194、0.314、0.147、0.174。以GLIS3表达的中位值为界,将375个肿瘤标本分为高低表达两组,使用CIBESORT算法分析22种免疫细胞表达水平的差异,结果显示记忆B细胞、巨噬细胞(M2)、静止树突状细胞、活化的树突状细胞是受GLIS3表达影响的主要细胞,其中高表达组的巨噬细胞(M2)、静止树突状细胞增加(P<0.05),而活化的树突状细胞减少(P<0.05),见图7。
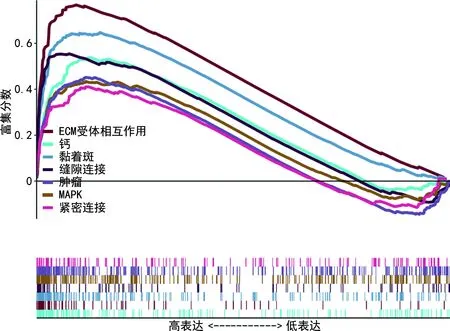
图6 GLIS3在胃癌中的相关通路
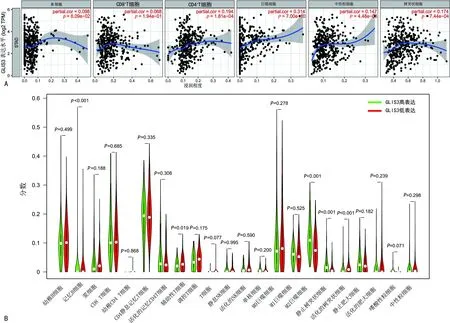
A:GLIS3表达与免疫浸润水平之间的相关性;B:肿瘤标本中GLIS3高表达和低表达组中22种免疫细胞小提琴图。
3 讨 论
胃癌的发生是癌基因、抑癌基因、细胞黏附因子、DNA修复基因、遗传不稳定性及端粒酶活化等多种因素共同作用的结果,而转录因子在胃癌的发生、发展中也发挥着重要的作用。GLIS3基因中的锌指结构区和C末端转录激活区在其发挥转录激活功能中起到重要作用[8]。GLIS3的过表达已在多种肿瘤细胞类型中发现,包括甲状腺癌[9]、结直肠癌[10]和黑色素瘤[11]。此外。RAMI等[7]检测了15例新鲜乳腺癌组织和癌旁组织GLIS3基因mRNA的含量,发现癌组织中GLIS3表达明显高于癌旁正常组织,同时使用免疫组织化学技术检测了雌激素受体、孕激素受体和人类表皮生长因子受体-2(HER-2)的表达情况,发现三阴性乳腺癌中的GLIS3同样高表达。因此,GLIS3有助于三阴性乳腺癌的诊断和预后,或许还可作为这些患者治疗的靶点。本研究首先进行GLIS3基因的泛癌表达分析,发现其在包括胃癌的多种肿瘤中高表达,再利用TCGA数据库证实了GLIS3在胃癌组织中明显上调,且对胃癌具有一定的诊断价值,进一步研究发现GLIS3高表达与胃癌患者预后不良有关,COX回归模型再次验证:GLIS3表达是胃癌患者的独立危险因素,可作为胃癌潜在的预后标志物。
为了进一步研究胃癌中GLIS3基因异常表达的潜在机制,本研究使用多个数据库预测其上游的miRNAs。miRNAs作为一类内源性非编码短RNA,在肿瘤的发生、发展中扮演着重要作用,其作为肿瘤致癌或抑癌因子参与肿瘤细胞增殖、分化、侵袭和转移等生物过程[12]。既往研究表明,miR-204-5p作为肿瘤抑制因子在结肠癌[13]、肺癌[14]、前列腺癌[15]、胃癌[16]等癌症中明显下调。YANG等[17]研究发现miR-204-5p在胃癌组织中明显下调,且通过调节HER-2来抑制细胞增殖、迁移和侵袭,并促进细胞凋亡,从而发挥其抗肿瘤功能,这可能是胃癌的一个潜在治疗靶点。ZHANG等[18]研究表明miR-204-5p通过靶向CXCR4和CXCL12来调控胃癌的侵袭和迁移,且miR-204-5p低表达与胃癌的淋巴结转移密切相关。本研究结果显示,miR-204-5p在胃癌组织表达明显下调,这与此前的研究报道结论一致,且miR-204-5p与GLIS3表达呈负相关。因此,推测GLIS3在胃癌中的异常表达,可能是由于miR-204-5p表达下调造成的,但仍需进一步研究证实。
本研究使用GSEA分析了GLIS3可能参与的生物学通路,高表达标本主要富集到ECM受体相互作用、钙、黏着斑、缝隙连接、肿瘤、MAPK、紧密连接等,其中ECM受体相互作用是富集分数最高的信号途径,它在肿瘤的脱落、黏附、降解和增生过程中发挥着重要作用[19],并参与了胃癌的侵袭和转移过程[20]。此外,在侵袭性黑色素瘤中,GLIS3表达水平升高与E-钙黏蛋白表达水平降低有关,且通过siRNA下调GLIS3的表达后可抑制黑色素瘤细胞的迁移和侵袭[11]。本研究表明GLIS3的表达与胃癌的分化程度相关,因此,推测GLIS3的表达增加可能会促进癌细胞增殖、迁移和转移,有研究证实可能与刺激了上皮-间充质转化(epithelial-mesenchymal transition,EMT)有关[21],而EMT是肿瘤最常见的侵袭和转移起始原因[22]。因此,GLIS3可能是通过参与细胞的增殖和侵袭转移过程影响患者的生存,进一步证实GLIS3可以作为预测患者肿瘤转移、判断预后的有效生物标志物。
此外,TIMER数据库分析结果显示GLIS3的表达与CD4+T细胞、巨噬细胞、中性粒细胞、树突状细胞具有相关性。CIBESORT算法结果表明GLIS3高表达组中,巨噬细胞(M2)、静止树突状细胞增加,这与TIMER数据库得到的结论一致。既往研究表明巨噬细胞通过分泌多种细胞因子来促进肿瘤的生长和转移,且巨噬细胞浸润程度越高,胃癌患者预后越差[23]。这可能提示GLIS3的过表达有效促进了巨噬细胞的免疫反应和浸润。
综上所述,GLIS3有望成为胃癌潜在的诊断及预后分子标志物。同时,本研究还探讨了GLIS3异常表达的潜在调控机制、可能参与的生物学功能和免疫浸润之间的关系,为后续深入研究GLIS3基因与胃癌的关系提供了理论支持。
